Com o desenvolvimento de novas terapias contra o câncer, o perfil de toxicidade sistêmica e os efeitos na sobrevida tiveram uma grande evolução. No entanto, uma constelação de toxicidades emergiu, ainda mais notavelmente, eventos adversos cutâneos. Essas recomendações, desenvolvidas por um grupo de especialistas brasileiros em oncodermatologia, visam a estabelecer uma diretriz para o atendimento dermatológico de pacientes oncológicos. Quando possível, foram feitas recomendações baseadas em evidências, mas em muitos casos, quando não havia uma evidência forte, chegou‐se a um consenso com base em alguns dados que suportam o uso de tais medidas, associados a experiências pessoais dos autores.
Com o avanço do tratamento do câncer, as toxicidades sistêmicas e a sobrevivência enfrentaram uma melhora importante. Entretanto, seu uso está frequentemente relacionado a eventos adversos dermatológicos (EADs), que apresentam alta frequência, são frequentemente sintomáticos, podem ser desfigurantes e podem causar um importante impacto na qualidade de vida (QV) dos pacientes. Outro ponto fundamental é o de essas toxicidades cutâneas poderem levar a reduções de dose ou até mesmo a interrupção da terapia oncológica, com impacto no prognóstico da doença. Por essas, entre outras razões, é importante que os dermatologistas conheçam os tipos mais comuns de reações para ajudar pacientes e oncologistas na prevenção e no manejo dessas toxicidades.1,2
Uma equipe multidisciplinar com uma boa interação entre os diferentes especialistas (p. ex., oncologistas, dermatologistas, enfermeiros) é fundamental para o melhor atendimento de suporte dos pacientes oncológicos e suas famílias. Diferentes sociedades e associações são dedicadas à pesquisa, apoio e educação em todos os aspectos do tratamento do câncer, como a Multinational Association of Supportive Care in Cancer (MASCC), a American Society of Clinical Oncology (ASCO), a Oncology Nurse Society (ONS) e a National Comprehensive Cancer Network (NCCN).
O objetivo deste artigo foi estabelecer uma diretriz para auxiliar os profissionais no cuidado dermatológico de pacientes oncológicos. Quando possível, foram feitas recomendações baseadas em evidências, mas quando fortes evidências não estavam disponíveis, um consenso foi alcançado com base em alguns dados disponíveis, associados às experiências pessoais dos autores. Os níveis de evidência são definidos abaixo e são reportados para cada tratamento nas tabelas 1 a 3.
Níveis de evidência de acordo com os tipos de estudo:3
- •
IA – Evidência de metanálise de ensaios clínicos randomizados (ECR);
- •
IB – Evidência de ao menos um ensaio clínico randomizado;
- •
IIA – Evidência de ao menos um estudo controlado sem randomização;
- •
IIB – Evidência de ao menos um outro tipo de estudo experimental;
- •
III – Evidência de estudos não experimentais descritivos, como comparativos, de correlação ou tipo caso‐controle;
- •
IV – Evidência de publicações de comitês de especialistas, opiniões ou experiência clínica de autoridades respeitadas ou ambos.
A quimioterapia citotóxica convencional ainda desempenha um papel importante no tratamento do câncer. Funciona principalmente através da inibição da divisão celular. Está associada a muitos eventos adversos (EA), especialmente em alguns sistemas que compartilham com o tumor a propriedade da rápida proliferação celular e, portanto, uma alta taxa de divisão celular, como os sistemas hematopoiético, gastrointestinal e a pele.2,4 Exemplos de efeitos comuns são êmese, citopenias, alopecia, mucosite e alterações nas unhas. Eles estão associados a dose, tipo de droga, tempo de infusão e, na maioria dos casos, são reversíveis com o fim dos ciclos de quimioterapia.
Pertencem a essa classe de drogas agentes como antimetabólitos (ex: capecitabina, fludarabina, cladribina, gemcitabina, 5‐fluoracila (5‐FU), agentes alquilantes (ex: ciclofosfamida, platinas), inibidores da topoisomerase (ex: irinotecano, topotecano, etoposídeo), antraciclinas (ex: doxorrubicina, daunorrubicina), bleomicina, agentes antimicrotúbulo (ex: taxanos e alcaloides de vinca). Os eventos adversos cutâneos relacionados a essa classe, agentes causadores e manejo mais frequentes (com nível de evidência) estão resumidos na tabela 1.
Eventos adversos dermatológicos dos agentes quimioterápicos clássicos
| Toxicidade dermatológica | Agentes mais frequentes | Manejo | Nível de evidência |
|---|---|---|---|
| Hiperpigmentação | Medidas de fotoproteção | IV | |
| Difusa | Bussulfano (aspecto “bronzeado”); metotrexate; procarbazina, capecitabina | Agentes clareadores | IV |
| Flagelata | Bleomicina | ||
| Em trajeto venoso | 5‐FU, docetaxel, vincristina, vinorrelbina | ||
| Áreas de pressão, flexural, sobre curativos oclusivos | Ifosfamida, tiotepa, hidroxiuréa, cisplatina, docetaxel | ||
| Palmas e plantas | Hidroxiureia, doxorrubicina, capecitabina | ||
| Cristas palmares | Ifosfamida, ciclofosfamida, bleomicina, busulfano, doxorrubicina | ||
| Mucosa | Ciclofosfamida (gengiva), busulfano, doxorrubicina, cisplatina, capecitabina | ||
| Alterações ungueais | Medidas gerais para todos os pacientes: redução do contato com a água, uso de luvas de algodão sob luvas de plástico ou borracha para qualquer trabalho úmido, evitar qualquer procedimento prejudicial (p. ex., manicure agressiva) e hidratação com emolientes espessos. | IV | |
| Onicólise | Taxanos, ciclofosfamida doxorrubicina, capecitabina, etoposídeo | Prevenção: luvas e meias congeladas durante a infusão (dependendo do agente e do tipo de infusão) | IIA |
| Tratamento: | |||
| Evitar traumas (por exemplo, manter unhas curtas) e umidade; | IV | ||
| Se descoloração verde: antibiótico tópico (colírio de tobramicina ou ciprofloxacina) | IV | ||
| Paroníquia | Taxanos, capecitabina, etoposídeo | Corticosteroides tópicos | IV |
| Se houver suspeita de infecção secundária, antibióticos guiados por cultura | IB | ||
| Hiperpigmentação ungueal | 5‐FU, taxanos, hidroxiureia, ciclofosfamida, doxorrubicina, capecitabina | Pode ser difuso ou em faixas/estrias. | |
| Nenhum tratamento é necessário. | |||
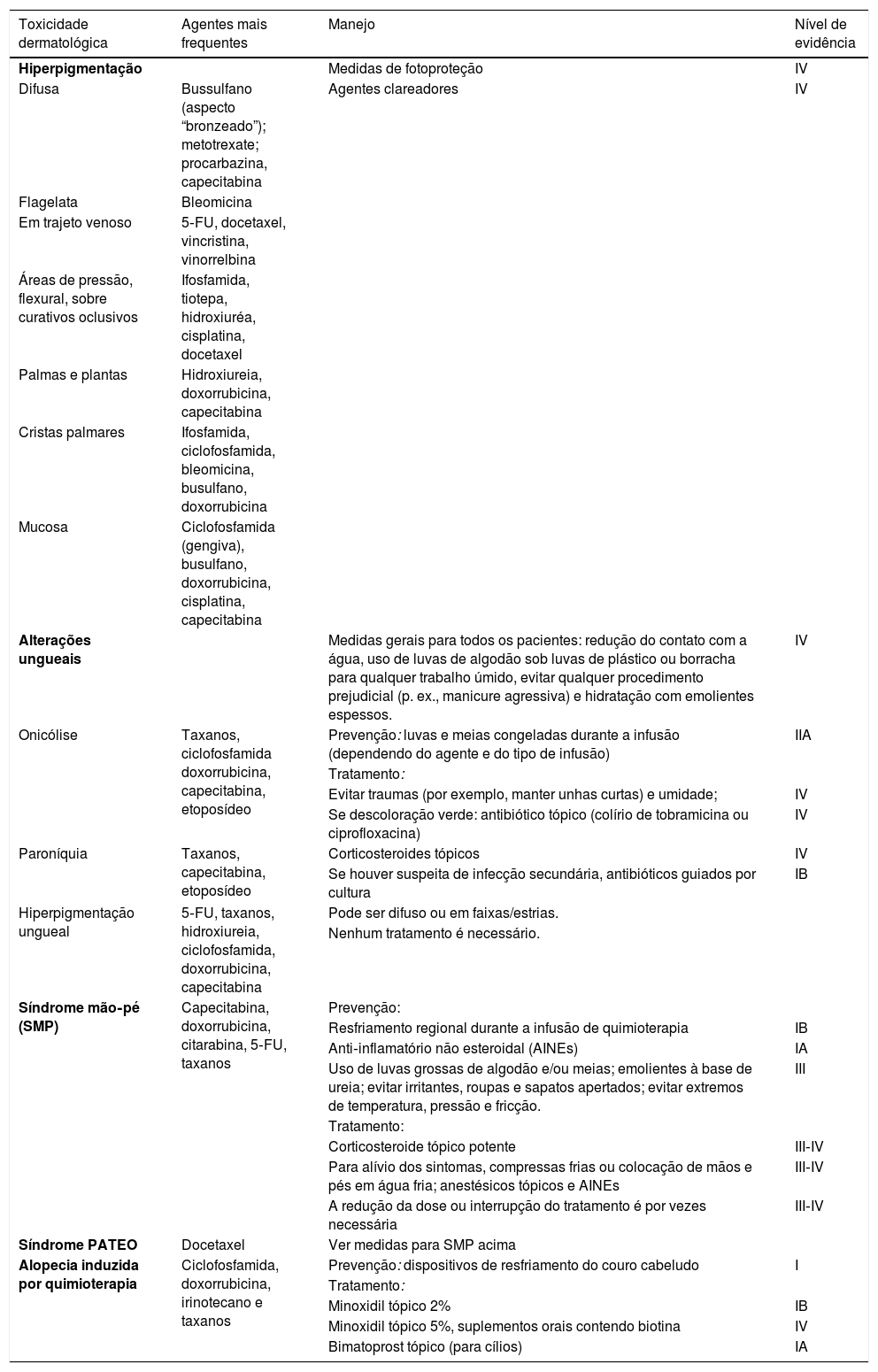
| Síndrome mão‐pé (SMP) | Capecitabina, doxorrubicina, citarabina, 5‐FU, taxanos | Prevenção: | |
| Resfriamento regional durante a infusão de quimioterapia | IB | ||
| Anti‐inflamatório não esteroidal (AINEs) | IA | ||
| Uso de luvas grossas de algodão e/ou meias; emolientes à base de ureia; evitar irritantes, roupas e sapatos apertados; evitar extremos de temperatura, pressão e fricção. | III | ||
| Tratamento: | |||
| Corticosteroide tópico potente | III‐IV | ||
| Para alívio dos sintomas, compressas frias ou colocação de mãos e pés em água fria; anestésicos tópicos e AINEs | III‐IV | ||
| A redução da dose ou interrupção do tratamento é por vezes necessária | III‐IV | ||
| Síndrome PATEO | Docetaxel | Ver medidas para SMP acima | |
| Alopecia induzida por quimioterapia | Ciclofosfamida, doxorrubicina, irinotecano e taxanos | Prevenção: dispositivos de resfriamento do couro cabeludo | I |
| Tratamento: | |||
| Minoxidil tópico 2% | IB | ||
| Minoxidil tópico 5%, suplementos orais contendo biotina | IV | ||
| Bimatoprost tópico (para cílios) | IA |
5‐FU, 5‐fluoracila; PATEO, PeriArticular Thenar Erythema and Onycholysis (Eritema tenar e periarticular, e onicólise).
Na última década, ocorreu um enorme desenvolvimento de tratamentos oncológicos, com o surgimento de numerosos agentes direcionados e agentes relacionados aos checkpoints imunológicos. Com esses novos mecanismos de ação, surgiu um escopo totalmente novo de reações adversas e os profissionais podem não estar familiarizados com o espectro de toxicidades dermatológicas.5–8 Por um lado, essas terapias foram cruciais para a melhoria da sobrevida. Por outro lado, criaram um novo desafio: com o uso contínuo e prolongado desses medicamentos, pacientes e profissionais têm que lidar com os aspectos crônicos das toxicidades, não mais relacionados com um número específico de ciclos de quimioterapia, mas com duração de meses a anos, com impacto importante na qualidade de vida.
Terapias‐alvo inibem moléculas específicas envolvidas no desenvolvimento e crescimento tumoral, têm uma ação mais específica do que a quimioterapia convencional, com maior eficácia e menor toxicidade. Muitas dessas moléculas são mutadas ou superexpressas nos tumores, mas também estão presentes em tecidos normais, como a pele. Isso justifica os efeitos colaterais dermatológicos comuns relacionados a essa classe. Eles podem ser anticorpos monoclonais – moléculas grandes que visam aos componentes extracelulares; ou inibidores de moléculas pequenas, que podem entrar nas células, bloquear a sinalização do receptor e interferir com moléculas intracelulares a jusante (serão referidos como inibidores tirosina quinase – TKI).9 Os principais agentes dessa classe são inibidores do receptor do fator de crescimento epidérmico – EGFRi (cetuximabe, panitumumabe, gefitinibe, erlotinibe, lapatinibe); agentes antiangiogênicos, inibidores do receptor do fator de crescimento endotelial vascular – VEGFRi (ex: bevacizumabe, sorafenibe); inibidores da via da proteína quinase mitógeno ativada (MAPK), tal como BRAFi (ex: vemurafenibe, dabrafenibe), MEKi (ex: cobimetinibe, trametinibe); inibidores de mTOR (ex: everolimo); inibidores multiquinase (ex: vandetanibe, pazopanibe, sunitinibe); e inibidores da via Hedgehog (vismodegibe). Os eventos adversos cutâneos relacionados aos agentes dessa classe, seu manejo e seus níveis de evidência estão resumidos na tabela 2.
Eventos adversos dermatológicos das terapias alvo
| Classes de droga | Agentes | Toxicidade dermatológica | Manejo | Nível de evidência |
|---|---|---|---|---|
| Inibidores do EGFR | Anticorpos monoclonais: cetuximabe e panitumumabeTKI específicos para o EGFR: erlotinibe e gefitinibeInibidores multiquinase menos específicos: vandetanibe | Erupção papulopustulosa (começa nas primeiras 2 semanas) | Prevenção: | |
| Antibióticos sistêmicos durante as primeiras 6?8 semanas (tetraciclinas), protetor solar | IB | |||
| Tratamento: | ||||
| Esteroides tópicos de baixa potência | III | |||
| Antibióticos sistêmicos (tetraciclinas) | IB | |||
| Isotretinoína sistémica (doses baixas) | III | |||
| Antibióticos orientados pela cultura, se infecção secundária | IB | |||
| Xerose | Tempo de banho limitado, uso de produtos de limpeza suaves (sabonetes com pH‐neutro ou syndets), uso regular de emolientes | III | ||
| Corticosteroide tópico, se lesões eczematosas | III | |||
| Paroníquia e lesões tipo granuloma piogênico‐like | Prevenção: | |||
| Antibióticos sistêmicos (tetraciclinas) | IB | |||
| Soluções antissépticas | III | |||
| Tratamento: | ||||
| Corticoesteroides tópicos | III | |||
| Antibióticos sistêmicos (tetraciclinas) | III | |||
| Antibióticos orientados pela cultura se a infecção secundária | IB | |||
| Fissuras | Revestimentos protetores (cola biológica ou de cianoacrilato, hidrocoloide), cremes de barreira (vaselina, óxido de zinco) e emolientes espessos | IIB | ||
| Alterações dos pêlos e cabelos | Alopecia não cicatricial: minoxidil tópico | IB | ||
| Alopecia inflamatória e cicatricial: corticoesteroides tópicos | III | |||
| Tricomegalia: corte dos cílios | III | |||
| Hipertricose: redução de pelos a laser | IB | |||
| Inibidores do KIT e BCR‐ABL | Imatinibe, nilotinibe, dasatinibe | Exantema (rash) | Corticosteroides orais e pequenos períodos de corticosteroides sistêmicos | III |
| Hipopigmentação | Reversível após descontinuação do tratamento | III | ||
| Agentes antiangiogênicos | Inibidores seletivos do VEGFR: bevacizumabe e ranibizumabeInibidores não seletivos multiquinase: sorafenibe, pazopanibe, sunitinibe | Reação Mão‐Pé (RMP) | Prevenção: | |
| Uso de luvas grossas de algodão e/ou meias; evitar irritantes, roupas e sapatos apertados; vitar extremos de temperatura, pressão e fricção. | III | |||
| Avaliação pré‐tratamento com um podólogo com desbastamento das calosidades e o uso de palmilhas ortopédicas quando necessário | III | |||
| Emolientes à base de uréia | IB | |||
| Tratamento: | ||||
| Agentes queratolíticos | III | |||
| Corticosteroides tópicos potentes | III | |||
| Para alívio dos sintomas, compressas frias ou imersão de mãos e pés em água fria, anestésicos tópicos e AINEs | III | |||
| Curativos hidrocoloides | IB | |||
| Alterações pigmentares | Hipopigmentação do cabelo e da pele (pazopanib e sunitinib), descoloração amarela da pele (sunitinib) – reversível após a descontinuação | III | ||
| Couro cabeludo e cabelos | Dermatite seborreica‐símile: corticoesteroides tópicos | III | ||
| Alopecia não cicatricial: minoxidil tópico | IV | |||
| Inibidores de BRAF | Vemurafenibe e dabrafenibe | Exantema (rash) | Anti‐histamínicos orais, corticosteroides tópicos ou cursos curtos sistêmicos | III |
| * Interrupção temporária do tratamento pode ser necessária | ||||
| Fotossensibilidade | Prevenção: medidas fotoprotetoras | IIB | ||
| Tratamento: corticosteroides tópicos ou cursos curtos sistêmicos | III | |||
| * Principalmente vemurafenibe, induzida por UVA | ||||
| Erupção tipo queratose pilar‐símile | Queratolíticos e emolientes | III | ||
| Dermatite seborreica‐símile | Corticosteroides tópicos | III | ||
| Reação mão‐pé | Ver acima (agentes antiangiogênicos) | |||
| Ceratoacantomas e carcinomas espinocelulares | Monitoramento dermatológico frequente | III | ||
| Se poucas lesões: excisão cirúrgica | III | |||
| Se múltiplas lesões: 5‐FU, retinoides sistêmicos ou terapia fotodinâmica | IIA/B | |||
| * Associação com um MEKi diminui lesões | ||||
| Verrugas e queratoses verrucosas | Medidas destrutivas ou cirúrgicas | III | ||
| Tratamentos tópicos: queratolíticos, 5‐FU, imiquimode | III | |||
| Inibidores de MEK | Cobimetinibe, trametinibe, selumetinibe | Erupção papulopustulosa | Ver em inibidores de EGFR acima | |
| Xerose | ||||
| Paroníquia | ||||
| Exantema (rash) | Anti‐histamínicos orais, corticosteroides tópicos ou cursos curtos sistêmicos | III | ||
| Inibidores de mTOR | Rapamicina, everolimo, sirolimo | Estomatite | Enxagues antissépticos, corticoesteroides tópicos e anestésicos tópicos | IV |
* AINE, anti‐inflamatórios não esteroidais.
Mais recentemente, a compreensão dos processos regulatórios envolvidos na restrição da resposta imune ao câncer levou ao desenvolvimento de um novo e promissor grupo de agentes, os agentes direcionados aos checkpoints imunológicos, também conhecidos como imunoterapia. Têm o objetivo de liberar o sistema imunológico contra células tumorais, bloquear receptores inibitórios expressos em células T, como Programmed Death 1 (PD‐1) ou Cytotoxic T Lymphocyte‐associated Antigen (CTLA‐4). Essa liberação/ativação do sistema imune também afeta as células normais, explicando os eventos adversos mais comuns relacionados a essa classe, também conhecidos como eventos adversos imunomediados (EAi). Nesse grupo, encontra‐se o inibidor de CTLA‐4 (ipilimumabe), inibidores do PD‐1 e PD‐1 ligante (nivolumabe, pembrolizumabe, atezolizumabe).7,10–13 Eventos adversos cutâneos relacionados aos agentes dessa classe, seu tratamento e os níveis de evidência estão resumidos na tabela 3.
Eventos adversos dermatológicos à imunoterapia (eventos adversos imunomediados ‐ EAi)
| Classes de droga | Agentes (*) | Toxicidade dermatológica | Manejo | Nível de evidência |
|---|---|---|---|---|
| Inibidores de checkpoint | Inibidores de CTLA‐4: ipilimumabeInibidores de PD‐1: nivolumabe, pembrolizumabeInibidores de PD1 ligante: atezolizumabe | Exantema (rash) | Leve (< 30% de SC): anti‐histamínicos orais, corticoesteroides tópicos | IV |
| Moderada (> 30% SC): corticoesteroides orais (1?2 mg/kg); mantenha imunoterapia | IV | |||
| Grave (SSJ/NET ou complicações necróticas, bolhosas ou hemorrágicas): corticoesteroide sistêmico (1?2 mg/kg); descontinuar permanentemente a imunoterapia | IV | |||
| Prurido | Prevenção: | |||
| Tempo de banho limitado, uso de limpadores suaves (sabonetes pH‐neutro ou syndets), uso regular de emolientes | IV | |||
| Tratamento: | ||||
| Anti‐histamínicos orais | IV | |||
| Corticoesteroides tópicos ou orais | IV | |||
| Agonistas do GABA (pregabalina, gabapentina) | IV | |||
| Toxicidade oral | Corticoesteroides e anestésicos tópicos, boa higiene bucal | IV | ||
| ‐ lesões liquenóides | ||||
| ‐ boca seca | ||||
| Vitiligo | Sem tratamento definitivo | IV | ||
| Outras: | Apenas relatos de casos na literatura | |||
| Erupções liquenoides | ||||
| Sarcoidose | ||||
| Doenças autoimunes bolhosas (penfigoide bolhoso) | ||||
| Psoríase |
Duplo bloqueio do checkpoint (anti‐CTLA‐4+anti‐PD1) está relacionado a um grau mais elevado de eventos adversos, inclusive toxicidades dermatológicas. Relatos de casos de EAi graves existem também para outros agentes imunomoduladores.
CTLA‐4, Cytotoxic T Lymphocyte Associated antigen 4; NET, necrólise epidérmica tóxica; PD‐1, Programmed Death 1; PD‐1l, Programmed Death 1 Ligand; SC, Superfície Corporal; SSJ, Síndrome de Steven‐Johnson.
O National Cancer Institute's Common Terminology Criteria for Adverse Events (CTCAE – Critério Comum de Terminologia para Eventos Adversos) é uma ferramenta padronizada usada em ensaios de oncologia para documentar e classificar os efeitos tóxicos das terapias oncológicas. Está disponível online com acesso aberto em https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm.
Ele divide os EA em sistemas e tem um capítulo específico para distúrbios da pele e tecido subcutâneo. Ajuda a estabelecer uma terminologia e uma linguagem comuns entre diferentes especialistas (oncologistas, dermatologistas, enfermeiros) e a padronizar tratamentos ou modificações de dose com base na gravidade de manifestações específicas.
Impacto dos eventos adversos dermatológicos na qualidade de vidaA QV é uma questão importante quando se lida com pacientes oncológicos. Diferentes estudos já demonstraram que a graduação da gravidade do EA é diferente da perspectiva do médico e do paciente.14 Portanto, também é importante usar os instrumentos de avaliação pelo paciente dos EADs. Diferentes instrumentos estão disponíveis, como Skindex‐16©, Skindex‐29©, Dermatology Life Quality Index (DLQI), DIELH‐24 ou mesmo questionários para agentes específicos, como a Functional Assessment of Cancer Therapy‐Epidermal Growth Factor Receptor Inhibitors‐18 (FACT‐EGFRI‐18 – Avaliação Funcional da Terapia do Câncer – Inibidores dos Receptores do Fator de Crescimento Epidérmico‐18)15.
Ao comparar diferentes classes de medicamentos, o número de EADs e seu impacto na QV pareceu ser maior em pacientes em terapias‐alvo se comparados às terapias clássicas (diferença=8,9; p=0,02)15.
Toxicidade cutânea como marcador preditivo para a resposta clínicaUma revisão recente tentou abordar a associação de toxicidades cutâneas e desfechos clínicos. Para a erupção papulopustular induzida pelo EGFRi, essa associação já foi estabelecida (quatro ensaios, todos com p<0,05). A reação mão‐pé associada ao sorafenibe foi associada à redução do risco de morte em uma revisão sistemática de 12 estudos de coorte (p <0,00001; hazard ratio – HR=0,45). No entanto, os autores concluíram que, para outras toxicidades, como vitiligo e imunoterapia para o melanoma (dados baseados principalmente em análises retrospectivas), as análises ainda são observacionais e exploratórias e necessitam de mais investigações a partir de estudos prospectivos maiores.16
Cuidados gerais com a peleA xerose é uma condição dermatológica frequente em pacientes em tratamento oncológico, com incidências que variam de 1%–84%, pode colaborar para a diminuição da QV e para a ocorrência de outros EADs, como infecções, sensibilização a alérgenos e prurido. É ainda mais frequente com o uso de terapias direcionadas (para xerose – RR=2,99; 95% IC 2,0–4,3; p <0,001; para prurido RR=2,56, 95% IC 1,51–4,35; p <0,001).17,18 A pele também torna‐se mais sensível à radiação ultravioleta e mais propensa à pigmentação da pele. Portanto, é fundamental educar os pacientes sobre medidas preventivas, mesmo antes do início de qualquer terapia, que ajudem a manter a função de barreira cutânea, possivelmente diminuem a ocorrência e a gravidade das EADs.
Algumas medidas importantes para todos os pacientes com câncer são: evitar loções à base de álcool e produtos irritantes, tempo de banho limitado, uso de limpadores suaves (sabonetes com pH‐neutro ou syndets), uso regular de emolientes e proteção solar (p. ex.: filtro solar de amplo espectro – SPF30 ou superior com proteção UVA, roupas protetoras).1
O uso de desodorantes é controverso, mas alguns dados não mostram evidências de danos e, portanto, os pacientes podem usar esses produtos para manter sua rotina regular e ajudar em seu bem‐estar.19 Maquiagem ou camuflagem também pode ser usada para benefícios na autoestima. A preferência por produtos não comedogênicos é recomendada.
Eventos adversos dermatológicosComo os dermatologistas geralmente iniciam sua avaliação no exame cutâneo, os diferentes EADs serão agrupados em tipos de reações cutâneas e áreas de acometimento. Nas tabelas 1 a 3, os leitores podem encontrar os EADs agrupados por classe de agentes e o nível de evidência das recomendações para cada tratamento usado nessa diretriz.
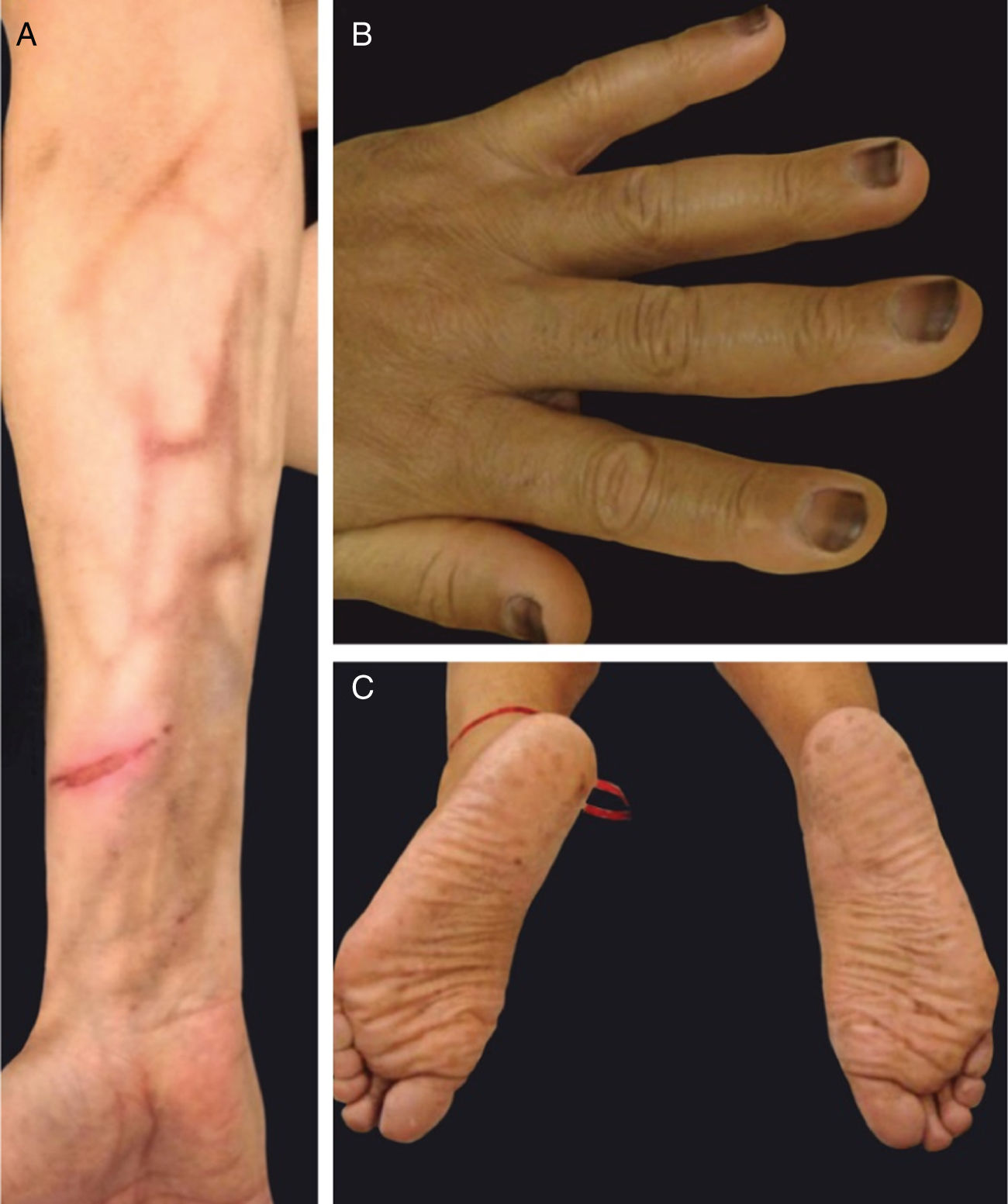
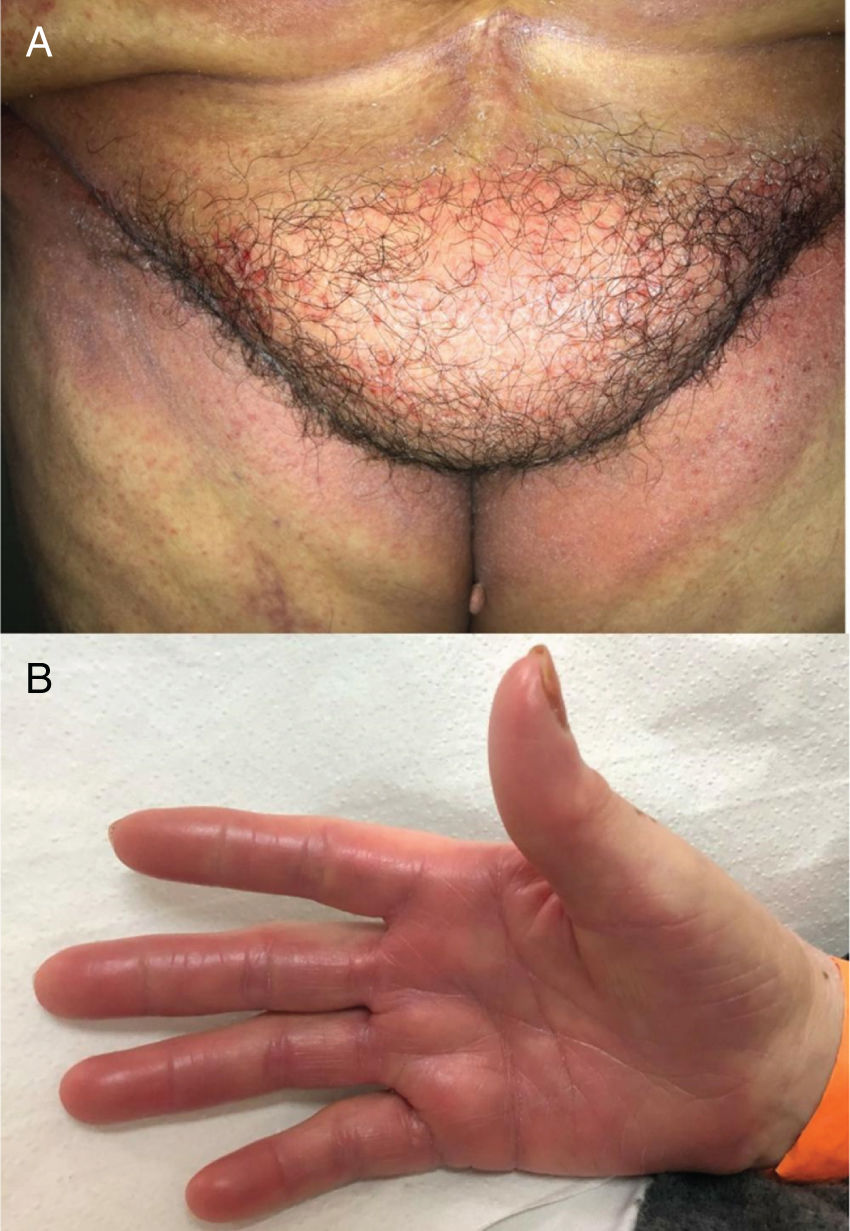
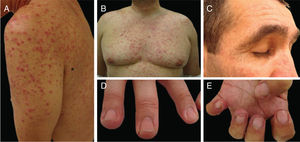
Alterações pigmentaresA hiperpigmentação pode ocorrer em diferentes locais e em diferentes padrões (fig. 1). Elas podem começar dias a meses após o início e, na maioria das vezes, desaparecem meses após a descontinuação da terapia. Pode ocorrer: a) Em áreas fotoexpostas, precedidas ou não por sinais de fotossensibilidade; b) Como uma hiperpigmentação supravenosa após infusão de quimioterapia periférica (p. ex., fluorouracila, docetaxel), que pode ser precedida ou não de eritema e inflamação; c) Em um padrão difuso, às vezes reticulado (doxorrubicina, hidroxiureia, metotrexato); d) Localizada em áreas de pressão, áreas flexurais ou sob curativos oclusivos (ifosfamida, tiotepa); e) Como pigmentação acral (ao longo das cristas ou macular, sobre as palmas das mãos e plantas dos pés).4,20
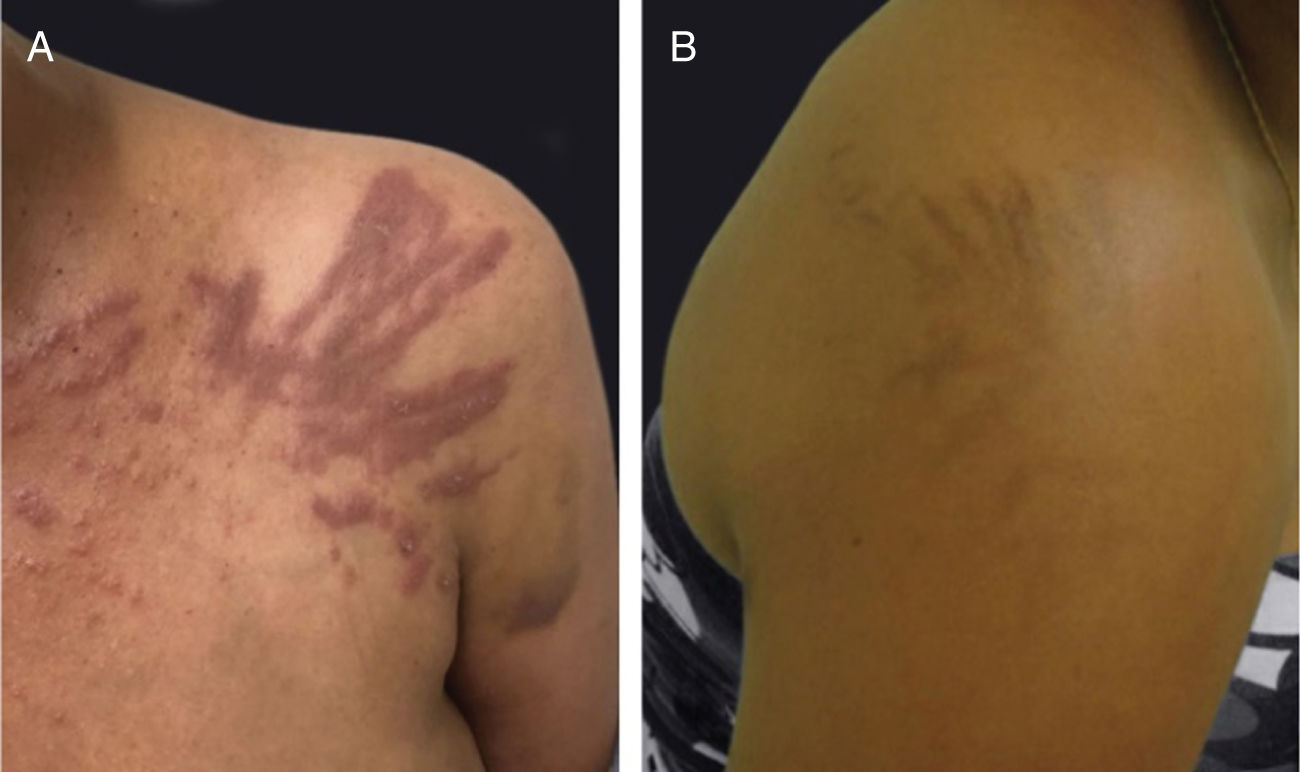
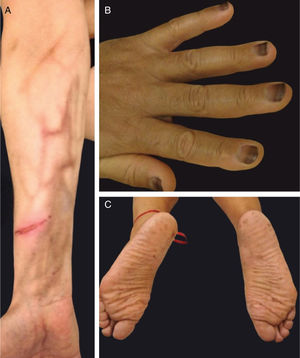
A dermatite flagelada e posterior pigmentação estão relacionadas ao tratamento com bleomicina (20% a 30% dos pacientes) e ocorrem como lesões lineares eritematosas pruriginosas, seguidas de pigmentação (fig. 2). O tratamento com bussulfano pode causar pigmentação do “tipo Addison”, com aparência bronzeada.4
Os pacientes devem ser orientados a aderir a medidas de proteção solar e agentes clareadores também podem ser usados para acelerar a despigmentação.
Terapias‐alvo também podem causar alterações pigmentares, como uma pigmentação amarela em pacientes tratados com sunitinibe (VEGFRi). A hipopigmentação (difusa ou localizada) está associada aos inibidores do c‐kit, como o imatinibe, especialmente em pacientes com pele mais escura, já que o c‐kit também regula a função dos melanócitos. São geralmente reversíveis com redução da dose ou descontinuação.5
Mais recentemente, a imunoterapia tem sido associada a lesões do tipo vitiligo, principalmente, mas não apenas, em pacientes tratados com melanoma. A despigmentação dos cabelos também pode ser observada. Não existe tratamento definitivo e geralmente persiste após o término da imunoterapia. Relatos de repigmentação de cabelos brancos também são encontrados.10–12,21
Alterações ungueaisAlterações nas unhas durante o tratamento do câncer são frequentes, geralmente bem toleradas e desaparecem com a cessação do tratamento. No entanto, em algumas circunstâncias podem ser sintomáticas e interferir nas atividades diárias do paciente.22
Os agentes quimioterápicos clássicos geralmente estão relacionados a alterações como melanoníquia (difusa, transversa ou longitudinal), leuconíquia, onicólise, linhas de Beau, onicomadose e onicorrexe.
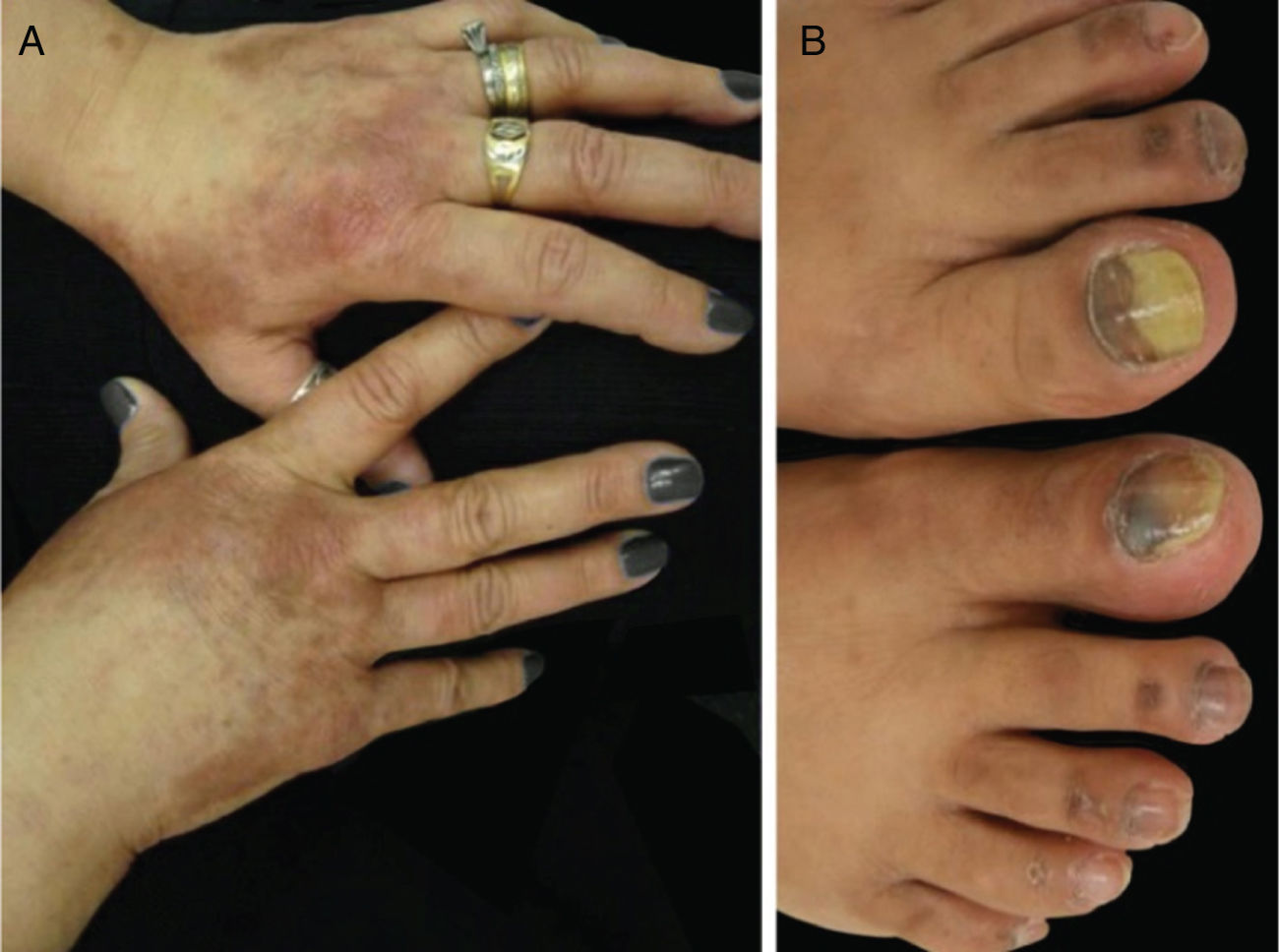
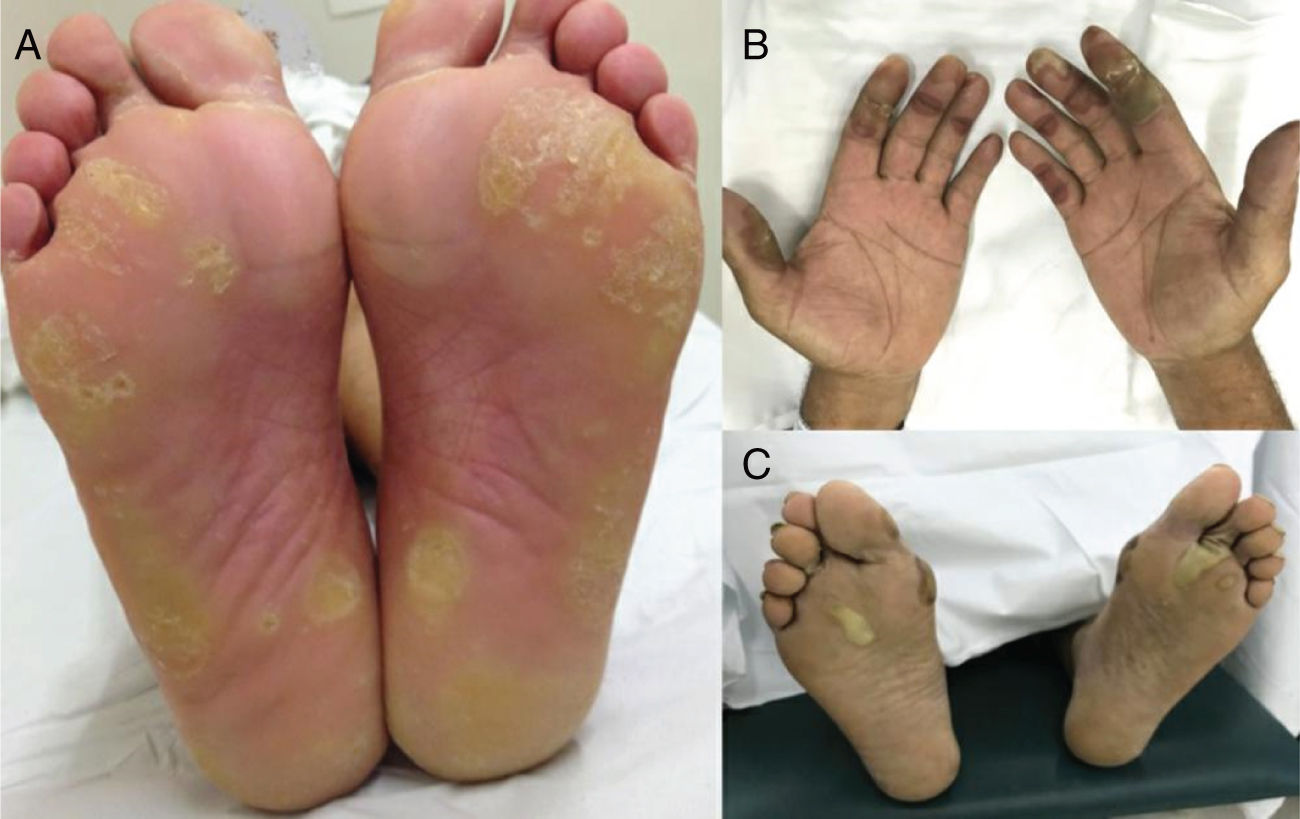
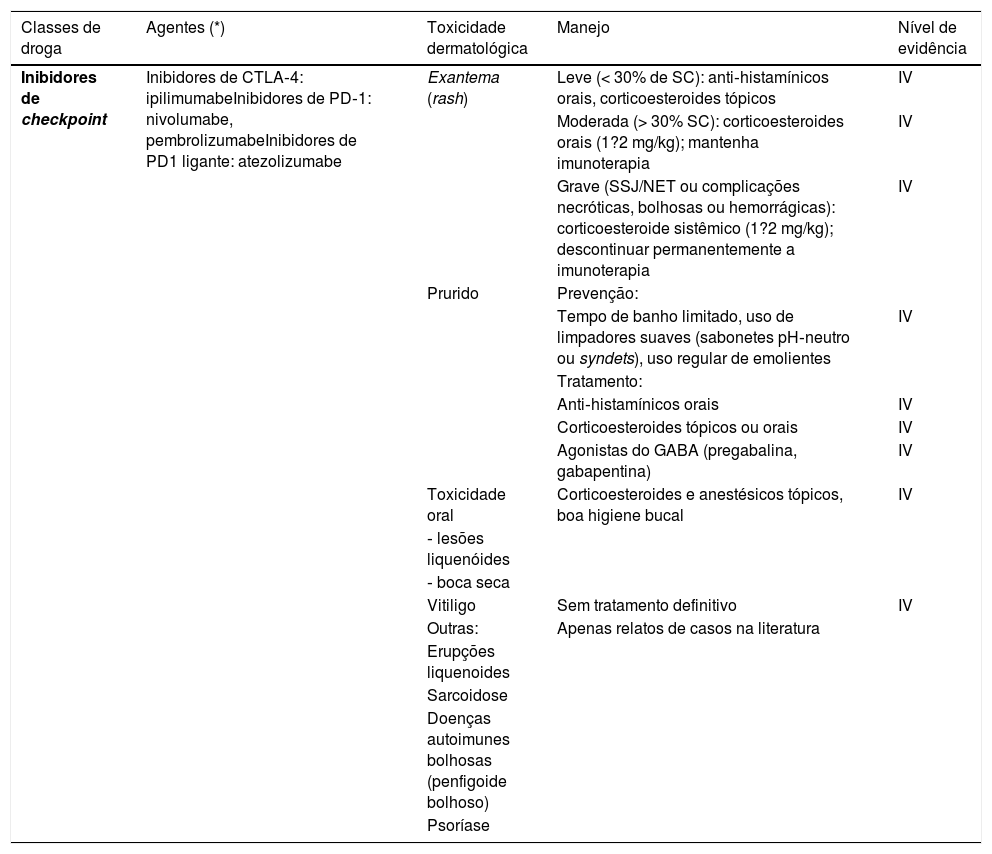
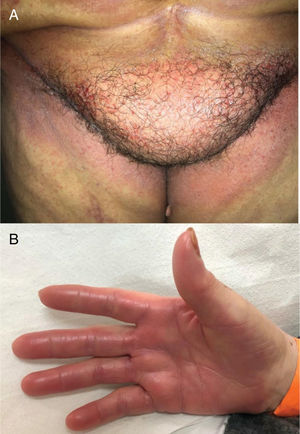
Os taxanos estão associados à hemorragia subungueal dolorosa, seguida de onicólise e, às vezes, formação de abscessos subungueais, bastante sintomáticos e que podem levar a reduções de dose ou descontinuidade do tratamento (fig. 3). O uso de luvas e meias congeladas durante a infusão pode reduzir a gravidade das alterações ungueais, mas geralmente não são bem toleradas (toxicidade ungueal, um estudo, 45 pacientes, lado a lado, 11% vs. 51%; p=0,0001).2,4,20 A drenagem da hemorragia e dos abscessos pode ser necessária para o alívio dos sintomas, bem como antibioticoterapia guiada por cultura.
Agentes clássicos e terapias‐alvo podem causar alterações na placa ungueal, como unhas quebradiças, frágeis e onicosquizia. Esses efeitos podem ser manejados com medidas preventivas, como redução do contato com a água, uso de luvas de algodão sob luvas de plástico ou borracha para qualquer trabalho úmido, evitar qualquer procedimento prejudicial (por exemplo, manicure agressiva) e hidratação com emolientes espessos. Biotina oral e esmaltes como a hidroxipropilquitosana e o poliureauretano podem ser usados, embora ainda não haja estudo controlado.22
Para onicólise, é importante evitar traumas (p. ex., manter unhas curtas) e umidade. Se houver sinais de colonização por pseudomonas (coloração verde), um antibiótico tópico pode ser usado (sugerem‐se soluções oftalmológicas como tobramicina ou colírio de ciprofloxacina duas vezes ao dia).
O VEGFRi está associado a hemorragias subungueais em estilhaço assintomáticas (linhas longitudinais pretas, vermelhas ou marrons) em 25-70% dos pacientes, as unhas das mãos são as mais afetadas principalmente.5,7
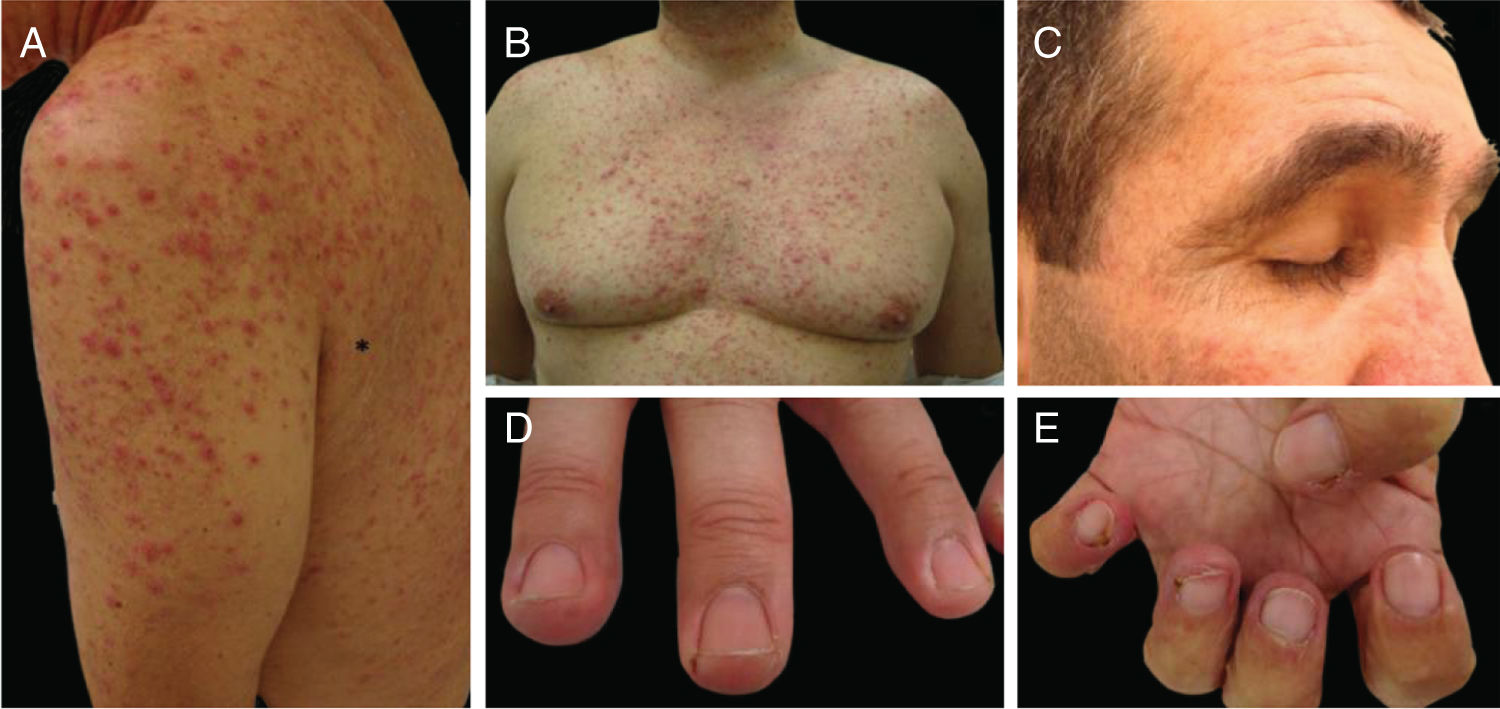
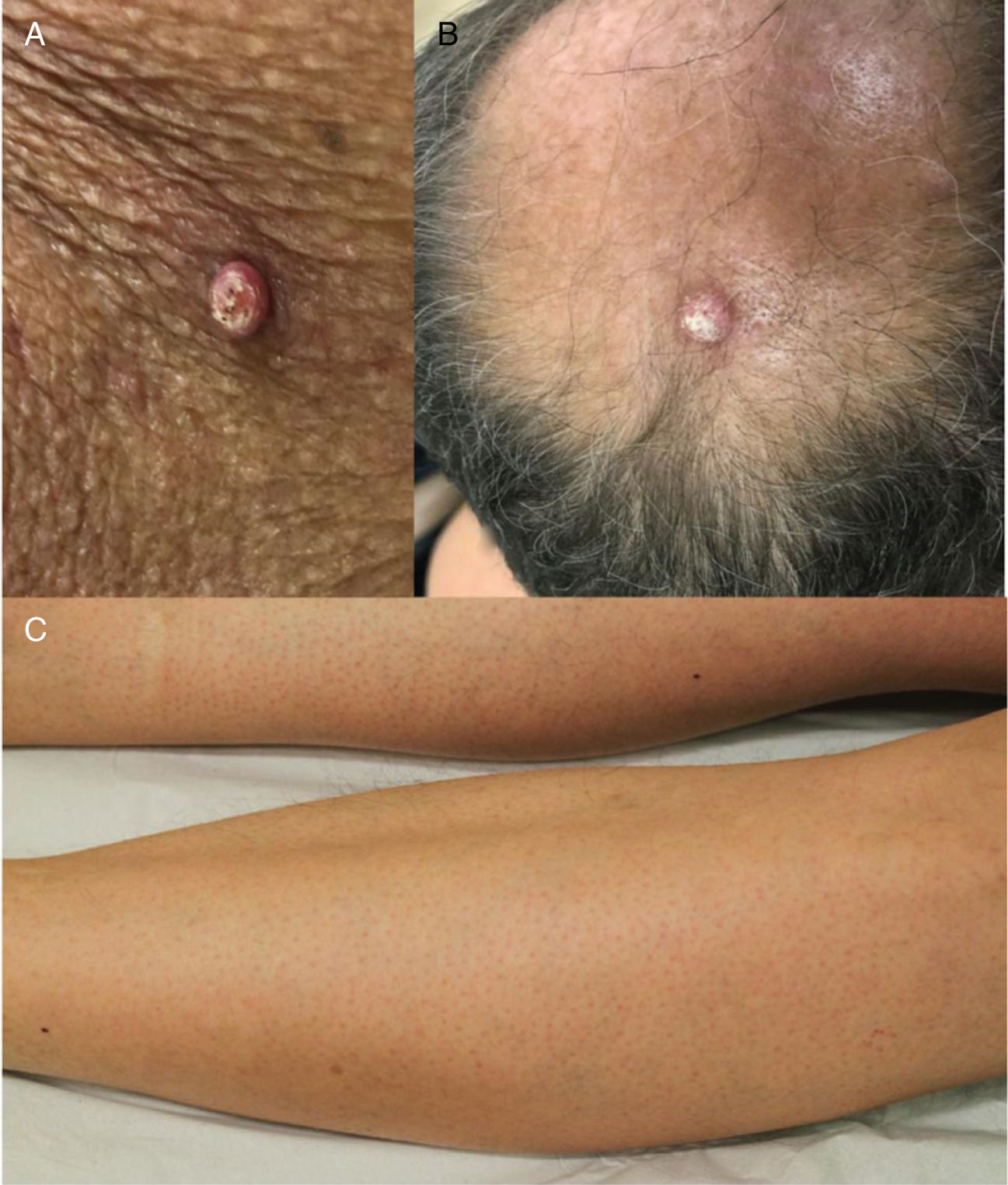
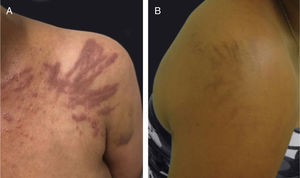
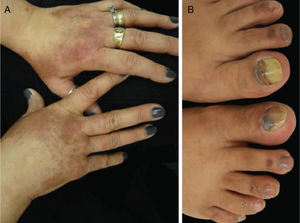
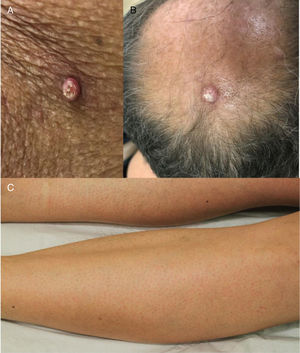
Os EGFRi estão relacionados a toxicidades frequentes das unhas, ocorrem em 17,2% dos pacientes em uma metanálise anterior.23 As fissuras periungueais, paroníquia e lesões semelhantes a granuloma piogênico começam a se desenvolver dois ou mais meses após o início da terapia, tanto nos quirodáctilos quanto nos pododáctilos (fig. 4). Eles são inicialmente estéreis, mas pode ocorrer infecção secundária. Medidas preventivas incluem as listadas acima e também o uso de calçados confortáveis, dispositivos acolchoados para as unhas afetadas, corte de unhas adequado e uso de soluções antissépticas como solução embebida em Burrow, imersão de vinagre branco (1:1), alvejantes (1/4 xícara: aprox. 10 litros de água), clorexidina ou iodopovidona,6,24–26 ou solução de hipoclorito de sódio a 2,5%, cloreto de sódio a 1,0% e água deionizada qsp 100 mL (5 gotas/1 litro). O uso de tetraciclinas orais é controverso, pois foi relacionado à diminuição da incidência de paroníquia em alguns ensaios e não mostrou benefícios em outros.27 Para as fissuras, coberturas protetoras como hidrocoloide, cola biológica ou mesmo cola de cianoacrilato para aliviar a dor e promover a cicatrização, cremes barreira (vaselina, creme de óxido de zinco) e emolientes grossos podem ser usados. Para os granulomas, se houver suspeita de infecção secundária, a cultura é indicada e os antibióticos adequados devem ser prescritos. Para lesões não infectadas, medidas destrutivas como ácido tricloroacético (70%–90%) ou crioterapia podem ser usadas. Corticosteroides tópicos potentes, oclusivos ou não, também são indicados.28 Às vezes, o tratamento cirúrgico pode ser necessário. Recentemente, o uso de betaxolol tópico (betabloqueador) foi descrito para o tratamento de uma lesão granuloma piogênico‐like induzida por EGFRi.29
Eventos adversos relacionados aos inibidores de EGFR: (A e B) erupção cutânea papulopustular, com xerose associada (*); (C) tricomegalia e hipertricose; (D) fissuras periungueais e (E) lesões granuloma piogênico‐símiles. (A, B, D e E em pacientes tratados com cetuximabe; C em paciente tratado com panitumumabe).
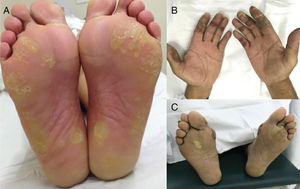
Síndrome mão‐pé (SMP), também conhecida como eritrodisestesia palmoplantar, é um EAD relacionado a drogas quimioterápicas clássicas, comum com agentes como capecitabina, doxorrubicina, citarabina, 5‐FU. É precedida por sintomas de pródromo, como formigamento ou dor nas extremidades, seguidos de eritema e edema simétricos e bem demarcados das palmas das mãos e plantas dos pés (fig. 5). Vesículas e bolhas também podem estar presentes. A dor geralmente limita as atividades diárias e pode ser uma causa de redução da dose ou descontinuação da terapia. A incidência é maior com infusões prolongadas ou agentes orais.2,4
Síndrome PATEO (PeriArticular Thenar Erythema and Onycholysis – Eritema tenar periarticular e onicólise) é uma variante da SMP, específica aos taxanos (docetaxel) (fig. 3). Caracteriza‐se por lesões eritêmato‐escamosas, com distribuição distinta nos faces dorsais das mãos (cobrem as articulações) e eminências tenares. Mais raramente, também pode afetar o dorso dos pés. Embora comum, as unhas não são universalmente afetadas. Geralmente é bilateral, não necessariamente simétrico. Pode começar no primeiro ciclo de quimioterapia ou desenvolver progressivamente. Queimação e dor são os sintomas mais relatados.20
Reação mão‐pé (RMP) é outra variante de toxicidade acral relacionada a terapias alvo, tanto com anticorpos monoclonais quanto com pequenas moléculas inibidoras de tirosina quinase, especialmente aquelas que têm como alvo VEGFR (bevacizumabe, sorafenibe, sunitinibe) e BRAF (vemurafenibe) (fig. 6). Apesar das semelhanças de distribuição palmoplantar, dependência de dose e da dor associada, a RMP se desenvolve em áreas de atrito ou propensas ao trauma (áreas de pressão), como o calcanhar e aspectos laterais das plantas e espaços interdigitais. As lesões iniciam 2–4 semanas após o início da terapia e são caracterizadas por hiperqueratose, lembram calosidades, ocasionalmente com bolhas superficiais e halos eritematosos.2,5,6,30,31 Dependendo da droga, as lesões podem melhorar ou não com o tempo.32
SMP e PATEO: numa revisão sistemática prévia, as duas únicas medidas com evidências significativas para prevenção (para diminuir a incidência e/ou severidade) foram o uso de anti‐inflamatório não esteroidal (AINE – celocoxibe) (para qualquer Grau: oddsratio – OR=0,47; 95% IC 0,29–0,78; p=0,003; para Grau 2–3: OR=0,39; 95% IC 0,20–0,73; p=0,003) e redução da dose. Um estudo mostrou benefício com o uso do resfriamento regional durante a infusão de quimioterapia (incidência de 36%×7,1%; p=0,0097). No entanto, como discutido anteriormente, luvas e meias congeladas geralmente não são bem toleradas pelos pacientes; em relação aos AINEs, os riscos e benefícios de seu uso devem ser ponderados; em relação às reduções de dose, tem impacto direto no desfecho da doença.33,34 O uso de emolientes pareceu promissor, mas sem diferença estatística significativa. A piridoxina não foi eficaz para a prevenção.33–35 Um ECR pequeno mostrou benefícios com o uso de uma pomada que contém antioxidante quando comparado ao placebo em pacientes tratados com doxorrubicina lipossomal peguilada.36 Para RMP, um ECR mostrou uma incidência menor de qualquer grau e de reação >Grau 2 com o uso de creme de ureia a 10% comparado ao “melhor tratamento de suporte” (para qualquer Grau: OR=0,457; 95% IC 0,34–0,60; p <0,001; para ≥ Grau 2: OR=0,635; 95% IC 0,46–0,86; p=0,004). Os resultados podem ser questionados, no entanto, porque “o melhor tratamento de suporte” foi de fato nenhum tratamento preventivo.37,38 Outro estudo prospectivo pequeno mostrou uma diminuição na ocorrência de RMP em pacientes tratados com sorafenibe com a ingestão de um alimento japonês (Bonito broth) quando comparado a não ingestão (razão de risco, HR=0,097; 95% IC 0,011–0,846; p=0,035 na análise multivariada). Esse alimento mostrou levar a aumento do fluxo sanguíneo periférico em humanos.39 Outro relato isolado mostrou sucesso com o uso de calcipotriol tópico em um caso.40
Apesar da ausência de evidências fortes, recomendam‐se as seguintes medidas preventivas:2,5–7,30,31,41
- •
Educar pacientes quanto aos primeiros sinais e sintomas;
- •
Uso de luvas grossas de algodão e/ou meias;
- •
Aplicação de cremes emolientes (emolientes à base de ureia no tipo hiperceratótico) nas mãos e pés regularmente;
- •
Evitar substâncias irritantes como álcool, agentes de limpeza agressivos e roupas e sapatos apertados;
- •
Evitar extremos de temperatura, pressão e atrito (por exemplo: atividades repetitivas, trabalho manual estressante)
- •
Para RMP também incluir uma avaliação pré‐tratamento com um podólogo com desbastamento de calosidades e o uso de palmilhas ortopédicas quando necessário.
Também existe pouca evidência sobre medidas de tratamento. As reduções de dose são eficazes, mas interferem nos resultados relacionados à doença. Um pequeno ensaio prospectivo não comparativo demonstrou melhoria na qualidade de vida e diminuição dos sintomas da SMP com o uso de um polímero tópico não oclusivo por oito semanas.42 Para RMP, um pequeno estudo randomizado de fase II mostrou benefício com o tratamento de toxicidade de Grau 1 com um curativo hidrocoloide que continha ceramida com superfície externa de baixo atrito quando comparado à ureia 10% creme (Grau 2–3: 29% vs. 69%, p=0,03).43 Recentemente, uma revisão sistemática mostrou benefícios de diferentes ervas chinesas no tratamento de toxicidades acrais. No entanto, a maioria dos estudos não era cega e era de qualidade metodológica inferior.44,45 Um relato de caso e uma pequena série de casos sugerem benefícios no uso de Henna tópica para RMP pela capecitabina.46,47 Além das medidas preventivas já mencionadas, recomendações desse grupo para o tratamento dessas toxicidades incluem:2,5–7,30,31,41
- •
Continuar o uso de medidas preventivas;
- •
Manter o uso de emolientes e, no caso do RMP, incluir o uso de agentes queratolíticos (p. ex.: ureia 10%–40%, ácido salicílico);
- •
Adicionar um corticosteroide tópico potente;
- •
Para alívio dos sintomas, compressas frias ou imersão de mãos e pés em água fria, anestésicos tópicos e AINEs podem ser usados;
- •
A redução da dose ou interrupção do tratamento é por vezes necessária até que os sintomas diminuam.
Um dos problemas de definir melhor os EADs em muitos estudos de oncologia é que frequentemente os pesquisadores relatam os diferentes tipos de erupções cutâneas como um rash. No entanto, como veremos, existem diferentes tipos de erupções cutâneas, associadas a diferentes classes de drogas e com diferentes opções de tratamento.
Reações de hipersensibilidade agudas: as reações mediadas por imunoglobulina Tipo I podem ocorrer em questão de minutos a horas da infusão. Elas se manifestam como reações de hipersensibilidade clássicas às drogas convencionais, como prurido, rubor, urticária e até anafilaxia. A diferença depende da maneira como lidamos com isso. Com os medicamentos convencionais, os pacientes geralmente são orientados a evitar a reexposição. Ao lidar com tratamentos oncológicos, o agente quimioterápico é fundamental para a sobrevida relacionada à doença. Portanto, costumamos manter o fármaco para os próximos ciclos e administrar a reação com uma infusão mais lenta, uma pré‐medicação com corticosteroides e anti‐histamínicos antes de cada infusão e um monitoramento mais próximo.4,6,7
Exantemas: muitos tratamentos podem estar relacionados a uma erupção maculopapular inespecífica ou erupção morbiliforme que começa gradualmente, às vezes semanas após o início da droga, com sintomas leves, como prurido. Esses EADs podem ser manejados com anti‐histamínicos e corticosteroides tópicos quando limitados, ou com ciclos curtos de corticosteroides orais quando mais disseminados. Todas as classes de agentes podem causar esse tipo de reações, como inibidores da quinase (por exemplo: inibidores de BRAFi – vemurafenibe/kit e BCR‐ABL – imatinibe, dasatinibe), inibidores de checkpoint (ipilimumabe, nivolumabe) e agentes quimioterápicos clássicos (bleomicina, carboplatina, etoposídeo, etc.).4,6,7 Apenas em casos raros, reações graves como necrólise epidérmica tóxica (NET), síndrome de Steven‐Johnson (SSJ) ou erupção cutânea com eosinofilia e sintomas sistêmicos (DRESS) podem ocorrer, mas deve ser lembrado que uma erupção maculopapular pode representar a primeira manifestação dessas condições potencialmente graves. Atenção especial deve ser dada ao usar uma terapia direcionada após o uso de uma imunoterapia (p. ex.: pacientes com melanoma tratados com imunoterapia e depois trocados para um BRAFi), pois pode estar associado a um risco maior de toxicidade cutânea grave (> Grau 3 e SSJ/NET). Alguns autores sugerem pelo menos um intervalo de 4 semanas entre os tratamentos com esses agentes.7,48–50
Quando um paciente está em imunoterapia, os eventos adversos da pele com drogas convencionais (por exemplo, antibióticos) podem ser mais intensos. Por isso é sempre importante excluir outros agentes causadores, antes de relacionar a erupção ao inibidor do checkpoint.
Eritema tóxico da quimioterapia (ETQ): esse termo é sugerido por alguns autores para unificar diferentes manifestações, como SMP, erupção intertriginosa da quimioterapia ou outros termos histopatológicos usados, como “siringometaplasia escamosa écrina”, todos relacionados à toxicidade direta do agente quimioterápico, e não devido a uma reação alérgica. Esse tipo de EAD caracteriza‐se por características sobrepostas de eritema doloroso bilateral, edema e até mesmo lesões bolhosas localizadas nas mãos e nos pés (ver síndrome mão‐pé) e às vezes também afeta áreas intertriginosas, como axilas e virilhas (menos frequentemente orelhas, joelhos e cotovelos) (fig. 5). É importante distinguir, porque essas manifestações geralmente são autolimitadas, muitas vezes resolvem‐se com descamação e pigmentação pós‐inflamatória e não exigem medidas agressivas. Além disso, as lesões desenvolvem‐se 2–3 semanas após o ciclo de quimioterapia, geralmente quando as defesas do paciente são mais baixas (p. ex.: neutropenia), são muitas vezes diagnosticadas como infecções ou doença do enxerto contra o hospedeiro (DECH). O tratamento baseia‐se em corticosteroides tópicos e emolientes e educar o paciente sobre a natureza da manifestação. Frequentemente recrudesce nos ciclos subsequentes. Pode ser mais suave com reduções de dose.20,51
Erupção papulopustulosa: também conhecida como “erupção cutânea acneiforme” ou “foliculite”, é a toxicidade dermatológica mais comum do tratamento com EGFRi (fig. 4). Geralmente aparece 1–2 semanas após o início da terapia, inicia‐se com eritema, seguido pela erupção de pápulas e pústulas (estéreis) na face, couro cabeludo, parte superior do tórax e dorso, com ausência de comedões. Às vezes, as lesões se estendem aos membros. A pele é geralmente seca, pruriginosa e sensível (os pacientes referem sensação de queimação, ardência, sensibilidade). Esse EAD tem um alto impacto na qualidade de vida do paciente e nos aspectos sociais da vida diária, é uma causa de redução da dose ou mesmo de interrupção do tratamento. A erupção tende a melhorar em torno da 8ª semana, mas geralmente persiste, como uma erupção mais branda, com períodos de melhoria e pioria. Outras características presentes, principalmente mais tardiamente no tratamento, são as já citadas paroníquia, fissuras periungueais e granulomas, xerose, prurido e as alterações capilares que ainda serão discutidas como tricomegalia, hipertricose e alopecia não cicatricial.6,24–26,52
PrevençãoMedidas gerais diárias já foram discutidas e são de grande importância para esse grupo de agentes. Elas incluem o uso regular de emolientes, medidas de proteção solar (a exposição ao sol pode piorar a erupção), evitar agentes irritantes, tempo de banho limitado e uso de limpadores suaves. O uso de antibióticos sistêmicos (principalmente tetraciclinas) nas primeiras 6–8 semanas de tratamento foi avaliado em alguns estudos com resultados discordantes. Os dados disponíveis sugerem algum benefício do tratamento preventivo em diminuir a incidência e principalmente a intensidade da erupção papulopustular quando comparado a nenhum tratamento ou mesmo ao tratamento reativo (iniciado uma vez que a erupção já está presente).27,53,54 Essa também é a opinião desse painel de especialistas. Sugerimos o uso de tetraciclinas orais (p. ex., doxiciclina 100 mg 2×ao dia) durante as primeiras 6 a 8 semanas de tratamento com EGFRi. Em um estudo randomizado de fase II, a eritromicina tópica foi inferior à doxiciclina oral na prevenção da toxicidade cutânea do EGFR.54 Outro ensaio mostrou algum benefício com o uso preventivo de corticosteroides tópicos de baixa potência, mas recomendamos seu uso apenas como tratamento reativo.
TratamentoApesar da aparência semelhante à acne, os agentes tópicos usados para tratar acne e erupções acneiformes, tais como peróxido de benzoíla, ácidos retinóicos e produtos com ácido salicílico, são contraindicados. Se a erupção ocorrer, medidas preventivas devem ser mantidas e, a isso, corticosteroides tópicos podem ser adicionados. Se mais pronunciada e a tetraciclina não foi iniciada para prevenção, ela pode ser iniciada como tratamento reativo.6,24,25 Algumas vezes, reduções de dose podem ser necessárias. Se crostas ou secreção excessiva, as culturas são indicadas para excluir infecção bacteriana secundária. Nesses casos, o tratamento antimicrobiano guiado por cultura é indicado. Recentemente, um ECR único mostrou benefício com o uso de um composto tópico fitoterápico chinês (comparado ao placebo) para o tratamento dos EADs relacionados à terapia alvo, inclusive a erupção papulopustular.45 Além disso, há alguns relatos e alguma experiência pessoal sobre o uso de baixas doses de isotretinoína sistêmica para casos refratários.55
Erupção acneiforme: os regimes quimioterápicos convencionais frequentemente contêm altas doses de corticosteroides sistêmicos, como dexametasona ou prednisona. Por esse motivo, pode ocorrer erupção acneiforme clássica relacionada aos corticosteroides e deve ser tratada de forma semelhante aos pacientes não oncológicos.
Reações de fotossensibilidade: há relatos de tratamentos oncológicos que causam tanto reações fototóxicas quanto fotoalérgicas. Muitos agentes convencionais, como 5‐FU e taxanos, têm relatos de erupções inflamatórias em áreas fotoexpostas (principalmente a UVB).4,20 Com o EGFRi, não apenas erupções fotossensíveis podem ocorrer, mas também os outros EADs podem ser exacerbados pela exposição à luz.6 Um dos agentes mais fotossensibilizantes é o vemurafenibe (BRAFi), com uma sensibilidade comprovada para a radiação UVA, que está presente nas lâmpadas de fluorescência e passa pelas janelas.5,7,56,57 O vandetanibe (TKI) também está associado a uma sensibilidade UVA. Medidas preventivas de proteção solar são fundamentais. Se a reação ocorrer, ela pode ser tratada com corticosteroides tópicos ou com ciclos curtos de corticosteroides orais.
Erupção queratose pilar‐símile: esse evento adverso tem sido associado ao uso de BRAFi e é caracterizado por pápulas ceratóticas foliculares difusas em uma distribuição generalizada, semelhante à queratose pilar (fig. 7). Podem ser usados agentes queratolíticos tópicos.7 O vemurafenibe também pode causar erupção morbiliforme foliculocêntrica.
Anormalidades dos pêlos e cabelosAlgumas medidas gerais recomendadas para o cuidado diário do cabelo e couro cabeludo incluem o uso de um xampu suave, evitar água quente, tinturas e uso de secador.
Alopecia induzida por quimioterapia clássica (AIQC): é um dos eventos mais estressantes em pacientes com câncer tratados com agentes clássicos. É causada principalmente por um eflúvio anágeno e é geralmente (embora nem sempre) completamente reversível 2 a 6 meses após o tratamento ser descontinuado.2,20 Afeta mais frequentemente o couro cabeludo, mas sobrancelhas, cílios e outras áreas do corpo também podem ser afetadas. A perda de cabelo será influenciada não apenas pelo fármaco, mas também pela via de administração, dosagem e frequência (p. ex.: doses altas, regimes intravenosos e intermitentes são mais propensos a causar alopecia completa). Exemplos de agentes com alto risco incluem ciclofosfamida, doxorrubicina, irinotecano e taxanos (docetaxel e paclitaxel).
PrevençãoUma revisão sistemática de medidas preventivas não encontrou benefício com o uso de minoxidil tópico ou compressão do couro cabeludo. O benefício foi encontrado com o uso de um dispositivo de resfriamento do couro cabeludo (RR=0,38; 95% IC 0,32–0,45; p <0,001).58–61 Os sistemas de resfriamento do couro cabeludo incluem dispositivos estáticos (toucas resfriadas) e sistemas de resfriamento dinâmico do couro cabeludo. Os doentes devem ser advertidos de que a eficácia do tratamento é variável (cerca de 50%–80%, depende do agente). Dados disponíveis sugerem que essa tecnologia é mais eficaz para esquemas quimioterápicos baseados em taxanos em comparação com esquemas quimioterápicos baseados em antraciclinas.62 Além disso, o uso de dispositivos de resfriamento nem sempre é bem tolerado, pois pode causar sintomas como dor de cabeça e sensibilidade no couro cabeludo. Os dispositivos também não são reembolsáveis pelas companhias de seguros e podem ter um alto custo. Estudos recentes mostraram que a incidência de metástase do couro cabeludo não está aumentada em pacientes com câncer de mama com doença localizada tratada com resfriamento do couro cabeludo.63,64 No entanto, há dois casos relatados de recorrência da doença em pacientes com neoplasias hematológicas (micose fungoide e leucemia mieloide aguda).65,66 Por esse motivo, o resfriamento do couro cabeludo deve ser evitado em neoplasias hematológicas.67
TratamentoO minoxidil não foi eficaz na prevenção da AIQC, mas um pequeno estudo mostrou que o minoxidil 2% foi associado a uma repilação mais rápida dos cabelos (tempo de repilação de 86 vs. 136 dias no grupo placebo).68 Outros agentes como calcitriol tópico estão sob investigação, mas ainda sem resultados definitivos.2,69 Com base nos estudos e na prática diária dos autores, recomendamos o uso de minoxidil tópico 5% uma vez ao dia após o término dos ciclos de quimioterapia. Para sobrancelhas e cílios, a bimatoprosta tópica pode ser usada (um estudo controlado para cílios mostrou benefício aos 12 meses).70 A biotina e outros suplementos orais podem ser adicionados. Camuflagem e apoio aos pacientes também são estratégias importantes.
Reversibilidade: AIQC é completamente reversível na maioria dos casos. Quando ocorre crescimento do cabelo incompleto/subótimo após 6 meses de descontinuação da terapia, é considerado uma AIQC persistente (pAIQC). Tem um padrão geralmente difuso e não cicatricial e ocorre mais frequentemente com regimes de altas doses pré‐transplante de medula óssea (geralmente bussulfano e ciclofosfamida) ou com taxanos.20,71
Outro padrão frequente de alopecia persistente em pacientes com câncer é descrito como alopecia induzida por terapias endócrinas (ET). Para muitos sobreviventes de carcinamas de mama receptores hormonais positivos, moduladores seletivos do receptor de estrogênio (p. ex., tamoxifeno, toremifeno), inibidores de aromatase (p. ex., anastrozol, letrozol, exemestano) e agonista do hormônio liberador de gonadotropina (p. ex., leuprolide) são geralmente administrados por anos para reduzir o risco de recorrência.5–10 Essa privação de estrogênio pode levar a uma alopecia‐padrão androgenética. O minoxidil tópico pode ser usado. Quanto ao uso de terapias sistêmicas para alopecia androgênica (p. ex., espironolactona, finasterida), há um risco mínimo de estimulação hormonal de tumores receptores endócrino‐positivos. Portanto, o uso desses agentes deve ser discutido com o oncologista e feito com cautela.67,71
Alterações dos pêlos induzidas pelas terapias‐alvo: alterações na qualidade do cabelo, textura e padrão de crescimento podem ser vistos em torno do segundo ou terceiro mês de tratamento.
Cabelos: no couro cabeludo, os cabelos crescem mais lentamente e com uma maior fragilidade da haste. Pode ocorrer uma erupção semelhante à dermatite seborreica (especialmente com VEGFRi e BRAFi). Além disso, a erupção cutânea papulopustular que afeta a face e o tronco pode envolver o couro cabeludo (especialmente com EGFRi). A alopecia é geralmente leve e com padrão androgenético, mas casos de alopecia inflamatória não cicatricial têm sido descritos, assim como casos de alopecia cicatricial induzida por erlotinib.5,6
Para essas alterações inflamatórias, sugerimos o uso de xampus anticaspa e corticosteroides tópicos (loção ou xampu). Se houver suspeita de infecção bacteriana, os antibióticos guiados por cultura são indicados.
Face, cílios e sobrancelhas: tricomegalia (cílios mais longos, mais grossos e muitas vezes enrolados) e hipertricose são frequentes (fig. 4). Os cílios encurvados para dentro podem resultar em ceratite. Portanto, o corte dos cílios é recomendado e os pacientes com sintomas oculares devem ser encaminhados a um oftalmologista. Para hipertricose, podem ser usadas intervenções cosméticas tópicas (p. ex., depilação com cera ou branqueamento). Quando disponíveis, os tratamentos com laser e fotoepilação são mais eficazes e não estão contraindicados.69 Os cremes para depilação devem ser evitados devido ao seu potencial de sensibilização naqueles indivíduos que já têm uma disfunção da barreira da pele.
Alterações dos pêlos induzidas por imunoterapia: foram relatados casos de alopecia com um padrão clínico e histológico consistente com alopecia areata (AA). Os pacientes devem ser tratados de forma semelhante aos casos de AA não oncológicos. Também foram descritos relatos de despigmentação e repigmentação do cabelo. Embora aconselhemos os pacientes a evitar a tintura dos cabelos, ela não é contraindicada e, se houver uma preocupação cosmética importante, tinturas podem ser usadas.69
Mudanças em nevos melanocíticosInibidores de BRAF: podem estar associados ao aparecimento de nevos melanocíticos eruptivos (NME), alteração de nevos preexistentes (aumento e aquisição de estruturas dermatoscópicas, assim como a regressão de nevos que apresentam a mutação BRAF) e aparecimento de novos melanomas.72,73 Portanto, o acompanhamento dermatoscópico próximo é recomendado. A involução dos NME induzida por inibidor de BRAF após a adição concomitante de inibidor de MEK foi descrita.74
Imunoterapia: recentemente, tem sido descrita regressão de múltiplos nevos melanocíticos após imunoterapia para melanoma.75,76
Outras toxicidades particularesNeoplasias epidérmicas relacionadas aos inibidores de BRAF: queratoacantomas, carcinomas espinocelulares e queratoses verrucosas são um EAD comum dos BRAFi, podem também ocorrer com alguns agentes antiangiogênicos (fig. 7). Isso é provavelmente devido à estimulação paradoxal da via da MAPK em células do tipo BRAF selvagem. Quando os inibidores de MEK são usados em associação, esse EA é muito menos frequente. As lesões podem ser tratadas com excisão cirúrgica (quando apenas algumas lesões estão presentes), tratamentos destrutivos (crioterapia, curetagem), tratamentos tópicos (queratolíticos, 5‐FU, imiquimod) ou terapia fotodinâmica.7
Estomatite relacionada aos inibidores de mTOR (rapamicina, everolimo, sirolimo): a estomatite é o EA mais comum e pode ser grave, leva a ajustes de dose. Diferentemente da mucosite de quimioterapia convencional (ulceração ampla com formações de pseudomembrana), a estomatite relacionada à mTOR manifesta‐se como aftas discretas no epitélio não queratinizado. Elas podem ser tratadas com enxagues antissépticos, corticosteroides e anestésicos tópicos.7
Outras erupções relacionadas à imunoterapia: uma erupção maculopapular não específica, como relatada anteriormente, representa o tipo mais prevalente de evento adverso imunomediado (EAi) a essa classe de agentes. No entanto, tipos peculiares de reações foram descritos e incluem:
- •
Reações liquenoides: essas erupções podem se desenvolver tanto na pele quanto nas mucosas (orais e genitais). O envolvimento oral também pode incluir xerostomia e alteração do paladar;
- •
Psoríase e rosácea: esses agentes podem induzir exacerbação ou novo surgimento de psoríase;
- •
Doenças bolhosas autoimunes: o desenvolvimento de doenças bolhosas autoimunes, especialmente o penfigoide bolhoso, tem sido relatado.
- •
Sarcoidose: também estão sendo publicados recentemente relatos de sarcoidose (início recente ou reativação).
- •
Vitiligo: a imunoterapia tem sido associada a lesões do tipo vitiligo, principalmente, mas não apenas, em pacientes tratados para melanoma.64
Um ponto de discussão é sobre se o uso de corticosteroides pode ou não diminuir a eficácia da imunoterapia. Os dados clínicos atuais são limitados e controversos. Em algumas análises retrospectivas, não foi associada a respostas inferiores ao tratamento oncológico. Uma recente revisão sistemática concluiu que “pode não levar necessariamente a desfechos clínicos mais desfavoráveis”.77 Por outro lado, a análise retrospectiva em pacientes com câncer de pulmão com o uso de corticosteroides no início do tratamento ou para EAi sugeriu um possível efeito deletério.78,79 A maioria das diretrizes atuais e painéis de especialistas não contraindica seu uso.7,10–13 Como não há conclusões definitivas, sugerimos que os corticosteroides sejam usados com cautela e sempre se discuta seu uso com o restante da equipe, especialmente os oncologistas. Para casos refratários a esteroides, outros agentes imunomoduladores, como micofenolato, infliximabe, metotrexato e outros, e também rituximabe para doenças bolhosas, podem ser necessários e alguns relatos com seu uso foram publicados.
Considerações finaisOs eventos adversos dermatológicos são uma das toxicidades mais frequentemente observadas em tratamentos contra o câncer. Mesmo que raramente apareçam como manifestações de ameaça à vida, elas podem levar a reduções de dose ou até mesmo a descontinuação da terapia oncológica, o que interfere no desfecho da doença. Além disso, eles têm um grande impacto na qualidade de vida dos pacientes. A capacidade de reconhecer e controlar essas toxicidades relacionadas à pele confere aos dermatologistas um papel importante na equipe multidisciplinar, fundamental para o melhor atendimento aos pacientes com câncer.
Ensaios clínicos randomizados prospectivos maiores, focados no manejo dos eventos adversos dermatológicos, ainda são necessários, mas com o crescente desenvolvimento e reconhecimento do campo da oncodermatologia essa realidade está a cada dia mais próxima.
Suporte financeiroGalderma.
Contribuição dos autoresJade Cury Martins: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura, revisão crítica do manuscrito.
Adriana Pessoa Mendes Eris: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Cristina Martinez Zugaib Abdalla: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Giselle de Barros Silva: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Veronica Paula Torel de Moura: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Jose Antonio Sanches: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflitos de interesseTodos os membros do painel de especialistas receberam honorários de Galderma por suas contribuições. Os autores não declaram outro conflito de interesse neste estudo.
Como citar este artigo: Cury‐Martins J, Eris APM, Abdalla CMZ, Silva GB, Moura VPT, Sanches JA. Management of dermatologic adverse events from cancer therapies: recommendations of an expert panel. An Bras Dermatol. 2020;95:221–237.
Trabalho realizado na Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.