A urbanização, a poluição e a modificação das paisagens naturais são características da sociedade moderna, cujo impacto na biodiversidade e mudança das relações humanas com o meio são determinantes ambientais que afetam a relação saúde‐doença. A pele é um órgão de intensa interface com o meio ambiente e, portanto, padrões de prevalência das dermatoses podem refletir mudanças ambientais. Nesse texto são abordados os aspectos relacionados a desflorestamento, queimadas, urbanização, agricultura de escala, pecuária extensiva, poluição e modificações climáticas quanto a sua influência na epidemiologia das doenças cutâneas. É importante que os dermatologistas estejam atentos à sua responsabilidade social no sentido de promover práticas sustentáveis em sua comunidade, além de identificar os impactos dos desequilíbrios ambientais em diferentes dermatoses, o que é fundamental na prevenção e no tratamento dessas enfermidades.
Desde sua origem, há 100‐200 mil anos, a história do Homo sapiens compreendeu uma intensa interação com o meio ambiente, especialmente a partir das migrações para fora da África, em que as contingências climáticas, de relevo e vegetação impuseram pressões adaptativas que resultaram em grande parte da diversidade da espécie.1 Sem a adaptação aos diversos desafios ambientais, o ser humano não teria ocupado todo o planeta.
Assim, os determinantes ambientais influenciaram tanto a evolução da espécie quanto a saúde da humanidade.2 Por exemplo, a hipótese mais aceita para a diferenciação das tonalidades da cor da pele deve‐se ao ganho evolutivo decorrente da síntese cutânea de vitamina D pela radiação UVB e à fotólise do folato pela radiação UVA, selecionando peles mais claras nas regiões de baixas latitudes.3‐5 O isolamento geográfico associado à deriva genética e à seleção sexual também foram importantes na definição das características dos principais grupos humanos.6 Entretanto, essa variabilidade genotípica implicou não somente nos fenótipos variados, mas também no desenvolvimento de diferentes respostas fisiológicas, originando propensões a doenças, respostas imunológicas, metabólicas e terapêuticas.7‐14Enquanto a espécie Homo sapiens evoluiu, ela interagiu intensamente com o meio ambiente, interferindo na relação saúde‐doença. Os grupos humanos caçadores e coletores (como os pigmeus e grupos ameríndios) causavam impacto ambiental discreto, tinham menor expectativa de vida e estavam mais expostos aos agravos ambientais, tais como acidentes por animais, inundações, infestações, zoonoses e restrições alimentares (p. ex., longas estiagens).15
A partir do momento em que o Homo sapiens adquiriu certo domínio da agricultura, pesca e domesticação de animais, começou a se fixar em territórios, estabelecendo os primeiros núcleos populacionais. Isso exigiu maior exploração dos recursos naturais e modificação do ambiente local. Dessa maneira, houve ganho de longevidade, de proteção contra agravos naturais e da possibilidade de expansão territorial.16
Com o desenvolvimento da industrialização e as mudanças nos meios de produção, houve explosões demográficas, urbanização e fluxo migratório para áreas urbanas. Esses fatores causaram grande impacto ambiental, acarretando em poluição do ar, do solo e das águas, além do consumo não sustentável dos recursos naturais.17,18 Do ponto de vista médico, as variadas formas de trabalho fizeram emergir as doenças ocupacionais, e o transporte globalizado disseminou doenças infecciosas como a sífilis e a ADIS, além de favorecer pandemias como a peste negra, influenza e a doença causada pelo novo coronavírus (COVID‐19).19–25 A condição histórica da humanidade reforça sua relação bilateral com o meio ambiente, assim como fundamenta relações sociológicas e econômicas e determina condições específicas de saúde. Face ao elevado grau de interação da pele com o meio exterior, a Dermatologia reflete sobremaneira as mudanças no meio ambiente. Os principais impactos das mudanças ambientais na especialidade serão discutidos a seguir.
Degradação ambientalDesmatamentoTanto a expansão urbana quanto a rural modificam as paisagens naturais, restringem a cobertura vegetal nativa, modificam o relevo, o fluxo de água e de resíduos, impactando de maneira direta a biodiversidade.26–29 O desflorestamento, a formação de pastos e lavouras e a exploração do subsolo estão historicamente associado à emergência de arboviroses, zoonoses ou outras doenças infecciosas que surgem em surtos ou de maneira endêmica, dependendo da forma que se procede o desmatamento. À medida que reduzem (ou se desequilibram) as florestas e ocorre a extinção dos reservatórios de certas doenças, o ser humano passa a ser envolvido em seu ciclo natural.2,29‐31 São exemplos que emergiram por esse desequilíbrio: epidemias de malária após a construção do canal do Panamá, mineração e de ferrovias na região Norte do Brasil; epidemia de febre amarela no litoral do Nordeste brasileiro na expansão canavieira do século XVII; e o surto de raiva na ilha de Marajó (2018), após a expansão agrícola.32‐36 Do mesmo modo, a recente pandemia da COVID‐19 originou‐se em área industrializada na China (Wuhan), provavelmente a partir da interação humana com morcegos contaminados, em consequência da restrição do seu ecossistema, o que deve alertar a humanidade sobre a emergência das questões ambientais como prioridade no desenvolvimento sustentável da sociedade moderna.25,37,38
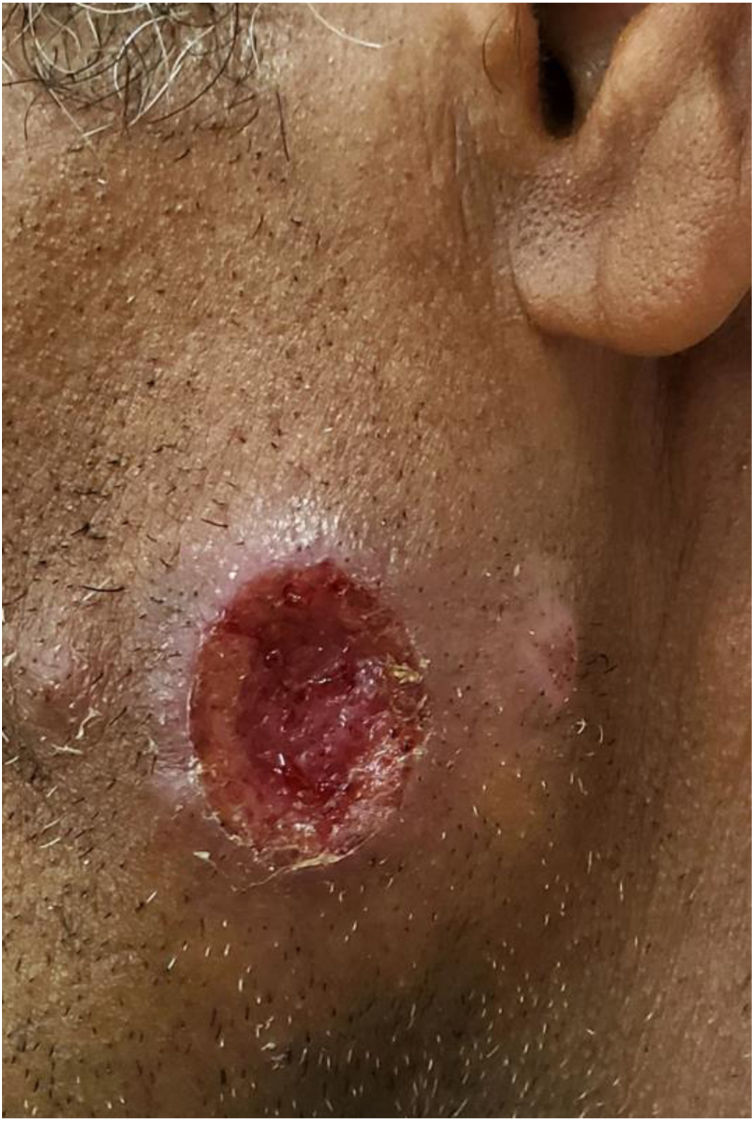
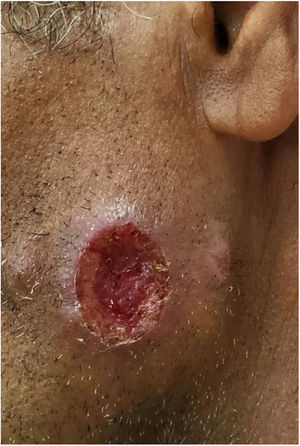
Na Dermatologia, a leishmaniose tegumentar americana (LTA) é causada por protozoários do gênero Leishmania, que causa úlceras cutâneas (fig. 1) e pode acometer mucosas em fases posteriores. É transmitida por mosquitos do gênero Phlebotomus, e apresenta ciclo zoonótico em mamíferos, especialmente marsupiais e roedores.39‐41 No Brasil, a descrição da LTA ocorreu durante a construção da estrada de ferro Noroeste, no início do século XX. Essa estrada visava o escoamento da produção cafeeira do interior de São Paulo e Mato Grosso. Toda essa área é rica em flebotomíneos, e a doença recebeu a denominação: “úlcera de Bauru”.36
A incidência de LTA vem aumentando nos últimos 30 anos em praticamente todos os estados do Brasil; foram descritos surtos nas regiões Sudeste, Centro‐Oeste, Nordeste e na região Amazônica. A maioria dos casos de LTA está associada ao processo predatório de colonização, construção de estradas, novos núcleos populacionais e ampliação de atividades agrícolas.42,43
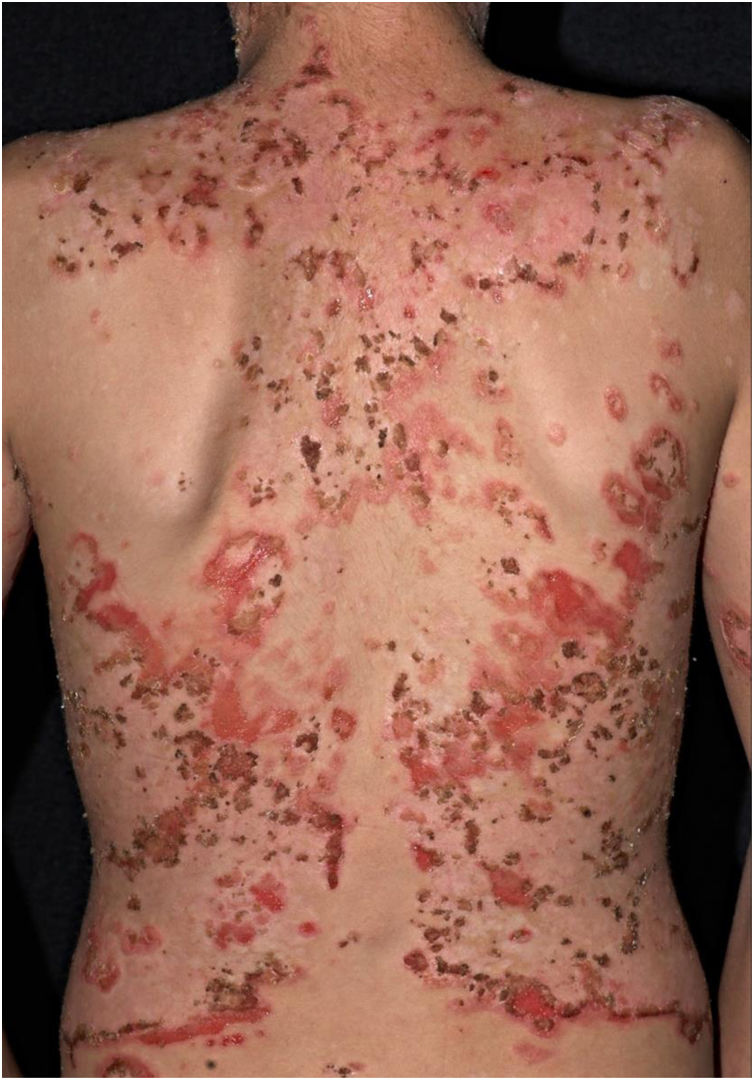
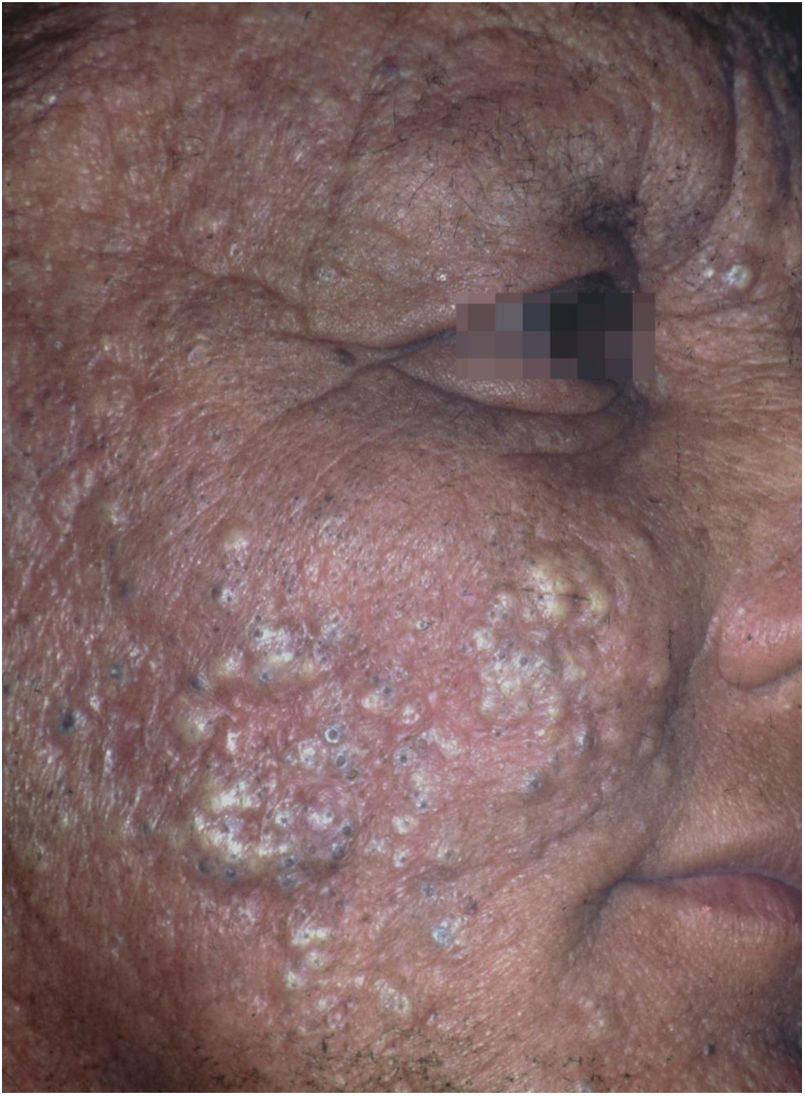
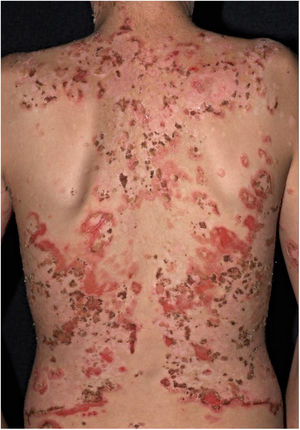
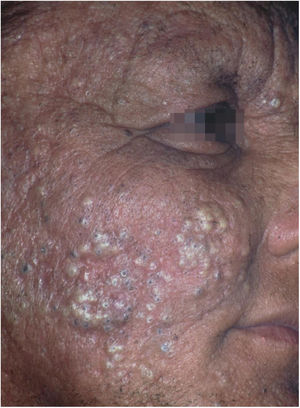
O desflorestamento pode causar migração de agentes infecciosos para vetores em áreas urbanas, favorecendo epidemias. Isso foi notado com a febre amarela, anteriormente transmitida pelo mosquito Haemogogus em áreas silvestres e que teve fases de intensa transmissão nas cidades pelo Aedes aegipti.44 Do mesmo modo, o Aedes albopictus, o outro disseminador de doenças virais, originário da Ásia e da África, foi recentemente introduzido no Brasil, e é também um vetor de dengue, zika e chikungunya.45,46 O desflorestamento e o esgotamento dos reservatórios naturais é a principal explicação para a ocorrência de casos autóctones de LTA em área metropolitanas, doença de Chagas e raiva (humana) por ataques de morcegos hematófagos em cidades.47‐54O subtipo “fogo selvagem” do pênfigo foliáceo difere da forma descrita por Cazenave por acometer pacientes mais jovens (com menos de 45 anos) e apresentar caráter endêmico (entre longitudes 45°‐60°W e latitudes 5°‐25°S, e altitudes entre 500‐800 m). O pênfigo foliáceo endêmico é uma dermatose bolhosa autoimune caracterizada por uma erupção eritemato‐descamativa com exulcerações por rompimento de bolhas frágeis, de distribuição craniocaudal, com fotossensibilidade e sem acometimento mucoso (fig. 2). A patogênese da doença está associada ao epitope spreading, em que a exposição repetida à picada de insetos (Simulium nigrimanum) aumentaria a produção de anticorpos patogênicos da subclasse IgG4 que levam ao reconhecimento dos domínios EC1 e EC2, da desmogleína 1.55,56 Durante o século XX, houve grande incremento da incidência da doença junto a áreas de desflorestamento no interior do Brasil, especialmente São Paulo, Mato Grosso, Goiás e Minas Gerais, seguindo por grandes bacias hidrográficas.57
A restrição territorial e da biodiversidade, promovidos pelo desflorestamento, afetam a reprodução dos grandes predadores, que demandam maior carga alimentar. Ademais, a recente descrição de ataques a humanos por animais selvagens (p. ex., macacos, onças‐pintadas, tamanduás, quatis) pode ser justificada pelo contingenciamento alimentar dos animais e aproximação forçada de centros urbanos.58‐60 A restrição numérica (ou extinção) dos predadores também pode explicar a proliferação e o aumento da incidência de acidentes com escorpiões, especialmente, no Nordeste e Sudeste do Brasil.61,62
A ocorrência de surtos de febre maculosa no interior de São Paulo é atribuída ao aumento da população de capivaras e outros reservatórios naturais de Rickettsia sp., protegidos por proibição de caça. Ainda, com a diminuição do número de predadores, como os grandes felinos, as populações de capivaras aumentaram exponencialmente e isto contribuiu para disseminarem os carrapatos infectados (principalmente Amblyomma sp.), levando a doença a áreas onde se encontram animais domésticos e a população humana.31,63,64
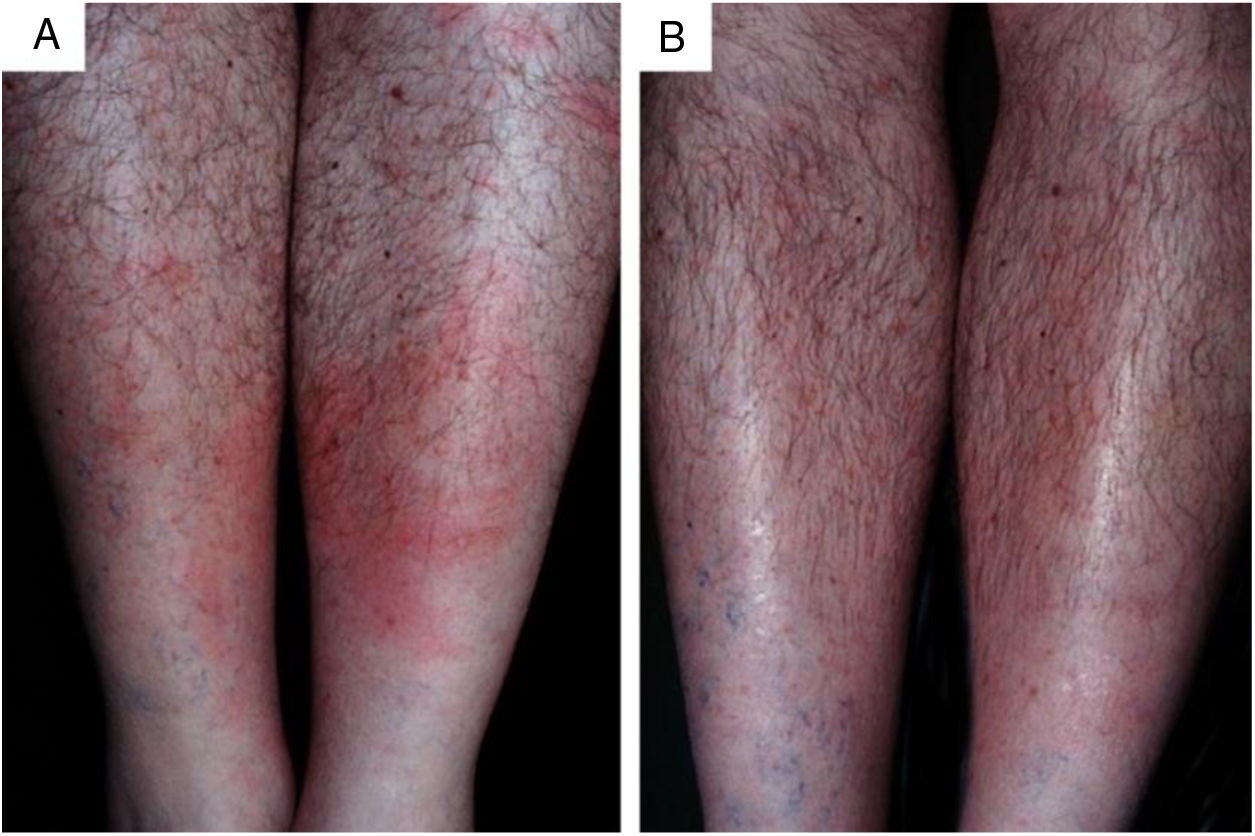
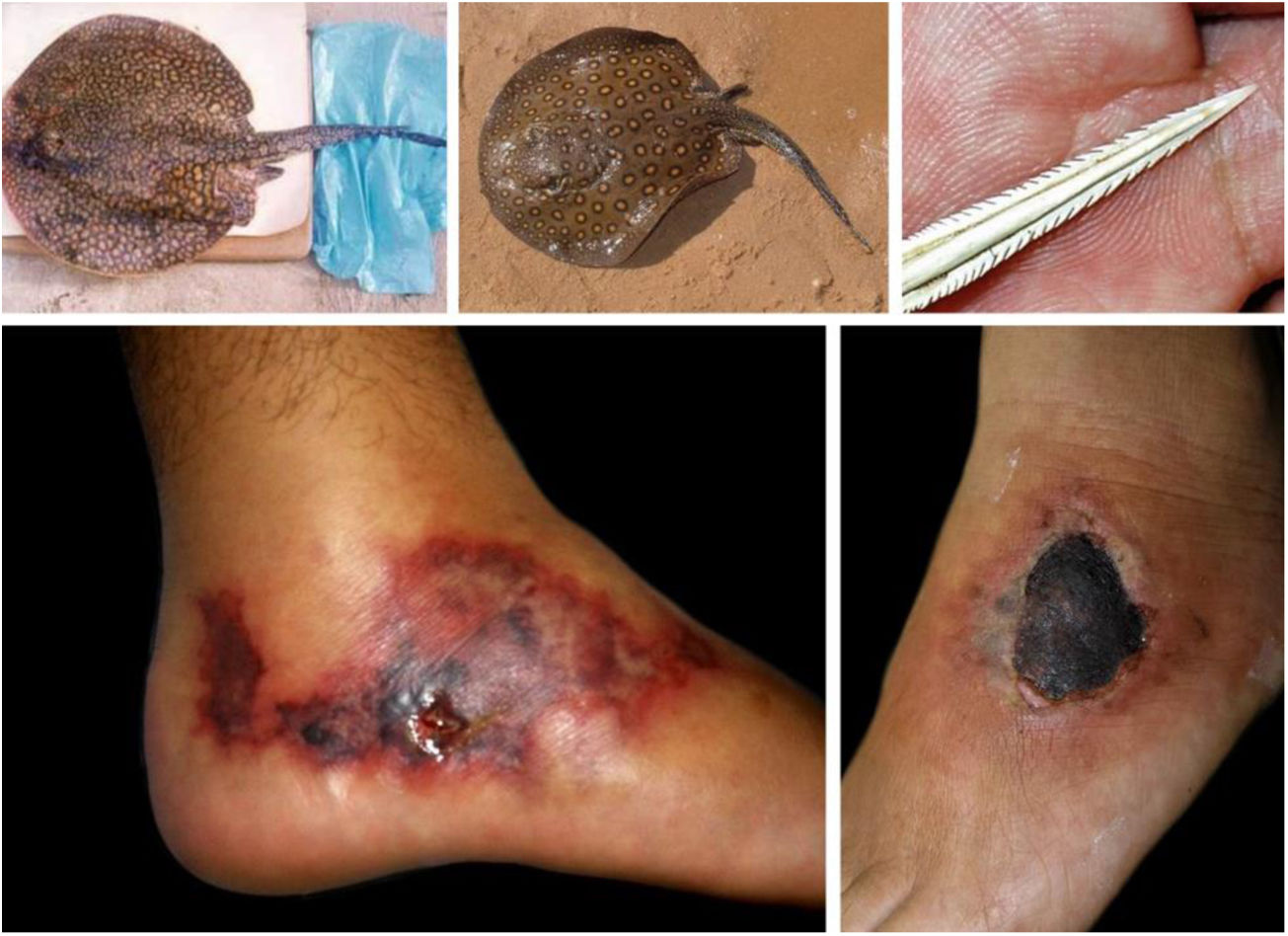
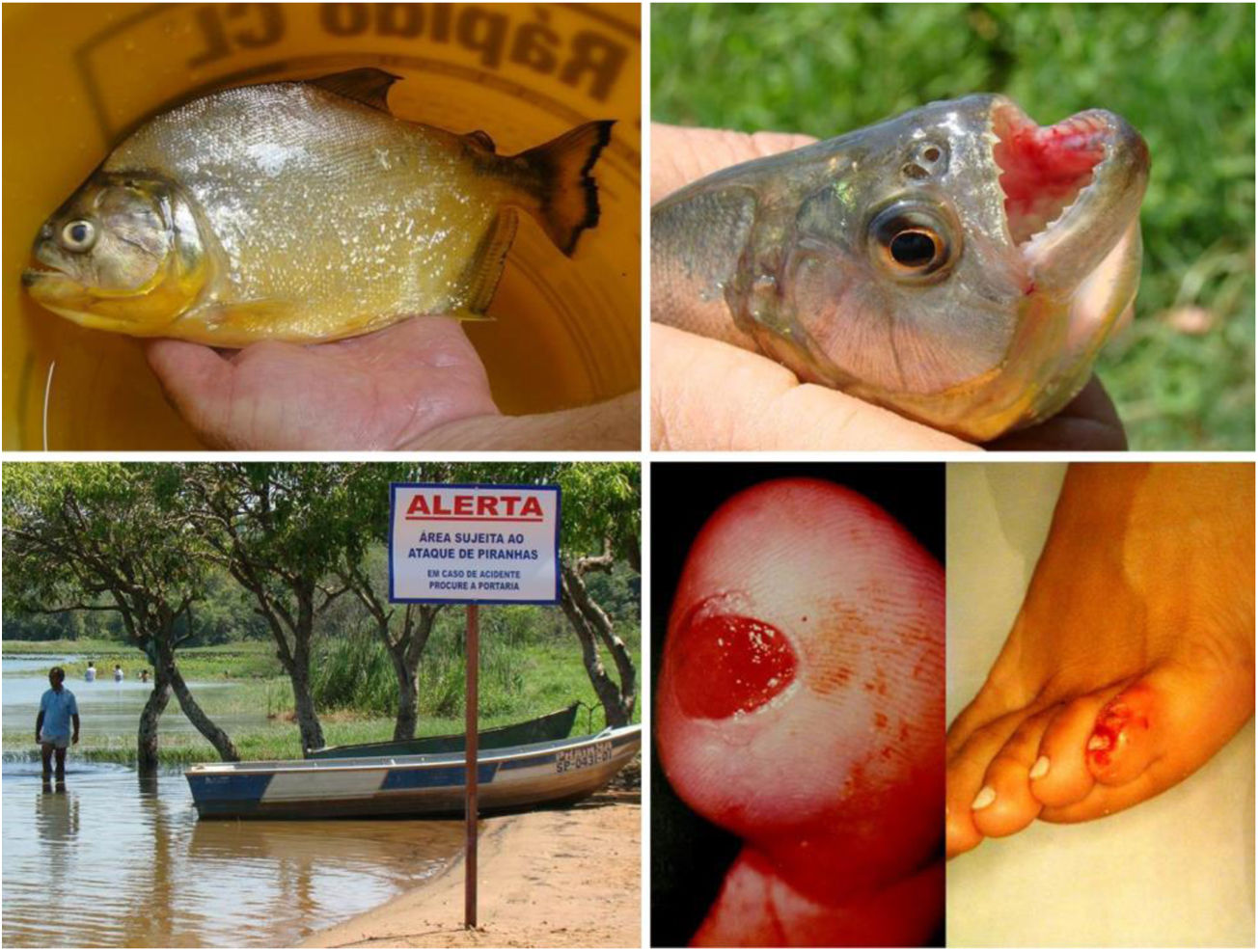
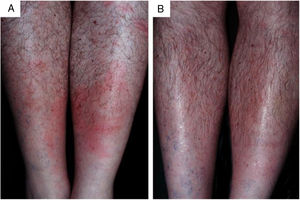
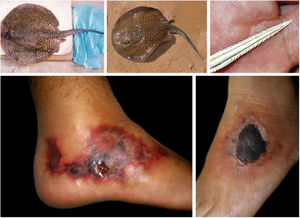
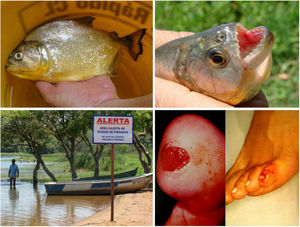
Fruto do mesmo desequilíbrio ambiental, a doença de Lyme, no continente americano, é causada principalmente pela espiroqueta Borrelia burgdorferi (sensu lato) e transmitida pela picada de carrapatos. Originalmente, ocorre entre animais silvestres, e é descrita em cervídeos europeus e norte‐americanos. Entretanto, está presente também no Brasil, atingindo cervídeos e capivaras, que ao se aproximar de centros urbanos disseminaram a doença para animais domésticos e seres humanos. A doença apresenta manifestação cutânea precoce (erythema chronicum migrans), podendo desencadear reações esclerodermiformes, e é potencialmente grave (fig. 3).65 A variante brasileira da doença de Lyme (borreliose‐símile, ou síndrome de Baggio‐Yoshinari) carece de maiores estudos, especialmente porque sua incidência parece ser subdimensionada frente à pluralidade de manifestações clínicas que podem não ser exatamente iguais à doença de Lyme clássica (europeia ou norte‐americana).66‐70O Brasil é o país com a maior rede de água doce do mundo. Por isso, a principal matriz energética nacional se desenvolveu a partir da construção de hidrelétricas, especialmente a partir da década de 1950, levando à inundação de mais de 34.000km2.71 Grandes represamentos de água, porém, promovem profundas e danosas modificações no relevo e no ecossistema ribeirinho. As influências das mudanças no microclima local (temperatura e pluviosidade) serão discutidas adiante. As modificações na fauna aquática, quer pela redução da vazão dos rios, quer pela introdução não planejada de espécies de peixes, são determinantes ambientais para agravos à saúde.72‐74Arraias fluviais, por exemplo, são animais autóctones das regiões Norte e Centro‐Oeste brasileiros. Após a construção de barragens pluviais, reduziram‐se as barreiras naturais, o que favoreceu a mobilização dos peixes à jusante do rio Paraná, precipitando graves acidentes em pescadores e banhistas na região Sudeste, incluindo o estado de São Paulo e o rio Tietê (fig. 4).75 De maneira semelhante, piranhas se estabeleceram em áreas represadas e causam surtos de acidentes em banhistas no período de veraneio (fig. 5).76,77
Arraias fluviais (Potamotrygon sp.) associadas a acidentes graves com banhistas e pescadores na bacia do rio Paraná. Detalhe do ferrão serrilhado. Lesões cutâneas por acidentes com arraia: úlceras nos membros inferiores com extensa base livedoide (< 72 horas) que evoluem com necrose e escara (> 7 dias).
Por fim, o desflorestamento também modifica o ciclo pluviométrico regional, cujo alcance do impacto na biodiversidade ultrapassa a área desmatada. No início do século XX, a cidade de São Paulo era conhecida como “terra da garoa”, em função da intensa atividade pluviométrica decorrente da densa mata atlântica que a cercava e da rica hidrografia. Atualmente, constitui a maior megalópole da América Latina, e a extensa “ilha de calor” modificou substancialmente o microclima da região. O progressivo desflorestamento da Amazônia também já é perceptível na redução do índice pluviométrico da região Norte dos últimos 50 anos.78
Um processo de desflorestamento de pequenas áreas utilizado por indígenas e quilombolas são as queimadas (coivaras), que consiste em um uso controlado e circunscrito do fogo, já que o incêndio é limitado pelos aceiros, áreas desmatadas para interromper a continuidade da combustão, provocando dano ambiental mínimo. Entretanto, os recentes incêndios em extensas áreas do Pantanal e da Floresta Amazônica (assim como ocorreu na Austrália e na Argentina) são imputados tanto à combustão espontânea em tempos de seca quanto à prática de desflorestamento pelos moradores, principalmente para expansão de pastagens e agricultura.79
A redução do regime de chuvas favorece a disseminação de focos de incêndio, que, além da massiva poluição do ar e do dano à biodiversidade, promovem uma rápida migração de animais selvagens e de vetores de doenças em fuga de seu habitat em chamas. Nesse contexto, aumentam as chances de acidentes com/por animais e da transmissão de zoonoses em áreas urbanas próximas às regiões incendiadas.
Agricultura de escalaA produção de alimentos para a atual demanda populacional do planeta depende do aprimoramento de técnicas de produção, e isso inclui a mecanização das lavouras, o melhoramento genético e o uso de defensivos agrícolas.
Desde a década de 1950, os defensivos agrícolas foram inseridos progressivamente na agricultura brasileira. Entretanto, a qualificação dos agricultores para seu uso e manejo não acompanhou essa tendência, gerando danos à saúde e ao meio ambiente. A falta de proteção individual no manuseio dos pesticidas favorece a toxicidade cutânea e respiratória.80,81
A exposição (ocupacional ou industrial) aos hidrocarbonetos clorados (dinitrofenol, pentaclorofenol) leva a erupções acneiformes do tipo cloracne (fig. 6).19 Já o manejo de organofosforados, carbamatos, piretroides e dipiridilos leva ao desenvolvimento de dermatites de contato alérgica e irritativas.80 A exposição aos pesticidas já foi também apontada como fator de risco para neoplasias cutâneas, incluindo o carcinoma espinocelular e o melanoma. Acredita‐se que o arsênico seja o principal carcinógeno envolvido nesse processo.82,83
A mecanização da agricultura reduziu sobremaneira o contato direto do lavrador com a terra e com a vegetação, o que, além de demandar menos profissionais para a mesma atividade, exigiu maior qualificação profissional no campo. No âmbito da Dermatologia, além de reduzir acidentes ocupacionais e por animais peçonhentos, a mecanização promoveu redução nos casos de micoses profundas na área rural.84 A incidência de paracoccidioidomicose vem declinando progressivamente nos últimos 30 anos, até porque ocorre interferência da umidade do ar, reservatório hídrico e pressão atmosférica na viabilidade dos fungos no solo. Estados da região amazônica (p. ex., Rondônia), devido à agricultura mais recente, ainda mantêm os indicadores mais expressivos.85‐87Modificações genéticas nas sementes (plantas transgênicas), cultivo de espécies não autóctones, agricultura de escala e a pecuária extensiva demandam desflorestamento e promovem importante redução na biodiversidade, favorecendo a emergência de agravos à saúde.
UrbanizaçãoA transição demográfica brasileira do último século se caracterizou pela migração urbana da população, industrialização e modificação da pirâmide etária. Poucos municípios, porém, apresentaram um desenvolvimento planejado e sustentável, resultando em problemas de habitação, acesso à saúde, água potável e saneamento básico (fig. 7).88,89 Essa conjuntura constitui um grande desafio para as políticas públicas de saúde, por depender do conhecimento e da modificação de seus determinantes sociais, em vez de apenas promover diagnósticos e oferecer medicamentos.90
Grandes aglomerados urbanos, com meios de transporte de massa (p. ex., trem, ônibus), são desafios no controle de doenças com transmissão respiratória, como a tuberculose e a COVID‐19, cuja progressão em metrópoles é mais evidente que em municípios com baixa densidade populacional.91,92
Na Dermatologia, as ectoparasitoses são majoritariamente influenciadas pelos aglomerados urbanos e condições sanitárias precárias. A prevalência de escabiose em favelas do Nordeste atinge até 8,8% dos moradores, enquanto a pediculose pode afetar 43,4%.93 Como fator complicador, o uso indiscriminado de piretroides para tratamento de pediculose do couro cabeludo promoveu a emergência de cepas resistentes de Pediculus humanus var. capitis, impondo maior dificuldade no controle da infestação e contenção da epidemia (fig. 8).94,95
As infecções sexualmente transmissíveis (IST), especialmente sífilis, verrugas anogenitais pelo papilomavírus humano (HPV), vírus da imunodeficiência humana (HIV), gonorreia, uretrites não gonocócicas (p. ex., Chlamydia sp.) e herpes genital apresentaram aumento da incidência nas últimas duas décadas, em vários países.96,97 O desenvolvimento econômico associado à urbanização favorece o aumento da prostituição e maior intercâmbio sexual, maximizando o risco de transmissão de IST.2,98,99 A formação de novas comunidades de trabalhadores para construção de usinas hidrelétricas, parques de mineração ou cidades planejadas (p. ex., Brasília, Teresina e Palmas) cursaram historicamente com o aumento de violência por armas de fogo e IST.100‐103Alguns animais anteriormente encontrados apenas em áreas rurais se adaptaram às cidades pela falta de predadores e oferta alimentar com os resíduos da sociedade humana, como ocorreu com as aranhas do gênero Loxosceles, causadoras de acidentes graves com formação de úlceras e comprometimento renal nas vítimas (fig. 9).104 Certas cidades como Curitiba, na região Sul do Brasil, chegam a registrar anualmente milhares de acidentes.105 Outro exemplo é a proliferação de pombos originários da Europa e do Norte da África (Columbia livia) em áreas urbanas, elevando o risco de micoses sistêmicas como a criptococose e infestações como a gamasoidose, já registrados em vários pontos do país.106‐109A urbanização não planejada dos municípios promove importantes modificações na paisagem natural, com impacto que transcende a biodiversidade e afeta o microclima local. A drenagem sistemática dos cursos de água associada à impermeabilização extensiva do solo e redução da cobertura vegetal modificam tanto a capacidade de estabilização térmica pelas massas de água quanto o albedo terrestre (coeficiente de reflexão da energia solar). Esses elementos promovem sensível elevação da temperatura, amplificada pela redução da circulação do ar decorrente da edificação consecutiva de arranha‐céus e pela produção de calor decorrente da atividade humana (p. ex., trânsito de automóveis).
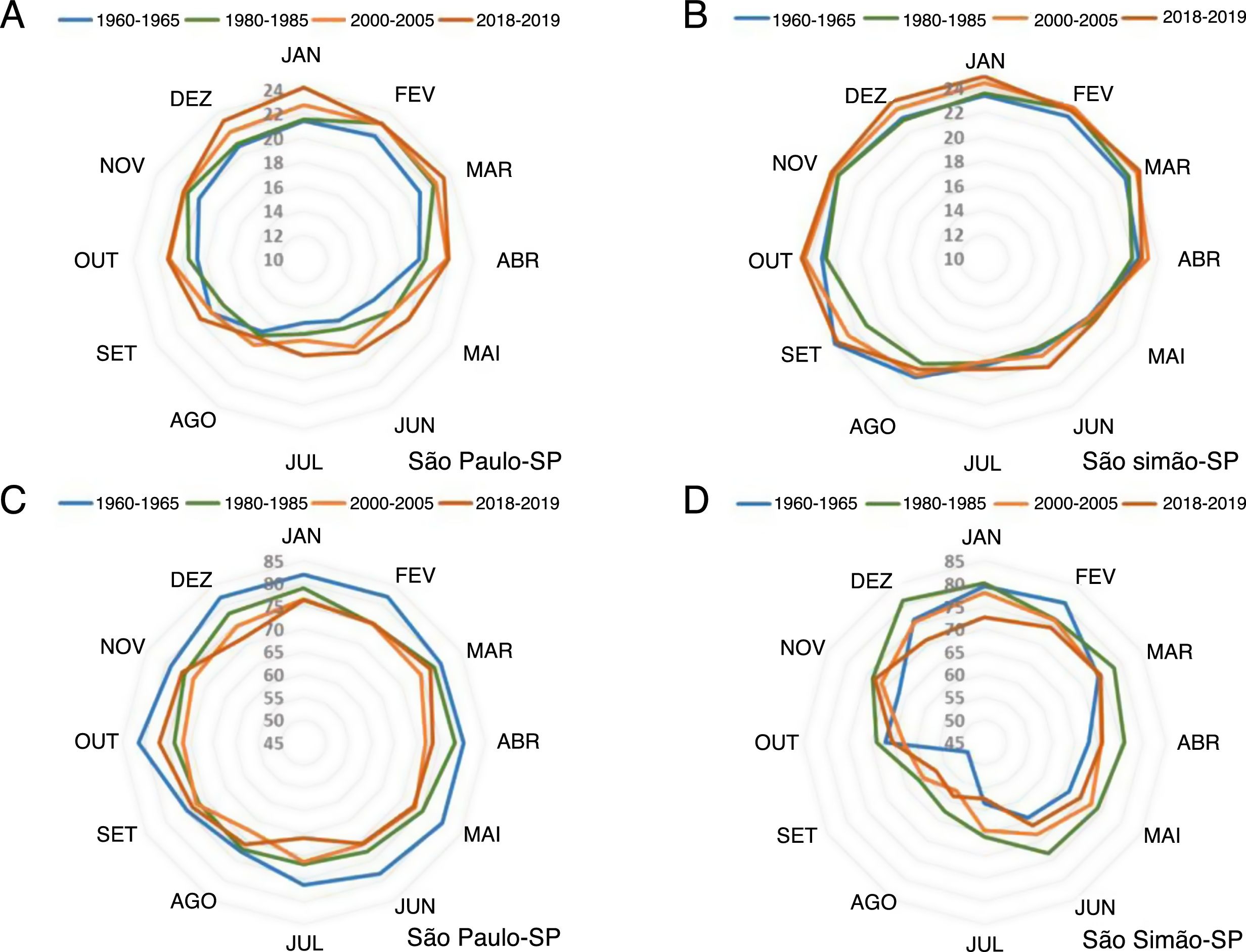
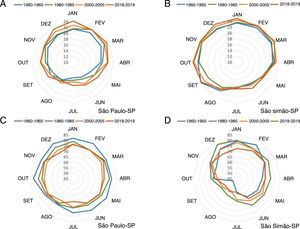
A formação dessas ilhas de calor decorrentes da urbanização pode alterar em mais de 6°C a temperatura no centro de uma área urbana em relação à área rural adjacente, com importante redução na umidade e da dispersão de poluentes do ar, o que favorece diversos riscos à saúde humana.110‐115A figura 10 apresenta o efeito de ilha de calor infligido na temperatura e umidade do ar nos últimos 70 anos na área metropolitana do município de São Paulo (latitude: 23°32’56”S, longitude: 46°38’20”W; altitude: 745 m), em comparação com o pequeno município rural de São Simão (latitude: 21°28’41”S, longitude: 47°33’3”W; altitude: 663 m). Houve elevação consistente e progressiva da temperatura média (+3,2°C) e redução da umidade relativa do ar (−10%) na área metropolitana, enquanto a temperatura e a umidade oscilaram naturalmente durante a série temporal da cidade rural.
A modificação do albedo terrestre pelas edificações e a pavimentação do solo também promovem maior reflexão da radiação ultravioleta, o que potencialmente agrava dermatoses fotoinduzidas, tais como o melasma, rosácea, lúpus eritematoso e o campo de cancerização cutâneo.84,116
As grandes cidades (em especial as megalópoles) formam imensas ilhas de calor e poluição do ar, que são associadas primariamente às doenças ligadas à hipersensibilidade, tais como asma, conjuntivite e dermatite atópica.117‐119 Os efeitos específicos da poluição do ar na pele são discutidas adiante.
Ilhas de calor também interferem na atividade e reprodução de insetos e aracnídeos. Em Curitiba, o número de acidentes por aranhas‐marrom mostrou comportamento sazonal, especialmente, quando a temperatura da superfície ultrapassa os 30°C.120
A interferência do calor nos ritos culturais ligados ao vestuário (ternos, roupas sintéticas, calçados fechados) e ao modo de trabalho (p. ex., linhas de produção mal ventiladas), que promovem sudorese e produção sebácea aumentada, favorece infecções bacterianas e fúngicas.
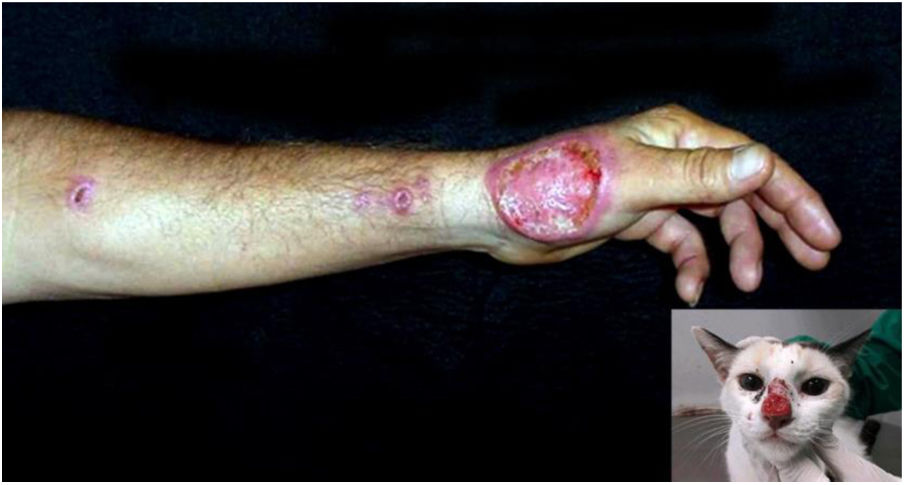
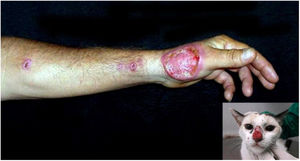
A urbanização, quando associada à falta de controle da proliferação de animais domésticos errantes, como cães e gatos, em paralelo à falta de predadores no ambiente urbano, também favorece a emergência de zoonoses. A esporotricose é a micose subcutânea causada pelo fungo Sporothrix schenckii, mais frequente em países de clima tropical ou subtropical. Na pele, manifesta‐se principalmente como úlceras e presença de linfangite nodular ascendente (fig. 11).121
No Brasil, a esporotricose de origem ocupacional, ligada a traumas com vegetais (“doença dos jardineiros”) reduziu sua incidência, em detrimento da contaminação por animais, em franca ascensão entre adultos jovens, especialmente pela arranhadura ou mordedura de gatos doentes, os maiores envolvidos nessa cadeia zoonótica.122 Felinos apresentam alta carga fúngica, hábito de arranhar árvores, percorrer longas distâncias e envolvimento em brigas, favorecendo a contaminação. O acesso de gatos não castrados à rua, o abandono ou sacrifício de animais doentes pelo tutor, descarte inadequado das carcaças, associado à falta de integração entre a Vigilância Epidemiológica com o Núcleo de Controle de Zoonoses entre os municípios são negligências que contribuem para a dinâmica da transmissão da doença. A esporotricose zoonótica está sendo descrita em vários estados do Brasil, tornando‐se endêmica na região Sudeste, sobretudo no Rio de Janeiro, nos últimos 20 anos.123
Da mesma maneira, em consequência da grande mobilidade urbana (como nas viagens internacionais), falta de predadores e emergência de resistência aos piretroides geralmente empregados na dedetização residencial, epidemias de picadas de percevejos‐de‐cama (Cimex lectularius) foram descritas em diversos centros urbanos em todo o mundo.124,125 A cimidíase se manifesta clinicamente como pápulas edematosas pruriginosas, principalmente nas extremidades, podendo assumir aspecto linear (“café da manhã, almoço e jantar”), típico de pulgas e percevejos‐de‐cama.126,127 Uma preocupação adicional às reações cutâneas de hipersensibilidade é a possibilidade de os percevejos serem vetores de outras doenças infecciosas, evidência ainda não consensual entre os pesquisadores.128‐130
PoluiçãoUm dos mais danosos efeitos da modernidade é o comprometimento do ambiente (solo, ar e água) com resíduos da produção humana. As modificações ambientais não ocorrem de maneira isolada na comunidade. O desflorestamento, a redução da biodiversidade, a urbanização e a poluição do meio ambiente costumam se apresentar de forma inter‐relacionada, como marcas da atividade humana moderna. A contaminação das águas, a poluição sonora e a destinação de resíduos são da maior importância em saúde pública.131‐135Do ponto de vista dermatológico, a pele é afetada pela poluição particulada do ar e gases voláteis, especialmente o dióxido de nitrogênio (NO2), dióxido de enxofre (SO2), ozônio (O3) e dióxido de carbono (CO2). Os principais mediadores da poluição do ar na pele são os receptores de hidrocarboneto arílico (AhR) presentes em todas as estruturas cutâneas, que são ativados por hidrocarbonetos aromáticos, como as dioxinas, extensamente presentes na fumaça veicular.136,137
A poluição do ar contribui para o envelhecimento extrínseco da pele, e sua maior parte nos centros urbanos é derivada da queima de combustível fóssil e da atividade industrial. A pele submetida à intensa poluição do ar apresenta déficit de barreira, com menor produção de esqualeno, além de consumo oxidativo do tocoferol e a formação de lentigos e rugas.136,138 Na derme, a poluição particulada pode induzir fenótipos inflamatórios nos fibroblastos, com maior síntese de metaloproteínas (MMP‐1, MMP‐3) e redução da síntese de colágeno (COL1A1, COL1A2) e elastina.139
O dano específico da poluição do ar depende do tipo do poluente, da integridade da pele e da intensidade da exposição.140 Os hidrocarbonetos aromáticos promovem diferentes estímulos epiteliais; além dos citados anteriormente, há a formação de epóxi e diols, que se ligam diretamente ao DNA promovendo alterações epigenéticas no crescimento celular e potencializando o desenvolvimento de neoplasias, especialmente se houver estímulo conjunto com radiação ultravioleta.141‐143Além do envelhecimento e carcinogênese, a poluição do ar favorece o desenvolvimento de dermatoses inflamatórias como os eczemas e a acne. Hidrocarbonetos aromáticos, em especial as dioxinas, são conhecidos indutores de acne mediada pela ativação dos AhR, com ação nos sebócitos, endotélio e epiderme.143‐145 Indivíduos que viajaram para áreas com grande poluição do ar referiram erupção de acne inflamatória. Em Pequim, a procura por atendimento por acne correlacionou‐se com maiores indicadores de poluição do ar.144
A incidência de dermatite atópica é influenciada pela baixa umidade do ar, temperatura e poluentes. A poluição particulada é composta por inúmeros sais, metais pesados e hidrocarbonetos aromáticos, que penetram na pele pelos folículos pilosos e acrossiríngios. O suor aumenta a penetração transepidérmica, promovendo dano oxidativo e induzindo resposta inflamatória na derme e epiderme, que culminam com dano à função de barreira.110,137 Em série temporal chinesa de quatro anos, a procura por atendimento por eczema se associou aos indicadores diários de poluição do ar.146 A poluição é um dos fatores imputados pelo aumento da incidência de dermatite atópica na Europa, que ocorre de maneira mais relevante nos centros urbanos que nas comunidades rurais.131,140
Os incêndios florestais, quer acidentais, quer controlados visando o desmatamento para agricultura, promovem, além do desflorestamento, redução da biodiversidade, redução da fixação de água no solo e lançam no ar grande quantidade de gases e partículas. Isso evidencia que as modificações do meio ambiente não são dimensionáveis apenas por seu efeito direto, mas de todo o ecossistema.
Além do ozônio poluente da atmosfera, que promove dano oxidativo na pele, com redução da microflora e consumo do tocoferol, o ozônio também se forma, naturalmente, na estratosfera, 20 a 30km acima do nível do mar, em função da reação da radiação ultravioleta solar com o oxigênio atmosférico.147 Ele exerce primordial função no bloqueio completo da radiação UVC emitida pelo sol (extremamente mutagênica) e aproximadamente 90% da radiação UVB. Esse equilíbrio entre a síntese e a degradação do ozônio na estratosfera garante que quantidade tolerável de radiação mutagênica atinja a superfície do planeta.148
A camada de ozônio que circunscreve a Terra não é homogênea, e apresenta áreas mais delgadas, especialmente nos polos. Há intensa discussão sobre a variação cíclica da conformação da camada de ozônio e sua degradação por poluentes do ar. Emissões atmosféricas de compostos halogenados como o clorofluorcarbono (CFC), halon, hidroclorofluorcarbono (HFC), brometo de metila, tetracloreto de carbono (CTC), metilclorofórmio e hidrobromofluorcarbono (HBFC) foram associadas à redução da camada de ozônio da atmosfera.148 O emprego desses compostos em refrigerantes, propelentes e espumas vem sendo reduzido em todo o mundo desde a década de 1990, com expectativa de suspensão completa nos próximos 30 anos.
Estima‐se que 1% de redução na camada de ozônio promova aumento de 2% na incidência de UVB e consequentemente, aumento de 2% na incidência de câncer de pele.149 De fato, nas regiões habitadas com menores concentrações de ozônio estratosférico são registrados maiores índices de neoplasias cutâneas e mucosas (carcinoma basocelular, carcinoma espinocelular e melanoma) de humanos e animais, demandando maior rigor nas estratégias de fotoproteção.150‐154
Modificações climáticasClima pode ser definido como o conjunto de alterações atmosféricas em certa região do planeta, como temperatura, precipitação e ventos, com padrões que tendem a se repetir em determinado período de tempo (p. ex., faz calor e chove em janeiro, na cidade do Rio de Janeiro). Convencionalmente, o comportamento climático é avaliado em períodos de 30 anos, e a principal característica do clima é a a variabilidade natural em função dos anos, havendo complexa interação entre os fatores que o determinam. É importante diferenciar “clima” de “tempo meteorológico”, que considera o estado da atmosfera local em dado momento (p. ex., hoje é o dia mais quente do ano na cidade de São Paulo).
Variação na temperatura dos oceanos (fenômenos El Niño, La Niña e a oscilação decadal do Pacífico), da atividade solar (ciclos solares), da trajetória orbital (mais circular ou elíptica), da inclinação do eixo terrestre, da atividade vulcânica e de alterações gravitacionais (lunar) são os principais modificadores globais do clima.155‐160 Já seus principais determinantes em regiões específicas são: latitude, altitude, continentalidade (distância do litoral), densidade de nuvens, temperatura dos oceanos, correntes marítimas, vegetação/urbanização (albedo), massas hídricas e relevo.111,115,161,162 Isso justifica a imensa variabilidade de características climáticas ao redor do planeta.
Durante a trajetória da humanidade, diversas mudanças climáticas globais foram registradas, tais como pequenas eras do gelo na Europa entre 540 e 550 e entre 1350 e 1850, por menor atividade solar, alterações da órbita do planeta e maior atividade vulcânica.163‐165 Também aconteceram aquecimentos importantes, como o período quente romano (entre 250 a.C. a 400 d.C.) e o medieval (entre 800 e 1200), detectados no hemisfério Norte. Todas essas mudanças implicaram em reflexos sociais, econômicos e na saúde da população.
Há, atualmente, intensa discussão com repercussão geopolítica se as modificações ambientais focais promovidas pela atividade humana podem influenciar o clima global, em detrimento das evidentes alterações locorregionais, apontadas anteriormente, e da variabilidade natural dos ciclos climáticos no planeta. Entretanto, essa discussão específica ultrapassa o escopo deste texto.
Há clara sazonalidade na incidência de doenças dermatológicas: a psoríase apresenta menor prevalência ou gravidade no verão, devido à radiação ultravioleta. Porém, há maior incidência de infecções estafilocócicas, queratoses actínicas e acidentes por animais peçonhentos pelo tipo de atividades de lazer praticados nessa época. Em contrapartida, no inverno ocorrem mais infecções respiratórias, cujo desequilíbrio imunológico favorece reações hansênicas.166‐168 Espera‐se, portanto, que modificações climáticas possam interferir na incidência de dermatoses.
A umidade e o aumento da temperatura são fatores que sabidamente influem na taxa de reprodução e atividade dos mosquitos, os principais vetores de doenças infecciosas.169,170 Uma série temporal mostrou que a incidência de LTA na Amazônia foi fortemente influenciada pelo aquecimento e modificação no regime de chuvas ocasionada pelo El Niño.171
Em outra série, no Peru, com 3.294 casos (2004‐2007), a incidência de verruga viral, queratose actínica, rosácea e eczemas foram influenciados pelos fenômenos climáticos do Pacífico (El Niño/La Niña).172 Esses estudos mostram que alterações de microclimas regionais promovidas por desflorestamento, inundação/represamento, aglomerações e ilhas urbanas de calor são potenciais determinantes ambientais na incidência das dermatoses.
Em conclusão, as modificações ambientais impactam nas relações de saúde e doença da humanidade, inseridas em contexto ecológico. Na atualidade, a urbanização, a agricultura de escala, a poluição da natureza e o desmatamento são os determinantes ambientais que mais devem repercutir na incidência de dermatoses.173 Os dermatologistas devem estar cientes inicialmente de sua responsabilidade social, no sentido de promover práticas sustentáveis em sua comunidade, além de identificar os desequilíbrios ambientais que favorecem cada dermatose, o que é fundamental na prevenção e no tratamento dessas enfermidades.
Suporte financeiroNenhum.
Contribuição dos autoresVidal Haddad Junior: Idealização do estudo, escrita e aprovação do texto final.
Adriana Lúcia Mendes: Idealização do estudo, escrita e aprovação do texto final.
Carolina Chrusciak Talhari: Idealização do estudo, escrita e aprovação do texto final.
Hélio Amante Miot: Idealização do estudo, escrita e aprovação do texto final.
Conflito de interessesNenhum.