As dermatoses bolhosas autoimunes são um grupo heterogêneo de doenças com autoanticorpos direcionados contra proteínas estruturais da pele. Embora a ocorrência das dermatoses bolhosas autoimunes na gestação seja baixa, esse tema merece atenção, uma vez que as alterações imunológicas e hormonais que ocorrem durante esse período podem trazer mudanças no curso esperado dessas dermatoses. Os autores fazem uma revisão dos diversos aspectos das dermatoses bolhosas autoimunes que afetam as gestantes, incluindo a abordagem terapêutica durante o período gravídico e de amamentação. O penfigoide gestacional, doença bolhosa específica da gestação, não foi objeto de estudo nesta revisão.
As doenças bolhosas autoimunes (DBAI) cursam com o surgimento de bolhas na pele e/ou em mucosas, resultantes da ligação de autoanticorpos contra antígenos epidérmicos ou estruturas da junção dermoepidérmica (JDE), relacionados à adesão celular, e são classificadas de acordo com o nível da clivagem epitelial.1 O primeiro grupo, das dermatoses bolhosas intraepidérmicas, tem como principais representantes o pênfigo foliáceo (PF) e o pênfigo vulgar (PV); outras condições incluem pênfigo por IgA, pênfigo paraneoplásico e pênfigo induzidos por fármacos. Há produção de autoanticorpos direcionados contra glicoproteínas epidérmicas intercelulares. O segundo grupo, das dermatoses bolhosas subepidérmicas, tem como principais representantes o penfigoide bolhoso (PB) e epidermólise bolhosa adquirida (EBA), seguidos por condições menos comuns como a dermatose bolhosa por IgA linear (DBAL), dermatite herpetiforme (DH), penfigoide das mucosas (PM) e lúpus eritematoso sistêmico bolhoso (LESB). Esse grupo é definido pela presença de autoanticorpos direcionados contra autoantígenos da zona da membrana basal (ZMB), levando à clivagem subepidérmica.
As DBAI podem ocorrer durante a gestação, mas são relativamente raras.2 Existem duas situações clínicas distintas: 1) paciente com DBAI previamente diagnosticada, engravida; 2) gestante sem histórico prévio de DBAI desenvolve um surto de bolhas que requer diagnóstico e manejo.3 De acordo com esta revisão, a primeira situação é a mais frequente.
O penfigoide gestacional (PG), uma variante do PB, tem seu início exclusivamente associado à gestação, ao período pós‐parto, a tumores trofoblásticos, mola hidatiforme ou coriocarcinoma, e não foi incluído nesta revisão.4
Os autores tiveram como objetivo realizar uma revisão sobre a ocorrência de DBAI durante a gestação, uma vez que a maioria das publicações é baseada em relatos de casos.
Sistema imune e gestaçãoA resposta imunológica existe principalmente para defender o hospedeiro contra patógenos invasores, e para proporcionar tolerância aos autoantígenos. Linfócitos derivados do timo, ou linfócitos T (LT), estão envolvidos com a manutenção de tal função. Assim, LT nativos podem diferenciar‐se em LT com especificidade para responder a antígenos externos, bem como a autoantígenos. A maturação celular dos LT depende essencialmente de interações com o ambiente físico‐químico e resulta no desenvolvimento de células com função efetora e de memória, ou no desenvolvimento de células com função regulatória. Linfócitos T auxiliares exercem um papel na defesa imunológica estimulando a síntese de anticorpos; e linfócitos T regulatórios têm ação anti‐inflamatória e desempenham um papel na manutenção da tolerância aos seus próprios componentes celulares. Dados da literatura indicam que, tanto em murinos quanto humanos, a depleção dos linfócitos T regulatórios está relacionada ao desenvolvimento de doenças autoimunes graves.5
A gestação constitui um estado imunológico específico, uma vez que o organismo materno deve equilibrar a tolerância fetal com a manutenção de seu próprio sistema imunológico. Alterações hormonais relevantes ocorrem na gestação, tanto nos níveis de progesterona e estrogênio quanto em cortisol, norepinefrina e deidroepiandrosterona. Os níveis séricos de progesterona e estradiol aumentam de cinco a 10 vezes ao longo da gestação, retornando rapidamente ao nível normal no pós‐parto.6 Sob a influência desses hormônios, mudanças profundas no sistema imunológico ocorrem durante toda a gestação, a fim de acomodar o feto alogênico, que incluem processos imunorregulatórios e imunossupressores. Esse estado de imunomodulação ocorre mais intensamente na interface materno‐fetal, na qual os níveis de progesterona são muito altos em função da maior produção desse hormônio pela placenta, e mais sutil no sangue periférico materno.7
Na região uterina onde a placenta se desenvolve (decídua), há supressão acentuada da citotoxicidade, infiltração de células natural killer (NK) útero‐específicas, bloqueio de antígenos fetais expostos a linfonodos maternos e acúmulo de células T reguladoras (Treg) feto‐específicas. A quantidade de células Treg está elevada durante a gestação, inclusive no sangue materno; elas desempenham um papel na supressão da resposta imune local por meio do fenômeno da supressão vinculada. Essa supressão pode explicar os baixos níveis de autoanticorpos durante a gestação em determinadas doenças autoimunes e inflamatórias, levando à remissão, seguida de reativação no pós‐parto como na doença de Graves e artrite reumatoide.3
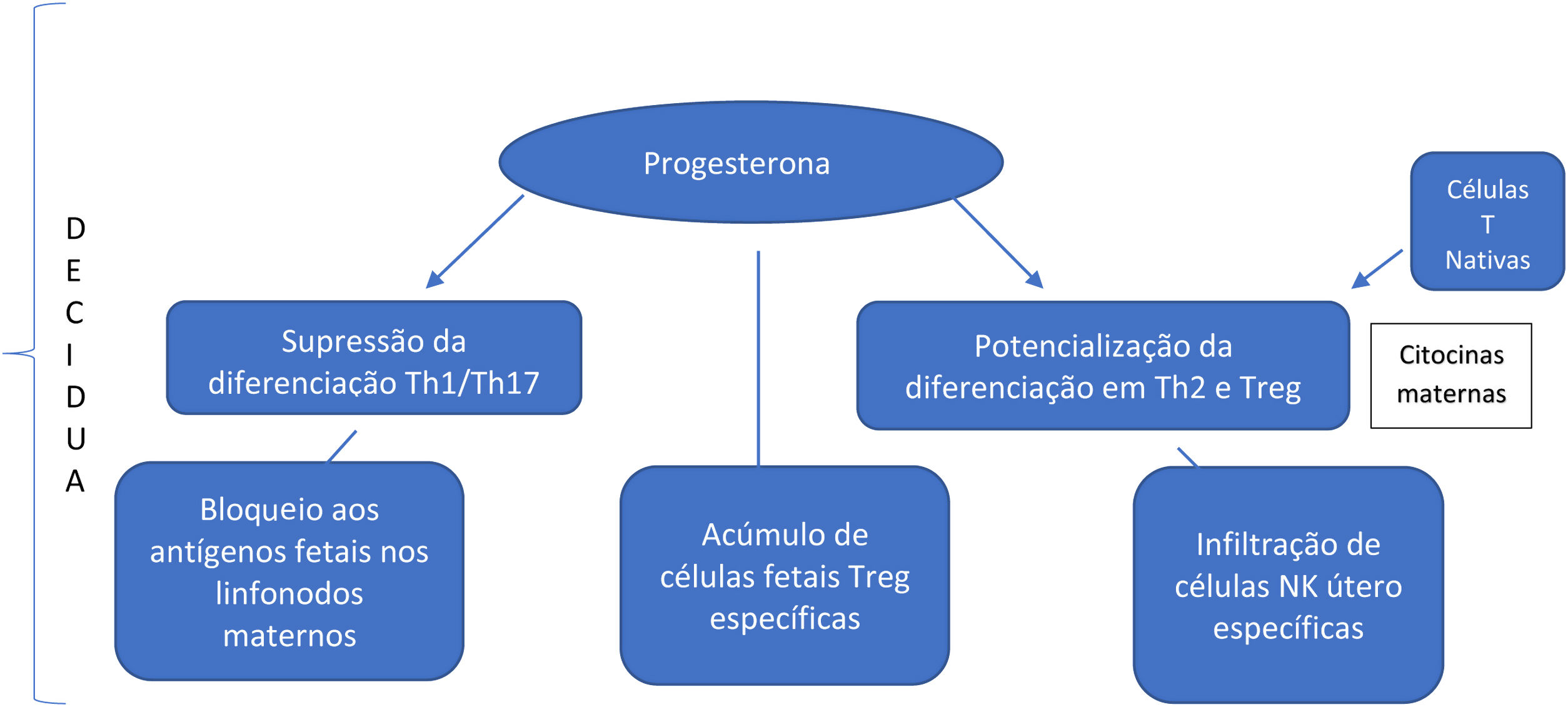
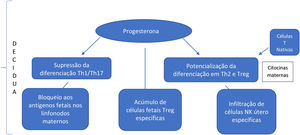
Há escassez de dados na literatura médica que mencionem as importantes mudanças na população de células Treg em gestantes. No entanto, essas células são conhecidas por desempenhar um papel de destaque na promoção da sobrevivência fetal, e sugere‐se que seu aumento esteja relacionado ao aumento das células Th2 efetoras. Estudos in vivo e in vitro mostram que a progesterona tem a capacidade de suprimir a diferenciação Th1/Th17 e, em contraste, potencializar a diferenciação Th2 e das células Treg. Além disso, citocinas maternas levam à maior diferenciação das células T nativas em células Th2.8 O resultado final é um desequilíbrio imunológico, com aumento da população celular Th2, em detrimento das células Th1 e Th17. Sugere‐se que haja maior direcionamento para a população Th2, essencial para a manutenção do estado normal de gestação. É importante ressaltar que um ambiente inicial na predominância do Th1 é necessário para o sucesso da implantação uterina. No entanto, em estágios posteriores da gestação, a predominância da resposta linfocitária Th2 é necessária para um ambiente de tolerância transitória aos antígenos fetais (fig. 1).
Considerando as alterações fisiológicas na resposta imune durante a gestação, a ocorrência de doenças autoimunes em gestantes é um fator de alto risco e pode levar a mudanças no estado de suas doenças durante esse período.3
A gestação é marcada pela predominância da resposta linfocitária Th2, um perfil coincidente com o desenvolvimento de dermatoses bolhosas autoimunes. Por causa da redução da resposta Th1 e possivelmente Th17 durante a gestação normal, doenças cutâneas com predominância da resposta Th1, como psoríase, artrite reumatoide e esclerose múltipla, apresentam melhora durante a gestação. Por outro lado, doenças com padrão de resposta Th2 como pênfigos, lúpus eritematoso e asma podem não se beneficiar dessa mudança no padrão imunológico, por causa da predominância da resposta Th2 na atividade dessas doenças.2,9
Assim, a coexistência da dermatose bolhosa autoimune em gestantes precipitaria ou aumentaria a ocorrência de pênfigos e penfigoides (tabela 1). No entanto, o curso das DBAI tende a flutuar durante a gestação em decorrência das alterações imunológicas causadas por estrogênio e progesterona, mas também por cortisol, norepinefrina e deidroepiandrosterona.2
Curso das doenças bolhosas autoimunes e efeitos adversos durante a gestação
| Doença | Curso da doença na gestação | Efeitos adversos | Doença bolhosa neonatal |
|---|---|---|---|
| Pênfigo vulgar | Pode melhorar no terceiro trimestre, mas recorrer no pós‐parto | Até 10%, em uma série de casos associados ao mau controle da doença. Risco de nascimento prematuro em doença grave | Transitória e facilmente tratada |
| Pênfigo foliáceo | Curso variável | Mínimos | Extremamente rara |
| Penfigoide bolhoso | Raramente visto na gestação | Não relatados | Não relatada |
| Dermatose IgA linear | Pode melhorar no segundo trimestre, mas recorrer no pós‐parto | Mínimos | Não relatada |
| Epidermólise bolhosa adquirida | Extremamente rara | Um caso de exacerbação na gestação | Um caso descrito |
| Penfigoide gestacional | Tende a ocorrer do segundo para o terceiro trimestre | Risco aumentado de parto pré‐termo, recém‐nascido pequeno para idade gestacional ou com baixo peso | Extremamente rara |
Além disso, a gestação traz outras exigências no manejo clínico usual das DBAI: restrições nos métodos habituais de confirmação diagnóstica, limitação no uso de determinados medicamentos e escolha da forma de parto. Por essas razões, pacientes com DBAI em idade fértil e que desejam engravidar devem ser aconselhadas a fazer o planejamento familiar, no intuito de garantir melhores condições de saúde para ela e o concepto. O uso de um método contraceptivo deve ser instituído até que a doença esteja bem controlada, de modo que a gestação ocorra durante período com redução na atividade da doença.3,10
Alguns aspectos etiológicos e epidemiológicos das DBAIPênfigo vulgarNo PV, há predominância do sexo feminino, evidenciada por razão mulher:homem de 1.4 e 2.3, segundo estudos epidemiológicos realizados na China e Grécia.3,11 Um desfecho pior do PV também tem sido observado em mulheres; análise recente mostrou que os alelos HLA DRB1*04:02 e DQB1 *03:02 estavam associados com PV grave, e DQB1*03:02 foi encontrado com maior frequência em pacientes do sexo feminino.
Uma revisão envolvendo 49 gestantes com PV constatou que 37% apresentavam a doença pela primeira vez durante a gestação, e desfechos adversos da gestação (ou seja, pênfigo neonatal e óbito perinatal) ocorreram em até 10% dos casos. O PV tende a melhorar na gestação, após o terceiro trimestre, e reativar no período pós‐parto. Portanto, a gestação pode precipitar ou agravar o quadro de PV.12
A ocorrência de PV neonatal é transitória, e sua resolução tende a ocorrer dentro de três semanas; em geral, deve‐se à transmissão transplacentária de anticorpos IgG da mãe para o feto, e é facilmente tratável.13 Além do PV neonatal, outras consequências para o recém‐nascido incluem: restrição ao crescimento intrauterino, recém‐nascido pré‐termo e morte fetal. No entanto, é difícil distinguir as consequências decorrentes do tratamento daquelas próprias da doença.14 Além disso, as diferenças na expressão da desmogleína na pele neonatal são responsáveis pela diversidade de manifestações clínicas entre mãe e filho.13 Os eventos adversos parecem estar mais correlacionados com mau controle da doença materna, maior nível sérico e no cordão umbilical de anticorpos maternos, do que com medicamentos específicos utilizados para tratar PV materno.15 Portanto, tratamentos que levem à diminuição nos níveis de anticorpos séricos maternos, a fim de limitar a passagem transplacentária de IgG patogênica, justificam a terapia imunossupressora, a despeito de essa abordagem durante a gestação ainda não ter sido bem estabelecida.15 Deve‐se lembrar que, antes da introdução do uso de corticosteroides sistêmicos para PV, a doença apresentava elevadas taxas de mortalidade.
Pênfigo foliáceoO PF se apresenta sob duas formas: a clássica (doença de Cazenave) e a endêmica. Esta última inclui o fogo selvagem (FS), que corresponde à forma endêmica sul‐americana.16 Não há relato de predominância de gênero no PF ou FS, mas as formas endêmicas de PF observadas no norte da África (Tunísia) mostram uma predominância feminina característica, especialmente entre as mulheres jovens (relação mulher:homem de 4:1). Em uma série de casos com 23 pacientes tunisianas com pênfigo, suspeitou‐se do papel provocador da gestação no desenvolvimento dessa doença, em função de ser a Tunísia um país onde mulheres jovens têm alta taxa de fecundidade.17
O PF pode ter curso variável na gestação, sem efeito sobre o feto. A associação com PF neonatal é extremamente rara no contexto de títulos de anticorpos excepcionalmente elevados.18 A desmogleína 3 é expressa em toda a epiderme, incluindo as camadas subcórneas na pele neonatal, e pode ser protetora contra anticorpos antidesmogleína 1 causadores da doença.13,19
Um estudo no Brasil com 19 gestantes que apresentavam FS não observou nenhuma doença clínica neonatal; a imunofluorescência direta foi negativa em 12 dos 17 espécimes de pele neonatal, os autoanticorpos IgG estavam presentes em títulos baixos (menos de 1:40) e a IgG4 era a subclasse predominante de IgG, em nove das 19 amostras de sangue do cordão umbilical. Os autores sugerem que a placenta possa servir como imunoabsorvente biológico de autoanticorpos patogênicos.20
Epidermólise bolhosa adquiridaA EBA é um subtipo raro, fenotipicamente heterogêneo de DBAI, predominante no sexo feminino e caracterizado por autoanticorpos contra o colágeno tipo VII. Dois trabalhos estudaram EBA e seus dados associados, com um total de 83 casos, revelando que a razão mulher:homem é de 1,56.21,22
Dermatose por IgA linearA DBAL é uma doença bolhosa autoimune rara com bolhas subepidérmicas, na qual os autoanticorpos IgA reconhecem como antígenos os ectodomínios subepidérmicos do colágeno tipo XVII (COL17, BP180) na ZMB. Há escassos dados epidemiológicos sobre sua ocorrência por gênero bem como sua incidência na gestação.23 Os pacientes são categorizados em dois grupos: um com início pré‐puberal e o outro de início posterior (DBAL adulto). Alguns pacientes com DBAL são mulheres jovens que engravidaram. Pouco se sabe sobre o efeito da DBAL e seu tratamento na gestação, ou sobre o efeito da gestação na DBAL. Sabe‐se que seu antígeno é expresso na membrana basal amniótica e a deposição do IgA ocorre na zona da membrana basal amniótica do feto das pacientes afetadas.24
De acordo com uma série de casos de DBAL na gestação, a doença geralmente melhora ao final do primeiro trimestre e normalmente recorre no segundo trimestre, mas pode recair no período pós‐parto. Por essa razão, pode ser possível a suspensão da dapsona durante a gestação. Há evidências de que os anticorpos IgA tornam‐se glicosilados durante a gestação, o que poderia explicar essa remissão; as células Treg também exerceriam algum papel. No entanto, os pacientes devem ser aconselhados sobre a possibilidade de uma recaída pós‐parto. A doença também pode reativar anos depois, mesmo após um período prolongado de remissão.25
Dermatite herpetiformeA DH está intimamente associada à doença celíaca; ambas as condições são mediadas por autoanticorpos IgA e têm como alvo o autoantígeno transglutaminase. Em contraste com os pênfigos e o penfigoide, as evidências de predominância de gênero na DH são conflitantes, sem conclusão sobre a prevalência em mulheres ou homens.26 Quanto à sua ocorrência durante a gestação, há escassez de dados, com apenas dois artigos encontrados na literatura.
DBAI e gestaçãoA presente pesquisa teve como principal foco relatos de casos e estudos retrospectivos. As referências foram recuperadas em um período de publicação de 1979 a 2017 por uma estratégia de busca eletrônica: “(pênfigo vulgar [Termos do MeSH]) E (gestação [Termos de MeSH]); (pênfigo foliáceo [Termos de MeSH]) E (gestação[Termos de MeSH]); (dermatite herpertiforme [Termos MeSH]) E (gestação[Termos de MeSH]); (epidermólise bolhosa adquirida [Termos de MeSH]) E (gestação[Termos de MeSH]); (dermatose IgA linear [Termos de MeSH]) E (gestação[Termos de MeSH]); Filtros: relatos de casos” no PubMed. Foram excluídos os artigos não publicados em inglês e aqueles de penfigoide gestacional e formas congênitas de doenças bolhosas. Foram incluídos 56 artigos, de acordo com seus títulos e resumos.
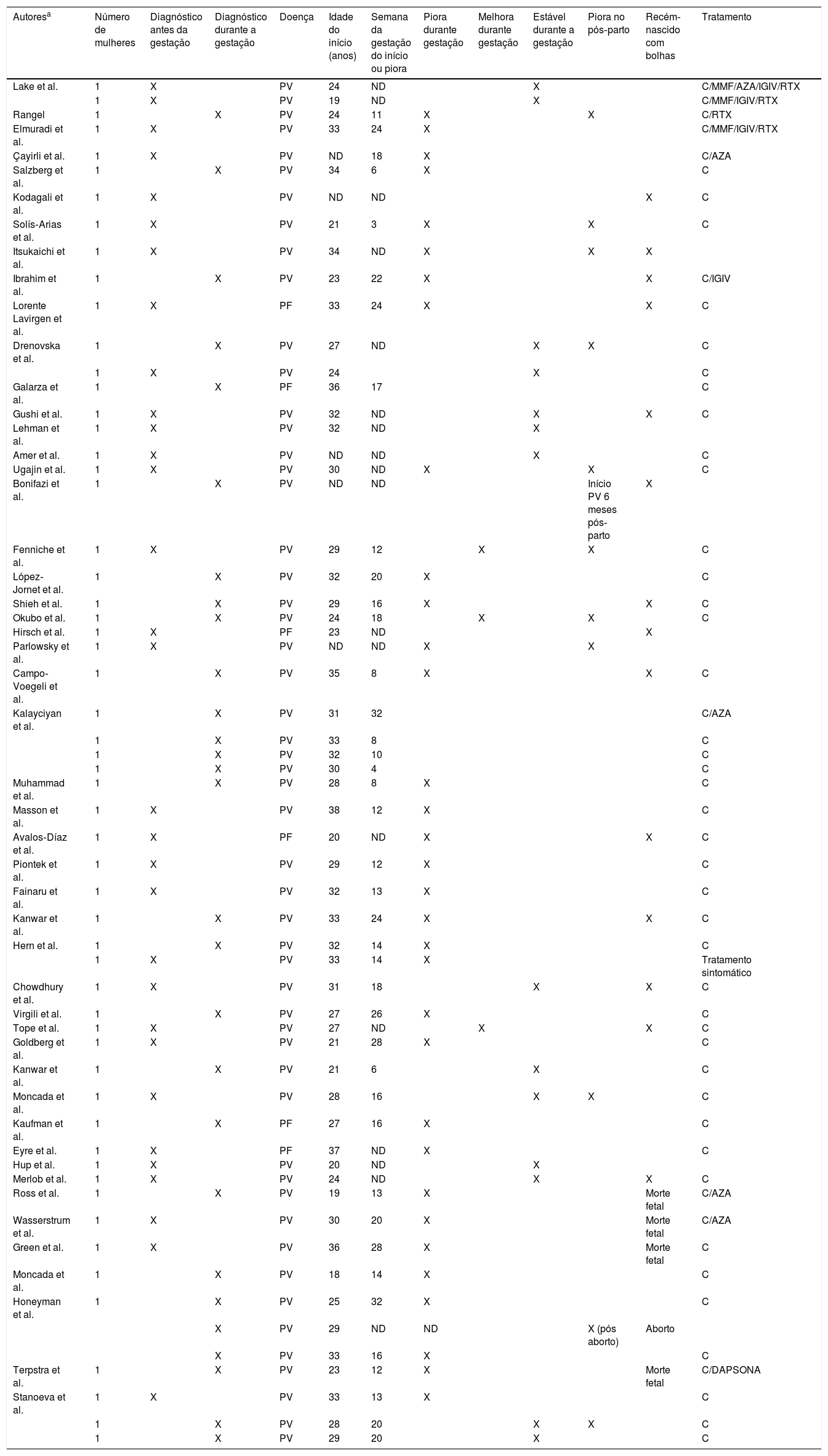
Pênfigos e gestaçãoForam incluídos 49 artigos (Apêndice A), que relatavam um total de 57 mulheres com 59 gestações (tabela 2); 31 pacientes (54,3%) tiveram o diagnóstico de pênfigo antes da gestação, e 26 (45,6%) durante a gestação. Cinquenta e um pacientes (89,4%) tiveram o diagnóstico de PV e seis (10,5%) de PF. A média de idade no início da doença foi de 28,4 anos, e a média das semanas de semana gestacional de início/piora da doença foi igual a 16. O comportamento do pênfigo foi relatado em 50 gestações. Em 33/50 (66%) gestações a doença piorou, em 14/50 (28%) a doença manteve‐se estável, e em 3/50 (6%) a doença melhorou. Em 12 das 50 gestações (24%) houve relato de reativação pós‐parto, e desfechos adversos da gestação como pênfigo neonatal, morte perinatal ou aborto foram relatados em 33% dessas gestações. Quanto ao tratamento de pênfigos durante a gestação, foram identificadas 51 pacientes cujos tratamentos foram descritos. Em 41 deles (80,3%) a monoterapia foi a escolha, e nos outros 10 (19,6%) a terapia combinada foi relatada. Rituximabe foi utilizado em quatro (7,8%); corticoides sistêmicos em todos os 51 (100%); azatioprina em cinco (9,8%); micofenolato mofetil em três (5,8%); dapsona em um (1,9%) e imunoglobulina intravenosa em quatro (7,8%) casos.
Dados clínicos e demográficos de mulheres grávidas com pênfigos
| Autoresa | Número de mulheres | Diagnóstico antes da gestação | Diagnóstico durante a gestação | Doença | Idade do início (anos) | Semana da gestação do início ou piora | Piora durante gestação | Melhora durante gestação | Estável durante a gestação | Piora no pós‐parto | Recém‐ nascido com bolhas | Tratamento |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lake et al. | 1 | X | PV | 24 | ND | X | C/MMF/AZA/IGIV/RTX | |||||
| 1 | X | PV | 19 | ND | X | C/MMF/IGIV/RTX | ||||||
| Rangel | 1 | X | PV | 24 | 11 | X | X | C/RTX | ||||
| Elmuradi et al. | 1 | X | PV | 33 | 24 | X | C/MMF/IGIV/RTX | |||||
| Çayirli et al. | 1 | X | PV | ND | 18 | X | C/AZA | |||||
| Salzberg et al. | 1 | X | PV | 34 | 6 | X | C | |||||
| Kodagali et al. | 1 | X | PV | ND | ND | X | C | |||||
| Solís‐Arias et al. | 1 | X | PV | 21 | 3 | X | X | C | ||||
| Itsukaichi et al. | 1 | X | PV | 34 | ND | X | X | X | ||||
| Ibrahim et al. | 1 | X | PV | 23 | 22 | X | X | C/IGIV | ||||
| Lorente Lavirgen et al. | 1 | X | PF | 33 | 24 | X | X | C | ||||
| Drenovska et al. | 1 | X | PV | 27 | ND | X | X | C | ||||
| 1 | X | PV | 24 | X | C | |||||||
| Galarza et al. | 1 | X | PF | 36 | 17 | C | ||||||
| Gushi et al. | 1 | X | PV | 32 | ND | X | X | C | ||||
| Lehman et al. | 1 | X | PV | 32 | ND | X | ||||||
| Amer et al. | 1 | X | PV | ND | ND | X | C | |||||
| Ugajin et al. | 1 | X | PV | 30 | ND | X | X | C | ||||
| Bonifazi et al. | 1 | X | PV | ND | ND | Início PV 6 meses pós‐ parto | X | |||||
| Fenniche et al. | 1 | X | PV | 29 | 12 | X | X | C | ||||
| López‐Jornet et al. | 1 | X | PV | 32 | 20 | X | C | |||||
| Shieh et al. | 1 | X | PV | 29 | 16 | X | X | C | ||||
| Okubo et al. | 1 | X | PV | 24 | 18 | X | X | C | ||||
| Hirsch et al. | 1 | X | PF | 23 | ND | X | ||||||
| Parlowsky et al. | 1 | X | PV | ND | ND | X | X | |||||
| Campo‐Voegeli et al. | 1 | X | PV | 35 | 8 | X | X | C | ||||
| Kalayciyan et al. | 1 | X | PV | 31 | 32 | C/AZA | ||||||
| 1 | X | PV | 33 | 8 | C | |||||||
| 1 | X | PV | 32 | 10 | C | |||||||
| 1 | X | PV | 30 | 4 | C | |||||||
| Muhammad et al. | 1 | X | PV | 28 | 8 | X | C | |||||
| Masson et al. | 1 | X | PV | 38 | 12 | X | C | |||||
| Avalos‐Díaz et al. | 1 | X | PF | 20 | ND | X | X | C | ||||
| Piontek et al. | 1 | X | PV | 29 | 12 | X | C | |||||
| Fainaru et al. | 1 | X | PV | 32 | 13 | X | C | |||||
| Kanwar et al. | 1 | X | PV | 33 | 24 | X | X | C | ||||
| Hern et al. | 1 | X | PV | 32 | 14 | X | C | |||||
| 1 | X | PV | 33 | 14 | X | Tratamento sintomático | ||||||
| Chowdhury et al. | 1 | X | PV | 31 | 18 | X | X | C | ||||
| Virgili et al. | 1 | X | PV | 27 | 26 | X | C | |||||
| Tope et al. | 1 | X | PV | 27 | ND | X | X | C | ||||
| Goldberg et al. | 1 | X | PV | 21 | 28 | X | C | |||||
| Kanwar et al. | 1 | X | PV | 21 | 6 | X | C | |||||
| Moncada et al. | 1 | X | PV | 28 | 16 | X | X | C | ||||
| Kaufman et al. | 1 | X | PF | 27 | 16 | X | C | |||||
| Eyre et al. | 1 | X | PF | 37 | ND | X | C | |||||
| Hup et al. | 1 | X | PV | 20 | ND | X | ||||||
| Merlob et al. | 1 | X | PV | 24 | ND | X | X | C | ||||
| Ross et al. | 1 | X | PV | 19 | 13 | X | Morte fetal | C/AZA | ||||
| Wasserstrum et al. | 1 | X | PV | 30 | 20 | X | Morte fetal | C/AZA | ||||
| Green et al. | 1 | X | PV | 36 | 28 | X | Morte fetal | C | ||||
| Moncada et al. | 1 | X | PV | 18 | 14 | X | C | |||||
| Honeyman et al. | 1 | X | PV | 25 | 32 | X | C | |||||
| X | PV | 29 | ND | ND | X (pós aborto) | Aborto | ||||||
| X | PV | 33 | 16 | X | C | |||||||
| Terpstra et al. | 1 | X | PV | 23 | 12 | X | Morte fetal | C/DAPSONA | ||||
| Stanoeva et al. | 1 | X | PV | 33 | 13 | X | C | |||||
| 1 | X | PV | 28 | 20 | X | X | C | |||||
| 1 | X | PV | 29 | 20 | X | C |
PV, pênfigo vulgar; PF, pênfigo foliáceo; ND, dado não disponível; C, corticosteroides; MMF, micofenolato de mofetila; AZA, azatioprina; RTX, rituximabe; IGIV, imunoglobulina intravenosa.
Foram encontrados três artigos sobre DBAL e gestação. Em um deles, 12 pacientes tiveram um total de 19 gestações. A doença permaneceu em atividade em 13 de 19 gestações, sofreu remissão em quatro e houve recorrência no pós‐parto em duas gestações. A idade de início da DBAL variou de 1,5 a 33 anos; três pacientes tinham doença bolhosa crônica na infância, e nove tinham DBAL forma do adulto. No geral, a DBAL tende a melhorar durante a gestação, especialmente por volta da décima semana gestacional. Doze das 19 pacientes receberam tratamento sistêmico (7/12 receberam dapsona), 4/19 estavam em remissão e 1/19 apresentou doença mínima, sem terapia.25
Dois artigos de relatos de caso descreveram DBAL e gestação: um refere‐se a uma mulher de 24 anos diagnosticada com DBAL e mola hidatiforme, excisada em sua terceira gestação, e o outro refere‐se a uma mulher de 29 anos, grávida de 38 semanas, com autoanticorpos direcionados contra o domínio não colágeno 16A (NC16A) de COL17.23,27
Epidermólise bolhosa adquirida e gestaçãoForam recuperados três artigos sobre EBA e gestação. Em um deles, uma mulher de 32 anos teve o diagnóstico de EBA e, no momento do parto, tanto a mãe quanto o recém‐nascido apresentavam erosões superficiais e profundas na face, tórax, abdome e extremidades.28 O segundo artigo descreve uma paciente que desenvolveu EBA no segundo dia do pós‐parto com resolução de bolhas na menopausa.29 O terceiro artigo relata uma mulher de 26 anos que teve uma recaída do EBA durante o primeiro mês de gestação. Por causa de uma resposta insuficiente aos corticosteroides sistêmicos, ela sofreu um aborto no segundo mês de gestação e, em seguida, teve redução significativa do número de bolhas.30
Dermatite herpetiforme e gestaçãoApenas um artigo foi recuperado. Uma paciente de 33 anos com quadro de DH grave engravidou, e foi necessária dapsona oral (25‐50 mg/dia) para controle da doença. A paciente deu à luz um recém‐nascido a termo, hígido, e no pós‐parto evoluiu com reativação da doença.31
Diagnóstico laboratorialPara todos os casos com suspeita clínica de DBAI, o diagnóstico é confirmado pela realização de exame citológico, biópsia cutânea com exame anatomopatológico, imunofluorescência direta e indireta e ELISA. Portanto, uma paciente com diagnóstico confirmado de DBAI prévio à gestação não precisaria ser submetida novamente à propedêutica investigatória, salvo se as lesões atuais não se apresentam com características típicas da DBAI previamente diagnosticada. No entanto, nos casos com quadro sugestivo de DBAI pela primeira vez durante a gestação, faz‐se necessária a confirmação diagnóstica. Com relação à biópsia cutânea, aplicação tópica de clorexidina para antissepsia pode ser usada com segurança em gestantes. Não há relatos de efeitos teratogênicos relacionados aos anestésicos tópicos. No entanto, a biópsia da pele deve ser realizada com cautela em gestantes em função do risco de metemoglobinemia fetal associada à prilocaína e da diminuição do fluxo uterino secundário ao uso de anestésicos locais.32 Por esses motivos, métodos alternativos podem ser úteis e incluem investigação sorológica por meio da imunofluorescência indireta, ELISA e microscopia de imunofluorescência com biochip.33
Tratamento das DBAI na gestação e durante a lactaçãoO desafio do tratamento das DBAI durante a gestação refere‐se à escolha do medicamento, tendo como questão principal a segurança da mãe e do concepto. A dificuldade em avaliar os medicamentos melhores e mais seguros para DBAI em gestantes se deve: 1) à ocorrência rara de DBAI na gestação; 2) à exclusão de gestantes de estudos clínicos sobre medicamentos; e 3) às alterações hormonais associadas à gestação que podem impactar o controle da doença, interferindo na resposta imune. Desde que a nova regulamentação para uso de medicamentos na gestação e lactação entrou em vigor, em 30 de junho de 2015, a Federal Drug Administration (FDA) eliminou as letras padrão da categoria para medicamentos prescritos na gestação (A, B, C, D e X).34 De acordo com o sistema da categoria anterior, nenhum medicamento para tratamento de DBAI pertencia à classe A, uma vez que as pacientes grávidas não podiam participar de ensaios clínicos controlados randomizados.
Diversos medicamentos frequentemente utilizados na gestação pertenciam à categoria C, uma vez que modelos animais evidenciaram efeitos adversos no feto. No entanto, existem diferenças significativas entre roedores e placenta humana, e, portanto, esses riscos muitas vezes não são aplicáveis aos seres humanos. Muitos desses medicamentos anteriormente classificados na categoria C são, de fato, boas opções para uso na gestação, especialmente quando os riscos da DBAI superam os riscos de utilização da medicação.10,35
Glicocorticoides tópicosGlicocorticoides tópicos são, frequentemente, tratamentos de primeira linha para DBAI e ainda mostram segurança na gestação, com a vantagem de não compartilhar os mesmos riscos dos esteroides sistêmicos.36
Os escores de Apgar, anormalidades congênitas, incluindo fissuras orofaciais, parto prematuro, tipo de parto e morte fetal não mostraram relação com o uso de glicocorticoides tópicos em qualquer potência. Uma exceção foi a associação dose‐resposta entre glicocorticoides tópicos e crescimento intrauterino restrito (CIUR) e recém‐nascido de baixo peso ao nascer (RNBP), especificamente quando aplicado no terceiro trimestre em doses muito altas.36
Glicocorticoides tópicos são seguros durante a lactação, uma vez que a transmissão para o leite materno é marginal e os glicocorticoides são um elemento natural do leite materno.37 No entanto, glicocorticoides tópicos de alta potência não devem ser aplicados no mamilo antes da amamentação, em função do risco de hipertensão arterial infantil.38
Inibidores tópicos da calcineurinaRelatos de casos e um ensaio clínico duplo‐cego placebo controlado demonstraram a eficácia dos inibidores tópicos da calcineurina no tratamento das DBAI, particularmente se a doença for leve e localizada.39 Esses agentes geralmente são usados para evitar os efeitos colaterais do uso prolongado de esteroides tópicos, especialmente em áreas como face, pescoço, dobras e genitais.10
Os efeitos sobre o feto, que podem ser extrapolados a partir de estudos sobre a administração sistêmica de tacrolimo em pacientes transplantados, incluem parto prematuro e RNBP. Embora não tenham sido realizados estudos formais em gestantes, especialistas recomendam o uso de no máximo 5g/dia, durante 2‐3 semanas, em pequenas áreas.40
Os dados de recomendação de segurança do tacrolimo tópico durante a lactação são limitados; portanto, ele deve ser usado com moderação, evitando‐se aplicação na área do mamilo.41
Glicocorticoides sistêmicosOs esteroides sistêmicos ainda são considerados uma opção de tratamento importante e segura para as DBAI na gestação. Esteroides não fluorados como prednisona e hidrocortisona costumam ser as formas preferidas, porque a inativação pela 11‐beta‐hidroxiesteroide‐desidrogenase limita a exposição fetal.10 Os riscos no feto são fissuras orofaciais, CIUR, RNBP, ruptura prematura de membranas, atraso do desenvolvimento neuropsicomotor e parto prematuro, e para gestantes, os principais efeitos colaterais incluem pré‐eclâmpsia, eclampsia, hipertensão arterial, diabetes gestacional, osteoporose, má cicatrização de feridas, formação de estrias e infecções puerperais e pós‐operatórias.10,40,41 A dose recomendada não deve exceder 20mg/dia de prednisona, evitando o uso a longo prazo.41 Se forem necessárias doses mais altas, a opção é mudar para um agente poupador de esteroides para o controle da doença.
O aleitamento materno deve ocorrer pelo menos 4 horas após a administração da prednisona, uma vez que sua meia‐vida sérica é de 60 minutos, com níveis no leite materno atingindo o pico após 2 horas de ingestão e diminuindo rapidamente em seguida.10,40
AzatioprinaAzatioprina é um análogo sintético da base purina de uso off label no tratamento das DBAI.10,40,41 Vários estudos clínicos e revisões recomendam a azatioprina como um imunossupressor relativamente seguro para ser usado durante a gestação e lactação.42 A placenta pode limitar a entrada de azatioprina e seu metabólito 6‐mercaptopurina. Linfopenia transitória e imunodeficiência podem ser evitadas se a dose diária não exceder 2mg/kg/dia.43
A European Federation of Crohn's & Ulcerative Colitis Associations classifica a azatioprina como “provavelmente segura” para uso durante a amamentação.42 O aleitamento deve ser feito pelo menos 4 horas após a última dose.44
Micofenolato de mofetilaMicofenolato de Mofetila (MMF) é um excelente agente poupador de esteroides em doenças autoimunes, incluindo DBAI. No entanto, é um componente teratogênico conhecido e não deve ser usado durante a gestação.45 Como o metotrexato, MMF inibe a síntese de DNA e interrompe a divisão celular, causando risco aumentado de aborto. MMF tem sido associado a abortos espontâneos (especialmente no primeiro trimestre), anormalidades de membros e face, defeitos de linha média e outras malformações congênitas.45
Apesar da escassez de dados sobre o uso de MMF durante o aleitamento materno, especialistas atualmente o classificam como contraindicado. O pequeno peso molecular do MMF permite que ele passe em quantidades significativas para o leite materno, o que poderia causar problemas de desenvolvimento e risco de infecção no recém‐nascido.38
DapsonaA dapsona (diaminodifenilsulfona) é frequentemente usada como terapia adjuvante para DBAI. Relatos de casos mostraram sua segurança na gestação, sem evidência de teratogenicidade, bem como em estudos de gestantes em tratamento de malária, hanseníase ou pneumonia por Pneumocystis jiroveci.41 Dapsona, principalmente acima de 50mg/dia, deve ser evitada em mãe ou feto com deficiência de glicose‐6‐fosfato desidrogenase (G6PD), em função do risco de anemia hemolítica; todos os pacientes devem ser testados antes do seu uso.46
A American Academy of Pediatrics considera a dapsona compatível com o aleitamento materno, uma vez que apenas quantidades pequenas de seus metabólitos são excretadas no leite. A icterícia no bebê deve ser monitorada, se o aleitamento materno ocorrer durante a terapia com dapsona, especialmente em caso de deficiência de G6PD diagnosticada no recém‐nascido.
DoxiciclinaDoxiciclina é um antibiótico com efeitos anti‐inflamatórios e pode ser útil no tratamento das DBAI.47 Doxiciclina há muito tempo tem sido agrupada com outras tetraciclinas e classificadas como não seguras durante a gestação, mas esse agrupamento pode não estar correto, uma vez que a doxiciclina foi desenvolvida após a toxicidade das outras tetraciclinas ter sido bem estabelecida. É provável que a doxiciclina tenha um perfil de segurança diferente das outras tetraciclinas, sem evidências que sustentem uma sobreposição de toxicidades. As tetraciclinas têm um risco aumentado de teratogenicidade, descoloração dentária, interrupção do crescimento ósseo e hepatotoxicidade materna, mas a doxiciclina parece não estar associada a esses riscos. Os dados que diferenciam a doxiciclina das tetraciclinas ainda são limitados e, por isso, os médicos tendem a evitar a doxiciclina quando há opção de outras substâncias com perfil de segurança conhecido.48
O uso de doxiciclina a curto prazo durante a lactação não é contraindicado, mas o fármaco excreta‐se no leite materno e estudos ainda são escassos.35
RituximabeRituximabe (RTX) é um anticorpo monoclonal quimérico anti‐CD20 cujos alvos são as células B, implicadas na patogênese das DBAI. O RTX é bem‐sucedido em propiciar remissão da doença, porém é contraindicado durante a gestação, por atravessar a placenta, esgotar as células B fetais e potencialmente aumentar o risco de infecções materno‐fetais e para o recém‐nascido. A passagem transplacentária do RTX é mínima no primeiro trimestre, moderada no segundo e mais elevada no terceiro. O RTX permanece no soro por três a seis meses e é capaz de atravessar a placenta; por isso, o planejamento da gestação é essencial e as pacientes são aconselhadas a esperar 12 meses após sua última infusão antes de tentar engravidar.10,35 Em relatos de casos de pacientes que acidentalmente receberam RTX durante a gestação não foi observada correlação definitiva com eventos adversos, mas os dados sobre o assunto permanecem escassos.49
O RTX não é recomendado durante a lactação devido à falta de evidências sobre o assunto.50
Considerações finaisA gestação constitui um período em que alterações imunológicas e hormonais intensas ocorrem no organismo materno, a fim de manter o feto halogênico e a estabilidade de seu próprio sistema imunológico. Como a gestação é marcada pela predominância da resposta linfocitária Th2, da mesma forma que as DBAI, seria esperada uma piora dessas dermatoses. No entanto, o que se observou nesta revisão foi o curso variável das DBAI durante a gestação. Com relação aos pênfigos, o PV tende a piorar, enquanto o PF não costuma sofrer alteração. Por outro lado, a DBAL apresenta tendência de melhora. Em razão do pequeno número de casos estudados, torna‐se difícil a análise da evolução da DH e da EBA durante a gestação.
De maneira geral, apesar da raridade, a ocorrência das DBAI durante a gestação é situação especial, considerando‐se as peculiaridades da confirmação diagnóstica por biópsia cutânea e os riscos potenciais de alguns medicamentos para o concepto. Glicocorticoides, azatioprina e dapsona podem ser consideradas opções relativamente seguras durante a gestação e o aleitamento, desde que sua prescrição e acompanhamento sejam feitos rigorosamente sob supervisão médica. Ao contrário, micofenolato de mofetila, doxiciclina e rituximabe, apesar de alternativas eficientes para tratamento das DBAI, têm seu uso contraindicado na gestação pelos riscos potenciais para o concepto. Excluído o penfigoide gestacional, ao conhecimento dos autores, até o momento não há nenhuma revisão semelhante de DBAI na gestação.
Suporte financeiroFUNADERSP (Fundo de Apoio à Dermatologia do Estado de São Paulo) – projeto 50‐2017.
Contribuição dos autoresPatrícia Penha Silveira Fagundes: Coleta de dados; concepção e desenho do estudo; análise dos dados; redação do artigo; revisão crítica do conteúdo e aprovação da versão final.
Claudia Giuli Santi: Concepção; revisão e aprovação da versão final.
Celina Wakisaka Maruta: Concepção; revisão e aprovação da versão final.
Denise Miyamoto: Concepção; revisão e aprovação da versão final.
Valeria Aoki: Concepção e desenho do estudo; análise dos dados; redação do artigo; revisão crítica do conteúdo e aprovação da versão final.
Conflito de interessesNenhum.
Como citar este artigo: Fagundes PPS, Santi CG, Maruta CW, Miyamoto D, Aoki V. Autoimmune bullous diseases in pregnancy: clinical and epidemiological characteristics and therapeutic approach. An Bras Dermatol. 2021;96:581–90.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.