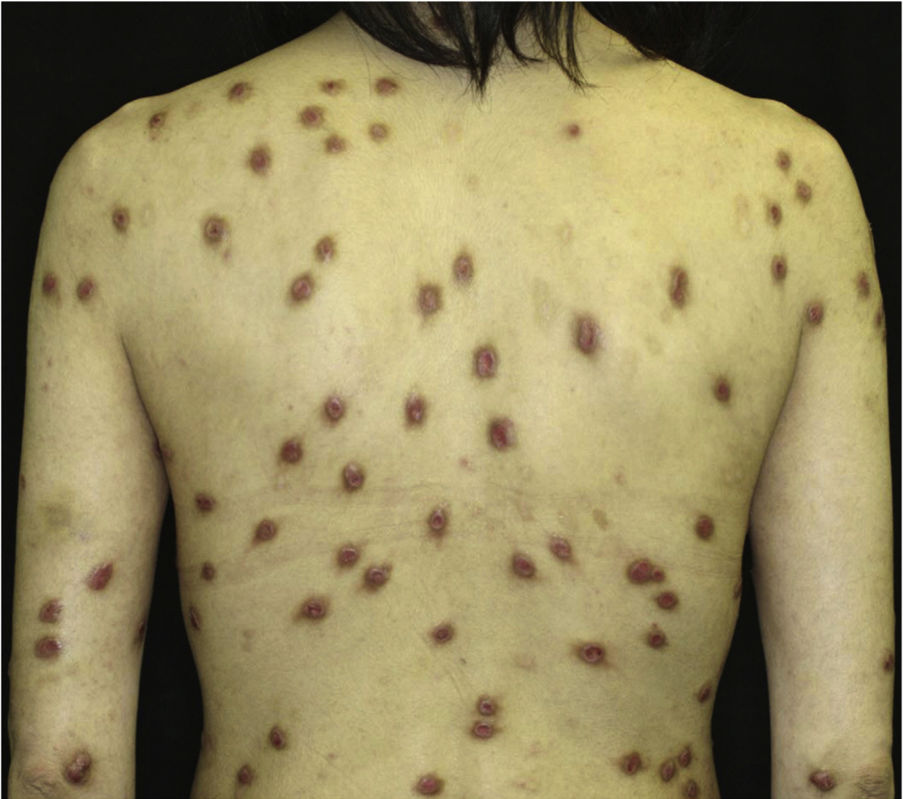
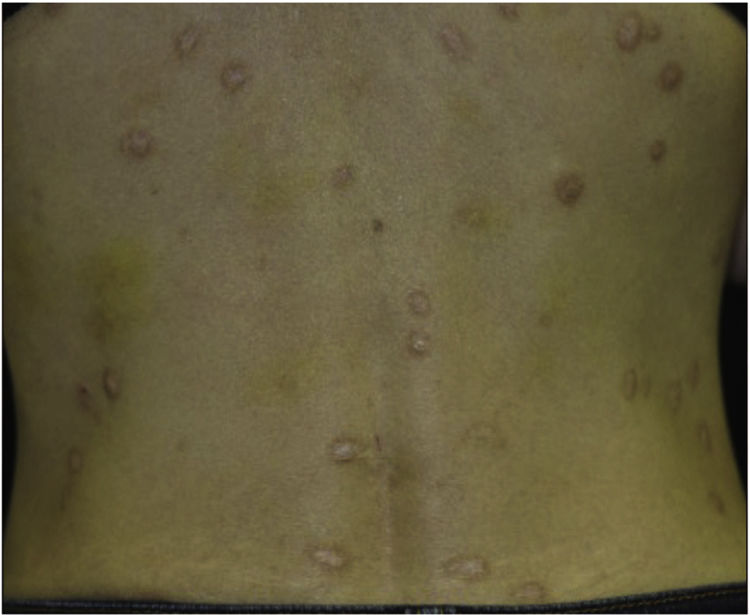
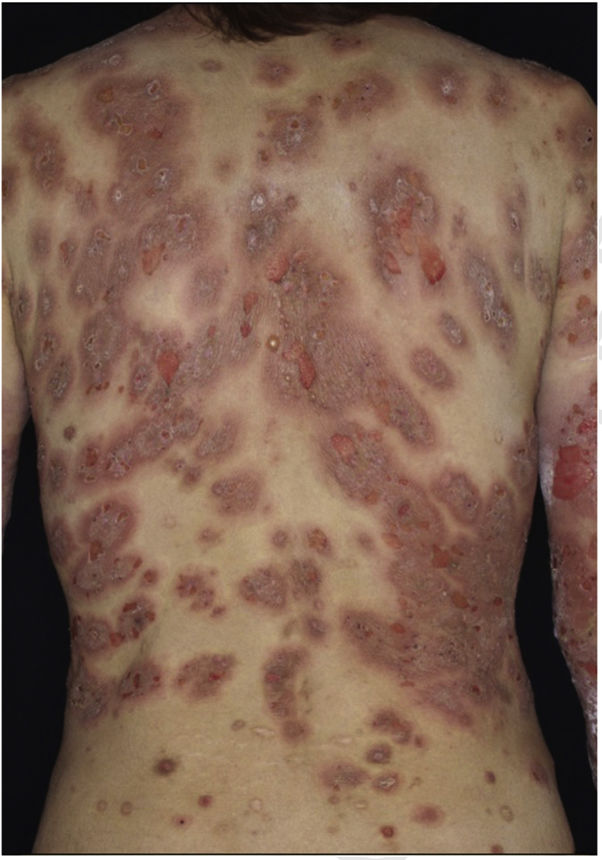
Paciente do sexo feminino, 40 anos, com síndrome de alergia oral, procurou o departamento queixando‐se de erupções pruriginosas que apareceram havia um ano. Ao exame físico, apresentava vários nódulos firmes no tronco e nas extremidades (fig. 1). Além disso, foi observada hiperceratose subungueal. A histopatologia revelou proliferação epidérmica irregular, discreta infiltração de células mononucleares e fibrose na derme superior (fig. 2). O exame laboratorial mostrou contagem de leucócitos de 9.700μL (12% eosinófilos) e aumento de AST (63 UI/L) e ALT (62 UI/L). O nível sérico de IgE estava acima de 5.000 UI/mL, enquanto o nível do anticorpo anti‐BP180‐NC16A IgG estava dentro da normalidade. A paciente foi tratada com várias terapias, todas ineficazes. Entretanto, as lesões nodulares haviam melhorado drasticamente quando ela retornou ao hospital, dois anos depois (fig. 3). A paciente afirmava ter se divorciado, o que, suspeitou‐se, teve o efeito de reduzir seu estresse mental com melhora das lesões cutâneas. O nível sérico de IgE permaneceu elevado (3.614 UI/mL). Três anos e meio após a resolução completa, voltou a visitar o Departamento queixando‐se de prurido, e lesões eritematosas e bolhosas. O exame físico mostrou bolhas tensas, erosões e eritema edematoso nas extremidades superiores e na região dorsal (fig. 4). Os exames laboratoriais mostraram aumento do número de eosinófilos (10%) no sangue periférico, e o título sérico do anticorpo anti‐BP180‐NC16A IgG estava acima de 10.000 U/mL (nível de corte: <10). A histopatologia de uma das bolhas revelou bolha subepidérmica com infiltração acentuada de eosinófilos (fig. 2). A imunofluorescência direta mostrou deposição linear de IgG e C3 na zona da membrana basal (fig. 2), e a imunofluorescência indireta com separação dermoepidérmica utilizando NaCl 1M (split‐skin) revelou anticorpos IgG circulantes no teto da clivagem. A paciente foi tratada com pulsoterapia de metilprednisolona (1.000mg por três dias consecutivos), seguida por prednisolona oral, metotrexato, ciclosporina e terapia de plasmaférese. O exame imuno‐histopatológico revelou basófilos BB1‐positivos nas lesões de prurigo nodular (PN) e penfigoide bolhoso (PB; fig. 2). As células imunomarcadas foram contadas em 10 campos aleatórios em grande aumento (400×) utilizando um microscópio óptico, que mostrou 13,8 ±5,2 no PN versus 15,2±5,0 em lesões de PB.
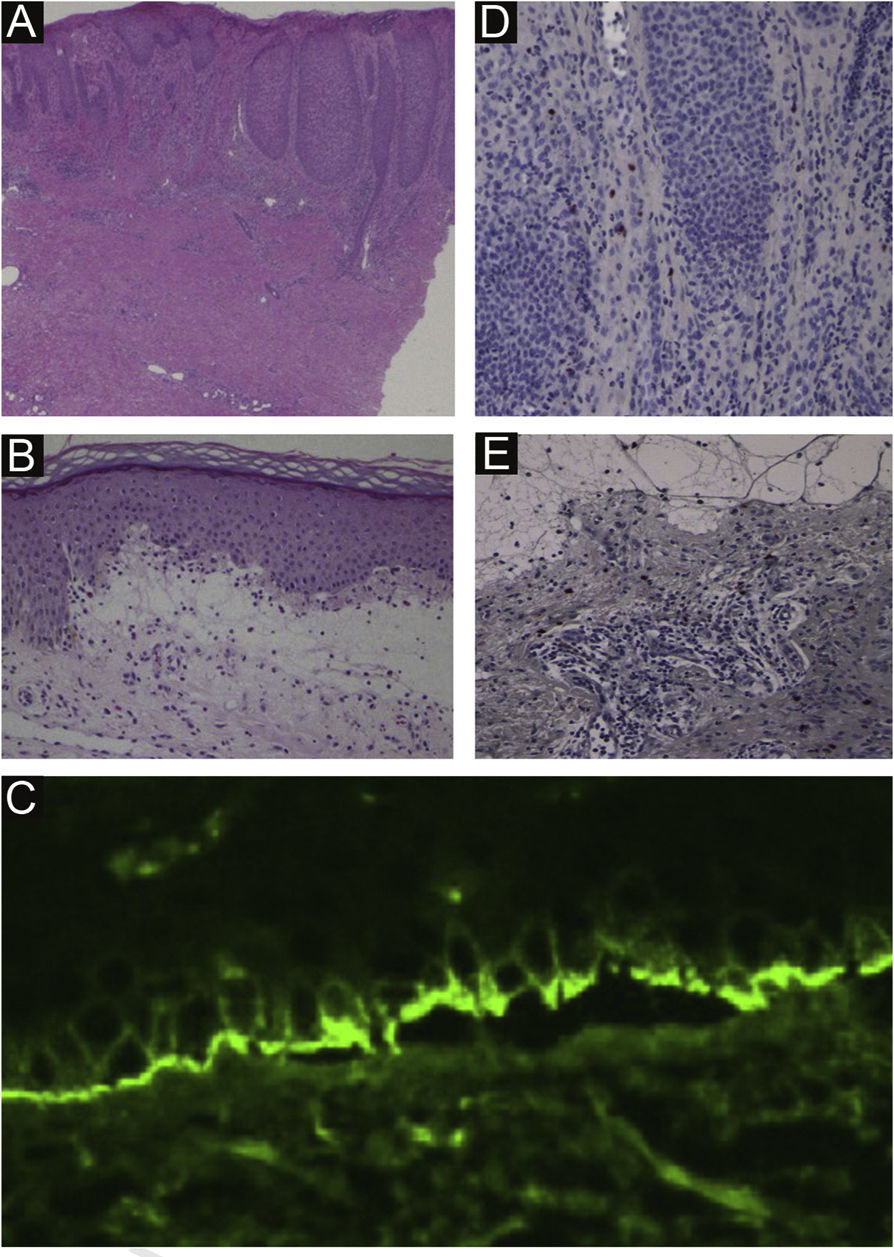
(A) Aspecto histopatológico do prurigo nodular mostrando acantose irregular da epiderme, infiltrado de células inflamatórias na derme superior e fibrose na derme (40×). (B) Histopatologia da lesão bolhosa mostrando bolha subepidérmica com infiltração de eosinófilos (100×). (C) Imunofluorescência direta mostrando deposição linear de IgG na zona da membrana basal. (D) Imunomarcação com BB‐1 na pele lesional do prurigo nodular (200×). (E) Imunomarcação com BB‐1 na pele lesional do penfigoide bolhoso (200×).
Relatamos aqui um caso de PB que ocorreu após resolução completa de PN grave. Caso semelhante foi relatado por Yoshimoto et al.,1 que desenvolveu PB 10 meses após a melhora do PN negativo para autoanticorpos. Eles especularam que o prurido e a inflamação local no PN levaram à exposição de neoepítopos na membrana basal, resultando na produção de anticorpos penfigoides.2 Chen et al.2 sugeriram que o acometimento da zona da membrana basal (ZMB) pode ter exposto os antígenos “self” ao sistema imunológico e induzido uma resposta autoimune contra os componentes da ZMB. Esse fenômeno de “epitope spreading” pode ter ocorrido no presente caso durante sua longa evolução.
Estudos recentes mostraram que a infiltração basofílica foi observada em PN e PB nos estados ativos.3,4 Os basófilos são uma das principais fontes de produção de citocinas do tipo Th2, levando ao aumento dos níveis de IgE.
Em conclusão, o número de basófilos estava aumentado em ambas as lesões de PB e PN e pode ter desempenhado importante papel na indução de PB e PN no presente caso.
Suporte financeiroNenhum.
Contribuição dos autoresTomoko Hiraiwa: Concepção e planejamento do estudo; obtenção de dados ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Natsuko Matsumura: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Tatsuhiko Mori: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Nobuyuki Kikuchi: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Toshiyuki Yamamoto: Concepção e planejamento do estudo; análise estatística; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem a Sra. Chiyako Miyagishi (Departamento de Dermatologia, Tokyo Medical and Dental University) pela coloração especial utilizando anticorpo anti‐BB‐1.