A dermatoscopia é uma técnica diagnóstica in vivo imprescindível na avaliação clínica de tumores cutâneos. Atualmente, o mesmo também pode‐se dizer sobre suas implicações na abordagem de diversas situações clínicas na Dermatologia. Um número crescente de relatos acerca de cenários e enfermidades dermatológicos tem sido publicado, nos quais a dermatoscopia tem prestado grande auxílio na elucidação diagnóstica. O termo “entomodermatoscopia” foi cunhado para descrever os achados dermatoscópicos em infestações cutâneas e também em dermatoses de origem infecciosa. Na parte I deste artigo serão abordadas as principais descrições dermatoscópicas nas zoodermatoses e nas infecções bacterianas. Em muitas delas, como a escabiose, a pediculose, a míiase e a tungíase, é possível identificar o patógeno, consequentemente realizar o diagnóstico com mais rapidez e utilizar‐se da técnica para seguimento de eficácia terapêutica. Em outras situações que serão descritas, a dermatoscopia pode propiciar a observação de achados clínicos em maior magnitude, afastar diagnósticos diferenciais e aumentar o nível de confiança em uma suspeita clínica.
A dermatoscopia é um método não invasivo utilizado para uma quantidade cada vez maior de sintomas cutâneos e cenários clínicos dermatológicos. Essa popularidade do método se deve, principalmente, a sua praticidade, boa acurácia e também por ser acessível a boa parte dos médicos que avaliam a pele. Ela propicia a observação in vivo de um novo mundo morfológico e, com isso, a identificação de estruturas não visualizáveis ao olho nu, o que colabora sobremaneira na detecção dessas dermatoses. Foi cunhada outrora de “o estetoscópio do dermatologista”, dado seu auxílio na prática clínica diária.1
Originalmente descrita para avaliação de lesões pigmentares e para diagnóstico diferencial de tumores cutâneos, a dermatoscopia ampliou suas indicações e, em especial para esta revisão, recebeu nas últimas décadas inúmeras descrições de relatos ou séries de casos na detecção de dermatoses de origem infectoparasitárias.2 O reconhecimento de estruturas dermatoscópicas requer uma curva de aprendizado, assim como para a aplicação do método na avaliação de lesões infectoparasitárias pigmentares. Cabe ressaltar que a variabilidade clínica que algumas doenças podem apresentar faz com que alguns padrões e estruturas dermatoscópicos relatados nessas enfermidades tenham graus variados de reprodutibilidade por outros observadores, dependendo dos cenários clínicos e das situações peculiares dos pacientes. Com o intuito de descrever os achados dermatoscópicos mais aceitos, a Sociedade Internacional de Dermatoscopia recentemente realizou um Consenso sobre a dermatoscopia empregada nas doenças infecciosas e inflamatórias.3
Os achados dermatoscópicos sempre devem ser associados com sintomas e características morfológicos clínicos apresentados pelos pacientes. Para o melhor desempenho da dermatoscopia na prática clínica, é indispensável aliá‐la a uma boa anamnese e a exame físico dermatológico. O presente artigo visa demonstrar as principais utilizações da dermatoscopia na identificação de doenças infectoparasitárias.2 Na parte I, serão descritos os padrões dermatoscópicos de dermatozoonoses e de infecções bacterianas.
DermatozoonosesEscabioseA escabiose é uma dermatose contagiosa causada pelo ácaro Sarcoptes scabiei var. hominis. Ocorre mundialmente e não apresenta predileção por sexo, idade ou etnia. Após copular, o ácaro macho morre e a fêmea penetra na epiderme. Ela se locomove criando os túneis escabióticos, nos quais elimina ovos e fezes (sibalas). O prurido nessas áreas pode ser intenso, especialmente à noite. Clinicamente, observa‐se a presença de pápulas eritematosas, eventualmente lineares ou serpiginosas (túnel escabiótico), muitas vezes recobertas por crostículas hemáticas consequentes de escoriações.4 Geralmente acomete os espaços interdigitais, punhos, pilares axilares, regiões inframamárias, periumbilicais e genitais. Lesões nodulares podem ocorrer, assim como eczematização ou impetiginização secundária. Apesar de comum, certos casos de escabiose podem ser inicialmente tratados como outra dermatose, o que retarda seu diagnóstico.
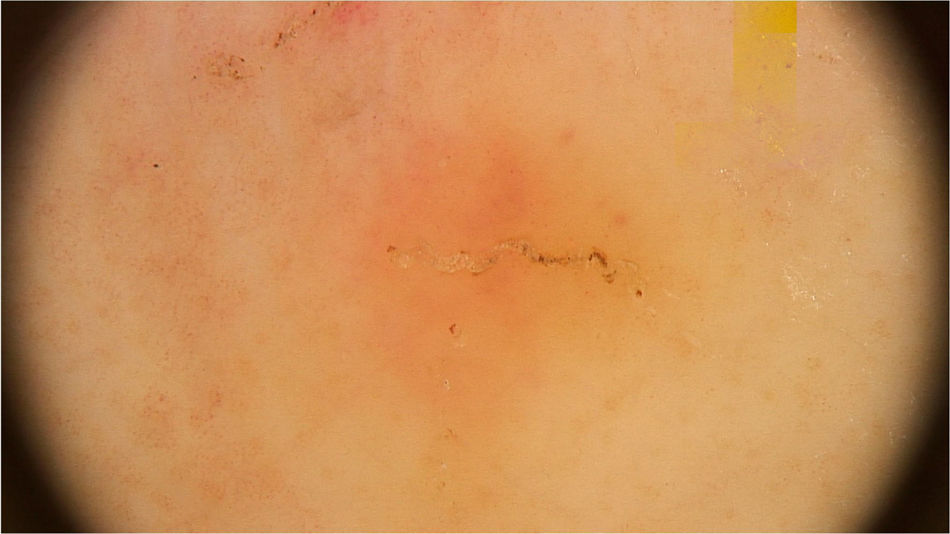
Os achados dermatoscópicos da escabiose foram descritos pela primeira vez por Argenziano et al. Em seu estudo, os autores identificaram em 93% de 70 pacientes uma estrutura triangular (em forma de “asa‐delta”) marrom na parte anterior de uma área esbranquiçada serpiginosa que foi denominada de “jato com sua fumaça” (jet with contrail – fig. 1). A estrutura amarronzada corresponde à porção anterior do ácaro, e a estrutura esbranquiçada, ao túnel escabiótico. Essa descrição é um marco na entomodermatoscopia, por ser o primeiro relato da aplicabilidade prática da dermatoscopia para o diagnóstico de doenças infectoparasitárias.5 Esses dados foram reproduzidos em outros estudos. Dupuy et al. compararam a dematoscopia com o método tradicional de escarificação da pele e observação dos fragmentos ao microscópio óptico após preparo. A dermatoscopia mostrou alta sensibilidade (91%) e especificidade (86%) e maior agilidade na execução, além de ser técnica preferida pelos pacientes.6 Atualmente, pode ser considerada um dos principais métodos de rastreamento da escabiose, uma vez que possibilita a identificação do agente causador, critério maior para considerar o caso comprovado segundo a 2020International Alliance for the Control of Scabies(IACS)Consensus Criteria for the Diagnosis of Scabies.7
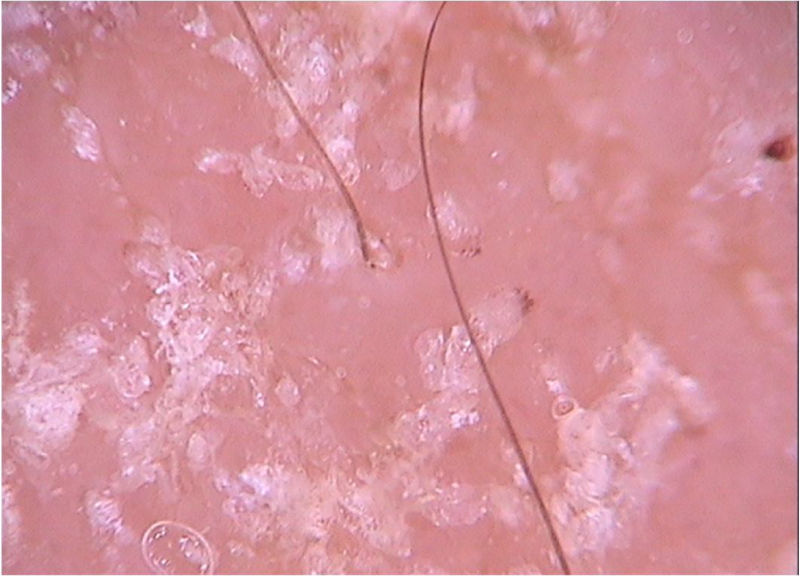
Em situações clínicas peculiares, como pacientes imunossuprimidos, com quadros neurológicos crônicos, entre outros, os ácaros podem disseminar e formar a variante crostosa, também chamada de sarna norueguesa. Clinicamente, observam‐se placas eritemato‐escamosas até eritrodermia. À dermatoscopia, é possível identificar uma quantidade enorme de estruturas tuneliformes com estrutura triangular amarronzada. Por vezes, podem se cruzar, configurando noodle pattern, ou padrão em espaguete (fig. 2).8
Muitos pacientes podem apresentar prurido ou lesões prurigoides nodulares por semanas após o tratamento. A dermatoscopia pode prestar também grande auxílio no seguimento terapêutico, possibilitando a visualização de ácaros viáveis ou afastando sua existência pós‐tratamento.
MííaseA míiase é consequente a infestação por larvas de moscas, e classicamente pode ser classificada como furunculoide ou cavitária. A infestação por larvas da mosca Dermatobia hominis na pele costuma caracterizar a míiase furunculoide, forma frequente de manifestação da doença, especialmente em áreas rurais. É uma dermatose frequente em toda a América tropical. Os ovos da mosca chegam até a pele transportados por insetos foréticos, como os mosquitos, e penetram através dos folículos pilosos ou pelas próprias picadas. O ciclo continua com o desenvolvimento da larva no subcutâneo (pode permanecer até 30 dias) até atingir estágio suficiente para emergir e virar pupa no solo.
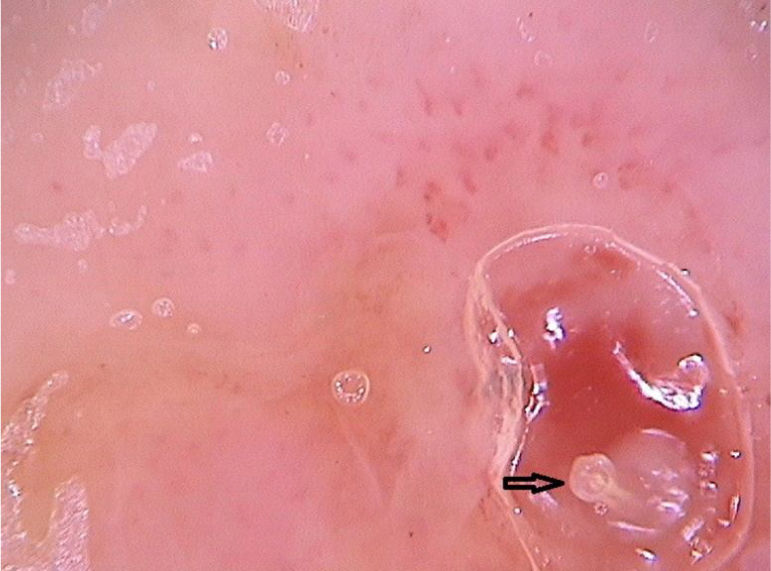
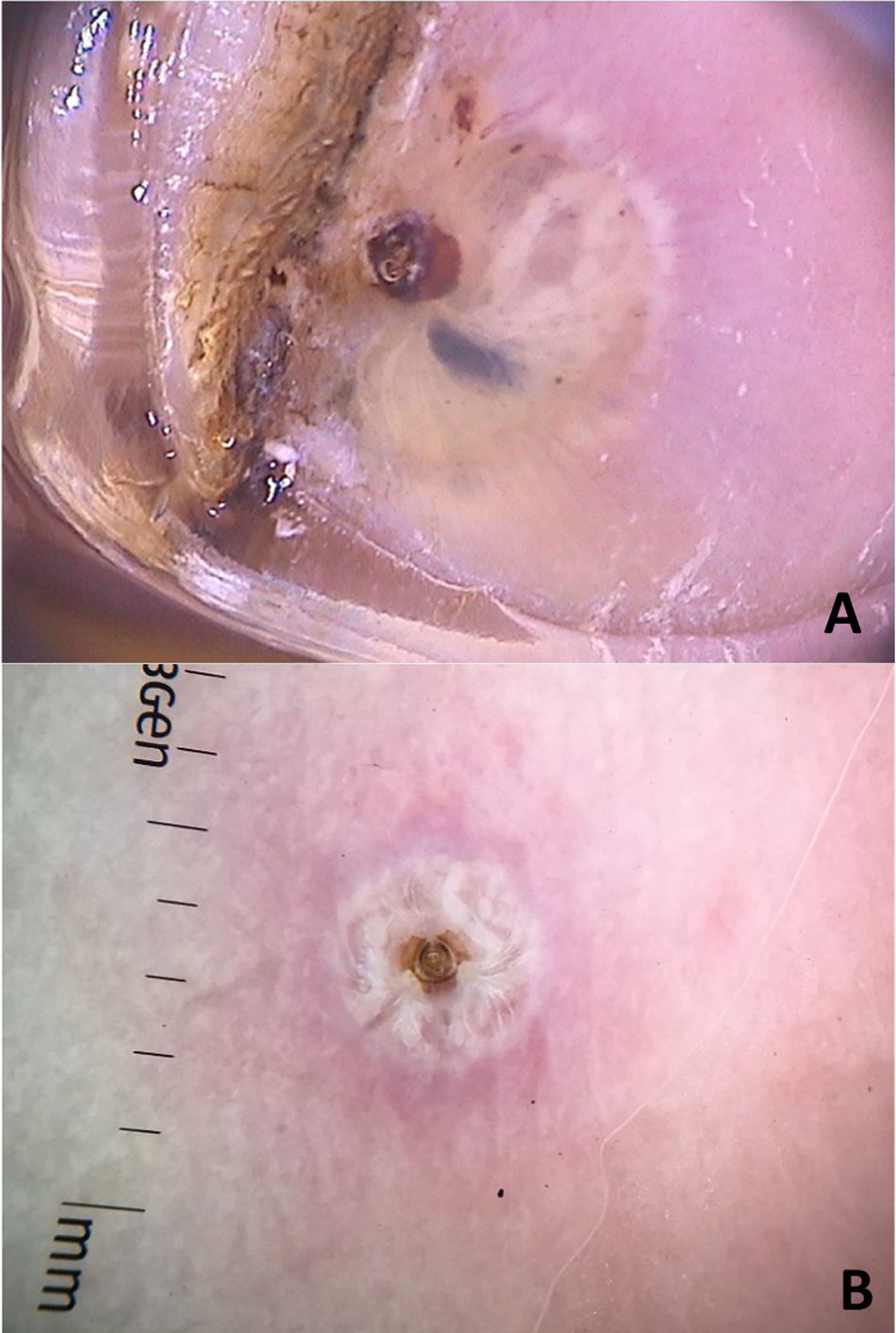
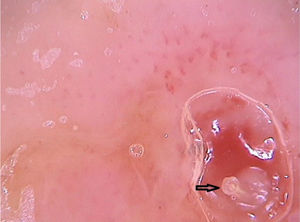
Clinicamente, se manifesta como um nódulo eritematoso, doloroso, com orifício central, que elimina secreção serosa, muitas vezes confundido com lesões abcedidas. É possível haver infecção secundária e, por isso, é importante sua suspeita e detecção. A dermatoscopia pode ser útil nesse processo, uma vez que propicia a identificação da larva.9 Sua porção anterior, onde fica o aparelho respiratório (espiráculo), é visualizável in vivo pelo orifício da cavidade. De maneira recorrente, ela apresenta movimentos à superfície para respirar. O uso de dermatoscopia com contato faz com que haja uma oclusão do orifício e, consequentemente, a larva inicia movimentos à superfície com mais frequência e acaba por ser identificada. É possível observar uma estrutura central amarelada com espículas ao redor, dependendo do tamanho da larva. É menos encontrada em casos de estágios iniciais de seu desenvolvimento (fig. 3). Há relatos de observação das larvas também com a dermatoscopia sem contato utilizando aparelhos de luz polarizada; entretanto, é possível que o tempo de observação precise ser mais prolongado para identificar os movimentos da larva. Esses achados auxiliam também na terapêutica da míiase furunculoide, uma vez que a oclusão por algumas horas leva à morte da larva. A oclusão do orifício com fita adesiva ou similar dificulta a respiração da larva, e a dermatoscopia auxilia na percepção de ausência de movimentos respiratórios.4,9
A míiase cavitária ocorre usualmente em ferimentos, áreas necróticas ou tumores. Má higiene ou indivíduos com condições sociais especiais (como idade avançada) ou portadores de doenças psiquiátricas ou neurodegenerativas podem também ser mais predispostos. Clinicamente, caracteriza‐se por apresentar grande quantidade de larvas na mesma cavidade. No Brasil, a espécie mais associada é a da mosca Cochliomyia hominivorax. À dermatoscopia, as larvas são imediatamente identificadas; é possível observá‐las com coloração amarelada, com espiráculo em uma das extremidades e anéis de espículas enegrecidas.10
PediculoseA pediculose é caracterizada pela infestação do couro cabeludo pelo piolho Pediculus humanis capitis. Ocorre no mundo inteiro, por vezes na forma de surtos em escolas ou locais de grande aglomeração de pessoas. A detecção dos piolhos é determinante para o diagnóstico; entretanto, pela velocidade com que se locomovem, nem sempre podem ser visualizados. Desse modo, é comum a suspeita diagnóstica recair sobre a ocorrência de sintomas, como prurido no couro cabeludo e na região cervical posterior. Além disso, clinicamente é possível observar pápulas eritematosas com crostículas hemáticas, por vezes escoriadas, nessas áreas, assim como a visualização de lêndeas aderidas às hastes capilares. Impetiginização e eczematização secundárias são frequentes.
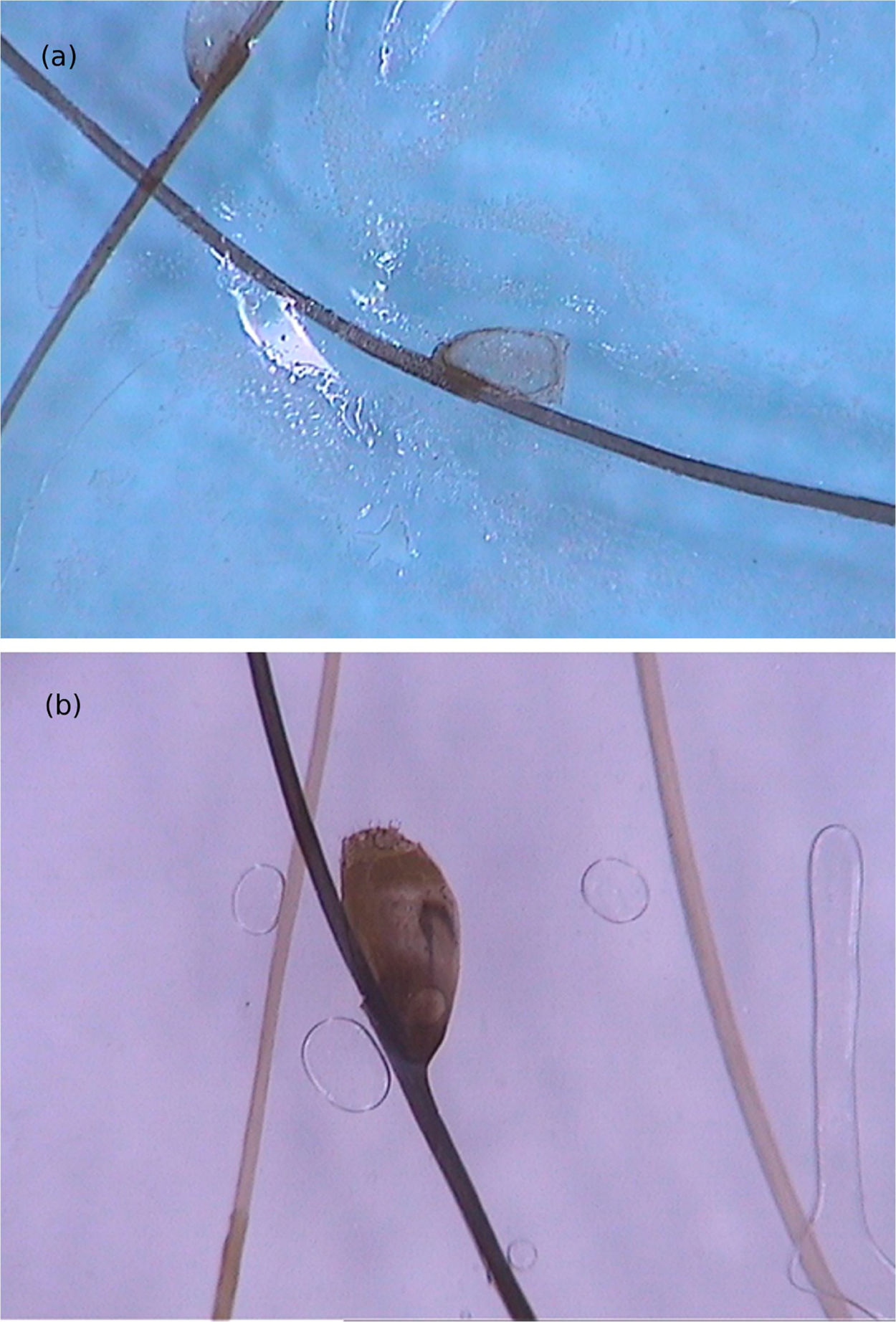
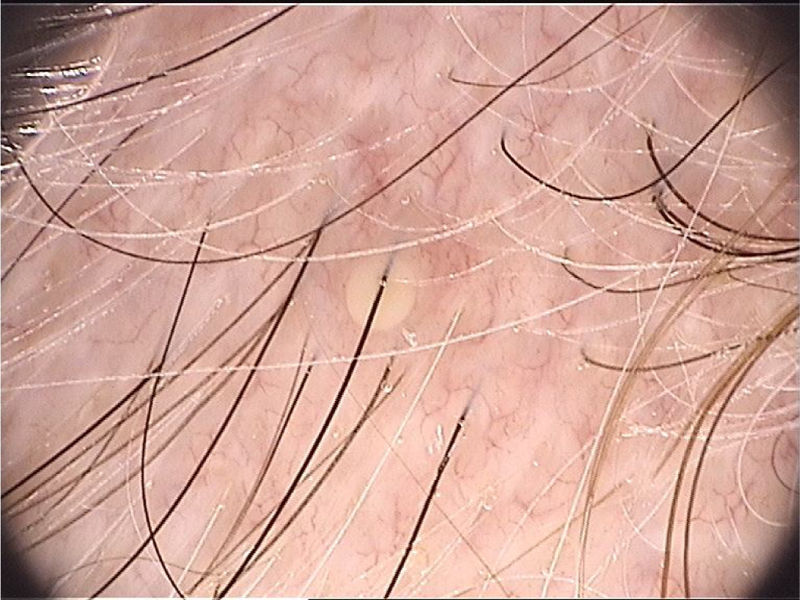
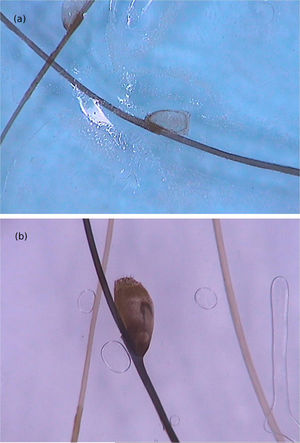
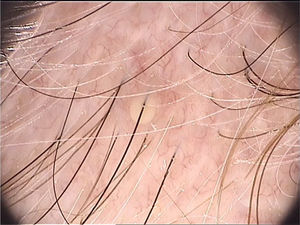
Di Stefani et al. descreveram pela primeira vez a utilização da dermatoscopia para o auxílio diagnóstico na pediculose. Utilizando dermatoscópios de luz polarizada, demonstraram que era possível diferenciar in vivo lêndeas de debris de queratina aderidos às hastes capilares derivadas de erupções escamosas de couro cabeludo como a dermatite seborreica ou a psoríase. Além disso, foi possível observar que algumas lêndeas estavam vazias, com uma fratura de uma de suas extremidades, enquanto outras permaneciam íntegras e preenchidas por piolhos viáveis.11 Outro relato apontou a possibilidade de utilizar a dermatoscopia ex vivo para a visualização das lêndeas. Os fios de cabelo com estruturas esbranquiçadas são cortados, e é possível também identificar escamas, lêndeas viáveis ou vazias (fig. 4).12
A pediculose pubiana, ou fitiríase, é causada pelo piolho Phthirus pubis. É mais frequente em adultos jovens, geralmente adquirido por contato sexual. Fômites como lençóis e toalhas também podem transmitir o agente. O prurido na zona genital é o sintoma mais relevante; dependendo do grau de infestação, pode se estender para outras áreas do corpo. Pápulas eritematosas escoriadas são frequentes. À dermatoscopia, é possível identificar o piolho com nitidez. Pode ser encontrado com suas garras aderidas aos pelos, muitas vezes com a porção anterior invadindo a pele. Do mesmo modo que a pediculose do couro cabeludo, as lêndeas encontram‐se aderidas aos pelos e podem estar vazias ou ainda viáveis.
TungíaseA tungíase é uma ectoparasitose autolimitada endêmica de áreas tropicais e subtropicais, originária das Américas do Sul e Central, com posterior disseminação para a África e Ásia. É causada pela fêmea da pulga Tunga penetrans, que habita solos secos e arenosos, e penetra a pele de seus hospedeiros (homens, cachorros, gatos e porcos) após contato direto com o solo. Tem elevada prevalência em áreas de baixa renda de países endêmicos, com carência de ruas pavimentadas e hábito de andar descalços. Costuma ser mais comum em crianças, principalmente nas do sexo masculino.13
A pulga adentra a epiderme e nutre‐se de sangue proveniente do plexo vascular dérmico.14 Considerada a menor de todas as pulgas (com comprimento máximo de 1 mm), a fêmea gravídica da Tunga pode alcançar até 1cm dentro do hospedeiro, onde permanece por um período de até 5 semanas. Esse crescimento exponencial acontece nas primeiras duas semanas, sucedido pela eliminação dos ovos e pela morte da pulga.15
Considerada uma má saltadora (pulos de até 20cm), a área mais comumente afetada nos hospedeiros são os pés, preferencialmente as bordas subungueais, embora qualquer local do corpo possa ser acometido.13,15 Apresenta‐se normalmente como uma pápula de cor branco‐amarelada de centro marrom‐escurecido. Costuma estar acompanhada de sintomas como prurido, dor e sensação de corpo estranho.15 A infecção bacteriana secundária é uma complicação comum, e ocasionalmente o tétano pode ser uma complicação grave.13
Tunga penetrans é um inseto macroscópico, e muitas de suas estruturas são visíveis a olho nu. Seus achados dermatoscópicos normalmente correspondem a elementos anatômicos da pulga, como estruturas externas do exoesqueleto ou mesmo estruturas viscerais internas.
Do ponto de vista dermatoscópico, uma estrutura anelar pigmentada com um poro central costuma estar presente na maioria das lesões. Sua cor pode variar de marrom‐claro a quase preto, e corresponde à quitina pigmentada que circunda a abertura na extremidade posterior do abdome do inseto.
O sangue do hospedeiro no interior do intestino da pulga pode ser flagrado ao exame dermatoscópico. As manchas cinza‐azuladas e os túbulos contorcidos avermelhados são os achados dermatoscópicos correspondentes à hematina. A demonstração em vídeodermatoscopia da peristalse intestinal da pulga in vivo movimentando tais estruturas corrobora os achados. Essas estruturas não são encontradas em todos os casos e podem não ser visualizadas ao exame.
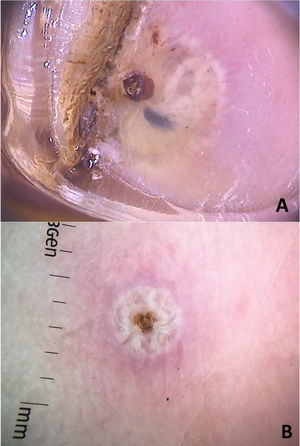
Estruturas descritas como “correntes esbranquiçadas” são achados dermatoscópicos frequentes e correspondem aos ovos no interior do abdome gravídico da fêmea.16 Os ovos são visíveis como pequenas estruturas brancacentas ovaladas e costumam se organizar em cadeia no interior da pulga, formando esse achado característico. Além disso, não é incomum que ovos já eliminados pela fêmea sejam visualizados na área externa à lesão (fig. 5).16
Imagens dermatoscópicas de tungíase. Anel de quitina com mancha cinza‐azulada (hematina) ao redor e estruturas esbranquiçadas em distribuição em corrente (A); anel central de quitina circundado por estruturas esbranquiçadas (ovos) (Fotofinder, magnitude original 20×) (B). Fonte: Acervo do Hospital de Clínicas de Porto Alegre e pessoal dos autores.
Mais recentemente, outro achado foi descrito como fibras dendríticas prateadas, caracterizado por estruturas fibrosas de cor prateada conectadas ao anel pigmentado central. Essas estruturas corresponderiam, provavelmente, à traqueia da pulga, que se ligaria aos espiráculos localizados no poro central pigmentado. Ademais, a análise dermatoscópica torna possível evidenciar atividades da T. penetransin vivo, como a respiração pelos espiráculos e a defecação. A peristalse visceral também já foi registrada em vídeos na literatura.17
Nas áreas endêmicas, a tungíase é facilmente reconhecida e tratada com excisão simples0 muitas vezes pelos próprios pacientes ou pelo médico da atenção primária.13 Entretanto, as lesões fazem diagnóstico diferencial com verrugas virais, miíase, furúnculos, abscessos, paroníquia, picadas de artrópodos, foliculites, granulomas de corpo estranho e granulomas fúngicos, o que pode resultar em um desafio diagnóstico, principalmente em áreas não endêmicas, com médicos não familiarizados com a doença ou em casos com apresentações atípicas. A dermatoscopia é um método não invasivo, rápido e de baixo custo que auxilia no reconhecimento, a fim de evitar complicações e a continuação de seu ciclo de vida.
Larva migransA larva migrans cutânea é uma doença parasitária causada por larvas de ancilóstomos após contato com solo contaminado por fezes de gatos ou cães.14 O principal agente é o Ancylostoma braziliense, mas diversas espécies estão envolvidas, como o Ascaris suum e o Bunostomum phlebotum. Essas larvas não conseguem penetrar a membrana basal da pele humana e permanecem confinadas à epiderme, provocando lesões conforme o trajeto da larva na pele. Clinicamente, se apresentam como lesões serpiginosas, eritematosas e pruriginosas, normalmente na extremidade inferior, onde o contato com o solo é mais frequente.14,18
Existem relatos de visualização da larva e de suas estruturas com a dermatoscopia.14,18 Embora com o aumento de 40×tenha sido possível a detecção da larva, o aumento de 10× não se mostrou útil para esse diagnóstico.19
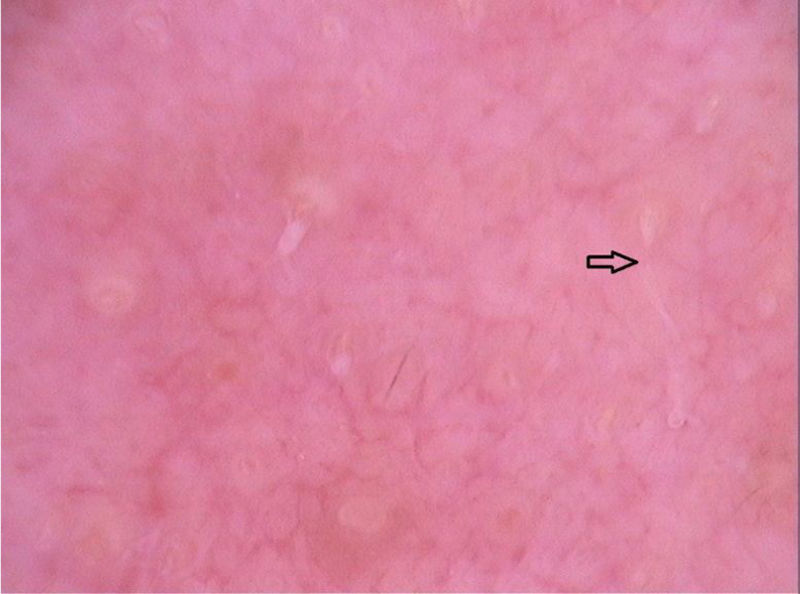
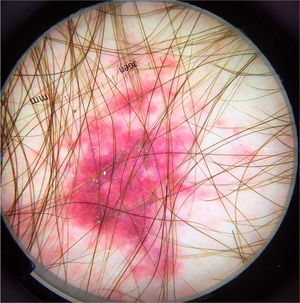
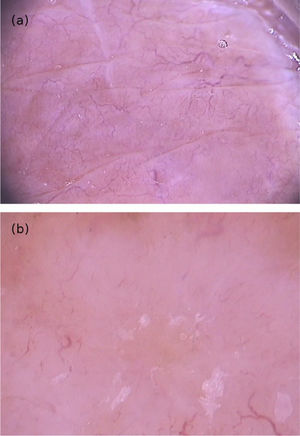
À dermatoscopia, foram observadas áreas translúcidas, sem estruturas, de cor marrom com a periferia amarelada.14,18 Apresentaram‐se em um arranjo segmentar ou oval.14 Esses achados correspondiam ao corpo da larva e foram confirmados por observações de imagem de fluorescência infravermelha próxima. O trajeto vazio construído pela passagem da larva foi visualizado como vasos em ponto de cor vermelha (fig. 6).14
Embora a anamnese e o exame físico sejam suficientes para o diagnóstico, a visualização desses achados à dermatoscopia pode ser útil em casos duvidosos.
Estrongiloidíase disseminadaEstrongiloidíase disseminada é uma infecção helmíntica causada pelo Strongyloides stercoralis que ocorre mais frequentemente em pacientes imunocomprometidos e apresenta altas taxas de mortalidade. Embora as manifestações cutâneas sejam incomuns, quando presentes elas podem ser relevantes para a suspeita diagnóstica, e a dermatoscopia é útil nesses casos.20 A incidência de estrongiloidíase disseminada está aumentando, com a maioria dos casos associados ao uso de corticoides sistêmicos ou outros agentes imunossupressores. Corticoides sistêmicos estão associados à hiperinfecção por Strongyloides stercoralis, aumentando o risco de desenvolver a forma disseminada da doença em até três vezes, mesmo em doses baixas e por curtos períodos. Além disso, pacientes com imunidade celular prejudicada, como aqueles com malignidades hematológicas e os infectados pelo vírus da imunodeficiência adquirida (HIV) ou por vírus linfotrópico T humano (HTLV‐1), estão sob risco aumentado de desenvolver estrongiloidíase disseminada. A infecção por Strongyloides stercoralis inicia‐se com penetração da larva filariforme pela pele em contato com solo contaminado. Nos pacientes imunossuprimidos, o ciclo de infecção é acelerado, levando a uma alta carga parasitária e à infecção disseminada sintomática. Nesses casos, vários órgãos são afetados, incluindo a pele.
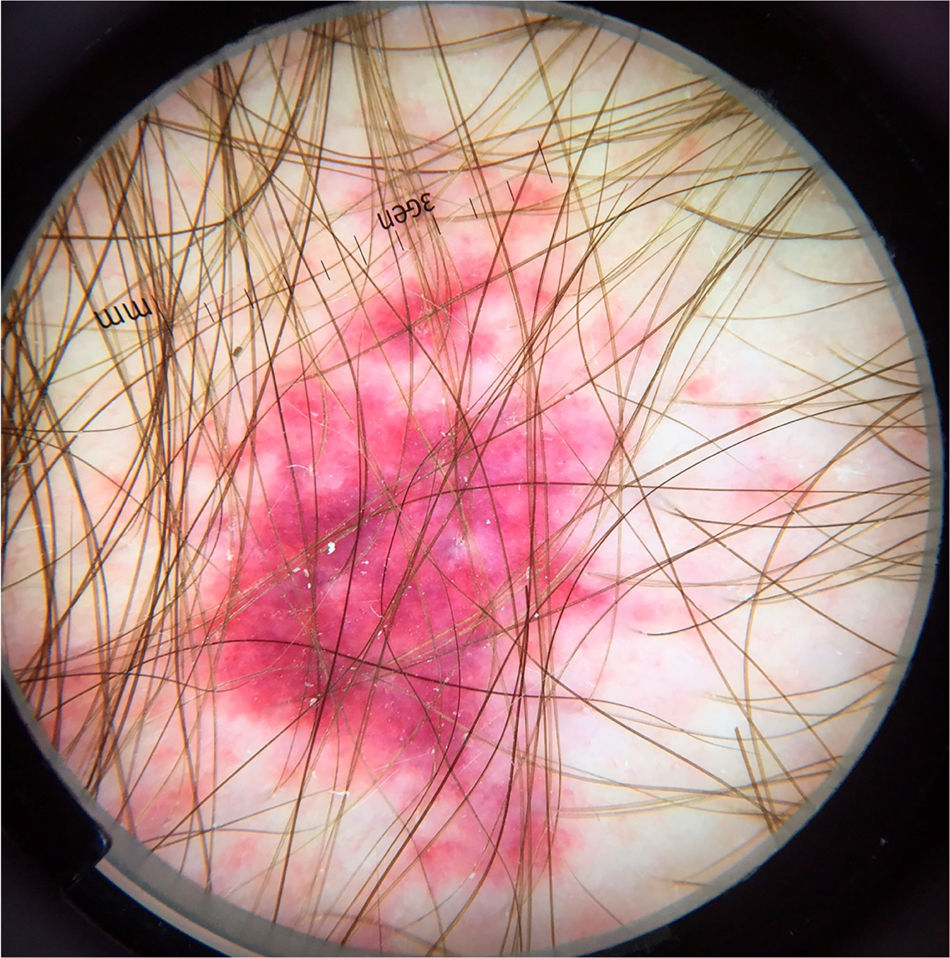
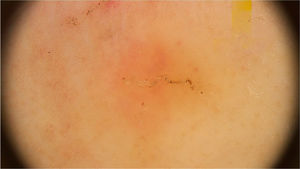
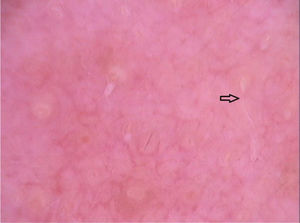
O sintoma cutâneo mais comum da infecção por Strongyloides stercoralis é a larva currens, uma lesão linear, urticariforme e pruriginosa no local de penetração ativa da larva na pele. Na forma disseminada, as manifestações cutâneas decorrem da disseminação hematogênica do parasita: púrpura e petéquias periumbilicais e nas coxas, resultando no chamado padrão em “impressão digital”.21 A púrpura periumbilical ocorre em decorrência do envolvimento da derme por larvas de Strongyloides stercoralis que migram da parede dos vasos para o tecido conectivo dérmico, em razão do extravasamento de eritrócitos, e a localização periumbilical é resultado do fluxo venoso retrógrado. A dermatoscopia dessas lesões purpúricas descreve a presença de áreas purpúricas homogêneas, correspondendo a áreas hemorrágicas (fig. 7).22,23 Esses achados são baseados em poucos relatos de caso; entretanto, os achados dermatoscópicos podem ser úteis para afastar outras entidades dermatológicas. O diagnóstico definitivo de estrongiloidíase disseminada envolve a identificação da larva, seja no estudo anatomopatológico de pele, no lavado broncoalveolar, gástrico ou nas secreções traqueais, dependendo da sintomatologia do paciente. Na histopatologia de lesões de pele purpúricas, modesto infiltrado linfocítico e a presença de larvas na derme são observados.
DemodecidoseDemodecidose é uma infecção da unidade pilossebácea humana associada ao Demodex, um ácaro ectoparasita que afeta a face e o couro cabeludo.24 Existem duas espécies envolvidas na infecção em humanos: Demodex folliculorum e Demodex brevis. Estima‐se que a prevalência de infecção por Demodex em humanos varie de 24% a 100% em indivíduos saudáveis. A infestação sempre deve ser considerada nos casos de dermatite perioral ou em pacientes com lesões rosaceiformes refratárias ao tratamento. As lesões podem ainda apresentar‐se de modo a lembrar dermatite seborreica e foliculite pustulosa.24
Clinicamente, a infecção se manifesta por aspereza na pele (espinulose), eritema, pápulas e/ou pústulas, geralmente associadas a prurido e sensação de queimação. A forma primária ocorre quando não há nenhuma doença inflamatória da pele preexistente, e a secundária ocorre quando há um aumento anormal na quantidade de ácaros de Demodex em pacientes com dermatose preexistente na área, ou até mesmo por aplicação de corticoide tópico por longos períodos. Os diagnósticos diferenciais mais importantes são rosácea e dermatite seborreica, foliculite, dermatite perioral e acne também devem ser incluídos.24,25 O diagnóstico definitivo de demodecidose é realizado pela identificação microscópica do parasita, o que demanda tempo e requer equipamento específico e um profissional habilitado.25
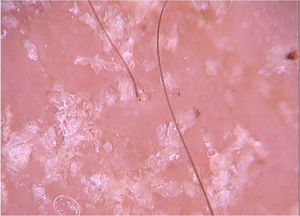
A dermatoscopia pode oferecer auxílio na diferenciação de outros diagnósticos. Como exemplo, o padrão observado na dermatite seborreica, que inclui vasos em pontos e escamas finas amareladas, não costuma ser encontrado na demodicidose.24 Segal et al. realizaram estudo com 72 pacientes que apresentavam erupções eritematosas na face, dos quais 55 pacientes apresentavam demodecidose. À dermatoscopia, 54 pacientes apresentaram Demodextails e aberturas foliculares com Demodex. A confirmação microscópica do diagnóstico de demodecidose foi possivel em 52 pacientes, e a concordância entre os achados dos dois métodos foi bastante alta. Demodextails são filamentos gelatinosos não foliculares e perifoliculares que protrudem das aberturas foliculares. Eles representam a presença do ácaro (fig. 8). Já as aberturas foliculares com Demodex são dilatadas contendo plugs de material amorfo cinzento‐acastanhado circundado por halo eritematoso. Ambos os achados são específicos para diagnóstico de demodecidose.24,25
Nos pacientes com variantes inflamatórias de demodecidose também foram observados vasos dilatados horizontais reticulados, porém esse achado é inespecífico para a dermatose.25 Nas formas pustulosas, os achados também são pouco específicos, podendo ser observado coleção purulenta de 1 a 10mm de diâmetro, circundados por halo eritematoso.25 A dermatoscopia pode ainda ser utilizada para acompanhamento de resposta ao tratamento, uma vez que as estruturas supracitadas podem estar ausentes ou presentes em menor frequência na análise dermatoscópica.25
Infecções bacterianasHanseníaseA hanseníase é uma doença infecciosa crônica causada por Mycobacterium leprae, endêmica no Brasil e em outros países em desenvolvimento.26 Apresenta amplo espectro clínico, variando desde o polo tuberculoide paucibacilar até o polo virchowiano multibacilar. Essa variação se dá conforme a resposta imunológica do paciente e dificulta a identificação correta da doença.26 Além disso, apresentações atípicas e reações hansênicas podem ocorrer, o que atrasa ainda mais o diagnóstico.26–28
Em que pese a suspeita da hanseníase ser realizada por um conjunto de sinais e sintomas detectados ao exame físico e por dados de anamnese, a dermatoscopia foi recentemente incorporada como uma ferramenta que pode ser útil na identificação da doença em determinados casos. Por conseguinte, inúmeros achados foram descritos, variando de acordo com as formas clínicas.
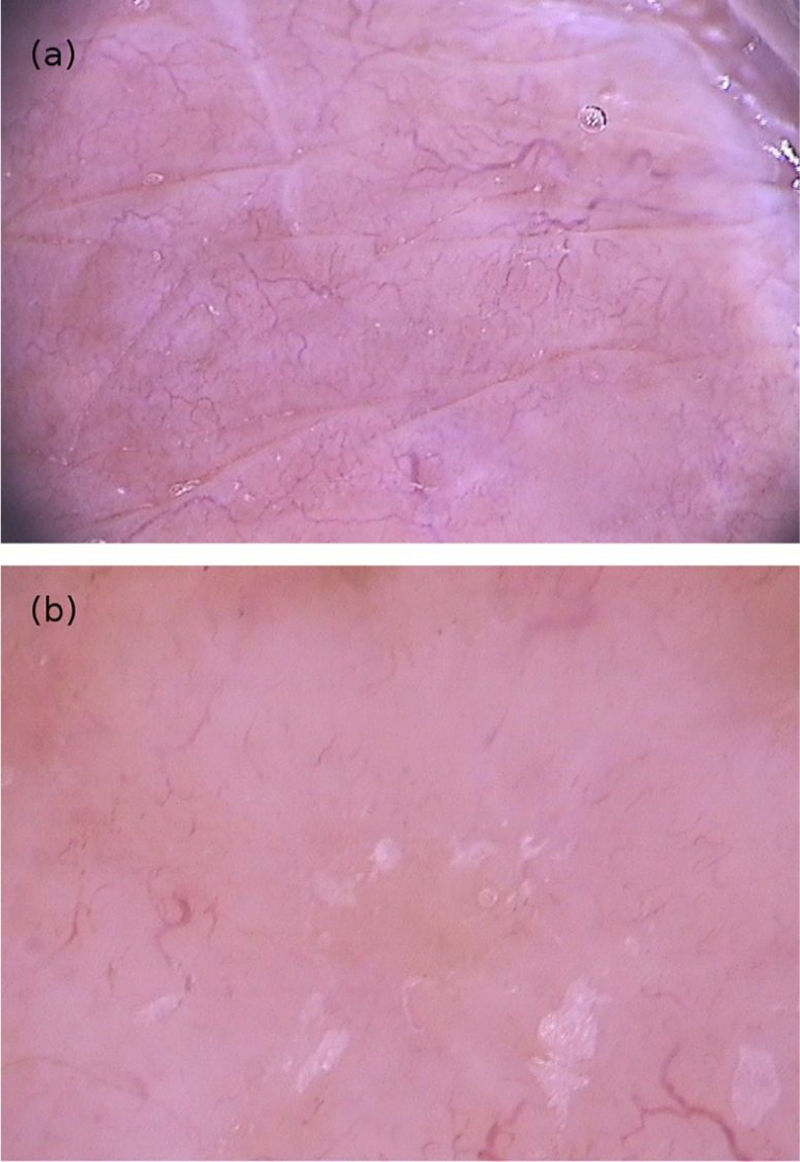
A hanseníase tuberculoide (HT) é uma forma clínica limitada por uma boa resposta imune do hospedeiro, com poucas lesões, que se apresentam clinicamente como placas anulares bem definidas de bordas elevadas e centro hipocrômico.26,27 A dermatoscopia da borda das lesões revelou áreas sem estruturas, de cor amarelo‐alaranjada, rodeadas por eritema e telangiectasias de ramificação linear, associadas à visualização diminuída da rede pigmentar, à perda dos folículos pilosos e à redução dos pontos brancos (óstios das glândulas sudoríparas) (fig. 9A).27 Esses achados dermatoscópicos foram semelhantes aos encontrados na forma dimorfa tuberculoide (HDT).27–29 Além desses, áreas brancas, interpretadas como uma redução dos melanócitos induzida pela doença, foram comumente observadas nas lesões de HDT.28,29 Histologicamente, foi observada nesdes casos uma escassez de anexos cutâneos, granulomas dérmicos e ectasias vasculares. Esdes dois últimos corresponderiam, respectivamente, às áreas amarelo‐alaranjadas e às telangiectasias observadas à dermatoscopia.27,29
(A), Imagem dermatoscópica de hanseníase dimorfa tuberculoide demonstrando áreas de cor amarelo‐alaranjada, rodeadas por eritema e telangiectasias de ramificação linear; (B), imagem dermatoscópica de hanseníase multibacilar variante histoide demonstrando lesão papulosa com coloração amarelada difusa e múltiplas telangiectasias heteromórficas (Fotofinder, magnitude original 20×). Fonte: Acervo do Hospital de Clínicas de Porto Alegre.
A hanseníase dimorfa virchowiana (HDV) e a hanseníase virchowiana (HV) se apresentaram à dermatoscopia com as típicas áreas laranja‐amareladas de outras dermatoses granulomatosas e com redução dos anexos cutâneos com áreas de atriquia.27 Apesar dessa similaridade com relação aos achados dermatoscópicos, nesses casos, possivelmente o infiltrado histiocitário difuso é que explique sua ocorrência. A HDV apresentou também uma rede pigmentar reduzida ou ausente que foi relatada como áreas lineares semelhantes a crisálides, cuja visualização pode ajudar a diferenciar de outras dermatoses granulomatosas.27 Já na HV, foi descrito um aumento da rede pigmentar associado a vasos ramificados dilatados. Além disso, a descamação associada à xerose cutânea também foi visualizada.27,29
A HV pode cursar com lesões nodulares, denominadas de hansenomas, que se apresentaram à dermatoscopia com coloração amarelada difusa, um discreto halo acastanhado e, no centro da lesão, um aspecto nacarado cicatricial cercado de múltiplas telangiectasias heteromórficas.26,30 Esse padrão dermatoscópico é semelhante ao encontrado nas lesões da hanseníase histoide,27,31–33 uma forma rara de HV caracterizada pela alta carga bacilar e por apresentar nódulos e placas sobre uma pele aparentemente normal (fig. 9B).33,34 Entretanto, as lesões da forma histoide apresentaram, por sua vez, estruturas brancas brilhantes semelhantes às visualizadas nos dermatofibromas, no melanoma e nos carcinomas basocelular e espinocelular.31,32 Essas estruturas só seriam visualizadas sob a dermatoscopia de luz polarizada e podem corresponder às alterações fibróticas da derme.31 Na histopatologia, os hansenomas demonstraram inúmeros macrófagos e ectasia vascular que explicariam, respectivamente, o aspecto nodular e as telangiectasias à dermatoscopia.30
A perda dos pelos do corpo, inclusive das sobrancelhas, são eventos comuns na hanseníase, com cerca de três quartos dos pacientes multibacilares apresentando madarose. Diversos achados tricoscópicos compatíveis com alopecia não cicatricial foram descritos nas sobrancelhas – os principais são densidade capilar reduzida, múltiplos fios velos e distorção da pigmentação cutânea. Em seguida, pontos brancos em formato de cabeça de alfinete cercados por uma pigmentação em alvo e áreas sem estrutura de cor branco‐amareladas foram os mais comuns.35
Além disso, a hiperpigmentação induzida pela clofazimina, medicação presente nos esquemas de poliquimioterapia para pacientes multibacilares, foi descrita à dermatoscopia como um padrão em favo de mel característico, com glóbulos amarelos e brancos intercalados ao longo de um fundo escurecido.29
As reações hansênicas também foram estudadas à dermatoscopia. Essas condições podem ocorrer antes, durante ou mesmo após a conclusão do esquema terapêutico.36 Também chamada de reação reversa, a reação hansênica do tipo 1 costuma acometer formas clínicas dimorfas e é consequência de uma resposta imune celular associada a hipersensibilidade tardia.26 Na dermatoscopia, as lesões cursam com um fundo eritematoso difuso27,29,36 associadas a áreas laranja‐amareladas27,36 ou áreas laranja‐avermelhadas.36 Foram ainda observados vasos arboriformes, vasos finos lineares curtos e vasos lineares borrados.29,36 A presença de uma descamação branca e de tampões foliculares também foi reportada.27,36 Os vasos borrados parecem ser um achado específico, e postulou‐se serem consequência de um número aumentado de linfócitos e da perda da organização normal do granuloma.36
A reação hansênica do tipo 2, também chamada de eritema nodoso hansênico, é resultado da deposição de imunocomplexos e é típica de pacientes multibacilares.26 Cursa com lesões nas faces extensoras dos membros, por vezes associadas a sintomas sistêmicos.26 Os achados dermatoscópicos foram inespecíficos e corresponderam a um eritema aumentado e vasos sanguíneos telangiectásicos ramificados.27,29
Assim como nas enfermidades granulomatosas não infecciosas, a presença de estruturas descritas como alaranjadas ou amareladas à dermatoscopia, na hanseníase, está fortemente associada à presença de granulomas dérmicos e seu consequente efeito de massa.29 Já os vasos telangiectásicos e seu padrão de apresentação costumam variar conforme a etiologia. No granuloma anular, os vasos têm padrão pontilhado, e na necrobiose lipoídica são arboriformes; no lúpus vulgar e na sarcoidose, apresentam‐se com uma ramificação linear. Percebemos que essa variação se repete dentro do espectro clínico da hanseníase, com padrões vasculares variando segundo a forma clínica. Além dessas duas principais alterações, que são comuns às outras doenças granulomatosas da pele, os distúrbios pigmentares e a perda dos apêndices cutâneos são achados adicionais mais específicos que orientam o diagnóstico para hanseníase.
A prevalência da hanseníase vem diminuindo constantemente em todo o mundo desde o advento da poliquimioterapia.26 Entretanto, essa doença milenar ainda é endêmica em diversas regiões do Brasil e do mundo. Como demonstrado, a dermatoscopia pode contribuir para o diagnóstico in vivo, uma etapa fundamental para interromper a manutenção do contágio.
SífilisA sífilis é uma doença infecciosa causada pelo Treponema pallidum, transmissível principalmente pela via sexual, mas também verticalmente, com ressurgimento importante nas duas últimas décadas. A sífilis secundária ocorre após a disseminação do patógeno por via sanguínea ou linfática, geralmente 6‐8 semanas após a resolução das lesões primárias. Caracteriza‐se por uma erupção simétrica, macular ou papular, normalmente descamativa, com distribuição no tronco, nas extremidades, nas palmas das mãos e nas plantas dos pés.
A variedade de apresentações típicas e atípicas da sífilis secundária faz essa doença ser conhecida como “a grande imitadora” e torna seu diagnóstico difícil, com uma ampla gama de diagnósticos diferenciais. Desses, os principais incluem: pitiríase rósea de Gilbert, poroceratose actínica, eritema anular centrífugo, granuloma anular, lúpus subagudo, lúpus discoide e certas variantes anulares da psoríase.37 O estudo dermatoscópico das lesões pode ajudar no reconhecimento e na diferenciação dessas outras dermatoses. Até o presente momento, apenas relatos de caso foram publicados sobre o tema.
Em casos de lesões cutâneas descamativas, o reconhecimento do sinal ou colarete de Biett pode ser facilitado pela dermatoscopia e vem sendo descrito, principalmente em lesões de localização palmar, como uma descamação circular esbranquiçada com progressão direcionada para fora.37,38 Embora seja visível a olho nu, a dermatoscopia propicia sua detecção em lesões menores, nas quais o colarete não está clinicamente evidente.39 Caracteristicamente, apresenta‐se em um fundo alaranjado ou vermelho‐amarelado difuso.37,38 Foi postulado que possa corresponder ao extravasamento de hemácias e depósitos de hemossiderina que ocorrem nas lesões de sífilis secundária.38 Sua presença poderia ajudar a diferenciar de quadros que podem confundir e atrasar o diagnóstico da sífilis, como a psoríase palmar em sua apresentação papular, a poroceratose e o líquen plano.38 Além disso, um caso de lesões no couro cabeludo foi descrito apresentando uma descamação circular de orientação para dentro à dermatoscopia.40
O acometimento palmoplantar é uma das apresentações mais comuns da sífilis secundária; algumas dessas doenças podem envolver essa região, dificultando a diferenciação.37,38 Além disso, os vasos pontilhados, encontrados em alguns casos de sífilis secundária, são achados característicos da psoríase. Desse modo, a identificação da presença do colarete de Biett e do fundo alaranjado por meio da inspeção clínica e/ou da dermatoscopia são achados mais específicos de sífilis secundária nessas localizações.41
A alopecia sifilítica (AS) também pode ser uma manifestação da sífilis secundária. É classificada como uma alopecia não cicatricial que pode vir associada a outros comemorativos cutaneomucosos da sífilis (AS sintomática) ou ser o único elemento clínico da infecção (AS essencial).42,43 Apesar de a AS afetar mais comumente o couro cabeludo, os pelos de qualquer área corporal podem ser envolvidos.42 A tricoscopia vem se mostrando uma importante ferramenta diagnóstica em pacientes com alopecia de origem desconhecida e pode ajudar na identificação da AS, especialmente quando as lesões cutâneas típicas da sífilis não estão presentes. A ausência de fios em ponto de exclamação pode ajudar a excluir alopecia areata, uma condição que frequentemente se assemelha à AS.43 São quatro os padrões clínicos da AS: (1) padrão roído por traças: o mais comum e característico; (2) padrão difuso: semelhante a um eflúvio telógeno agudo; (3) padrão misto: combinação dos dois anteriores; (4) alopecia das sobrancelhas.42
As áreas de alopecia no padrão roído por traças parecem exibir características específicas à tricoscopia: um número reduzido de pelos terminais, com hastes finas semelhantes a pelos velos emergentes invisíveis a olho nu (diâmetro <20 μm), ou mesmo atriquia foi demonstrada.42,43 Diversos óstios foliculares vazios são evidentes, mesmo na região occipital do couro cabeludo, o que pode ajudar a diferenciar de uma alopecia androgenética.42,43
Outros achados não específicos da infecção já foram relatados, como pontos pretos, hipopigmentação das hastes dos pelos, pontos amarelos, capilares sanguíneos irregularmente dilatados, fios quebrados e em “zigue‐zague”.42–45 Uma pigmentação marrom‐avermelhada nas áreas de alopecia do couro cabeludo pode estar presente, não sendo evidenciada nas áreas de alopecia da barba e das sobrancelhas.42,45 Essa pigmentação regrediu após antibioticoterapia, e foi especulado que ela seja decorrente de uma vasculite de pequenos vasos induzida pela resposta imune contra T. pallidum localizado nos vasos sanguíneos do epitélio perifolicular.42
Finalmente, a sífilis é uma doença de alta prevalência, com repercussões graves em diversos órgãos e sistemas. Apesar da potencial gravidade, a sífilis tem tratamento bastante eficaz com uso de penicilina. O reconhecimento precoce e a administração de tratamento adequado podem prevenir as complicações sistêmicas graves da doença. Os achados dermatoscópicos e tricoscópicos descritos potencializam a detecção precoce de “pistas” diagnósticas, o que propicia uma suspeita clínica maior e a pronta interrupção no curso natural da doença por meio da instalação de medidas terapêuticas.
FoliculitesAs foliculites formam um grupo de doenças inflamatórias que podem ser de origem infecciosa ou não. Ocorrem em áreas pilosas, e clinicamente revelam erupção papulopustulosa sobre base eritematosa, muitas vezes acompanhada de prurido. O tratamento varia de acordo com a identificação do agente causador. Uma série prospectiva avaliou os achados dermatoscópicos de 240 casos de foliculite. As áreas mais afetadas foram a face (35% dos casos), o tronco (30,4%) e o couro cabeludo (21,3%). A maioria dos casos era de origem infecciosa (90%), com uma acurácia diagnóstica pela dermatoscopia de 72%.46 Dependendo do agente etiológico, os achados dermatoscópicos podiam variar. No caso de foliculites de origem bacteriana, geralmente causadas por Staphylococcus aureus, o principal achado foi de pústulas centrofoliculares circundadas por eritema ou vasos em ponto (fig. 10). Outras, como foliculite ptirospórica, escabiótica ou por demodecidose, apresentaram as estruturas usuais e já descritas neste artigo.
Relato de caso identificou também a presença de pústulas centrofoliculares em caso de foliculite por Pseudomonas aeruginosa.47 Nesses casos, é importante agregar a história clínica de contato com ambientes potencialmente contaminados pelo patógeno, como banheiras de hidromassagem, piscinas ou objetos infláveis de piscina ou esponjas. Além disso, uma apresentação típica também consiste na erupção papulopustulosa em áreas intertriginosas ou cobertas por traje de banho.
TricobacterioseA tricobacteriose, anteriormente chamada de tricomicose, é uma infecção bacteriana superficial causada por bactérias do gênero Corinebacterium sp.48 Pode ocorrer de maneira isolada ou associada a outras corinebacterioses, como o eritrasma e a queratólise puntata. Antes atribuída ao C. tenuis, seu principal agente é o C. flavescens.48 Outros agentes descritos são C. propinquum e Dermabacter hominis.
Clinicamente, apresenta‐se com concreções amareladas firmemente aderidas às hastes dos fios, principalmente em regiões úmidas do corpo, como a axilar e a pubiana.48 Em casos raros, pode apresentar cor avermelhada ou enegrecida. Costuma estar associada a odor desagradável e eliminação de pigmento no suor que pode manchar as roupas. Seus principais fatores predisponentes são a hiperidrose, a obesidade e a higiene inadequada.48
Do ponto de vista dermatoscópico, são descritas concreções cerosas ou cremosas, de cor amarelada ou translúcida, aderentes ao longo de todo o comprimento das hastes dos fios.49,50 Formas com interrupções entre as concreções também podem ser encontradas.50 As concreções foram descritas em um formato nodular, em chamas, em escova ou penas.49
Embora o diagnóstico seja clínico na maioria das vezes, sua apresentação pode ser confundida com outras afecções que cursem com estruturas aderidas à haste pilar. Por simularem clinicamente as lêndeas dos piolhos, essas estruturas foram denominadas pseudolêndeas e correspondem a condições que fazem diagnóstico diferencial com a pediculose, como a própria tricobacteriose, a piedra branca, a piedra negra e os cilindros presentes em condições inflamatórias, como a psoríase, a dermatite seborreica, o lúpus cutâneo e o líquen plano pilar. A tricoscopia propicia uma fácil diferenciação entre essas condições e viabilizaria de modo rápido o diagnóstico da tricobacteriose quando existirem dúvidas clínicas.49 A luz de Wood (fluorescência amarelada), o exame direto em hidróxido de potássio (KOH) e a coloração por Gram, além da confirmação por cultura, são métodos adicionais; entretanto, podem não ser necessários.48
O tratamento consiste na retirada dos pelos das áreas acometidas e otimização da higiene. Antibióticos tópicos, como a eritromicina ou a clindamicina, podem também ser utilizados.
Considerações finaisA dermatoscopia pode acrescentar informações valiosas na avaliação de uma série de zoodermatoses ou infecções bacterianas de pele. Os achados dermatoscópicos descritos baseiam‐se na identificação de uma série de agentes etiológicos dessas doenças, o que torna seu diagnóstico inequívoco. Em outras, a dermatoscopia auxilia a identificar as repercussões clínicas da presença do patógeno na pele. Nesses casos, a correlação clínica é fundamental para a elucidação diagnóstica, seja por dados de anamnese ou por peculiaridades no exame físico. Se por um lado há padrões dermatoscópicos bastante associados a algumas das dermatoses apresentadas, pode se observar que, até o presente momento, para outras entidades nosológicas as descrições se baseiam em relatos isolados ou séries de casos, o que seria insuficiente para determinar um padrão uniforme para todas. Desse modo, torna‐se uma área interessante para ser ainda explorada cientificamente. Cabe mencionar que boa parte das lesões causadas por agentes infecciosos tem soluções de continuidade, e são potencialmente contaminadas. Para evitar que o dermatoscópio sirva de fômite para transmissão de uma infecção, é prático utilizar aparelhos com luz polarizada sem o contato com a pele. Ao utilizar aparelhos com luz polarizada ou não polarizada com contato com a pele, deve‐se realizar a limpeza com antissépticos imediatamente após a utilização. O uso de um material isolante aderido à lente dermatoscópica também pode ser utilizado, em que pese exista uma perda na qualidade da visualização da área examinada.
Suporte financeiroNenhum.
Contribuição dos autoresRenato Marchiori Bakos: Idealização dos artigos; organização dos artigos; redação do manuscrito; revisão e aprovação do texto final.
Clarissa Reinehr: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Gabriela Fortes Escobar: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Leandro Linhares Leite: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Conflito de interessesNenhum.
Como citar este artigo: Bakos RM, Reinehr C, Escobar GF, Leite LL. Dermoscopy of skin infestations and infections (entomodermoscopy) – Part I: dermatozoonoses and bacterial infections. An Bras Dermatol. 2021;96:735–45.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.