.
FundamentosAtualmente, não existe terminologia uniforme e oficial na língua portuguesa para o exame de microscopia confocal de reflectância, apesar do número cada vez maior de dermatologistas brasileiros utilizando essa nova ferramenta.
ObjetivoApresentar terminologia na língua portuguesa do Brasil para a descrição do exame de microscopia confocal de reflectância e estabelecer o primeiro consenso brasileiro dos termos relacionados à pele normal e aos tumores cutâneos.
MétodosForam selecionados dez especialistas brasileiros de diferentes instituições e estados federativos do Brasil, que avaliaram os melhores termos correspondentes na língua portuguesa para pele normal, tumores melanocíticos e não melanocíticos. Os termos usados foram traduzidos de consensos internacionais na língua inglesa. Para a criação do consenso, foi utilizado o método Delphi modificado, em três etapas.
ResultadosForam apresentados os termos considerados mais adequados na língua portuguesa para a descrição dos achados da pele normal, lesões melanocíticas e não melanocíticas no exame de microscopia confocal de reflectância.
Limitações do estudoAs limitações de nosso estudo incluem o número de participantes e a representação regional limitada (apenas duas das cinco regiões brasileiras estavam representadas).
ConclusãoEste consenso brasileiro representa uma oportunidade para dermatologistas e médicos especialistas em oncologia cutânea se familiarizarem com a microscopia confocal de reflectância, e possibilita a divulgação da técnica em ambientes clínicos e de pesquisa, estimulando publicações nacionais e internacionais sobre esse tema.
Atualmente, diversas tecnologias estão disponíveis para auxiliar a avaliação e o diagnóstico das lesões cutâneas, como a ultrassonografia, a microscopia confocal de reflectância in vivo (MCR), a microscopia confocal ex vivo, a ressonância magnética, a espectroscopia, a tomografia de coerência óptica, entre outros.
A MCR é método de imagem não invasivo introduzido recentemente que permite o exame em tempo real da pele com avaliação morfológica em resolução celular e nuclear in vivo, sem a necessidade de utilização dos marcadores fluorescentes ou corantes teciduais1.
A profundidade da imagem é limitada a cerca de 200μm, que habitualmente permite o exame da derme papilar. Essa profundidade rotineiramente inclui e permite o exame da junção dermoepidérmica (JDE), que geralmente está em profundidades de 50 a 150μm. Para dermatologistas e patologistas, a JDE é de grande interesse, pois a maioria dos cânceres da pele origina‐se a partir da camada basal e JDE2. Entretanto, esse limite de profundidade pode dificultar a observação de estruturas de interesse para avaliação de tumores em áreas especiais como superfície palmopalmar, lesões espessas, hiperceratóticas e ulceradas.
O resultado da análise das imagens depende de uma longa curva de aprendizado, porém para médicos treinados é uma ferramenta sensível e específica para detecção precoce de melanomas e de outros tumores cutâneos. As principais indicações atuais do exame são: avaliação isolada de lesões melanocíticas duvidosas, investigação de lesões pigmentadas ou não pigmentadas suspeitas de câncer de pele e delimitação pré cirúrgica das margens de excisão ou seguimento pós‐tratamento1,2.
As principais associações entre os achados histopatológicos e a MCR foram descritas pela primeira vez na década de 19903,4. Desde então, centenas de artigos têm sido publicados, mostrando a importância da MCR como ferramenta complementar no diagnóstico do melanoma e dos cânceres da pele não melanoma. A MCR também é utilizada na avaliação da pele normal, dos nevos melanocíticos e lesões não melanocíticas benignas. A definição e os termos referentes aos critérios de MCR foram estabelecidos por um consenso publicado na literatura médica em 2007 e atualizado em 20095,6. A padronização da terminologia da MCR tanto para as lesões melanocíticas quanto para as não melanocíticas foi publicada recentemente na língua inglesa, após revisão sistemática dos termos utilizados para descrever os principais achados na MCR em artigos originais durante os anos de 1995 a 20177,8.
Apesar das numerosas publicações sobre MCR na língua inglesa e do número crescente de dermatologistas brasileiros utilizando essa nova ferramenta, até o momento não há uma terminologia oficial na língua portuguesa. O objetivo do presente estudo é propor uma terminologia na língua portuguesa do Brasil para a descrição do exame de MCR, gerando o primeiro consenso brasileiro dos termos relacionados à pele normal e aos tumores cutâneos, o que possibilitará aos dermatologistas brasileiros que se comuniquem de maneira mais precisa e homogênea, facilitando a troca de informações e conhecimento na área.
MétodosForam selecionados dez especialistas (nove dermatologistas e um dermatopatologista) de acordo com suas publicações, participação em estudos e anos de uso da técnica de MCR para o diagnóstico de tumores cutâneos. A seleção incluiu profissionais de diversas instituições e diferentes estados federativos do Brasil, determinando a heterogeneidade do grupo, característica fundamental nesse tipo de estudo.
Os participantes foram convidados como membros do painel por meio de comunicação eletrônica, e sua participação neste projeto foi totalmente voluntária e sem suporte financeiro.
Para a criação do consenso foi utilizado o método Delphi modificado9, em trêsetapas. Como instrumento de suporte à coleta de dados foram gerados formulários eletrônicos por meio da ferramenta Google Forms (pele normal, lesões melanocíticas e lesões não melanocíticas). Os formulários foram enviados a cada participante por meio de correio eletrônico, e as respostas foram recebidas de maneira anônima.
Na primeira etapa foi criada uma lista de termos usados na MCR para pele normal e tumores melanocíticos e não melanocíticos, englobando lesões benignas e malignas, com base nos termos relacionados na língua inglesa nas descrições do consenso de 2007, revisado em 2021, e em revisões sistemáticas publicadas em 2019 e 20205,7,8,10. Cada participante deveria escolher o melhor termo correspondente na língua portuguesa e de maior uso e representatividade da estrutura em questão, ou sugerir o termo mais adequado, além dos que foram discriminados em cada lista.
Após a análise das respostas e resultados da primeira etapa, foram criados formulários com os termos mais votados ou sugeridos para cada estrutura, apenas para os termos onde a concordância foi menor que 70%.
Na terceira etapa do processo, foram realizadas duas reuniões com presença virtual dos participantes para analisar os termos em que não foi alcançada concordância de pelo menos 70% na segunda etapa, para então definir consenso definitivo sobre o termo em questão. A primeira reunião foi realizada com a presença de 100% dos especialistas e foram analisados os resultados dos termos para pele normal e lesões melanocíticas. A segunda reunião foi realizada com a presença de 80% dos especialistas e foram analisados os termos das lesões não melanocíticas.
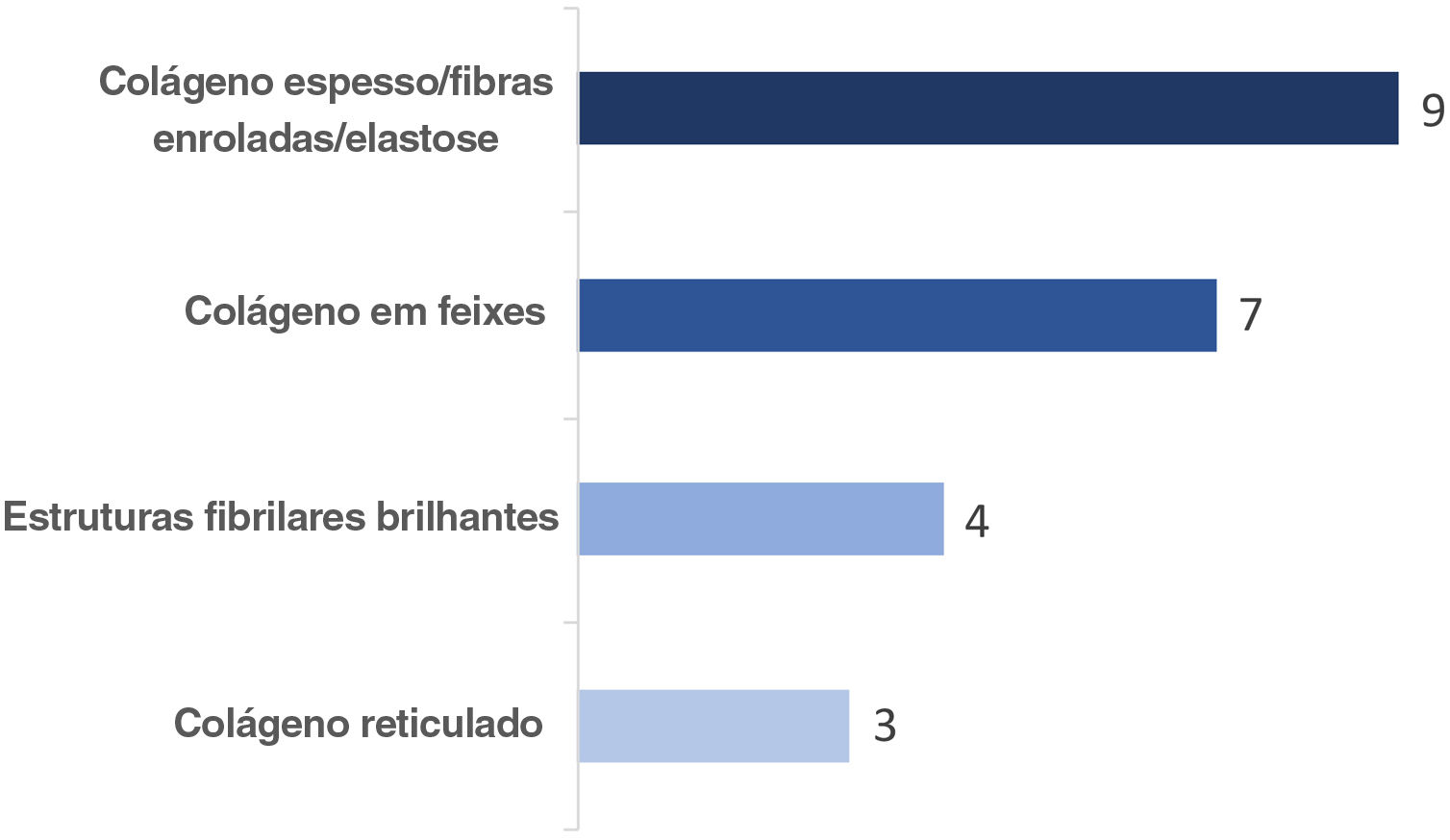
ResultadosComo resultado do consenso, apresentamos os termos mais votados, que foram considerados os mais adequados para o uso na língua portuguesa. Os termos estão relacionados nas tabelas 1, 2, 3, 4 e 5, que mostram sua descrição na microscopia confocal e correlação na histologia, para a pele normal, lesões melanocíticas e não melanocíticas. A figura 1 mostra os termos usados para a descrição dos diferentes aspectos do colágeno na derme papilar e o número de participantes que utilizam cada um dos termos citados. A figura 2 ilustra os principais termos considerados para a descrição das lesões melanocíticas e não melanocíticas.
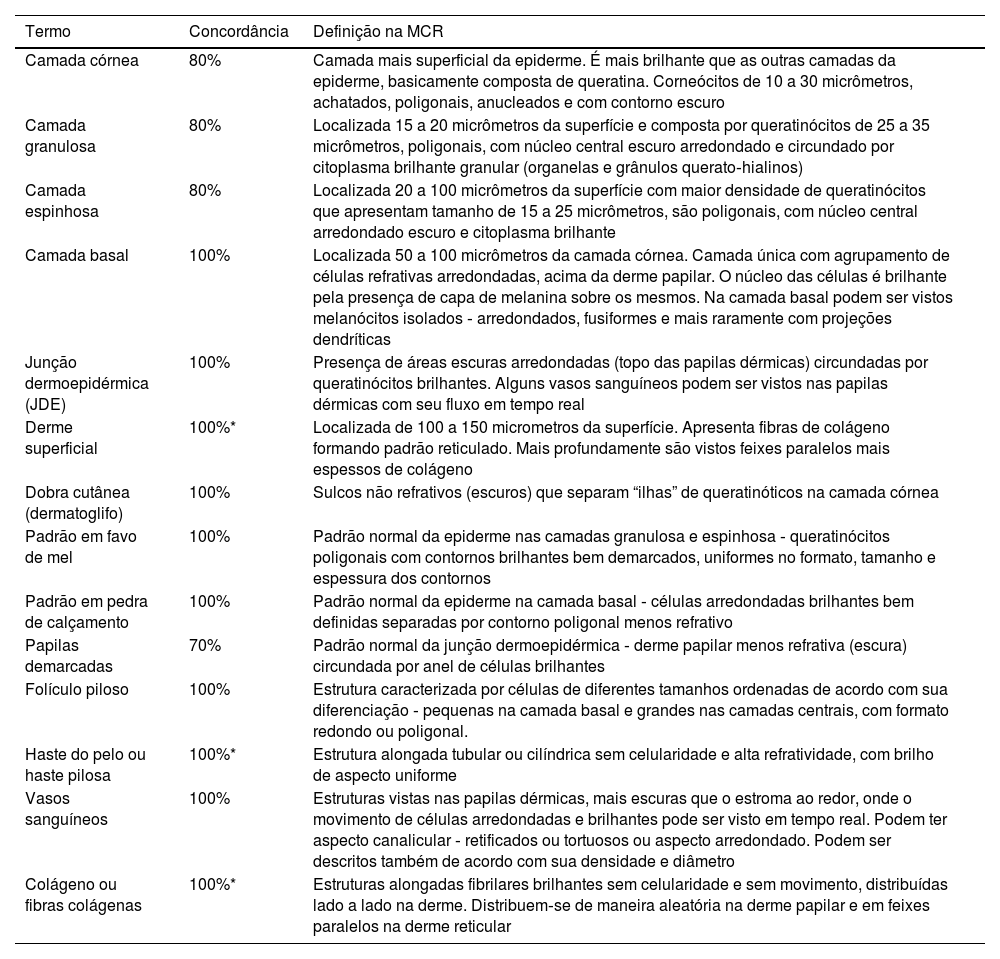
Resultado do consenso entre os especialistas – terminologia na MCR para descrição da pele normal
| Termo | Concordância | Definição na MCR |
|---|---|---|
| Camada córnea | 80% | Camada mais superficial da epiderme. É mais brilhante que as outras camadas da epiderme, basicamente composta de queratina. Corneócitos de 10 a 30 micrômetros, achatados, poligonais, anucleados e com contorno escuro |
| Camada granulosa | 80% | Localizada 15 a 20 micrômetros da superfície e composta por queratinócitos de 25 a 35 micrômetros, poligonais, com núcleo central escuro arredondado e circundado por citoplasma brilhante granular (organelas e grânulos querato‐hialinos) |
| Camada espinhosa | 80% | Localizada 20 a 100 micrômetros da superfície com maior densidade de queratinócitos que apresentam tamanho de 15 a 25 micrômetros, são poligonais, com núcleo central arredondado escuro e citoplasma brilhante |
| Camada basal | 100% | Localizada 50 a 100 micrômetros da camada córnea. Camada única com agrupamento de células refrativas arredondadas, acima da derme papilar. O núcleo das células é brilhante pela presença de capa de melanina sobre os mesmos. Na camada basal podem ser vistos melanócitos isolados ‐ arredondados, fusiformes e mais raramente com projeções dendríticas |
| Junção dermoepidérmica (JDE) | 100% | Presença de áreas escuras arredondadas (topo das papilas dérmicas) circundadas por queratinócitos brilhantes. Alguns vasos sanguíneos podem ser vistos nas papilas dérmicas com seu fluxo em tempo real |
| Derme superficial | 100%* | Localizada de 100 a 150 micrometros da superfície. Apresenta fibras de colágeno formando padrão reticulado. Mais profundamente são vistos feixes paralelos mais espessos de colágeno |
| Dobra cutânea (dermatoglifo) | 100% | Sulcos não refrativos (escuros) que separam “ilhas” de queratinóticos na camada córnea |
| Padrão em favo de mel | 100% | Padrão normal da epiderme nas camadas granulosa e espinhosa ‐ queratinócitos poligonais com contornos brilhantes bem demarcados, uniformes no formato, tamanho e espessura dos contornos |
| Padrão em pedra de calçamento | 100% | Padrão normal da epiderme na camada basal ‐ células arredondadas brilhantes bem definidas separadas por contorno poligonal menos refrativo |
| Papilas demarcadas | 70% | Padrão normal da junção dermoepidérmica ‐ derme papilar menos refrativa (escura) circundada por anel de células brilhantes |
| Folículo piloso | 100% | Estrutura caracterizada por células de diferentes tamanhos ordenadas de acordo com sua diferenciação ‐ pequenas na camada basal e grandes nas camadas centrais, com formato redondo ou poligonal. |
| Haste do pelo ou haste pilosa | 100%* | Estrutura alongada tubular ou cilíndrica sem celularidade e alta refratividade, com brilho de aspecto uniforme |
| Vasos sanguíneos | 100% | Estruturas vistas nas papilas dérmicas, mais escuras que o estroma ao redor, onde o movimento de células arredondadas e brilhantes pode ser visto em tempo real. Podem ter aspecto canalicular ‐ retificados ou tortuosos ou aspecto arredondado. Podem ser descritos também de acordo com sua densidade e diâmetro |
| Colágeno ou fibras colágenas | 100%* | Estruturas alongadas fibrilares brilhantes sem celularidade e sem movimento, distribuídas lado a lado na derme. Distribuem‐se de maneira aleatória na derme papilar e em feixes paralelos na derme reticular |
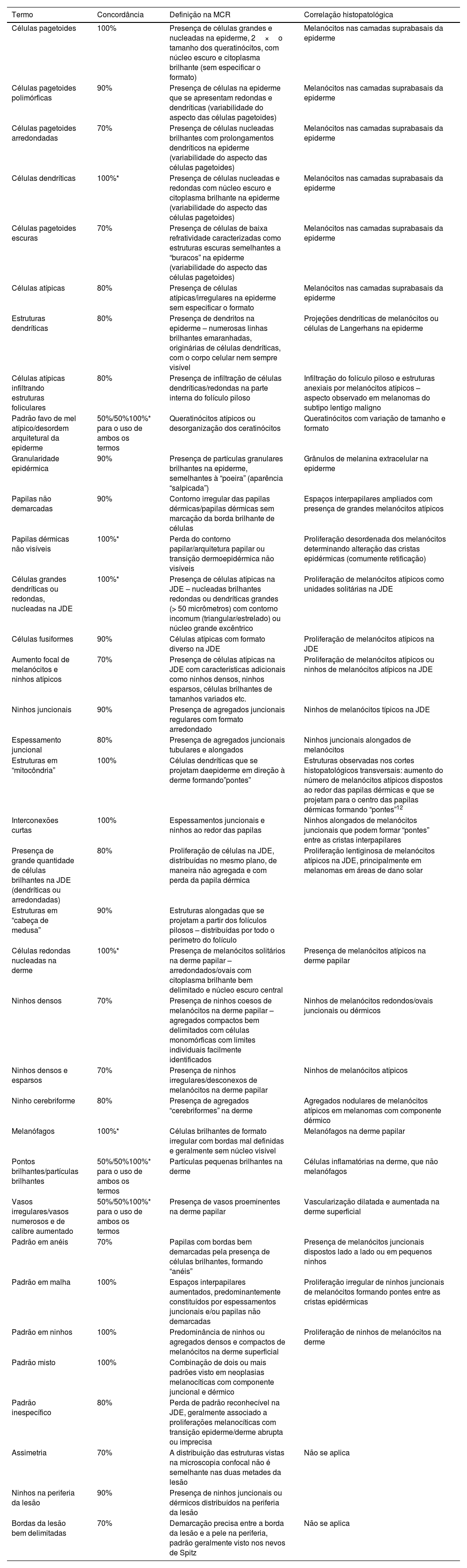
Resultado do consenso entre os especialistas – terminologia na MCR para descrição das lesões melanocíticas
| Termo | Concordância | Definição na MCR | Correlação histopatológica |
|---|---|---|---|
| Células pagetoides | 100% | Presença de células grandes e nucleadas na epiderme, 2×o tamanho dos queratinócitos, com núcleo escuro e citoplasma brilhante (sem especificar o formato) | Melanócitos nas camadas suprabasais da epiderme |
| Células pagetoides polimórficas | 90% | Presença de células na epiderme que se apresentam redondas e dendríticas (variabilidade do aspecto das células pagetoides) | Melanócitos nas camadas suprabasais da epiderme |
| Células pagetoides arredondadas | 70% | Presença de células nucleadas brilhantes com prolongamentos dendríticos na epiderme (variabilidade do aspecto das células pagetoides) | Melanócitos nas camadas suprabasais da epiderme |
| Células dendríticas | 100%* | Presença de células nucleadas e redondas com núcleo escuro e citoplasma brilhante na epiderme (variabilidade do aspecto das células pagetoides) | Melanócitos nas camadas suprabasais da epiderme |
| Células pagetoides escuras | 70% | Presença de células de baixa refratividade caracterizadas como estruturas escuras semelhantes a “buracos” na epiderme (variabilidade do aspecto das células pagetoides) | Melanócitos nas camadas suprabasais da epiderme |
| Células atípicas | 80% | Presença de células atípicas/irregulares na epiderme sem especificar o formato | Melanócitos nas camadas suprabasais da epiderme |
| Estruturas dendríticas | 80% | Presença de dendritos na epiderme – numerosas linhas brilhantes emaranhadas, originárias de células dendríticas, com o corpo celular nem sempre visível | Projeções dendríticas de melanócitos ou células de Langerhans na epiderme |
| Células atípicas infiltrando estruturas foliculares | 80% | Presença de infiltração de células dendríticas/redondas na parte interna do folículo piloso | Infiltração do folículo piloso e estruturas anexiais por melanócitos atípicos – aspecto observado em melanomas do subtipo lentigo maligno |
| Padrão favo de mel atípico/desordem arquitetural da epiderme | 50%/50%100%* para o uso de ambos os termos | Queratinócitos atípicos ou desorganização dos ceratinócitos | Queratinócitos com variação de tamanho e formato |
| Granularidade epidérmica | 90% | Presença de partículas granulares brilhantes na epiderme, semelhantes à “poeira” (aparência “salpicada”) | Grânulos de melanina extracelular na epiderme |
| Papilas não demarcadas | 90% | Contorno irregular das papilas dérmicas/papilas dérmicas sem marcação da borda brilhante de células | Espaços interpapilares ampliados com presença de grandes melanócitos atípicos |
| Papilas dérmicas não visíveis | 100%* | Perda do contorno papilar/arquitetura papilar ou transição dermoepidérmica não visíveis | Proliferação desordenada dos melanócitos determinando alteração das cristas epidérmicas (comumente retificação) |
| Células grandes dendríticas ou redondas, nucleadas na JDE | 100%* | Presença de células atípicas na JDE – nucleadas brilhantes redondas ou dendríticas grandes (> 50 micrômetros) com contorno incomum (triangular/estrelado) ou núcleo grande excêntrico | Proliferação de melanócitos atípicos como unidades solitárias na JDE |
| Células fusiformes | 90% | Células atípicas com formato diverso na JDE | Proliferação de melanócitos atípicos na JDE |
| Aumento focal de melanócitos e ninhos atípicos | 70% | Presença de células atípicas na JDE com características adicionais como ninhos densos, ninhos esparsos, células brilhantes de tamanhos variados etc. | Proliferação de melanócitos atípicos ou ninhos de melanócitos atípicos na JDE |
| Ninhos juncionais | 90% | Presença de agregados juncionais regulares com formato arredondado | Ninhos de melanócitos típicos na JDE |
| Espessamento juncional | 80% | Presença de agregados juncionais tubulares e alongados | Ninhos juncionais alongados de melanócitos |
| Estruturas em “mitocôndria” | 100% | Células dendríticas que se projetam daepiderme em direção à derme formando”pontes” | Estruturas observadas nos cortes histopatológicos transversais: aumento do número de melanócitos atípicos dispostos ao redor das papilas dérmicas e que se projetam para o centro das papilas dérmicas formando “pontes”12 |
| Interconexões curtas | 100% | Espessamentos juncionais e ninhos ao redor das papilas | Ninhos alongados de melanócitos juncionais que podem formar “pontes” entre as cristas interpapilares |
| Presença de grande quantidade de células brilhantes na JDE (dendríticas ou arredondadas) | 80% | Proliferação de células na JDE, distribuídas no mesmo plano, de maneira não agregada e com perda da papila dérmica | Proliferação lentiginosa de melanócitos atípicos na JDE, principalmente em melanomas em áreas de dano solar |
| Estruturas em “cabeça de medusa” | 90% | Estruturas alongadas que se projetam a partir dos folículos pilosos – distribuídas por todo o perímetro do folículo | |
| Células redondas nucleadas na derme | 100%* | Presença de melanócitos solitários na derme papilar – arredondados/ovais com citoplasma brilhante bem delimitado e núcleo escuro central | Presença de melanócitos atípicos na derme papilar |
| Ninhos densos | 70% | Presença de ninhos coesos de melanócitos na derme papilar – agregados compactos bem delimitados com células monomórficas com limites individuais facilmente identificados | Ninhos de melanócitos redondos/ovais juncionais ou dérmicos |
| Ninhos densos e esparsos | 70% | Presença de ninhos irregulares/desconexos de melanócitos na derme papilar | Ninhos de melanócitos atípicos |
| Ninho cerebriforme | 80% | Presença de agregados “cerebriformes” na derme | Agregados nodulares de melanócitos atípicos em melanomas com componente dérmico |
| Melanófagos | 100%* | Células brilhantes de formato irregular com bordas mal definidas e geralmente sem núcleo visível | Melanófagos na derme papilar |
| Pontos brilhantes/partículas brilhantes | 50%/50%100%* para o uso de ambos os termos | Partículas pequenas brilhantes na derme | Células inflamatórias na derme, que não melanófagos |
| Vasos irregulares/vasos numerosos e de calibre aumentado | 50%/50%100%* para o uso de ambos os termos | Presença de vasos proeminentes na derme papilar | Vascularização dilatada e aumentada na derme superficial |
| Padrão em anéis | 70% | Papilas com bordas bem demarcadas pela presença de células brilhantes, formando “anéis” | Presença de melanócitos juncionais dispostos lado a lado ou em pequenos ninhos |
| Padrão em malha | 100% | Espaços interpapilares aumentados, predominantemente constituídos por espessamentos juncionais e/ou papilas não demarcadas | Proliferação irregular de ninhos juncionais de melanócitos formando pontes entre as cristas epidérmicas |
| Padrão em ninhos | 100% | Predominância de ninhos ou agregados densos e compactos de melanócitos na derme superficial | Proliferação de ninhos de melanócitos na derme |
| Padrão misto | 100% | Combinação de dois ou mais padrões visto em neoplasias melanocíticas com componente juncional e dérmico | |
| Padrão inespecífico | 80% | Perda de padrão reconhecível na JDE, geralmente associado a proliferações melanocíticas com transição epiderme/derme abrupta ou imprecisa | |
| Assimetria | 70% | A distribuição das estruturas vistas na microscopia confocal não é semelhante nas duas metades da lesão | Não se aplica |
| Ninhos na periferia da lesão | 90% | Presença de ninhos juncionais ou dérmicos distribuídos na periferia da lesão | |
| Bordas da lesão bem delimitadas | 70% | Demarcação precisa entre a borda da lesão e a pele na periferia, padrão geralmente visto nos nevos de Spitz | Não se aplica |
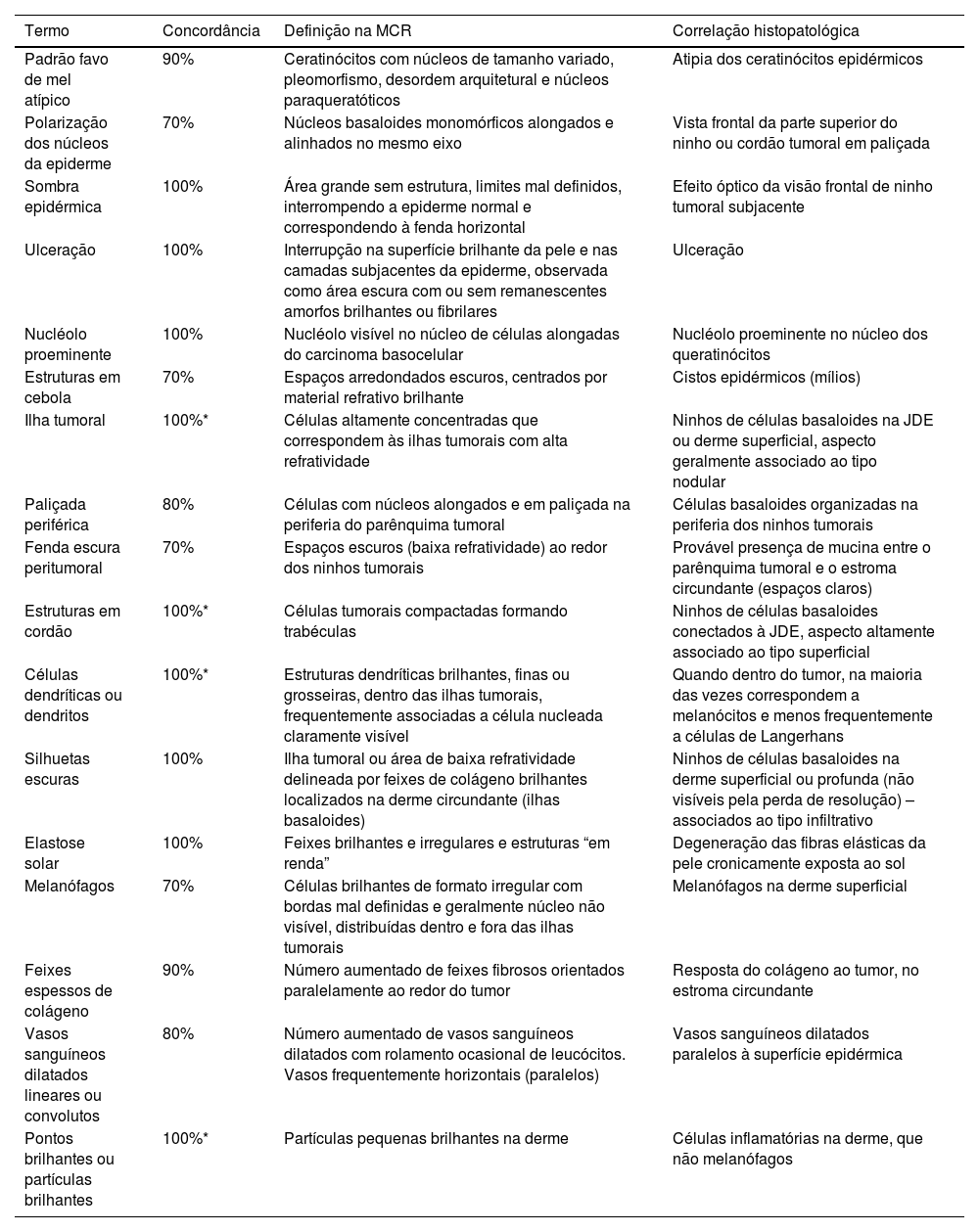
Resultado do consenso entre os especialistas – terminologia na MCR para descrição dos carcinomas basocelulares da pele
| Termo | Concordância | Definição na MCR | Correlação histopatológica |
|---|---|---|---|
| Padrão favo de mel atípico | 90% | Ceratinócitos com núcleos de tamanho variado, pleomorfismo, desordem arquitetural e núcleos paraqueratóticos | Atipia dos ceratinócitos epidérmicos |
| Polarização dos núcleos da epiderme | 70% | Núcleos basaloides monomórficos alongados e alinhados no mesmo eixo | Vista frontal da parte superior do ninho ou cordão tumoral em paliçada |
| Sombra epidérmica | 100% | Área grande sem estrutura, limites mal definidos, interrompendo a epiderme normal e correspondendo à fenda horizontal | Efeito óptico da visão frontal de ninho tumoral subjacente |
| Ulceração | 100% | Interrupção na superfície brilhante da pele e nas camadas subjacentes da epiderme, observada como área escura com ou sem remanescentes amorfos brilhantes ou fibrilares | Ulceração |
| Nucléolo proeminente | 100% | Nucléolo visível no núcleo de células alongadas do carcinoma basocelular | Nucléolo proeminente no núcleo dos queratinócitos |
| Estruturas em cebola | 70% | Espaços arredondados escuros, centrados por material refrativo brilhante | Cistos epidérmicos (mílios) |
| Ilha tumoral | 100%* | Células altamente concentradas que correspondem às ilhas tumorais com alta refratividade | Ninhos de células basaloides na JDE ou derme superficial, aspecto geralmente associado ao tipo nodular |
| Paliçada periférica | 80% | Células com núcleos alongados e em paliçada na periferia do parênquima tumoral | Células basaloides organizadas na periferia dos ninhos tumorais |
| Fenda escura peritumoral | 70% | Espaços escuros (baixa refratividade) ao redor dos ninhos tumorais | Provável presença de mucina entre o parênquima tumoral e o estroma circundante (espaços claros) |
| Estruturas em cordão | 100%* | Células tumorais compactadas formando trabéculas | Ninhos de células basaloides conectados à JDE, aspecto altamente associado ao tipo superficial |
| Células dendríticas ou dendritos | 100%* | Estruturas dendríticas brilhantes, finas ou grosseiras, dentro das ilhas tumorais, frequentemente associadas a célula nucleada claramente visível | Quando dentro do tumor, na maioria das vezes correspondem a melanócitos e menos frequentemente a células de Langerhans |
| Silhuetas escuras | 100% | Ilha tumoral ou área de baixa refratividade delineada por feixes de colágeno brilhantes localizados na derme circundante (ilhas basaloides) | Ninhos de células basaloides na derme superficial ou profunda (não visíveis pela perda de resolução) – associados ao tipo infiltrativo |
| Elastose solar | 100% | Feixes brilhantes e irregulares e estruturas “em renda” | Degeneração das fibras elásticas da pele cronicamente exposta ao sol |
| Melanófagos | 70% | Células brilhantes de formato irregular com bordas mal definidas e geralmente núcleo não visível, distribuídas dentro e fora das ilhas tumorais | Melanófagos na derme superficial |
| Feixes espessos de colágeno | 90% | Número aumentado de feixes fibrosos orientados paralelamente ao redor do tumor | Resposta do colágeno ao tumor, no estroma circundante |
| Vasos sanguíneos dilatados lineares ou convolutos | 80% | Número aumentado de vasos sanguíneos dilatados com rolamento ocasional de leucócitos. Vasos frequentemente horizontais (paralelos) | Vasos sanguíneos dilatados paralelos à superfície epidérmica |
| Pontos brilhantes ou partículas brilhantes | 100%* | Partículas pequenas brilhantes na derme | Células inflamatórias na derme, que não melanófagos |
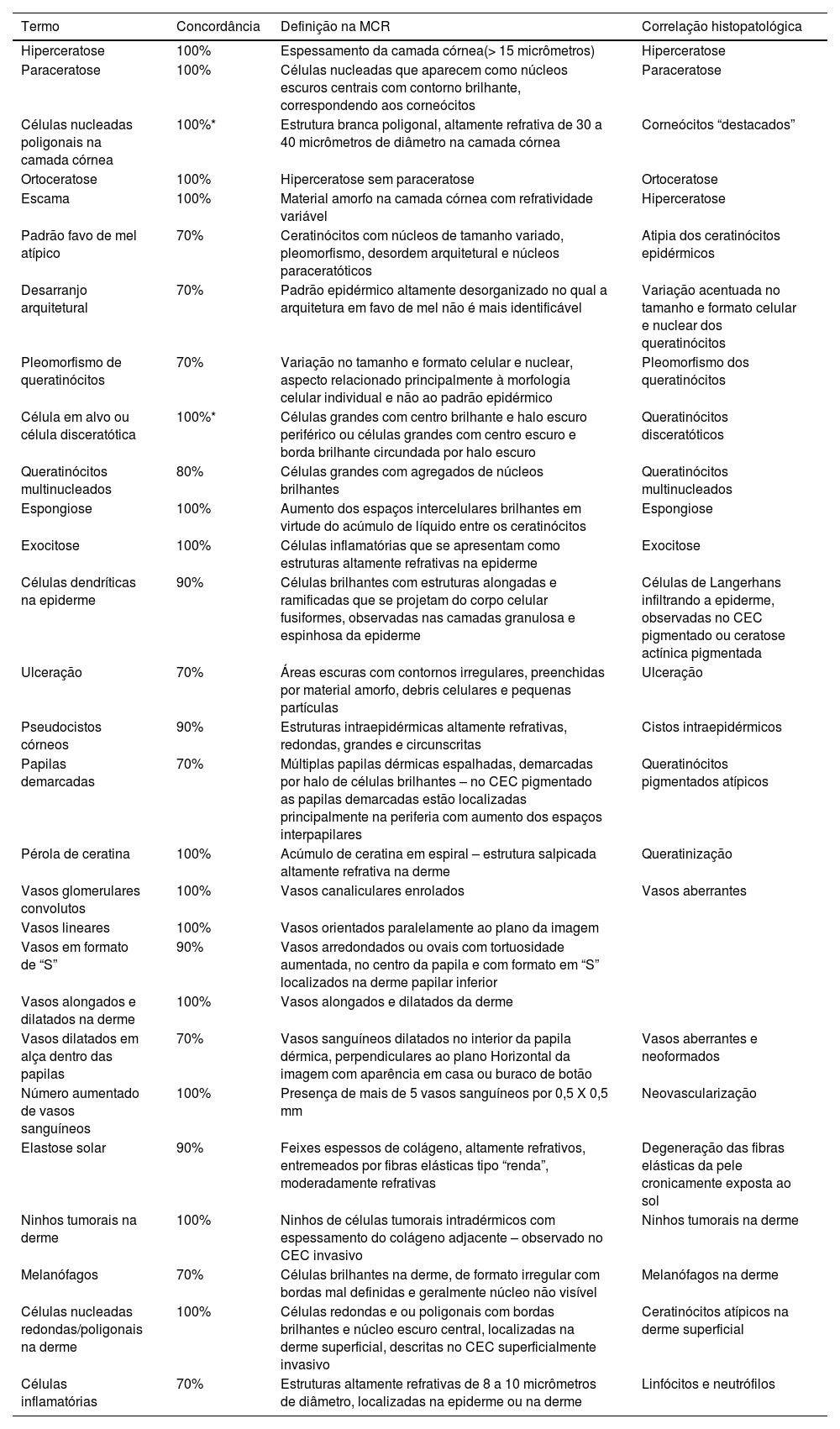
Resultado do consenso entre os especialistas – terminologia na MCR para descrição dos carcinomas espinocelulares (CEC) da pele e ceratoses actínicas
| Termo | Concordância | Definição na MCR | Correlação histopatológica |
|---|---|---|---|
| Hiperceratose | 100% | Espessamento da camada córnea(> 15 micrômetros) | Hiperceratose |
| Paraceratose | 100% | Células nucleadas que aparecem como núcleos escuros centrais com contorno brilhante, correspondendo aos corneócitos | Paraceratose |
| Células nucleadas poligonais na camada córnea | 100%* | Estrutura branca poligonal, altamente refrativa de 30 a 40 micrômetros de diâmetro na camada córnea | Corneócitos “destacados” |
| Ortoceratose | 100% | Hiperceratose sem paraceratose | Ortoceratose |
| Escama | 100% | Material amorfo na camada córnea com refratividade variável | Hiperceratose |
| Padrão favo de mel atípico | 70% | Ceratinócitos com núcleos de tamanho variado, pleomorfismo, desordem arquitetural e núcleos paraceratóticos | Atipia dos ceratinócitos epidérmicos |
| Desarranjo arquitetural | 70% | Padrão epidérmico altamente desorganizado no qual a arquitetura em favo de mel não é mais identificável | Variação acentuada no tamanho e formato celular e nuclear dos queratinócitos |
| Pleomorfismo de queratinócitos | 70% | Variação no tamanho e formato celular e nuclear, aspecto relacionado principalmente à morfologia celular individual e não ao padrão epidérmico | Pleomorfismo dos queratinócitos |
| Célula em alvo ou célula disceratótica | 100%* | Células grandes com centro brilhante e halo escuro periférico ou células grandes com centro escuro e borda brilhante circundada por halo escuro | Queratinócitos disceratóticos |
| Queratinócitos multinucleados | 80% | Células grandes com agregados de núcleos brilhantes | Queratinócitos multinucleados |
| Espongiose | 100% | Aumento dos espaços intercelulares brilhantes em virtude do acúmulo de líquido entre os ceratinócitos | Espongiose |
| Exocitose | 100% | Células inflamatórias que se apresentam como estruturas altamente refrativas na epiderme | Exocitose |
| Células dendríticas na epiderme | 90% | Células brilhantes com estruturas alongadas e ramificadas que se projetam do corpo celular fusiformes, observadas nas camadas granulosa e espinhosa da epiderme | Células de Langerhans infiltrando a epiderme, observadas no CEC pigmentado ou ceratose actínica pigmentada |
| Ulceração | 70% | Áreas escuras com contornos irregulares, preenchidas por material amorfo, debris celulares e pequenas partículas | Ulceração |
| Pseudocistos córneos | 90% | Estruturas intraepidérmicas altamente refrativas, redondas, grandes e circunscritas | Cistos intraepidérmicos |
| Papilas demarcadas | 70% | Múltiplas papilas dérmicas espalhadas, demarcadas por halo de células brilhantes – no CEC pigmentado as papilas demarcadas estão localizadas principalmente na periferia com aumento dos espaços interpapilares | Queratinócitos pigmentados atípicos |
| Pérola de ceratina | 100% | Acúmulo de ceratina em espiral – estrutura salpicada altamente refrativa na derme | Queratinização |
| Vasos glomerulares convolutos | 100% | Vasos canaliculares enrolados | Vasos aberrantes |
| Vasos lineares | 100% | Vasos orientados paralelamente ao plano da imagem | |
| Vasos em formato de “S” | 90% | Vasos arredondados ou ovais com tortuosidade aumentada, no centro da papila e com formato em “S” localizados na derme papilar inferior | |
| Vasos alongados e dilatados na derme | 100% | Vasos alongados e dilatados da derme | |
| Vasos dilatados em alça dentro das papilas | 70% | Vasos sanguíneos dilatados no interior da papila dérmica, perpendiculares ao plano Horizontal da imagem com aparência em casa ou buraco de botão | Vasos aberrantes e neoformados |
| Número aumentado de vasos sanguíneos | 100% | Presença de mais de 5 vasos sanguíneos por 0,5 X 0,5 mm | Neovascularização |
| Elastose solar | 90% | Feixes espessos de colágeno, altamente refrativos, entremeados por fibras elásticas tipo “renda”, moderadamente refrativas | Degeneração das fibras elásticas da pele cronicamente exposta ao sol |
| Ninhos tumorais na derme | 100% | Ninhos de células tumorais intradérmicos com espessamento do colágeno adjacente – observado no CEC invasivo | Ninhos tumorais na derme |
| Melanófagos | 70% | Células brilhantes na derme, de formato irregular com bordas mal definidas e geralmente núcleo não visível | Melanófagos na derme |
| Células nucleadas redondas/poligonais na derme | 100% | Células redondas e ou poligonais com bordas brilhantes e núcleo escuro central, localizadas na derme superficial, descritas no CEC superficialmente invasivo | Ceratinócitos atípicos na derme superficial |
| Células inflamatórias | 70% | Estruturas altamente refrativas de 8 a 10 micrômetros de diâmetro, localizadas na epiderme ou na derme | Linfócitos e neutrófilos |
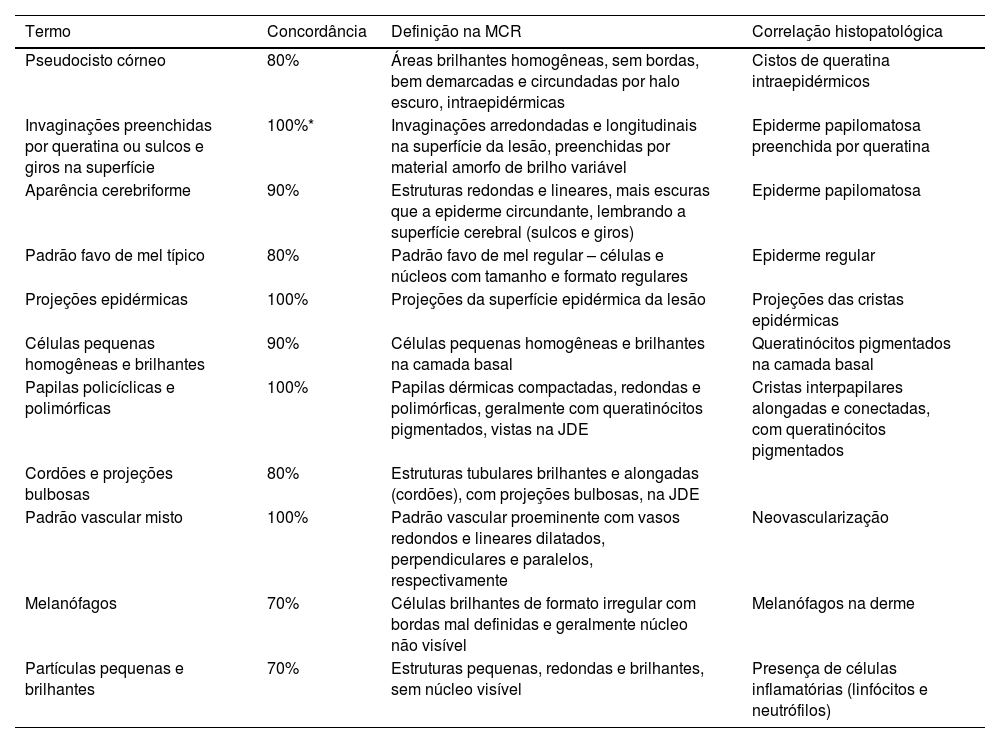
Resultado do consenso entre os especialistas – terminologia na MCR para descrição das ceratoses seborreicas, lentigos solares e ceratoses tipo líquen‐plano
| Termo | Concordância | Definição na MCR | Correlação histopatológica |
|---|---|---|---|
| Pseudocisto córneo | 80% | Áreas brilhantes homogêneas, sem bordas, bem demarcadas e circundadas por halo escuro, intraepidérmicas | Cistos de queratina intraepidérmicos |
| Invaginações preenchidas por queratina ou sulcos e giros na superfície | 100%* | Invaginações arredondadas e longitudinais na superfície da lesão, preenchidas por material amorfo de brilho variável | Epiderme papilomatosa preenchida por queratina |
| Aparência cerebriforme | 90% | Estruturas redondas e lineares, mais escuras que a epiderme circundante, lembrando a superfície cerebral (sulcos e giros) | Epiderme papilomatosa |
| Padrão favo de mel típico | 80% | Padrão favo de mel regular – células e núcleos com tamanho e formato regulares | Epiderme regular |
| Projeções epidérmicas | 100% | Projeções da superfície epidérmica da lesão | Projeções das cristas epidérmicas |
| Células pequenas homogêneas e brilhantes | 90% | Células pequenas homogêneas e brilhantes na camada basal | Queratinócitos pigmentados na camada basal |
| Papilas policíclicas e polimórficas | 100% | Papilas dérmicas compactadas, redondas e polimórficas, geralmente com queratinócitos pigmentados, vistas na JDE | Cristas interpapilares alongadas e conectadas, com queratinócitos pigmentados |
| Cordões e projeções bulbosas | 80% | Estruturas tubulares brilhantes e alongadas (cordões), com projeções bulbosas, na JDE | |
| Padrão vascular misto | 100% | Padrão vascular proeminente com vasos redondos e lineares dilatados, perpendiculares e paralelos, respectivamente | Neovascularização |
| Melanófagos | 70% | Células brilhantes de formato irregular com bordas mal definidas e geralmente núcleo não visível | Melanófagos na derme |
| Partículas pequenas e brilhantes | 70% | Estruturas pequenas, redondas e brilhantes, sem núcleo visível | Presença de células inflamatórias (linfócitos e neutrófilos) |
JDE, junção dermoepidérmica.
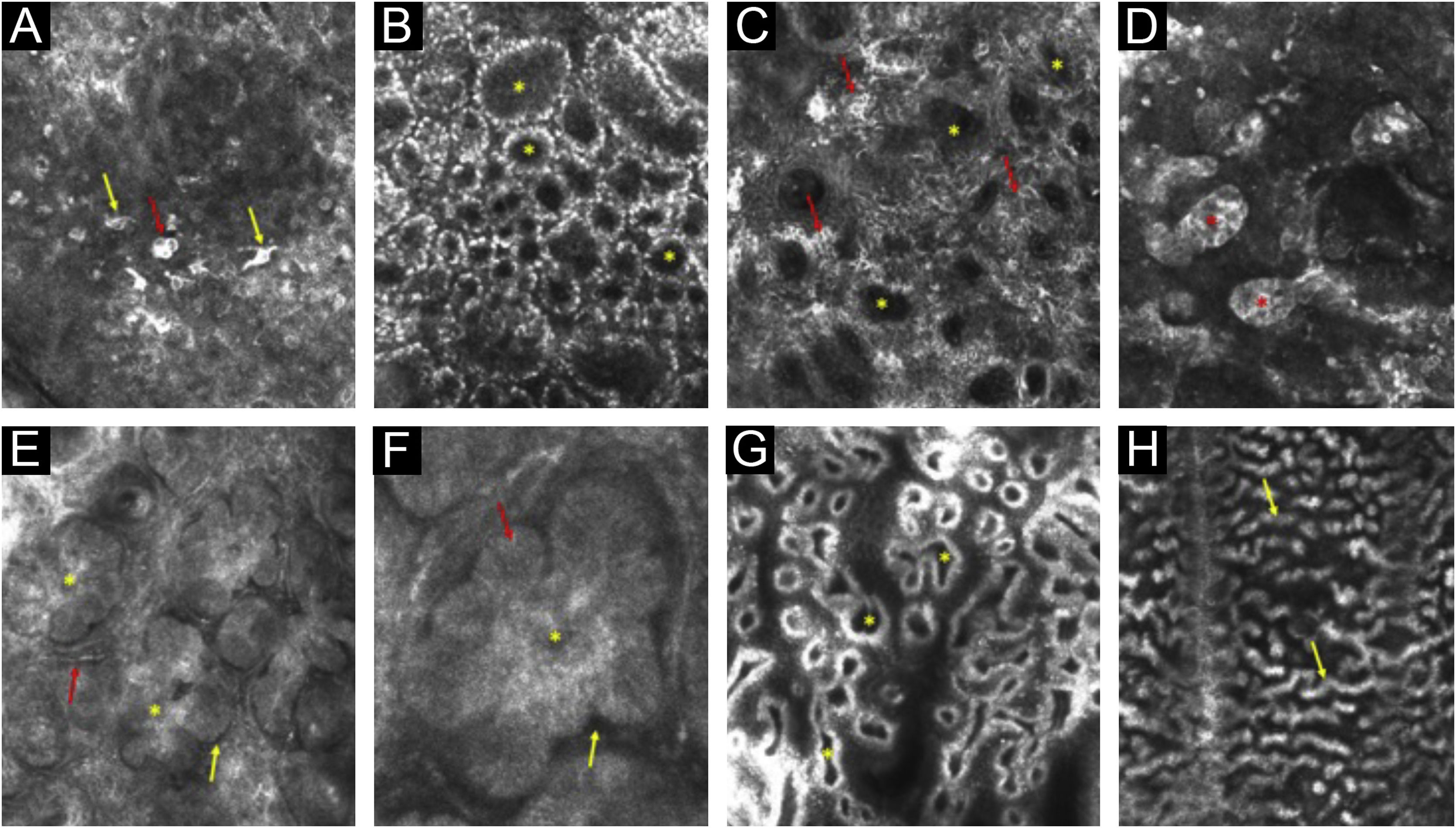
Imagens de MCR ilustrando alguns dos principais termos do consenso. (A) Células pagetoides polimórficas – redondas (seta vermelha) e dendríticas (setas amarelas). (B) Padrão em anéis – papilas demarcadas (asteriscos). (C) Padrão em malha – papilas não demarcadas (asteriscos) e células dendríticas nos espaços interpapilares (setas vermelhas). (D) Ninhos densos (asteriscos). (E) Ilhas tumorais (asteriscos), fenda escura peritumoral (seta amarela) e vasos sanguíneos dilatados lineares (seta vermelha). (F) Ilha tumoral (asterisco), paliçada periférica (seta vermelha) e fenda escura peritumoral (seta amarela). (G) Papilas policíclicas e polimórficas (asteriscos). (H) Cordões e projeções bulbosas (setas amarelas).
A MCR tem a finalidade de fornecer imagens instantâneas, em tempo real, com alta resolução, in vivo, permitindo a observação das estruturas microanatômicas (células, núcleos e arquitetura tecidual) da pele em uma resolução próxima à histopatológica. Essa ferramenta tem sido muito utilizada no diagnóstico dos tumores cutâneos melanoma e não melanoma. As imagens obtidas por esse método são em planos paralelos à pele, semelhante à dermatoscopia e diferente dos cortes histológicos convencionais3,4.
A microscopia confocal in vivo apresenta algumas diferenças em relação à histopatologia convencional. O exame é indolor e não invasivo, sem dano tecidual. A MCR fornece imagens em preto e branco, ao contrário da coloração em rosa e roxo vista nas lâminas histológicas coradas por Hematoxilina & eosina. A pele não é alterada pelo processo de fixação ou coloração, minimizando os artefatos ou ruptura da estrutura original do tecido. Atualmente, os microscópios confocais representam uma oportunidade única no exame não invasivo da pele sem a necessidade de utilização dos marcadores fluorescentes ou corantes teciduais. O contraste das imagens confocais ocorre em virtude das variações naturais do índice de refração, das organelas e microestruturas nas diferentes camadas da pele2–4.
A MCR pode eventualmente ajudar a evitar exérese desnecessária de lesão benigna, orientar biopsia de lesões pigmentadas suspeitas, mapear margens pré‐cirúrgicas e intraoperatórias do tumor e monitorar resposta terapêutica11. A interpretação das imagens da MCR é tarefa difícil com longa curva de aprendizado. Além disso, o uso inconsistente dos termos em reuniões científicas e a falta de padronização da terminologia na língua portuguesa do Brasil provavelmente representam desafio ainda maior na incorporação e no treinamento dessa tecnologia por iniciantes.
A padronização da terminologia, com a utilização de termos não redundantes, facilita a uniformidade na elaboração do laudo do exame de MCR e a comunicação entre os profissionais experientes da área. Com o objetivo de melhorar a consistência do uso dos termos da MCR por meio de linguagem padronizada, realizamos um consenso de terminologia na língua portuguesa do Brasil com a criação de um glossário conciso e unificado para a pele normal, lesões melanocíticas e lesões não melanocíticas.
Este consenso utilizou como base principal de pesquisa dois estudos publicados recentemente por Navarrete‐Dechent et al., na American Academy of Dermatology, onde realizaram revisão sistemática da terminologia de MCR utilizada na literatura tanto para as lesões melanocíticas quanto não melanocíticas. Os autores reuniram todos os termos de MCR descritos em artigos originais, identificaram prováveis sinônimos com definições e correlação histopatológica semelhantes que foram agrupados7,8. Assim, os termos redundantes foram unificados e a lista de termos foi reduzida em aproximadamente 50%, facilitando a elaboração de um glossário conciso e, consequentemente, facilitando também o aprendizado e a aplicação clínica da MCR por dermatologistas.
A MCR é uma tecnologia que tem ganhado destaque no Brasil desde 2009, principalmente no cenário da oncologia cutânea, quando os primeiros exames foram realizados. A partir de então, a nomenclatura utilizada é a descrita pela língua inglesa, gerando grande dificuldade tanto no aprendizado quanto na elaboração e interpretação dos laudos.
Profissionais brasileiros de diferentes estados, ativos e experientes nesse campo da MCR, foram reunidos para padronizar os termos descritivos mais utilizados para avaliação da pele normal, lesões melanocíticas e lesões não melanocíticas. Acredita‐se que a elaboração deste glossário na língua portuguesa do Brasil será de grande utilidade como guia para a descrição das imagens de MCR e também como ferramenta didática para o iniciante nessa tecnologia.
A metodologia utilizada neste estudo incluiu a possibilidade dos termos serem avaliados em três etapas, quando a concordância não alcançou pelo menos 70% dos participantes. Os termos que necessitaram de duas ou mais etapas para alcançar o consenso desejado estavam relacionados a questões de semântica, subjetividade de sua descrição e/ou variações entre termos descritivos e metafóricos. O consenso foi alcançado com ênfase na praticidade do uso do mesmo e na facilidade de entendimento do significado do termo em relação à sua correspondência histopatológica.
Este consenso brasileiro representa uma oportunidade para dermatologistas e médicos especialistas em oncologia cutânea se familiarizarem com a MCR, além da possibilidade de disseminação da técnica em ambientes clínicos e de pesquisa.
ConclusãoOs autores esperam que este consenso possa ser aplicado pelos profissionais brasileiros como forma de ampliar o aprendizado e o uso da MCR em diferentes cenários da área médica, facilitando os debates em simpósios, congressos e reuniões científicas e contribuindo para publicações nacionais e internacionais.
Suporte financeiroNenhum.
Contribuição dos autoresJuliana Casagrande Tavoloni Braga: Concepção e desenho do estudo; redação do artigo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Carlos B. Barcaui: Participação efetiva na orientação da pesquisa; obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Ana Maria Pinheiro: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Ana Maria Fagundes Sortino: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Cristina Martinez Zugaib Abdalla: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Gabriella Campos‐do‐Carmo: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Gisele Gargantini Rezze: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Juan Piñeiro‐Maceira: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Lilian Licarião Rocha: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Marcus Maia: Obtenção dos dados; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Bianca Costa Soares de Sá: Concepção e desenho do estudo; levantamento dos dados; análise e interpretação dos dados; redação do artigo, revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Braga JCT, Barcaui CB, Pinheiro AM, Sortino AMF, Abdalla CMZ, Campos‐do‐Carmo G, et al. Reflectance confocal microscopy ‐ consensus terminology glossary in Brazilian Portuguese for normal skin, melanocytic and non‐melanocytic lesions. An Bras Dermatol. 2024;99:100–10.
Trabalho realizado no Departamento de Imagem, Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.