O tratamento do carcinoma basocelular depende do subtipo histológico. Por isso, recomenda‐se biópsia antes do tratamento definitivo. Entretanto, como a biópsia é apenas uma amostra do tumor, nem sempre ela evidencia todos os subtipos histológicos presentes na neoplasia. Há poucos estudos que comparam os achados histológicos das biópsias com os achados da cirurgia micrográfica de Mohs. Essa técnica, ao avaliar a totalidade das margens periféricas, além de amostrar grandes áreas tumorais, fornece uma quantidade mais representativa de tecido que a biópsia pré‐operatória.
ObjetivosEstabelecer a concordância entre o subtipo histológico de carcinoma basocelular da biópsia por punch e os achados na cirurgia de Mohs; e averiguar, entre os casos discordantes, a prevalência de tumores não agressivos na biópsia pré‐operatória reclassificados como agressivos na cirurgia de Mohs.
MétodosAnálise retrospectiva de 79 carcinomas basocelulares submetidos à biópsia por punch e subsequente cirurgia de Mohs.
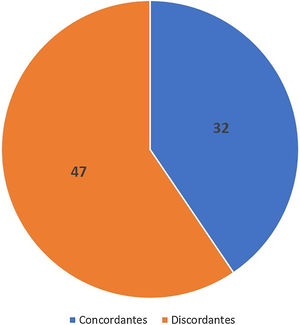
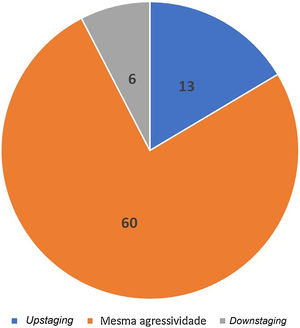
ResultadosA concordância entre os subtipos observados na biópsia e na cirurgia de Mohs foi de 40,5%. A biópsia por punch conseguiu predizer o padrão de crescimento mais agressivo do carcinoma basocelular em 83% dos casos.
Limitações do estudoNatureza retrospectiva, tamanho da amostra e biópsias feitas por diferentes profissionais.
ConclusõesA concordância entre os subtipos histopatológicos dos carcinomas basocelulares identificados na biópsia pré‐operatória e na cirurgia de Mohs foi baixa. No entanto, a biópsia pré‐operatória teve boa acurácia (83%) em detectar subtipos histopatológicos agressivos.
O carcinoma basocelular (CBC) é a neoplasia maligna mais prevalente no Brasil e no mundo e acomete principalmente indivíduos brancos.1 Apesar de raramente causar metástases, localmente o CBC pode ser destrutivo e é importante fonte de morbidade para os pacientes, principalmente quando localizado na face.2 Por isso, é crucial que seja tratado de maneira adequada e que não seja menosprezado apesar do crescimento indolente. O tratamento do CBC baseia‐se principalmente no subtipo histopatológico, em sua localização e em seu tamanho.3,4
Os CBCs podem ser classificados histologicamente em seis subtipos: superficial, nodular, micronodular, infiltrativo, esclerodermiforme e metatípico.5–7 Quando mais de um subtipo está presente na mesma lesão, o CBC é denominado de misto.8,9 Em termos de agressividade, pode ser dividido em dois grupos: os não agressivos (superficial e nodular) e os agressivos (micronodular, infiltrativo, esclerodermiforme e metatípico).6 CBCs agressivos têm maior risco de recorrência, principalmente quando tratados de maneira inadequada.
De modo geral, o tratamento de primeira escolha para o CBC é a excisão cirúrgica.3,4 Entretanto, CBC superficial em áreas de baixo risco também pode ser tratado por modalidades não invasivas, como terapia fotodinâmica, imiquimode ou 5‐fluorouracil, além de curetagem e eletrocauterização.10 Para CBC nodular ou tipos agressivos, a excisão cirúrgica é a modalidade de tratamento mais usada, com uma margem lateral de 4 a 6mm, respectivamente. CBCs localizados em áreas cosmeticamente sensíveis, principalmente na face, têm como primeira indicação de tratamento a cirurgia micrográfica de Mohs (CMM).10,11 Tal técnica possibilita avaliar 100% das margens cirúrgicas no intraoperatório, o que torna possível poupar tecido sadio, além de fornecer taxa de cura mais elevada.
Para escolher a melhor opção terapêutica, é essencial confirmar o diagnóstico e determinar o subtipo histológico do CBC por meio de biópsia prévia.4,10,12 Entretanto, a biópsia pré‐operatória representa apenas uma amostragem do tumor e pode não identificar todas as características histológicas da lesão como um todo.13 A não detecção de subtipos agressivos pode resultar em subtratamento e recorrência tumoral. Por isso, é fundamental saber em que proporção de pacientes a biópsia pré‐operatória identifica o subtipo histológico mais agressivo de CBC.
Tendo isso em vista, os objetivos deste trabalho foram: a) avaliar a concordância do subtipo histológico dos CBCs nas biópsias pré‐operatórias com os da CMM; b) averiguar, entre os casos discordantes, a prevalência de tumores não agressivos na biópsia pré‐operatória reclassificados como agressivos durante a CMM.
MétodosEstudo retrospectivo de amostra consecutiva de pacientes operados pelo mesmo dermatologista com a técnica de CMM provenientes de clínica privada e do Serviço de Dermatologia do Hospital de Clínicas da Universidade Federal do Paraná, de agosto de 2016 a dezembro de 2018.14 O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos (57268416.1.0000.0100).
Os critérios de inclusão foram: pacientes com mais de 18 anos submetidos à CMM para tratamento de CBC comprovado previamente por biópsia punch 3 ou 4mm. Foram incluídos apenas casos em que foi possível fazer a revisão da lâmina da biópsia pré‐operatória. Esses casos foram provenientes de dois laboratórios privados de dermatopatologia e do Laboratório de Anatomia Patológica do Hospital de Clínicas da Universidade Federal do Paraná. Casos com biópsia pré‐operatória provenientes de outros laboratórios foram excluídos devido à dificuldade de acesso às lâminas histopatológicas, muitas vezes em outras cidades. Também foram excluídos pacientes em que a biópsia pré‐operatória foi feita por outro método que não o punch e pacientes em que não foi visualizado tumor na CMM. Isso pode ocorrer quando as margens estão livres no primeiro estágio e o debulking não é feito ou não evidencia tumor nos cortes examinados.
A coleta de dados demográficos e demais dados referentes ao tumor e à cirurgia foram extraídos de uma base de dados do autor (Microsoft Excel®), alimentada rotineiramente pelo próprio autor, imediatamente após cada cirurgia. Os dados usados que foram extraídos consistiram de gênero, idade, fototipo de Fitzpatrick, localização do tumor, maior diâmetro do tumor, tumor primário×recorrente e número de estágios na CMM.
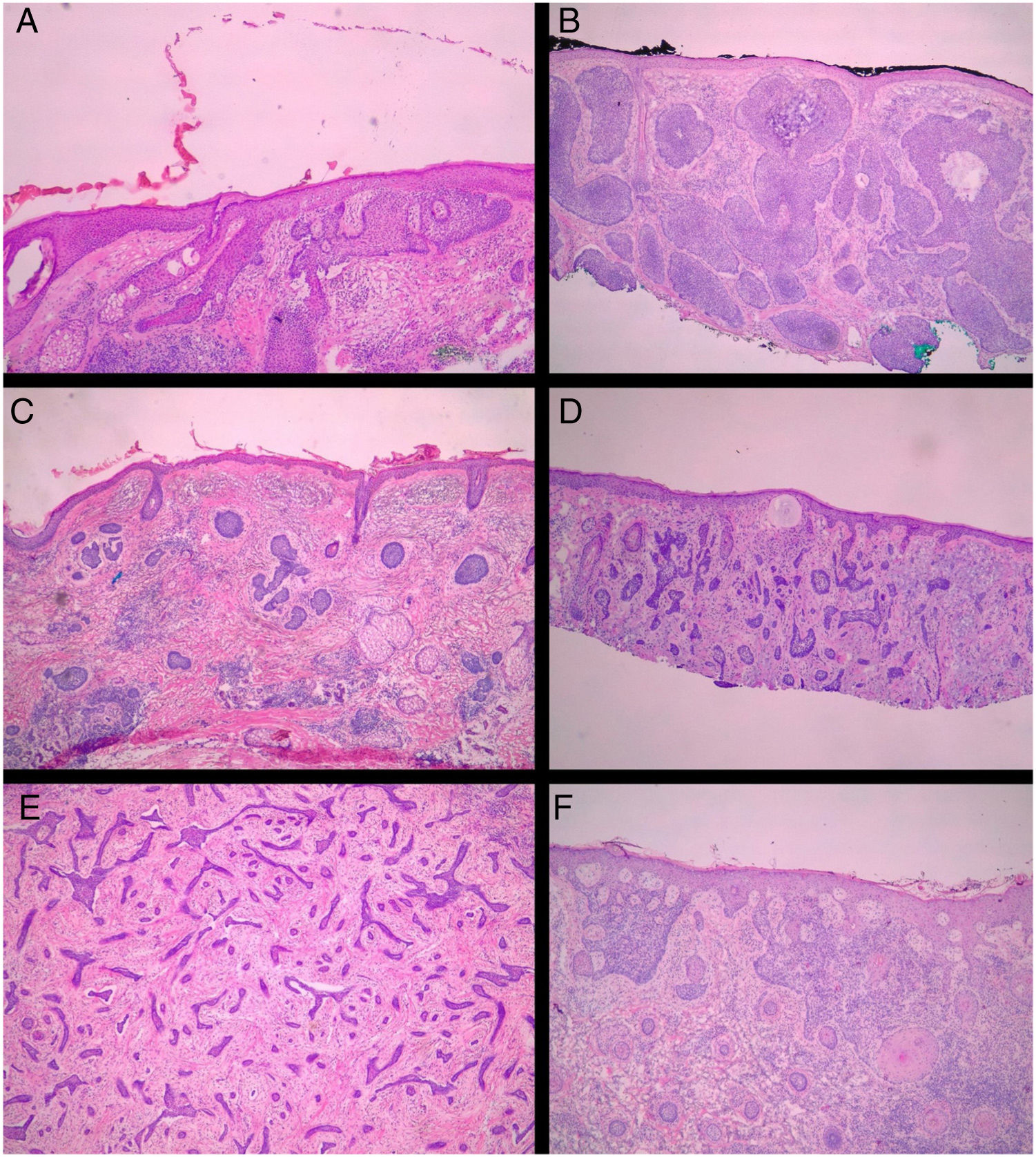
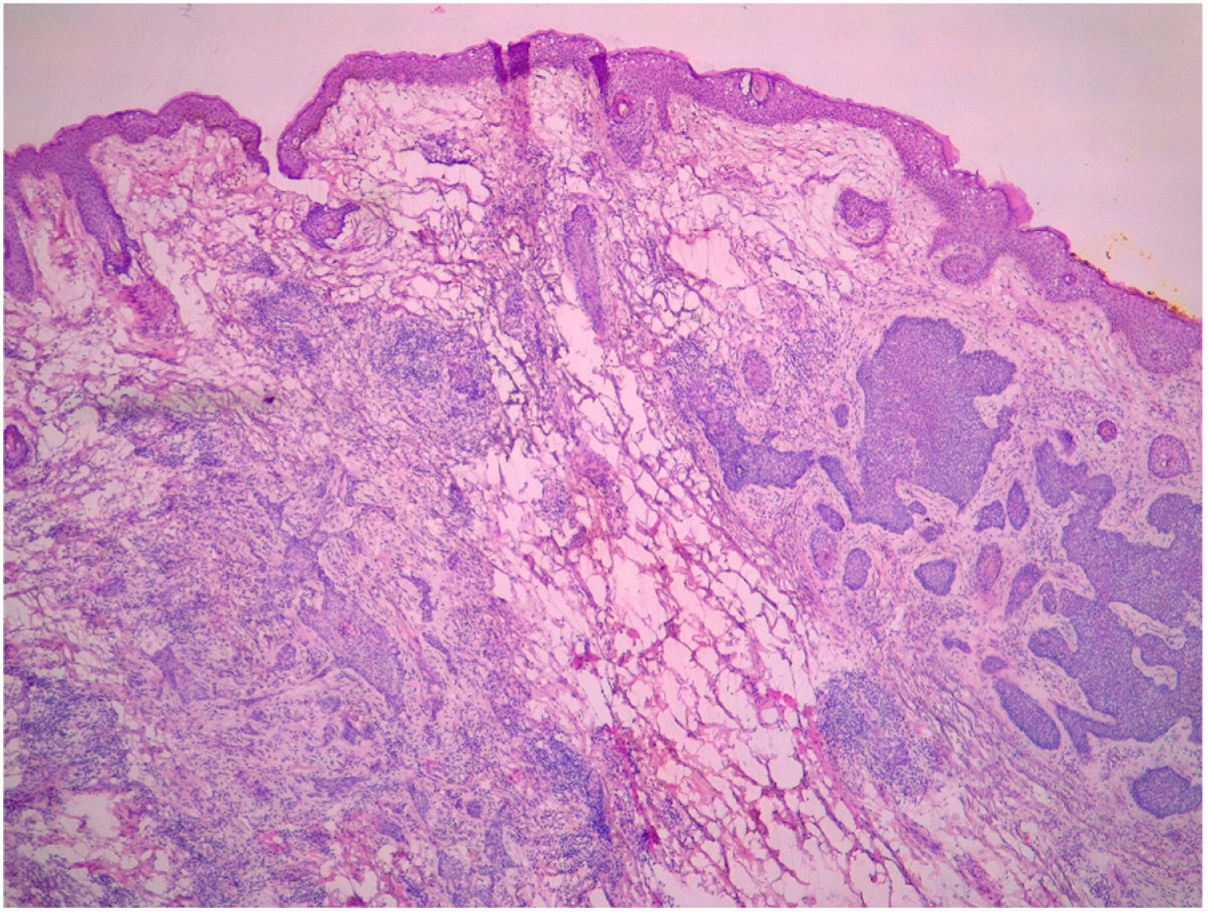
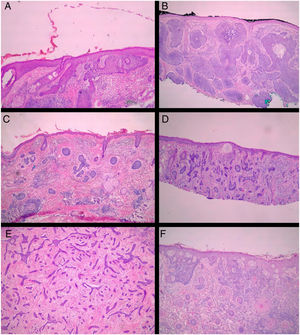
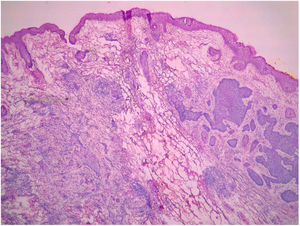
Todas as biópsias pré‐CMM foram revistas pelos autores do estudo (BW e FBC), de maneira cega, sem conhecimento do resultado histológico observado na CMM.14 Todos os espécimes obtidos na CMM foram revisados pelo cirurgião de Mohs de maneira cega, sem o conhecimento do tipo histológico observado na biópsia prévia. A classificação dos CBCs foi baseada na classificação de Sexton et al., separaram‐se os subtipos histopatológicos dos CBCs em superficial, nodular, micronodular, infiltrativo, esclerodermiforme, metatípico ou misto7 (fig. 1). Os subtipos superficial e nodular foram agrupados como não agressivos, enquanto micronodular, infiltrativo, esclerodermiforme e metatípico como agressivos.
Após comparação da biópsia pré‐operatória com os achados da CMM, os casos foram classificados como discordantes quando os subtipos histopatológicos presentes não fossem completamente iguais. A presença de qualquer área de um determinado subtipo histológico foi levada em consideração.
Após a avaliação dos subtipos histopatológicos tanto na biópsia pré‐operatória quanto na CMM, os casos foram divididos em três grupos: 1) grupo de casos nos quais a CMM mostrou um subtipo menos agressivo do que o mostrado na biópsia (downstaging); 2) grupo de casos nos quais a agressividade histológica se mostrou mais alta na CMM quando comparada à biópsia (upstaging); e 3) grupo de casos em que não houve alteração no grau de agressividade entre a classificação na biópsia e na CMM (semelhante).14
Os dados obtidos foram digitalizados em tabela Excel™ (Versão 14.0.6023.1000, Microsoft Office Professional Plus 2010©, 2010 Microsoft Corporation) e analisados pelo softwareStatystical Package for the Social Science (SPSS™) (Versão 22.0, IBM).
Inicialmente, fez‐se uma análise descritiva do conjunto de dados. Em seguida, para as análises de distribuição, foram aplicados testes de normalidade de Komolgorov‐Smirnov para variáveis quantitativas e testes não paramétricos de Mann‐Whitney. Quando a variável critério era categórica, aplicaram‐se o teste qui‐quadrado e o teste exato de Fisher.
Em todos os testes, aplicou‐se o nível de significância de 5%.
ResultadosDos 258 casos de CMM operados pelo autor (FBC) no período, foram incluídos 79 CBCs de 70 pacientes (29 homens, 41 mulheres). Nove pacientes apresentavam dois CBCs. A idade média foi de 64 anos (36‐93 anos). A maioria (n=36) era fototipo de Fitzpatrick III, seguido por fototipo II (n=33) e um paciente fototipo IV.14
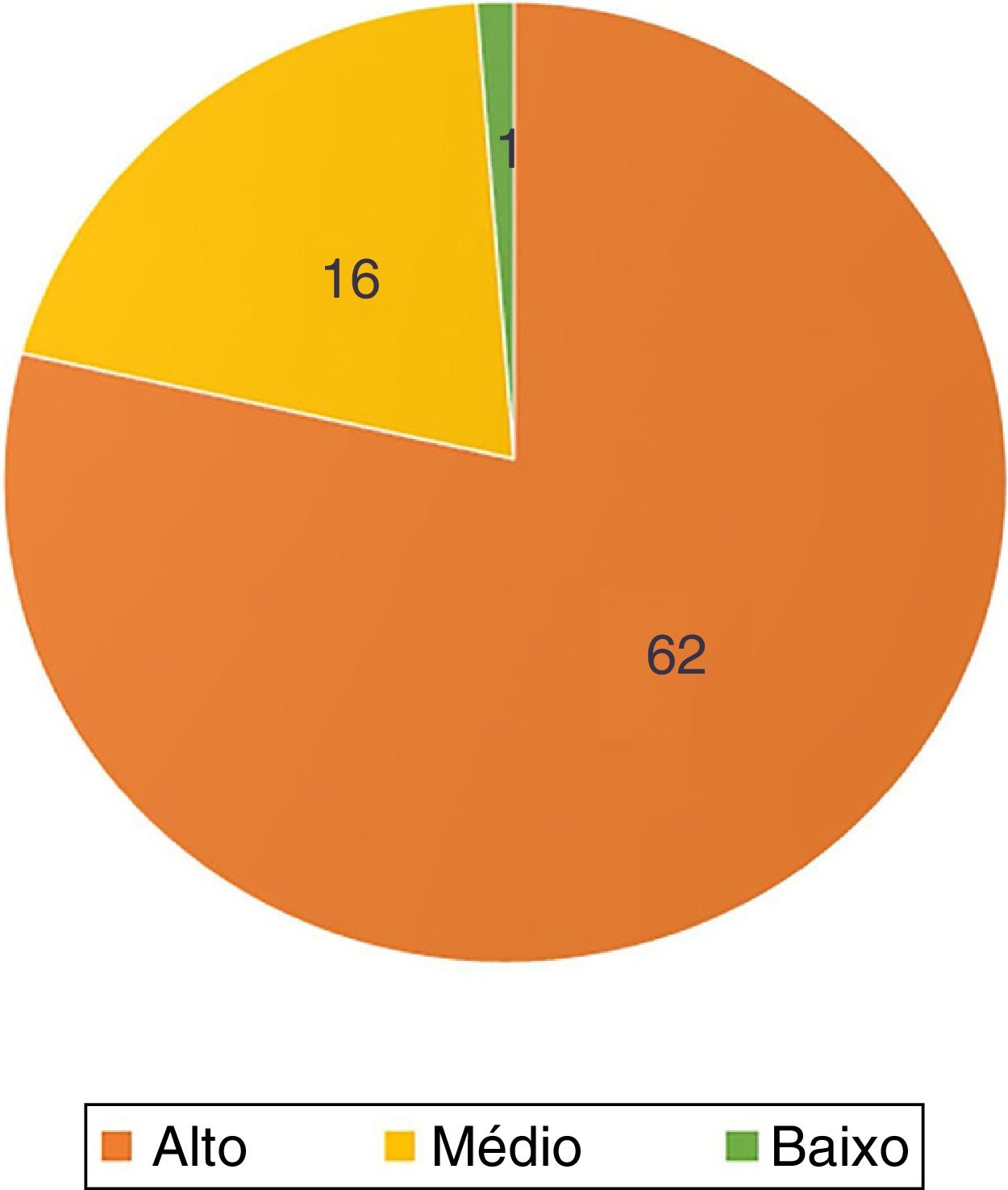
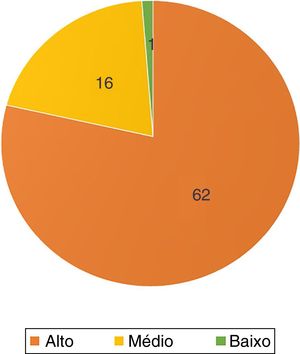
Em relação à topografia dos tumores, todos, exceto um no colo, estavam na região cefálica e cervical (n=78; 98,7%). Sessenta e dois (78,5%) acometiam áreas de alto risco, dos quais 44 ‐se no nariz (56% do total) (fig. 2).
A média do maior eixo do tumor foi de 10,7mm (3‐40mm); 37 (47%) apresentavam tamanho maior ou igual a 10mm. Os CBCs não agressivos tinham tamanho médio de 9,9mm (3‐19mm) e os agressivos de 10,9mm (3‐40mm). Quando classificados em mistos ou de subtipo único, o tamanho médio foi de 11,1mm e 9,6mm, respectivamente.
Do total, 75 (95%) eram primários e quatro (5%) eram recorrentes. Entre esses, dois haviam sido submetidos à cirurgia convencional, um à criocirurgia e outro à radioterapia. A média de estágios necessária para remoção completa dos tumores foi de 1,56 (1‐5).
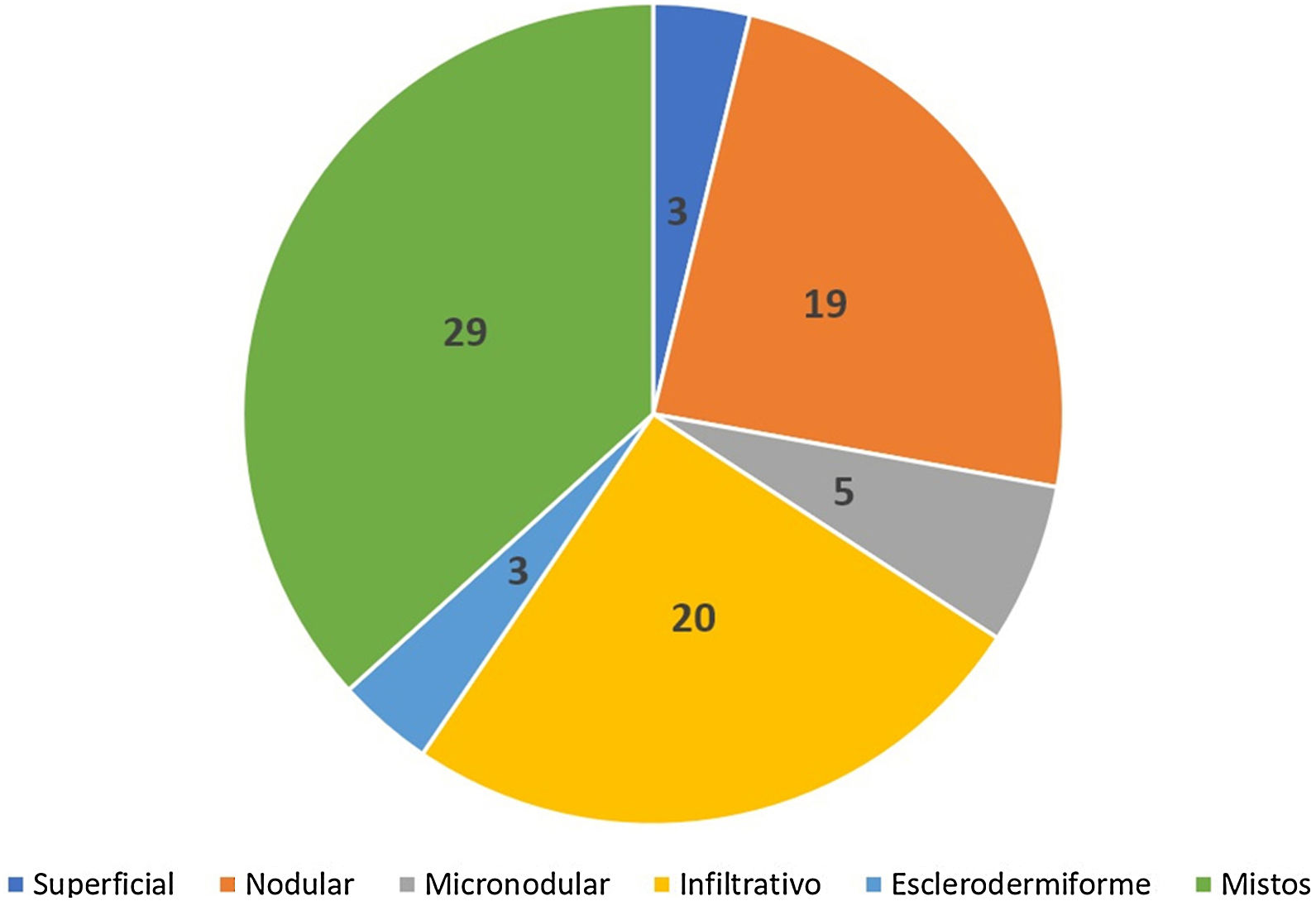
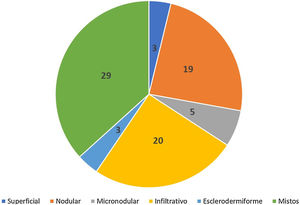
Avaliação histopatológica da biópsia pré‐operatóriaCom relação à classificação histopatológica, na biópsia por punch, 25% (n=20) dos CBCs eram infiltrativos, 24% nodulares (n=19), 6% micronodulares (n=5), 4% (n=3) superficiais, 4% (n=3) esclerodermiformes e 37% (n=29) mistos (fig. 3). Desses, 23 eram compostos de dois subtipos, cinco de três e um de quatro. O subtipo nodular estava presente em 86% (25/29) dos CBCs mistos. A combinação mais frequente foi nodular com infiltrativo (n=9). Em relação à agressividade, 62% (n=49) eram agressivos e 38% (n=30) não agressivos. A presença de qualquer componente agressivo os incluiu nesse grupo. Em 27% (21/79) foi notada presença de subtipo histopatológico agressivo e não agressivo na mesma lesão.
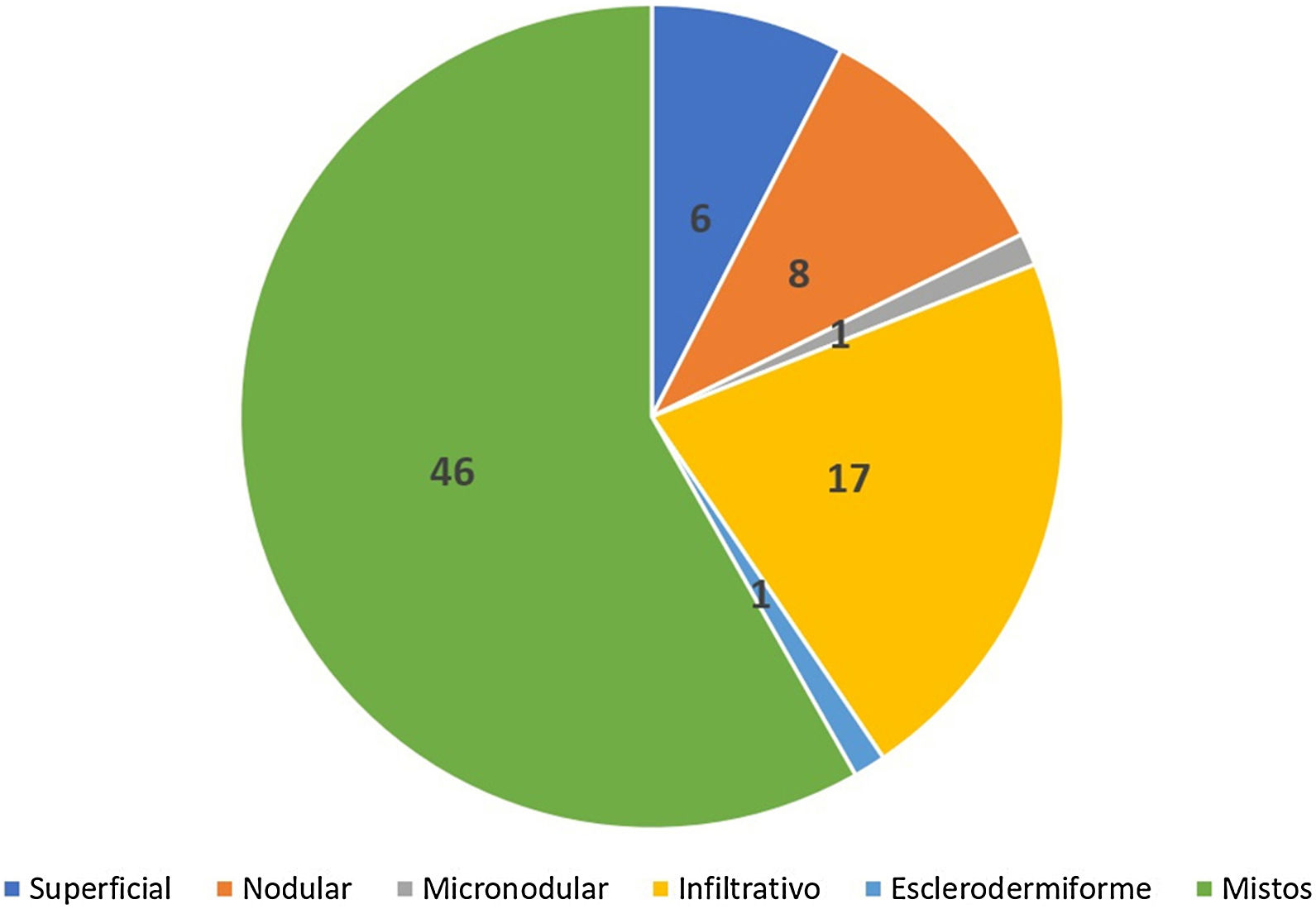
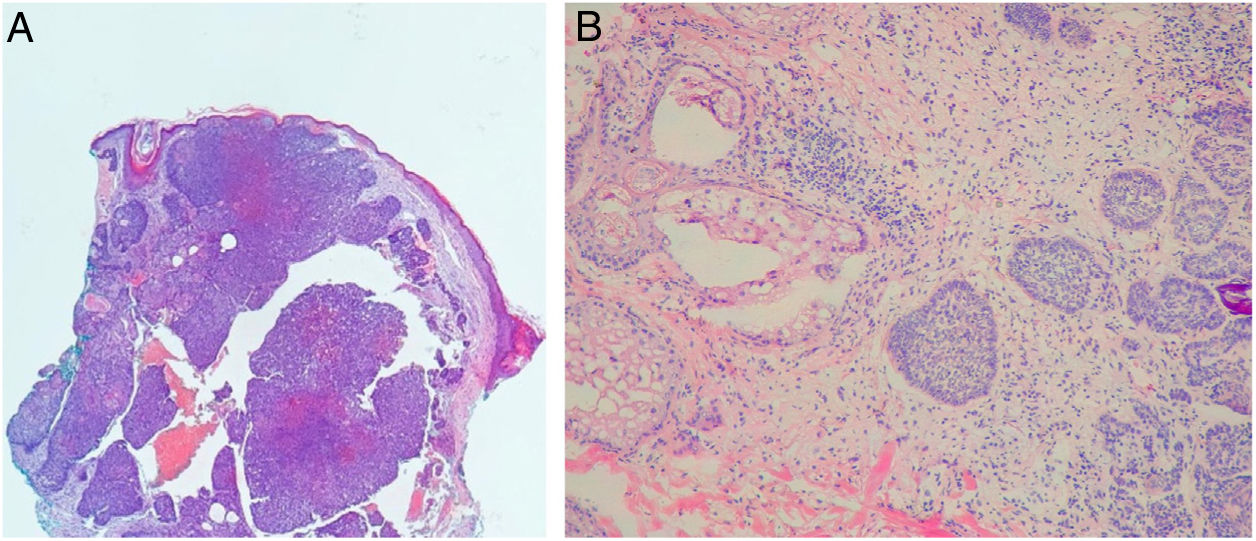
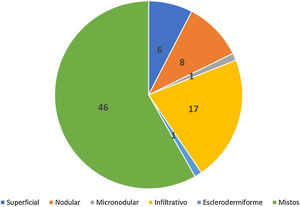
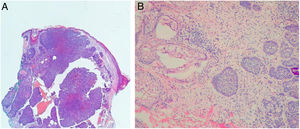
Avaliação histopatológica da cirurgia micrográfica de MohsNa classificação histopatológica na CMM, 22% dos CBCs eram infiltrativos (n=17), 10% eram nodulares (n=8), 1% micronodulares (n=1), 1% (n=1) esclerodermiforme, 8% (n=6) superficiais e 58% (n=46) mistos (fig. 4). Desses, 24 eram compostos por dois subtipos e 12 por três subtipos. O subtipo nodular estava presente em 80% (37/46) dos CBCs mistos. A combinação mais frequente foi nodular com infiltrativo (n=11) (fig. 5). Em relação à agressividade, 29% (n=23) eram não agressivos e 71% (n=56) eram agressivos. Em 43% (n=34/79) foi notada a presença de subtipo histopatológico agressivo e não agressivo na mesma lesão.14
CBCs mistosO número total de CBCs mistos, levando‐se em conta achados do punch e da CMM combinados, foi de 57 (72%). O número de CBCs agressivos foi de 61 (77%).
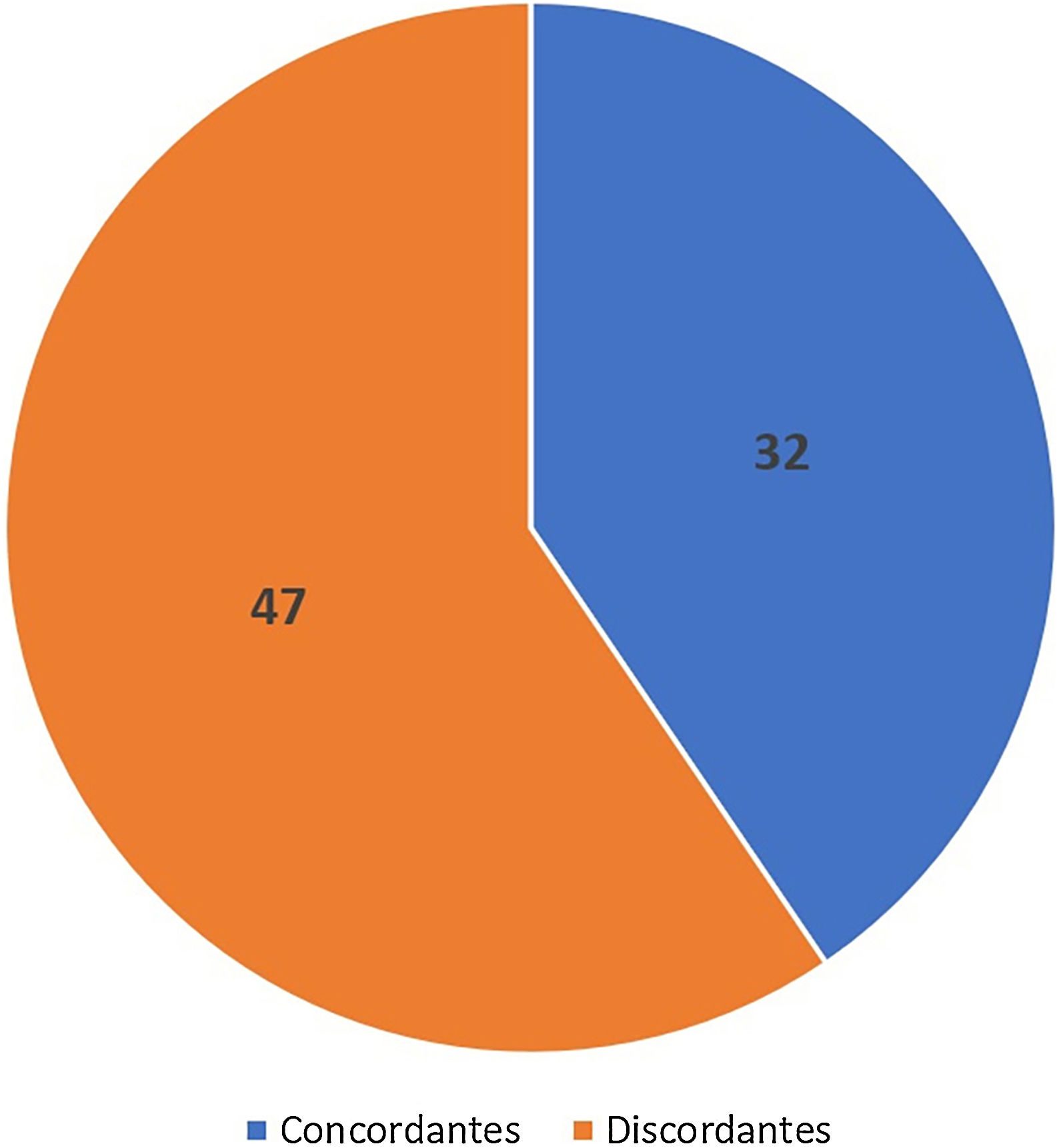
Concordância de subtipos histológicosA concordância entre os subtipos histológicos observados na amostra do punch e na CMM foi de 40,5% (32/79) (fig. 6).
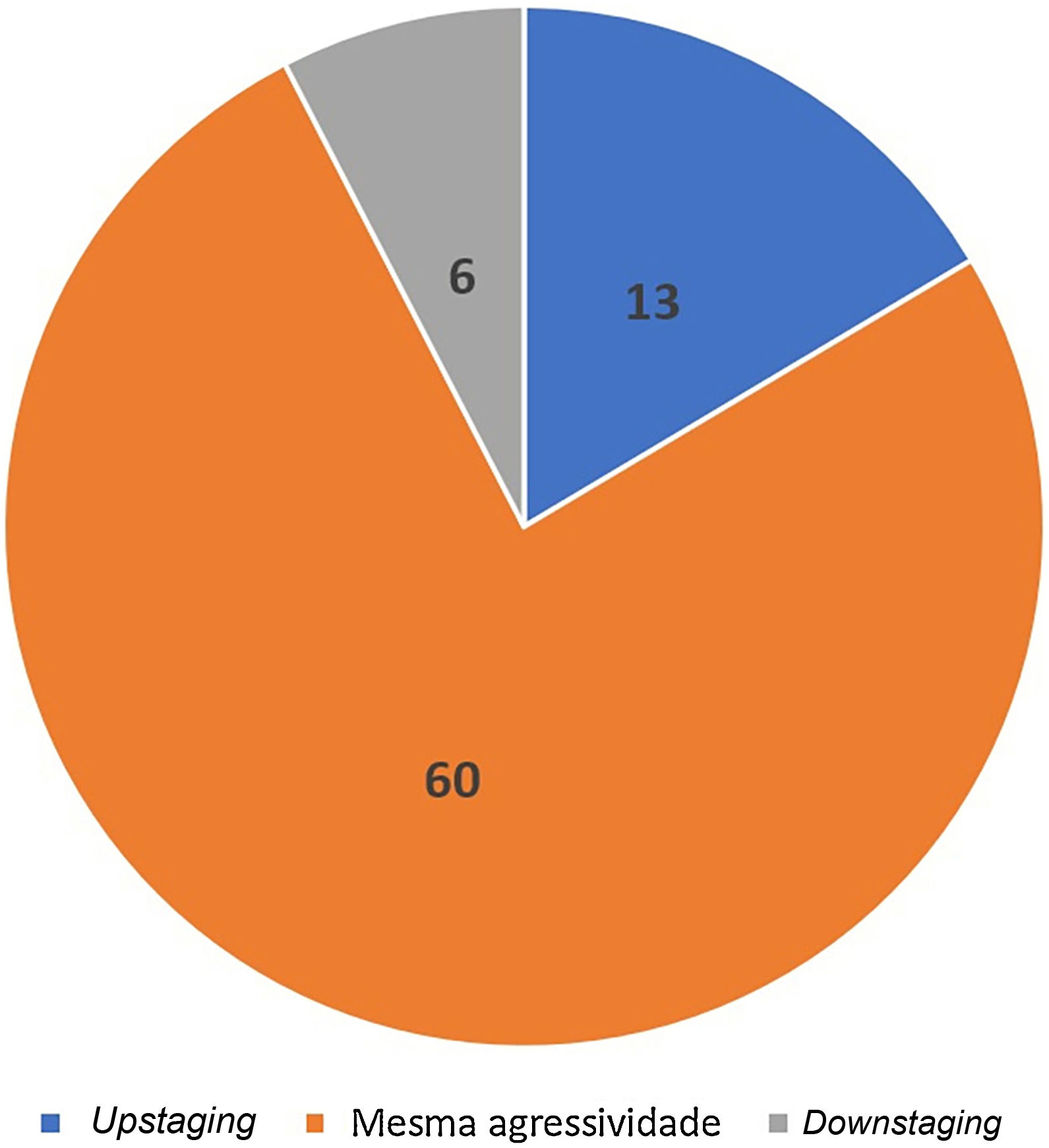
Acurácia da biópsia em detectar agressividade histológicaA biópsia pré‐operatória evidenciou o componente mais agressivo do tumor em 83% dos casos. Ou seja, a prevalência de tumores não agressivos na biópsia pré‐operatória reclassificados como agressivos durante a CMM foi de 17% (n=13) (upstaging). Em 7% (n=6), houve downstaging, em que a biópsia pré‐operatória evidenciou subtipo agressivo que não foi visualizado na CMM. Na maioria, 76% (n=60) dos tumores, a agressividade observada na biópsia pré‐operatória e na CMM foi a mesma (fig. 7).
Quando analisados os 57 CBCs mistos, o componente mais agressivo do tumor não foi detectado na biópsia pré‐operatória em 23% (13/57) dos casos.
Concordância da agressividade entre cirurgião de Mohs e dermatopatologistaTendo em vista a subjetividade inerente a qualquer avaliação histopatológica, foi feito teste de concordância referente à agressividade dos tumores na biópsia pré‐operatória, a qual foi substancial (Kappa=0,610).
Correlação do número de estágios de CMM versus agressividade do tumor na biópsia pré‐operatória e na CMMQuando foram considerados apenas os achados histopatológicos da biópsia pré‐operatória, tumores não agressivos tiveram uma média de 1,26 estágio na CMM e os agressivos média de 1,73 estágio (p=0,025). Quando foram considerados apenas os achados histopatológicos da CMM, a média de estágios na CMM foi de 1,48 estágio para tumores não agressivos e 1,59 para os agressivos (p=0,81).
Na amostra do estudo, não foi observada diferença entre “mudança de agressividade” e tamanho do tumor ou localização (áreas de alto, médio e baixo risco; p=0,955). Não foi observada relação entre “mudança de agressividade” e o fato de o CBC ser primário ou recorrente (p=0,305).
DiscussãoTrês estudos prévios compararam concordância dos subtipos histopatológicos da biópsia da pré‐operatória com a CMM. Izikson et al. demonstraram 49% de concordância; Stiegel 46,7%; Orengo 42,7%; e o presente estudo, 40,5%.15–17 O rigor na classificação dos subtipos histopatológicos adotado no atual estudo pode ter influenciado a menor concordância. A presença de qualquer área de subtipo distinto, mesmo que mínima, foi considerada. Outra observação importante é que no estudo de Stiegel não foi feito debulking dos tumores na CMM, reduziu‐se a quantidade de tecido que foi comparada com a biópsia pré‐operatória.16 Tal medida provavelmente aumentou a possibilidade de concordância dos achados. Genders et al. fizeram o único estudo em que o bloco da CMM foi cortado por completo e sem debulking, o que gera observação da maior amostra possível do tumor.18 Na prática diária, tradicionalmente, não se corta o bloco por completo, já que isso aumenta o custo e, principalmente, o tempo cirúrgico. Além disso, a presença de alguns cortes profundos com representação de 100% da margem periférica é o suficiente para se considerarem margens livres. É importante ressaltar que o debulking não é obrigatório, já que tal porção não faz parte da margem a ser avaliada. O debulking é uma das técnicas usadas em CMM para facilitar o “tombamento” das margens laterais de modo que fiquem no mesmo plano da margem profunda, o que possibilita que os cortes longitudinais incluam 100% da margem cirúrgica.
Em relação aos estudos que compararam os subtipos histológicos da biópsia pré‐operatória com a cirurgia convencional com margens amplas (CCMA), a concordância variou de 54%‐87%.8,19–23 Essa maior concordância, quando comparada com estudos feitos com CMM, possivelmente deve‐se ao fato de que na CMM mais tecido é avaliado, o que aumenta a chance de que áreas pequenas com outros subtipos sejam identificadas (e reduz a concordância).
As taxas de discrepância entre os subtipos observados na biópsia pré‐operatória e na CCMA ou CMM podem ser explicadas por alguns fatores como variação no método de biópsia pré‐operatória (punch ou shaving), tamanho da biópsia, escolha do local do tumor a ser biopsiado, tipos de CBC estudado (primário ou recorrente) e a referência usada para a classificação dos subtipos (os critérios variam de acordo com a referência). Por exemplo, Russell et al. usaram uma classificação simplificada e dividiram os CBCs em superficial, nodular e infiltrativo.22 Além disso, o rigor usado na classificação interfere diretamente na quantidade de CBCs mistos, a qual variou significativamente entre os estudos (18%‐74%) – 72% (57/79) no presente trabalho.6,24,25
Do ponto de vista prático, mais importante do que a acurácia em diagnosticar o subtipo histopatológico é a acurácia em detectar o subtipo agressivo na biópsia pré‐operatória. Isso porque o tratamento do CBC é fortemente baseado no fato de ser histologicamente agressivo ou não. A presença de um subtipo agressivo que não é detectado na biópsia pode ser responsável por falha de determinados tratamentos e maior índice de recorrência.26
No presente estudo, a acurácia da biópsia pré‐operatória em detectar o subtipo agressivo do CBC foi de 83%.14 Ou seja, em 17% dos casos a biópsia não detectou o subtipo mais agressivo (fig. 8). Estudos prévios que fizeram essa mesma análise, compararam biópsia pré‐operatória com achados da CMM, encontraram valores de 19%, 27% e 36%.15–17 Em uma recente revisão sobre o assunto, que incluiu estudos com CCMA e CMM, Singh encontrou taxa de upstaging de 31%.27 Possíveis explicações para a menor taxa de upstaging no presente estudo são o fato de que, nos Estados Unidos, local onde foram feitos os outros estudos, a cobertura à CMM é bem mais ampla, o que faz com que tumores não agressivos sejam frequentemente tratados com a técnica. Reflexo disso é a quantidade de CBCs agressivos (na biópsia pré‐operatória) na revisão de Singh (24,5%) quando comparada ao presente estudo (62%).27 Isso interfere diretamente na chance de ocorrer upstaging, uma vez que maior quantidade de tumores agressivos já na biópsia pré‐operatória reduz a chance de haver progressão para tumores agressivos na CMM.
A elevada discrepância no estudo de Stiegel et al. (36%) pode, em parte, ser explicada pela metodologia usada pelos autores. CBCs superficiais que demonstraram componente nodular na CMM também foram incluídos como upstaging.27 Nos demais estudos, essa alteração não foi considerada, já que CBC superficial e CBC nodular foram considerados não agressivos.
O método de biópsia pode também ter influenciado nos resultados. No estudo de Stiegel foram incluídos casos em que a biópsia pré‐operatória foi feita com punch ou com shaving. A biópsia por shaving, pelo fato de ser superficial, pode falhar em identificar subtipos de CBC localizados mais profundamente na derme.17 No caso do estudo de Stiegel, dentre os tumores que foram reclassificados como mais agressivos, 84% deles foram submetidos a biópsias com shaving e 14% com punch (restante não foi informado).16 Entretanto, em estudo prévio, Haws demonstrou apenas discreta superioridade da biópsia com punch em relação à shaving na correta detecção dos subtipos de CBC (89%×81%).8
Em relação aos estudos que compararam biópsia pré‐operatória com CCMA, o índice de upstaging foi menor e variou de 7%‐26%.8,9,20–24 A adoção de diferentes critérios entre os estudos para determinar concordância da biópsia pré‐operatória com CMM ou CCMA influenciou nessa discrepância. O menor índice de upstaging, quando comparado a estudos feitos com CMM, pode em parte ser justificado pelo fato de que na CMM mais tecido é avaliado do que na CCMA, há maior chance de discordância de agressividade também.
Na presente amostra, em 61% dos casos que tiveram upstaging, a biópsia pré‐operatória demonstrou CBC nodular, mas falhou em detectar o subtipo agressivo do tumor (infiltrativo ou micronodular), dado próximo ao reportado por Kamyab et al. (63%).21 Entre os CBCs inicialmente classificados como nodulares na biópsia pré‐operatória, 42% (8/19) demonstraram subtipo agressivo na CMM, dado superior ao relatado por Wolberink et al. (17%).20
A agressividade observada na biópsia pré‐operatória conseguiu predizer melhor o número de estágios na CMM do que a agressividade observada na própria CMM. Tal dado não havia sido avaliado em estudos semelhantes prévios. Quando foram considerados apenas os achados histopatológicos da biópsia pré‐operatória, os tumores não agressivos tiveram uma média de 1,26 estágio na CMM e os agressivos, média de 1,73 estágio (p=0,025). Quando foram considerados apenas os achados histopatológicos da CMM, a média de estágios na CMM foi de 1,48 para tumores não agressivos e 1,59 para os agressivos (p=0,81).14
A diferença do presente estudo é que a classificação histológica dos carcinomas basocelulares foi feita de maneira cega. Na maioria dos outros estudos, os dados foram coletados de base de dados ou a avaliação não foi cega.9,16 O avaliador não cego, ao avaliar as lâminas da CCMA ou da CMM, pode ter sido influenciado pelo resultado da biópsia inicial.
Tradicionalmente, o cirurgião de Mohs avalia as lâminas histológicas por conta própria durante o procedimento.28 Para isso, passa por intenso treinamento em dermatopatologia de tumores cutâneos. Nos Estados Unidos, por exemplo, são feitos cerca de 1.500 casos de CMM durante a especialização em um ano.29 Estudos feitos em diferentes países demonstraram grau de concordância de 99% entre cirurgião de Mohs e dermatopatologista na avaliação de margens livres.30–33 No presente estudo, a concordância da agressividade dos CBCs foi avaliada na biópsia pré‐operatória, o escore Kappa demonstrou concordância substancial entre o cirurgião de Mohs e a dermatopatologista. Essa variação na classificação dos subtipos já foi avaliada em outros estudos, conforme reportado por Genders et al., em que dois dermatopatologistas avaliaram as lâminas de CMM, com concordância substancial, semelhante ao presente estudo.18
Outro dado avaliado foi o downstaging, em que a biópsia pré‐operatória evidenciou subtipo agressivo que não foi visualizado na CMM. Ocorreu em 8% (n=6) dos casos. Em estudo de Genders foi 40% e de Stiegel, 17%.16,18 Em três casos, o subtipo infiltrativo visualizado na biópsia pré‐operatória (junto com nodular ou superficial) não foi visto na CMM, mas apenas o nodular ou superficial. Justificativas para o downstaging incluem duas possibilidades. Cortes histológicos insuficientes de um CBC nodular localizado profundamente ou tangencialmente ao plano de corte podem revelar apenas pequenos “ninhos” tumorais. Esses agregados tumorais pequenos podem ser incorretamente identificáveis como CBC micronodular na biópsia pré‐operatória por punch. Outra possibilidade é que um subtipo histológico que estava presente no tecido biopsiado tenha sido removido pela biópsia, não apareceu na excisão definitiva. Portanto, isso representa um falso positivo “potencial” para a biópsia por punch.21
Em 76% dos tumores (n=60) a agressividade foi a mesma na biópsia pré‐operatória e na CMM, dado compatível com os demais estudos.16,18,27
O tamanho médio dos tumores em seu maior eixo foi de 10,7mm – dado pouco disponível nos demais estudos.15,16,34 Entretanto, assim como nos estudos de Genders e de Wolberink, o tamanho não influenciou na alteração da agressividade do tumor.18,20 Além disso, tumor recorrente (amostra pequena dificultou a comparação) e localização não influenciaram a alteração da agressividade.
O fato de as biópsias terem sido feitas por diferentes médicos é uma limitação do estudo, já que isso influencia na escolha do local da biópsia. Outras limitações são o tamanho limitado da amostra e a natureza retrospectiva do estudo. Entretanto, essa última foi minimizada, já que os dados são inseridos de maneira prospectiva na base de dados do autor. Por último, uma limitação relativa (já que isso não é rotina na técnica) é o fato de os blocos não terem sido cortados por inteiro na CMM. Isso reduz a quantidade de tecido que é examinado. De qualquer modo, a avaliação do debulking e das margens periféricas torna possível uma avaliação de maior quantidade de tecido do que na avaliação da CCMA.
ConclusõesO presente estudo demonstrou que a concordância dos subtipos histopatológicos dos CBCs observados na biópsia pré‐operatória e na CMM foi baixa (40%). Entretanto, a biópsia pré‐operatória teve boa acurácia (83%) em detectar subtipos histopatológicos agressivos. Sabendo que o tratamento do CBC é baseado no subtipo mais agressivo observado na biópsia pré‐operatória, a chance de subtratamento está presente em cerca de um a cada seis casos de CBC.
Variáveis como localização, tamanho e tumores recorrentes não tiveram correlação com a alteração da agressividade observada entre biópsia pré‐operatória e CMM.
Os dermatologistas devem estar cientes da limitação da biópsia pré‐operatória no diagnóstico de subtipos agressivos de carcinoma basocelular.
Suporte financeiroNenhum.
Contribuição dos autoresFelipe Bochnia Cerci: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Elisa Mayumi Kubo: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados.
Betina Werner: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
À essencial colaboração da Drª Solena Kusma, responsável pela análise estatística do estudo.
Como citar este artigo: Cerci FB, Kubo EM, Werner B. Comparison of basal cell carcinoma subtypes observed in preoperative biopsy and Mohs micrographic surgery. An Bras Dermatol. 2020;95:594–601.
Trabalho realizado no Centro Especializado da Pele e Serviço de Dermatologia, Hospital de Clínicas, Universidade Federal do Paraná, Curitiba, PR, Brasil.