O índice mitótico não é mais empregado para classificar pacientes com melanoma T1 em T1a e T1b; portanto, não deve ser usado para indicar biópsia do linfonodo sentinela nesses pacientes.
ObjetivosAvaliar pacientes com melanoma T1 submetidos à biópsia do linfonodo sentinela e comparar aqueles que são T1a com T1b, de acordo com a 7ª e a 8ª edições, quanto à positividade para biópsia do linfonodo sentinela. Também avaliar se existe alguma diferença nos resultados em ambos os sistemas de estadiamento.
Material e métodosAnálise retrospectiva de 1.213 pacientes submetidos à biópsia do linfonodo sentinela por melanoma, entre 2000 e 2015, em uma única instituição.
ResultadosEm 399 pacientes com melanomas finos, 27 (6,7%) tinham linfonodos sentinelas positivos, mas não houve diferença na positividade para biópsia do linfonodo sentinela em comparação ao T1a versus T1b em ambos os sistemas de estadiamento. Além disso, os resultados clínicos também foram semelhantes entre os dois grupos. No entanto, na análise de coorte completa, o índice mitótico foi associado à positividade para biópsia do linfonodo sentinela (p < 0,0001), positividade para linfonodo não sentinela (p < 0,0001), sobrevida live de recorrência (p < 0,0001) e sobrevida melanoma específica (p=0,023).
Limitação do estudoEstudo unicêntrico.
ConclusãoO índice mitótico mostrou‐se um fator prognóstico muito importante em nossos dados, mas não foi observado em pacientes com T1. O índice mitótico não deve mais ser usado como única razão para propor biópsia do linfonodo sentinela em paciente com melanoma fino.
Desde janeiro de 2018, a 8a edição do estadiamento para melanoma do American Joint Committee on Cancer (AJCC) foi incorporada na prática clínica.1 Uma das diferenças desse novo sistema de estadiamento diz respeito à classificação do T1, que não mais divide os pacientes em T1a e T1b de acordo com o índice mitótico, como acontecia na 7a edição.2
Segundo o novo estadiamento, T1a corresponde a pacientes com espessura de Breslow inferior a 0,8mm sem ulceração, enquanto T1b corresponde a pacientes com espessura de Breslow menor do que 0,8mm com ulceração e espessuras entre 0,8 a 1,0mm com ou sem ulceração. Com essa nova classificação, os consensos para biópsia do linfonodo sentinela (BLS) propõem que não há indicação para que pacientes T1a se submetam a esse procedimento, enquanto pacientes T1b deveriam ser considerados para discussão sobre o procedimento, uma vez que a probabilidade de BLS positiva nesses casos gira entre 5% a 10%.3,4
Entretanto, uma vez que o índice mitótico era usado como critério para propor BLS em pacientes com melanomas finos de acordo com a 7a edição, e ainda permanece como fator prognóstico, os cirurgiões devem continuar a usar esse critério para indicar a cirurgia do linfonodo sentinela após o novo sistema de estadiamento?
O objetivo primário deste estudo é avaliar pacientes com melanoma T1 submetidos à BLS e compará‐los com melanoma T1a e T1b de acordo com a 7a e a 8a edições quanto à positividade do linfonodo sentinela. Também se pretende avaliar a positividade de linfonodos não sentinela (LNNS) nos pacientes submetidos à linfadenectomia.
O objetivo secundário é comparar a sobrevida livre de recorrência (SLR) e a sobrevida melanoma específica (SME) em pacientes com melanoma T1 de acordo com ambos os sistemas de estadiamento.
Material e métodosAnálise retrospectiva de pacientes submetidos à BLS entre 2000 a 2015 em uma única instituição. O trabalho foi aprovado pelo Comitê de Ética em Pesquisa local (Projeto 2183/16) e a rotina do serviço para a BLS já foi previamente descrita na literatura.5,6
Entre os pacientes submetidos à BLS, foram considerados apenas os pacientes T1 e divididos em T1a e T1b de acordo com a 7a e a 8a edições do AJCC para estadiamento. Foram comparados quanto à positividade de BLS e LNNS pelos testes qui‐quadrado ou de Fisher, com nível de significância de 0,05. Curvas de Kaplan Meyer foram feitas para avaliar desfechos clínicos em ambos os cenários e o teste não paramétrico de Log‐rank foi empregado para avaliar a significância.
As mesmas análises foram feitas na coorte completa de pacientes a fim de avaliar o impacto do índice mitótico independente da categoria T da Classificação de Tumores Malignos (TNM). Regressões de Cox foram usadas para avaliar SLR e SME.
ResultadosEntre 2000 e 2015, 1.213 pacientes foram submetidos à BLS na instituição. Nessa coorte, 411 pacientes apresentavam melanomas finos, mas 12 não tinham informações no laudo de anatomia patológica necessárias para o estadiamento e foram excluídos da análise, de modo que analisamos 399 pacientes com melanomas finos submetidos à BLS. Em 27 casos (6,7%) a BLS foi positiva e nenhum deles apresentou LNNS na linfadenectomia, que era nossa conduta de eleição no período do estudo.
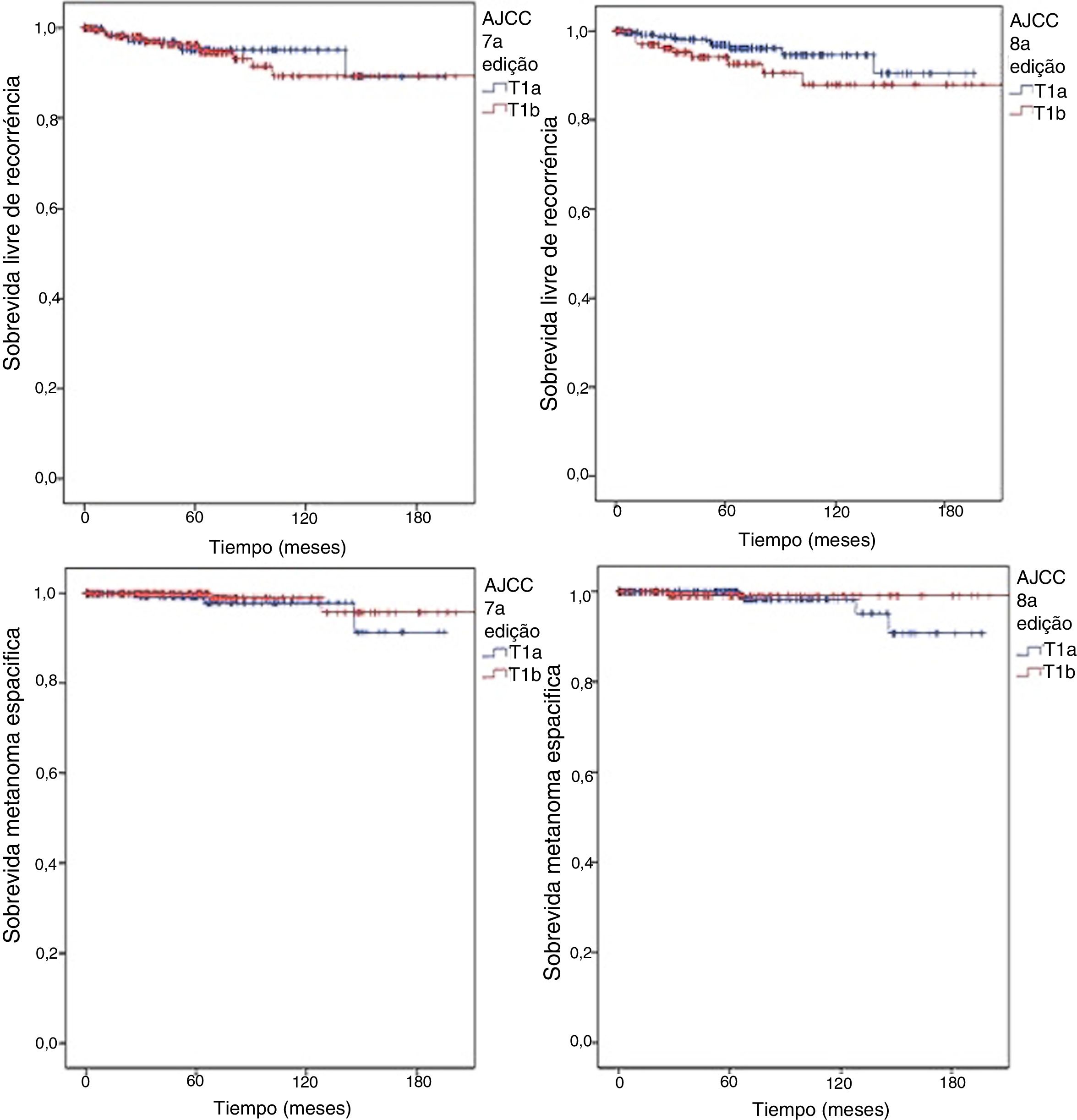
De acordo com a 7a edição, 244 (62,2%) pacientes seriam classificados como T1b por apresentar ulceração e/ou índice mitótico diferente de 0, independentemente da escala usada (milímetros quadrados – mm2, ou campo de grande aumento – CGA). Não houve diferença significativa de positividade da BLS (OR para T1b de 1,888; 95% IC 0,779‐4,576; p = 0,22). Classificando pela 8a edição, o número de pacientes T1b foi menor (148%‐37,1%) e novamente não houve diferença significativa entre T1a e T1b (OR para T1b 1,388; 95% IC 0,631‐3,052; p = 0,54). Os desfechos também foram semelhantes, independentemente da classificação do AJCC adotada (fig. 1). Não houve diferença em SLR em ambos os cenários (Log‐rank = 0,659 para a 7a edição e 0,135 para a 8a edição) nem em SME (Log‐rank = 0,363 para a 7a edição e 0,414 para a 8a edição).
Curvas de Kaplan Meyer para sobrevida livre de recorrência de acordo com (A), 7a edição (Log‐rank = 0,659) e (B), 8a edição (Log‐rank = 0,135); e para sobrevida melanoma específica de acordo com (C), 7a edição (Log‐rank = 0,363) e (D), 8a edição (Log‐rank = 0,414) para pacientes com melanomas finos submetidos à biópsia do linfonodo sentinela de 2000 a 2015.
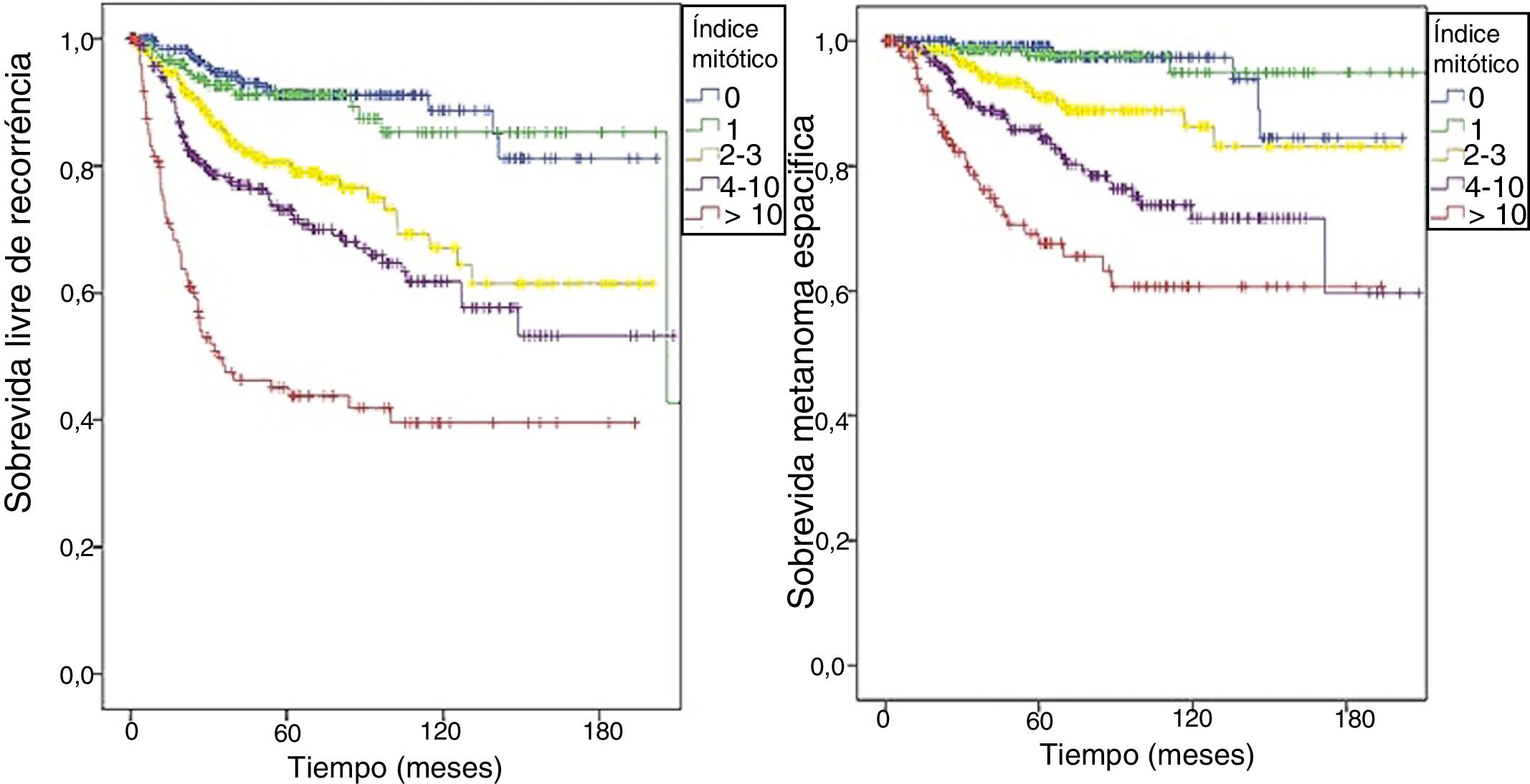
Entretanto, como a 8a edição apresentou diferentes curvas de sobrevida baseadas em índice mitótico, decidimos avaliar essa característica em nossa casuística completa. Entre os 1.213 pacientes submetidos à BLS, o índice mitótico foi estatisticamente diferente não apenas naqueles com BLS positiva (OR = 1,076; 95% IC 1,054‐1,099; p < 0,0001), mas também naqueles com LNNS positiva na linfadenectomia (OR = 1,067; 95% IC 1,032‐1,103; p < 0,0001).
O índice mitótico também foi estatisticamente significativo relacionado à SLR tanto na regressão de Cox simples (HR = 1,046; 95% CI 1,038‐1,053; p < 0,0001) quanto na múltipla (HR = 1,022; 95% CI 1,010‐1,034; p < 0,0001), junto com outras características do tumor primário. A análise de SME também mostrou significância do índice mitótico nos modelos de regressão simples (HR = 1,050; 95% CI 1,040‐1,060; p < 0,0001) e múltipla (HR = 1,020; 95% CI 1,003‐1,038; p = 0,023).
Como demonstrado na 8a edição do AJCC, também estratificamos os pacientes de nossa coorte e as curvas de SLR (Log‐rank < 0,0001) e SME (Log‐rank < 0,0001) foram diferentes de acordo com o valor do índice mitótico (fig. 2).
DiscussãoAtualizações nos sistemas de estadiamento para tumores sólidos podem ocasionar mudanças na prática clínica diária. Na 8a edição do estadiamento para melanoma, uma dessas alterações ocorreu na categoria T1.
A divisão entre T1a e T1b não usa mais índice mitótico, como acontecia na 7a edição.2 Essa mudança impacta principalmente ao se considerarem candidatos para BLS, uma vez que alguns pacientes com melanoma fino foram submetidos à cirurgia do linfonodo sentinela baseado apenas no índice mitótico.7 Agora, mesmo que os novos consensos não considerem mais o índice mitótico como critério para BLS, alguns cirurgiões podem questionar se realmente devem mudar sua prática.
Nossos dados mostraram que independentemente do sistema de estadiamento adotado, o índice mitótico não foi associado com positividade da BLS, o que sugere que possa ser abandonado nesse cenário. Além disso, a positividade da BLS nos pacientes T1 foi de 6,7% e nenhum deles apresentou LNNS comprometidos. Isso reforça a necessidade de discutir a BLS em pacientes T1b considerando riscos e benefícios do procedimento.3,4
Entretanto, nossos resultados também mostram o impacto do índice mitótico como fator prognóstico não relacionado ao estadiamento T. Ele esteve associado com positividade da BLS e de LNNS. Com os resultados apresentados no De‐COG Trial e MSLT‐II, muito se tem discutido sobre quem deveria se submeter à linfadenectomia.8–10 Acreditamos que o índice mitótico possa ser usado em ferramentas matemáticas como nomogramas e algoritmos para identificar esses pacientes.11,12
Provavelmente a maior limitação deste estudo é o baixo número de pacientes, uma vez que se trata de estudo unicêntrico. Entretanto, nossos resultados mostraram que à medida que o índice mitótico aumenta, isso representa um prognóstico pior, semelhantemente às curvas de sobrevida apresentadas na 8a edição do AJCC.1 Acreditamos que nossa coorte seja representativa e reforce a importância da avaliação do índice mitótico, que deve ser mantido nos relatórios de anatomia patológica para melanoma.13
ConclusãoApesar de o índice mitótico ser fator prognóstico importante em nossa análise, isso não foi observado em pacientes com melanoma T1. Como apresentado nos consensos atuais, concordamos que o índice mitótico não deva ser usado como único critério para indicar BLS em pacientes com melanomas finos. Além disso, nossos resultados sugerem que mesmo pacientes T1b não devem se submeter à BLS de rotina, uma vez que a positividade é baixa e nenhum paciente apresentou linfonodos adicionais comprometidos.
Suporte financeiroNenhum.
Contribuição dos autoresAmanda Zorzetto Antonialli: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Eduardo Bertolli: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Mariana Petaccia de Macedo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Clovis Antonio Lopes Pinto: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Vinicius Fernando Calsavara: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
João Pedreira Duprat Neto: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Antonialli AZ, Bertolli E, Macedo MP, Pinto CAL, Calsavara VF, Duprat Neto JP. How does the mitotic index impact patients with T1 melanoma? Comparison between the 7th and 8th edition of the American Joint Committee on Cancer melanoma staging system. An Bras Dermatol. 2020;95:691–5.
Trabalho realizado no A.C. Camargo Cancer Center, São Paulo, SP, Brasil.