A psoríase é uma doença dermatológica inflamatória crônica, mediada imunologicamente, associada a comorbidades cardiovasculares.
ObjetivoAvaliar a proteína C‐reativa (PCR), a razão monócitos/lipoproteínas de alta densidade (RMLAD), a razão neutrófilos/linfócitos (RNL), a razão plaquetas/linfócitos (RPL) e a razão monócitos/linfócitos (RML) como marcadores inflamatórios em pacientes com psoríase e procurar uma relação entre esses parâmetros e a gravidade da psoríase, conforme definido pelo Índice de Área e Gravidade da Psoríase (PASI, do inglês Psoriasis Area and Severit Index).
MétodosO estudo retrospectivo incluiu 94 pacientes com psoríase e 118 controles saudáveis, pareados por idade e sexo. Os valores de PCR, RMLAD, RNL, RPL e RML dos dois grupos foram avaliados retrospectivamente.
ResultadosDiferenças estatisticamente significativas foram observadas quanto a PCR, RMLAD, RNL e RML entre os grupos de pacientes e controles (p=0,001, p=0,003, p=0,038 e p=0,007, respectivamente). Foram observadas correlações positivas entre o escore PASI e os valores de PCR, RMLAD, RNL, RPL e RML (r=0,381, p=0,001; r=0,203, p=0,045; r=0,268, p=0,009; r=0,374, p=0,001; r=0,294, p=0,004; respectivamente).
Limitações do estudoO pequeno tamanho da amostra e o desenho retrospectivo do estudo são limitações.
ConclusãoNíveis elevados de PCR, RMLAD, RNL e RML foram significativamente associados à psoríase. A correlação positiva observada entre a PCR e a RMLAD leva à sugestão de que a RMLAD possa ser um parâmetro confiável na psoríase durante o acompanhamento. A relação entre a doença e os parâmetros inflamatórios pode levar à detecção precoce de morbidades cardiovasculares em pacientes com psoríase.
A psoríase, uma doença dermatológica crônica, é caracterizada pela infiltração de células imunes (p.ex., leucócitos mononucleares e neutrófilos) na pele, bem como pela proliferação anormal de queratinócitos.1 Sabe‐se que a psoríase está associada a maior risco de doenças cardiovasculares (DCV), por compartilharem vias inflamatórias.2
Os níveis de proteína C‐reativa (PCR), um conhecido biomarcador de inflamação, apontados como elevados em pacientes com psoríase, indicaram comorbidades cardiovasculares.3 Foi demonstrado que a razão entre a contagem de monócitos e a lipoproteína de alta densidade (RMLAD) é um marcador inflamatório e um novo fator preditivo e prognóstico para DCV.4 Além disso, a razão neutrófilos/linfócitos (RNL), a razão neutrófilos/linfócitos (RPL) e a razão monócitos/linfócitos (RML) foram apontadas como indicadores de inflamação sistêmica e mau prognóstico em uma variedade de doenças, como câncer, DCV e doenças inflamatórias autoimunes.5–7 Entretanto, esses novos biomarcadores não foram bem investigados na psoríase.
Vários biomarcadores foram estudados em amostras de sangue periférico de pacientes com psoríase para encontrar um marcador sérico adequado para avaliar a gravidade da doença. O Índice de Área e Gravidade da Psoríase (PASI) é uma ferramenta de pontuação usada para avaliar a gravidade da psoríase,8 mas pode apresentar variações de acordo com o médico. Portanto, seria benéfico encontrar um biomarcador clínico objetivo, barato e de fácil acesso para a psoríase. No entanto, ainda não foram estabelecidos biomarcadores bem aceitos para essa doença.
Tanto quanto é do conhecimento dos autores, não existem dados atuais sobre os valores de RMLAD ou RML em pacientes com psoríase e poucos estudos avaliaram os valores de RNL e RPL em pacientes com psoríase.6,9–12 Portanto, para entender melhor esses parâmetros inflamatórios séricos na psoríase e avaliar a associação com a atividade da doença, foi feito um estudo retrospectivo para avaliar PCR, RMLAD, RNL, RPL e RML em pacientes com psoríase.
MétodosO estudo incluiu 94 pacientes diagnosticados com psoríase em placas na fase crônica por exame clínico ou histopatológico, recrutados no ambulatório de dermatologia. Para comparação, foram recrutados 118 controles saudáveis, pareados por idade e sexo, sem evidência de psoríase ou outra doença inflamatória sistêmica, entre voluntários da equipe do hospital. Indivíduos com histórico de qualquer terapia tópica ou sistêmica para psoríase foram excluídos do estudo. Apenas aqueles com índice de massa corporal normal (IMC; 18,5‐25kg/m2) foram incluídos. Os indivíduos no grupo controle tiveram achados normais no exame físico e nenhum apresentava DCV ou doença em nenhum outro sistema de órgãos. Foram excluídos indivíduos com histórico documentado de qualquer outra doença sistêmica, inclusive doença coronariana, infarto do miocárdio, hipertensão, hiperlipidemia, acidente vascular cerebral, doença vascular periférica, doença pulmonar obstrutiva crônica, doença renal, insuficiência hepática ou evidência clínica/bioquímica de doença inflamatória concomitante ou qualquer doença autoimune. Indivíduos em qualquer tipo de tratamento foram excluídos. Indivíduos fumantes e/ou com hábito de consumo de álcool também foram excluídos.
O estudo foi aprovado pelo comitê de ética local e todos os participantes assinaram um termo de consentimento livre e esclarecido. O estudo foi feito em consonância com os princípios expressos na Declaração de Helsinque.
Os dados demográficos iniciais, as características clínicas e os resultados dos exames de sangue foram obtidos retrospectivamente nos prontuários dos pacientes. Níveis de lipoproteína de alta densidade (HDL‐C, do inglês High Density Lipoprotein), hemograma completo e PCR foram medidos em todos os indivíduos com amostras de sangue venoso em jejum. As amostras de sangue venoso foram coletadas dos participantes entre as 9h e as 11h, após um período de jejum de 12 horas para avaliar hemograma, HDL‐C e PCR. Os níveis de RMLAD, RNL, RPL e RML dos participantes também foram registrados.
As medições dos níveis séricos de PCR foram feitas com um sistema espectrofotométrico (Cobas c 501; Roche Diagnostics – Mannheim, Alemanha). Os hemogramas foram avaliados por um sistema de autoanalisador (Sysmex XE‐2100; Roche Diagnostics – Mannheim, Alemanha). As concentrações de HDL foram medidas com um sistema enzimático (Cobas c 701; Roche Diagnostics – Mannheim, Alemanha).
A psoríase foi classificada de acordo com o PASI, calculado no momento da coleta de sangue por um único dermatologista.8 Os pacientes com psoríase foram divididos em dois grupos de acordo com os escores PASI: leve (≤ 10) e moderado‐grave (> 10). Os níveis de RMLAD, RNL, RPL, RML e PCR dos pacientes com psoríase foram comparados com os dos controles; as comparações intragrupos foram feitas de acordo com a gravidade da doença.
Análise estatísticaFoi feita com o programa Number Cruncher Statistical System 2007 (NCSS; Kaysville – Utah, Estados Unidos). Os dados foram expressos com média±desvio‐padrão, mediana (primeiro quartil, terceiro quartil), contagem e porcentagens. Na análise de variáveis normalmente distribuídas, o teste t de Student para amostras independentes foi aplicado para avaliar as diferenças entre dois grupos. Nas variáveis não normalmente distribuídas, as diferenças entre dois grupos independentes foram examinadas pelo teste U de Mann‐Whitney. O teste Anova unidirecional, com testes post‐hoc de Bonferroni corrigidos, foi usado para comparar variáveis normalmente distribuídas entre três ou mais grupos. O teste de Kruskal‐Wallis, com os testes post hoc de Dunn‐Bonferroni, foi usado para comparar variáveis não normalmente distribuídas entre três ou mais grupos. O teste qui‐quadrado de Pearson foi usado para comparar variáveis categóricas. A associação entre variáveis foi avaliada pelo coeficiente de correlação de postos de Spearman. Um valor‐p<0,05 foi considerado estatisticamente significativo.
ResultadosO estudo incluiu 94 pacientes com psoríase e 118 controles saudáveis. O grupo psoríase foi composto por 50 pacientes com doença leve e 44 pacientes com doença moderada a grave. Não foram observadas diferenças significativas na proporção de sexo ou idade entre os pacientes com psoríase e controles saudáveis (p=0,393, p=0,222, respectivamente). Todos os participantes estavam dentro dos limites normais de IMC. O valor mediano (primeiro quartil, terceiro quartil) da duração da doença foi de 120 (72‐180) meses entre os pacientes com psoríase. Os escores do PASI dos pacientes variaram de 0,6 a 32,4, com uma mediana (primeiro quartil, terceiro quartil) de 9,65 (4,9±15,4).
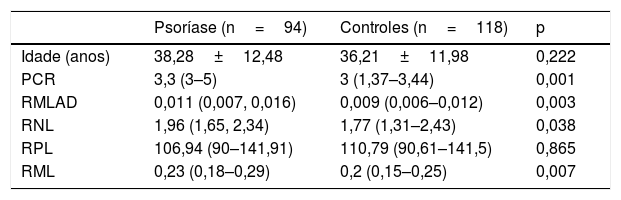
Uma diferença estatisticamente significativa nos níveis de PCR foi observada entre os grupos de pacientes e de controle: 3,3 (3–5) vs. 3 (1,37–3,44), p=0,001, respectivamente. Também foi observada diferença estatisticamente significante em termos de RMLAD, RNL e RML entre os grupos de pacientes e de controles (p=0,003, p=0,038 e p=0,007, respectivamente). Não foi observada diferença estatisticamente significativa nos valores de RPL entre os dois grupos (p=0,865). A tabela 1 apresenta as características clínicas do grupo de estudo.
Características demográficas e valores dos parâmetros inflamatórios dos pacientes e controles
| Psoríase (n=94) | Controles (n=118) | p | |
|---|---|---|---|
| Idade (anos) | 38,28±12,48 | 36,21±11,98 | 0,222 |
| PCR | 3,3 (3–5) | 3 (1,37–3,44) | 0,001 |
| RMLAD | 0,011 (0,007, 0,016) | 0,009 (0,006–0,012) | 0,003 |
| RNL | 1,96 (1,65, 2,34) | 1,77 (1,31–2,43) | 0,038 |
| RPL | 106,94 (90–141,91) | 110,79 (90,61–141,5) | 0,865 |
| RML | 0,23 (0,18–0,29) | 0,2 (0,15–0,25) | 0,007 |
Teste t de Student para amostras independentes, descrito como média±DP.
Teste U de Mann‐Whitney, descrito como mediana (primeiro quartil, terceiro quartil).
PCR, proteína C reativa; RMLAD, razão monócitos/lipoproteínas de alta densidade; RML, razão monócitos/linfócitos; RNL, razão neutrófilos/linfócitos; RPL, razão plaquetas/linfócitos.
Quando os pacientes com psoríase foram avaliados de acordo com a gravidade da doença, os valores de PCR, RMLAD, RNL, RPL e RML foram significativamente maiores naqueles com psoríase moderada a grave do que em pacientes com psoríase leve e controles saudáveis (p=0,001, p=0,003, p=0,024, p=0,019 e p=0,002, respectivamente; tabela 2).
Parâmetros inflamatórios de acordo com a gravidade da psoríase
| Psoríase leve (PASI ≤ 10) (n=50) | Psoríase moderada‐grave (PASI> 10) (n=44) | Controles (n=118) | p | |
|---|---|---|---|---|
| Idade (anos) | 38,28±12,48 | 37,36±10,99 | 36,21±11,98 | 0,378 |
| PCR | 3 (2,87–4,17)a | 3,5 (3,3–5)b | 3 (1,37–3,44)a | 0,001 |
| RMLAD | 0,01 (0,01–0,01)a | 0,01 (0,01–0,02)b | 0,01 (0,01–0,01)a | 0,003 |
| RNL | 1,94 (1,59–2,18) | 2,02 (1,69–2,86)b | 1,77 (1,31–2,43)a | 0,024 |
| RPL | 101,71 (85,15–119,06)a | 125,22 (99,34–159,6)b | 110,79 (90,61–141,5) | 0,019 |
| RML | 0,22 (0,17–0,26) | 0,27 (0,19–0,35)b | 0,2 (0,15–0,25)a | 0,002 |
Teste de Kruskal‐Wallis, com testes post hoc de Dunn‐Bonferroni, descritos como mediana (primeiro quartil, terceiro quartil).
a,b Letras iguais não apresentaram diferença no teste de Dunn, considerando‐se um nível de significância de 5%.
PCR, proteína C reativa; RMLAD, razão monócitos/lipoproteínas de alta densidade; RNL, razão neutrófilos/linfócitos; RPL, razão plaquetas/linfócitos; RML, razão monócitos/linfócitos.
Foram observadas correlações positivas entre o escore PASI e os valores de PCR, RMLAD, RNL, RPL e RML (r=0,381, p=0,001; r=0,203, p=0,045; r=0,268, p=0,009; r=0,374, p=0,001; r=0,294, p=0,004; respectivamente).
Observou‐se uma correlação positiva entre os valores de PCR e RMLAD (r=0,273, p=0,001). Os valores de MHR e NLR apresentaram correlação positiva entre os valores de PCR e RMLAD (r=0,163, p=0,018), enquanto uma correlação negativa foi observada entre os valores de RMLAD e RPL (r=−0,161, p=0,019). Foi observada correlação positiva entre os valores de RNL e RPL (r=0,461, p=0,001). Nenhuma outra relação estatisticamente significativa foi observada entre os parâmetros (entre PCR e RNL, p=0,243; PCR e RPL, p=0,116).
Não foram encontradas correlações entre os valores de PCR, RMLAD, RNL, RPL e RML e duração da doença (p=0,164, p=0,056, p=0,190, p=0,584, p=0,091, respectivamente).
DiscussãoNeste estudo, foram observados níveis elevados de PCR, RMLAD, RNL e RML e uma correlação positiva entre a gravidade da doença e os valores de PCR, RMLAD, RNL, RPL e RML. Curiosamente, a PCR, um conhecido biomarcador de inflamação, só foi correlacionada com a RMLAD. A psoríase é uma doença dermatológica inflamatória crônica, mediada imunologicamente, associada a comorbidades cardiovasculares. Muitas células inflamatórias e citocinas estão envolvidas na patogênese da doença.1,2 Fator de necrose tumoral (TNF)‐α, interferon (IFN)‐α, IFN‐g, interleucina (IL)‐1β, IL‐6, IL‐12, IL‐17A, IL‐17F, IL‐22 e IL‐ 23 de várias células imunes, principalmente as células T auxiliares tipo 1 (Th1) e tipo 17 (Th17), também contribuem para a fisiopatologia da psoríase, bem como queratinócitos, outras células T e células dendríticas.13 Avaliações histológicas de lesões psoriásicas observaram infiltração de linfócitos T e neutrófilos em lesões psoriásicas.6 Além disso, alguns relatos demonstraram aumento da contagem de neutrófilos, monócitos e linfócitos no sangue periférico de pacientes com psoríase.13 Também foi demonstrado que as plaquetas desempenham um papel nas reações inflamatórias imunológicas.14
Recentemente, estudos observaram uma associação entre psoríase e indicadores de DCV subclínica, como maior espessura da íntima‐média da artéria carótida, maior calcificação da artéria coronária, maior rigidez arterial e disfunção endotelial.15 Além disso, foi sugerido que a melhoria na gravidade da psoríase está relacionada a reduções na inflamação vascular.16 Aterosclerose, o processo patológico subjacente às doenças cardiovasculares, e psoríase compartilham características patogênicas comuns, inclusive processos imunológicos locais e sistêmicos, perfis inflamatórios de citocinas/quimiocinas e marcadores inflamatórios.2 As principais causas relatadas de morbimortalidade de pacientes com psoríase foram eventos cardiovasculares,15 o que torna ainda mais importante encontrar uma ferramenta apropriada para avaliar o risco cardiovascular em pacientes com psoríase.
A PCR, uma proteína de fase aguda, é produzida sob a influência de citocinas como IL‐6 e TNF‐α. Foi relatado que a concentração elevada de PCR está relacionada ao aumento do risco de DCV.17 Em vários estudos, um nível mais alto de PCR foi demonstrado na psoríase, como uma condição inflamatória.3 Coimbra et al.18 evidenciaram uma correlação positiva entre PCR e PASI e sugeriram que níveis elevados de PCR podem ser um preditor de futuras DCV. Outros estudos não observaram uma correlação significativa entre PCR e PASI.19 No presente estudo, os níveis de PCR também foram mais altos em pacientes com psoríase e associaram‐se ao escore PASI.
Pacientes com psoríase podem apresentar fatores de risco para DCV, inclusive diminuição dos níveis de HDL‐C, que podem estar relacionados à gravidade da psoríase.20 Foi demonstrado que o HDL‐C suprime os efeitos pró‐oxidantes e pró‐inflamatórios dos monócitos. O HDL‐C também inibe a proliferação e diferenciação de células progenitoras de monócitos, resulta em uma redução na atividade desses.21 Os monócitos desempenham um papel importante na progressão da aterosclerose por meio da interação com o endotélio ativado, o que resulta na superexpressão de citocinas inflamatórias, inclusive o ligante quimiotático da proteína 1 dos monócitos, a molécula de adesão celular vascular 1 e a molécula de adesão intercelular 1. Posteriormente, os macrófagos diferenciados dos monócitos ingerem LDL‐C oxidado, causam assim o surgimento das células espumosas iniciais.22 No entanto, as moléculas de HDL‐C removem resíduos de colesterol dos macrófagos. Pelas interações com monócitos, as moléculas de HDL‐C apresentam efeitos anti‐inflamatórios e antioxidantes.23 Portanto, foi sugerido que o aumento dos monócitos e a diminuição do HDL‐C estão relacionados à inflamação. Recentemente, demonstrou‐se que a RMLAD é um marcador inflamatório e um novo fator preditivo e prognóstico para DCV.4,21 Kanbay et al.24 demonstraram que a RMLAD mais alta está associada a um mau prognóstico cardiovascular na doença renal e a RMLAD foi relatada como preditora de fibrilação atrial após ablação por cateter em outro estudo.6 Açıkgöz et al.23 relataram que a RMLAD está associada à disfunção endotelial na doença de Behçet (DB) e sugeriram que essa razão pode ser usada como marcador de inflamação, bem como um preditor precoce de comprometimento vascular em pacientes com DB. Alguns estudos relataram valores mais altos de HDL‐C em pacientes com psoríase.25 No entanto, nenhum estudo até o momento investigou a RMLAD em pacientes com psoríase. O presente estudo observou uma maior RMLAD em pacientes com psoríase em comparação com os controles; uma correlação positiva foi observada entre a RMLAD e o escore PASI. Além disso, a correlação positiva observada entre a PCR e a RMLAD leva à sugestão de que a RMLAD possa ser um marcador de inflamação sistêmica na psoríase.
RNL, RPL e RML foram identificados como indicadores de inflamação sistêmica e mau prognóstico em várias doenças, como câncer, DCV e doenças inflamatórias autoimunes.5–7 Essas proporções são mais estáveis do que o hemograma e são menos afetadas por condições que alteram esse exame.6
Anteriormente, RNL, RPL e RML foram estudados em diabetes mellitus, síndrome coronariana aguda, colite ulcerativa, doença renal terminal, tuberculose, artrite reumatoide, cirrose, inflamação sistêmica, febre familiar do Mediterrâneo e em alguns tipos de câncer para determinar prognósticos.7,26–28
Alguns estudos avaliaram RNL e RPL em pacientes com psoríase, apresentaram resultados variados. A literatura relata níveis de RNL previamente aumentados em pacientes com psoríase9–12 e alguns relatos mostraram uma correlação positiva entre PASI e RNL,9,10 o que é consistente com os achados do presente estudo. No entanto, no estudo feito por Ataseven et al.11 não foi observada associação entre RNL e o escore PASI. No presente estudo, a RNL foi elevada na psoríase e associada aos escores do PASI.
Foi relatada uma associação entre aumento da ativação plaquetária e aterosclerose14; alguns estudos demonstraram uma elevação significativa da RPL em pacientes com psoríase.12 Kim et al.9 observaram uma relação significativa entre o escore PASI e a RPL, enquanto os valores da RPL não apresentaram diferenças estatisticamente significativas entre os pacientes com psoríase e os controles. Da mesma maneira, o presente estudo não encontrou diferença significativa nos valores de RPL entre pacientes com psoríase e controles, mas foi observada uma correlação positiva entre RPL e PASI.
Atualmente, a RML tem sido apontada como um indicador de inflamação sistêmica e um marcador de gravidade de muitas doenças, como DB, câncer e espondiloartrite axial.29,30 Na literatura, não foram observados estudos que avaliassem a RML em pacientes com psoríase. Entretanto, o presente estudo encontrou níveis mais altos de RML em pacientes com psoríase do que em controles e uma correlação positiva entre RML e PASI.
Os diferentes resultados nos parâmetros relatados na literatura podem ser devidos ao pequeno número de sujeitos incluídos nos estudos ou a outros fatores dos pacientes, como o tipo de psoríase e o método de seleção dos pacientes. Fatores relacionados à genética, estilo de vida, atividades diárias e questões alimentares também podem ter contribuído para esses achados diferentes.
No presente estudo, PCR, RMLAD, RNL e RML foram maiores em pacientes com psoríase do que nos controles. Todos os parâmetros estudados (PCR, RMLAD, RNL, RPL e RML) estavam positivamente correlacionados com os escores do PASI, o que leva à sugestão de que esses parâmetros possam ser usados durante o acompanhamento da psoríase. Além disso, apenas a RMLAD apresentou correlação positiva com a PCR. Como a PCR é um marcador bem aceito de inflamação, pode‐se sugerir que, entre os parâmetros estudados, a RMLAD tende a ser mais confiável na indicação do estado inflamatório da psoríase.
Além de indicar inflamação atual, a PCR, a RNL e a RPL foram reduzidas após o tratamento da psoríase com agentes biológicos, o que está relacionado à inibição da inflamação sistêmica.6 Com base nesses dados, pode‐se supor que esses parâmetros não apenas confirmem a inflamação atual, mas também sejam uma maneira de avaliar o efeito do tratamento da psoríase.
Como PCR, RMLAD, RNL, RPL e RML foram definidos como marcadores prognósticos de DCV, valores elevados desses parâmetros podem atuar como um alerta na detecção e prevenção de comorbidades cardiovasculares.
O pequeno tamanho da amostra e o desenho retrospectivo são limitações do presente estudo. Os diferentes resultados relatados na literatura podem ser devidos à natureza subjetiva da avaliação com PASI e ao fato de que os estudos podem ter incluído diferentes formas de psoríase. Apesar do pequeno tamanho amostral deste estudo, os autores acreditam que a análise estatística revela conclusões importantes.
ConclusãoA psoríase é uma doença inflamatória sistêmica associada a morbidades cardiovasculares. Nos últimos anos, os pesquisadores investigaram biomarcadores laboratoriais em pacientes com psoríase, além do exame clínico pelo PASI. Várias citocinas e mediadores, cuja análise é dispendiosa e demorada, foram determinados na psoríase. Tanto quanto é do conhecimento dos autores, este é o primeiro estudo que avaliou PCR, RMLAD, RNL, RPL e RML em conjunto em pacientes com psoríase. No presente estudo, PCR, RMLAD, RNL e RML estavam elevados e estavam correlacionados com o PASI. Pode‐se supor que, dentre as diferentes razões estudadas, a RMLAD possa ser a mais importante, pois é o único marcador correlacionado com a PCR, o que pode ser devido às muitas funções do HDL‐C, inclusive antioxidante, anti‐inflamatória, antiapoptótica e antitrombótica.31 Acredita‐se que RMLAD, RNL e RML, facilmente acessíveis na prática diária, possam ser usadas para avaliar a gravidade da psoríase em conjunto com o PASI. Esses parâmetros também podem levar à detecção precoce de comorbidades cardiovasculares em pacientes com psoríase.
Suporte financeiroNenhum.
Contribuição dos autoresEzgi Aktaş Karabay: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; composição do manuscrito; concepção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Damla Demir: Aprovação da versão final do manuscrito; concepção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Aslı Aksu Çerman: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Aktaş Karabay E, Demir D, Aksu Çerman A. Evaluation of monocyte to high‐density lipoprotein ratio, lymphocytes, monocytes and platelets in psoriasis. An Bras Dermatol. 2020;95:405.
Trabalho realizado no Departamento de Dermatologia e Venereologia, Faculdade de Medicina, Bahçeşehir University, Istambul, Turquia.