Culturas organoides são cultivos primários que mantêm características arquiteturais, relações entre as células e matriz extracelular. São opções para investigação fisiopatológica ou terapêutica, comparados aos ensaios animais e in vitro.
ObjetivoDesenvolvimento de modelo de cultura organoide cutânea, com vistas ao estudo da melanogênese induzida por radiações.
MétodoEstudo de validação, que envolveu biópsias da pele retroauricular de adultos. Uma amostra foi irradiada com diferentes doses de UVB, UVA ou luz visível e a outra, mantida ao abrigo da luz por 72 horas. A viabilidade dos tecidos foi avaliada a partir de parâmetros morfológicos e arquiteturais da histologia e a expressão do gene GAPDH, por PCR em tempo real. A pigmentação melânica induzida pelas radiações foi padronizada em função das doses de cada radiação e avaliada por análise de imagem digital (Fontana‐Masson).
ResultadosPadronizou‐se a cultura primária de pele em temperatura ambiente, com meio DMEM. As doses de UVB, UVA e LV (luz azul) que induziram melanogênese diferencial foram: 166 mJ/cm2, 1,524J/cm2 e 40J/cm2. A expressão do gene constitucional GAPHD não diferiu entre a amostra de pele processada imediatamente após a coleta do tecido e a amostra cultivada por 72 horas no protocolo padronizado.
Limitações do estudoEstudo preliminar que avaliou apenas a viabilidade e integridade do sistema melanogênico e o efeito das radiações isoladamente.
ConclusõesO modelo padronizado manteve viável a função melanocítica por 72 horas sob temperatura ambiente, tornou possível a investigação da melanogênese induzida por diferentes radiações.
A investigação fisiopatológica e de respostas terapêuticas de certas dermatoses, in anima nobile, pode ser limitada por elementos ligados à toxicidade de tratamentos, necessidade de diferentes grupos comparativos, aspectos ligados à adesão em ensaios terapêuticos, além da incerteza quanto à resposta biológica de uma intervenção (p.ex., carcinogênese).
A experimentação animal aumenta a extensão de possibilidades de pesquisa pelo menor custo, maior acessibilidade aos sujeitos e maior controle de exposição e influência ambiental.1 Entretanto, as respostas fisiológicas dos animais podem não se assemelhar aos humanos (p.ex., melanogênese), o que pode levar a conclusões equivocadas.2 Além disso, uma série de doenças cutâneas não tem modelos animais (p.ex., melasma), leva à necessidade de outros processos investigativos.
As simulações computacionais de fenômenos biológicos são uma opção à experimentação com seres vivos e fornecem resultados bastante verossímeis quando simulam interações entre variáveis amplamente conhecidas do ponto de vista experimental. Infelizmente, as variáveis que interferem em processos cutâneos (p.ex., melanogênese) ainda não são completamente elucidadas, assim como sua interação com os demais elementos externos.3
Culturas celulares humanas primárias ou de linhagens comerciais (p.ex., HaCaT) são amplamente usadas em pesquisa fisiopatológica ou de resposta a estímulos específicos. Apesar da homologia com os tecidos humanos, as culturas de linhagens celulares não contemplam a interação entre os diferentes tipos celulares que interagem na pele (p.ex., unidade epidermo‐melânica).4
Sistemas comerciais de culturas celulares múltiplas (p.ex., pele 3D: queratinócitos, melanócitos e fibroblastos) são propagados como uma solução para perceber a interação entre as células da pele e são mais propensos a estar relacionados à estrutura tecidual do hospedeiro.5–7 Entretanto, as linhagens são usualmente de doadores diferentes, com padrões de reprodução algo diverso do que se encontra no tecido; também não apresentam endotélio, células dendríticas, células de Merkel, que, mesmo pouco numerosas no tecido, podem oferecer alguma interação relevante, depende do fenômeno estudado. Além disso, até o momento, culturas 3D e coculturas celulares comerciais de pele ainda não caracterizam certas doenças.7–9
As culturas organoides são cultivos teciduais primários que mantêm as características arquiteturais e as principais relações entre os diferentes tipos celulares, além da matriz extracelular.10–12 Apresentam a vantagem adicional de poder ser amostrados a partir da pele sã e da pele com doença do mesmo hospedeiro, favorecem a comparação ex vivo entre os locais.13,14 A pele é um tecido relativamente viável à cultura organoide, com descrição de manutenção funcional por mais de sete dias à temperatura ambiente.12,15–19
A melanogênese é um processo complexo, que depende principalmente da ação da radiação ultravioleta (UVA e UVB) sobre a unidade epidermo‐melânica, com importante regulação parácrina, mas que também sofre interferência de elementos da derme.20,21 A luz visível (LV) foi descrita como promotora de melanogênese em fototipos elevados e a fração mais biologicamente ativa da LV na pele compreende a faixa azul‐violeta (400‐500 nm).22
Neste estudo, objetivamos o desenvolvimento de um modelo de cultura organoide a partir de um fragmento de pele com vistas ao estudo da melanogênese induzida por diferentes radiações.
MétodosO projeto foi aprovado no comitê de ética em pesquisa da instituição (n° 2.700.889) e todos os participantes preencheram o termo de consentimento antes da inclusão no estudo.
Foram incluídos 10 voluntários adultos (> 18 anos) atendidos no Hospital das Clínicas da Faculdade de Medicina de Botucatu (SP), que se submeteram a biópsias da região retroauricular com punch de 3mm, sob anestesia local (lidocaína 2%), após antissepsia com clorexidina alcoólico (2%) e campo estéril. Os fragmentos foram seccionados no nível da derme profunda para evitar grande quantidade de adipócitos que interferem na completa submersão do fragmento no meio de cultura.
Os fragmentos cilíndricos foram divididos longitudinalmente em duas partes (semicilindros) equivalentes e armazenadas em meio específico DMEM (Dulbecco's Modified Eagle's medium, Sigma Inc, UK),23 em frasco plástico transparente estéril, segundo protocolo estabelecido por Ayres, para cultura organoide (padronização de viabilidade) em temperatura ambiente (20°C), para posterior dosimetria das radiações para melanogênese.24 Um fragmento foi irradiado (imediatamente após a coleta) e o outro, mantido ao abrigo da luz por 72 horas.
Os fragmentos foram irradiados com doses crescentes de UVA, UVB e LV a partir de fontes artificiais de UVB (230μW/cm2; fonte FS72T12/UVB/HO), UVA (1270μW/cm2; fonte Phillips TL 100 W/10R) e luz LED (110 mW/cm2 na faixa azul‐violeta; fonte GBRLUX 200W), com distância padronizada de 10 cm. As radiações foram iniciadas como 166mJ/cm2, 1,270J/cm2 e 40J/cm2 e acrescidos 20% de radiação cada amostra consecutiva, até identificar pigmentação diferencial. Foi determinada a absorbância da parede dos frascos plásticos para cada radiação. Um volume de 10mL do meio de cultura foi estabelecido para garantir a submersão do fragmento.
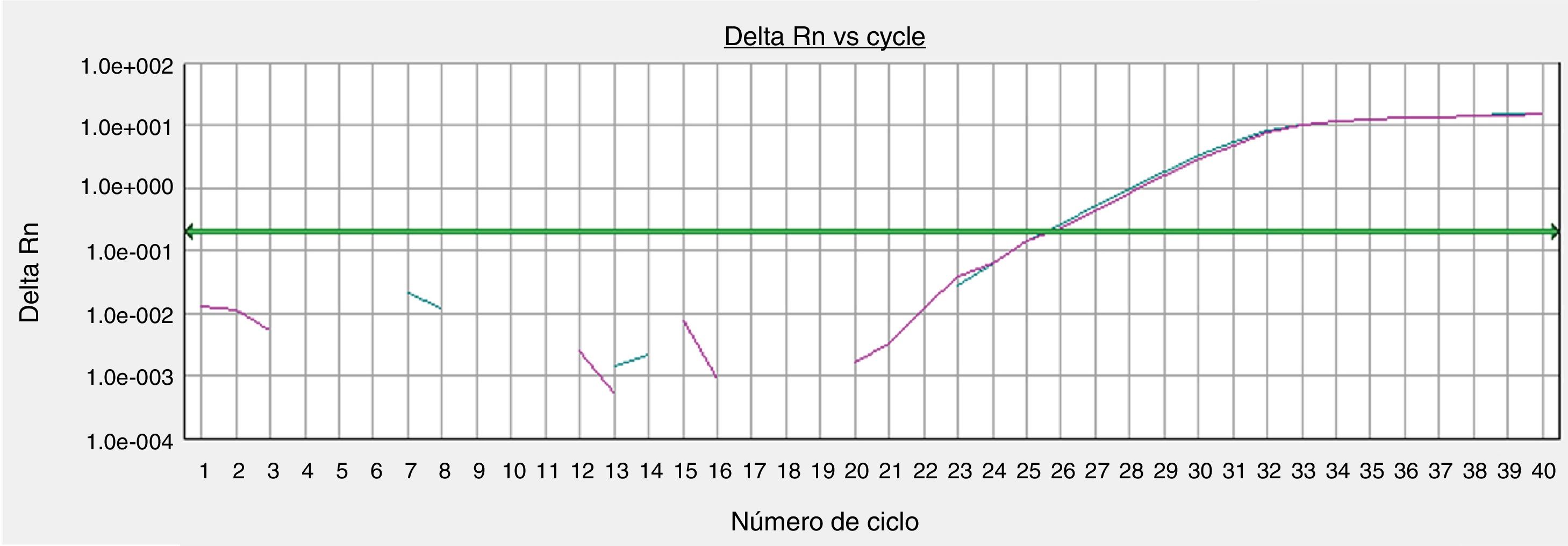
A viabilidade dos tecidos foi avaliada a partir de parâmetros morfológicos e arquiteturais da histologia (H&E) e a expressão quantitativa do gene constitucional GAPDH (glyceraldehyde‐3‐phosphate dehydrogenase) nas peles recém‐coletadas, versus as cultivadas em 72 horas, por PCR em tempo real. O gene GAPHD codifica uma proteína elementar para a execução de funções celulares básicas (p.ex., metabolismo energético), usada comumente como controle positivo em reações de PCR em tempo real, e representa a manutenção das funções metabólicas basais da célula.
A quantificação do PCR em tempo real foi feita a partir da amplificação do gene‐alvo GAPDH por primer e sonda validados TaqMan. Alíquotas do cDNA (3μL) extraído das amostras cutâneas foram submetidas à reação do PCR com o sistema TaqMan. Cada reação usou 15μL do TaqMan Gene Expression Master mix (Life Technologies, Carlsbad, CA, USA) e 1,0 a 1,5μL do conjunto de primers. A amplificação foi feita em um equipamento ABI7300 (Applied Biosystems, Carlsbad, CA, USA) com parâmetros padronizados pelo fabricante. Os dados foram processados pelo SDS Software System 7300 e os resultados expressos como ciclo limiar (Ct) para determinar a expressão do cDNA do GAPHD a partir do número de ciclos necessários para atingir o limite de detecção do sinal fluorescente, que foi predefinido entre 0,2 e 0,3.
A pigmentação melânica induzida pelas radiações foi padronizada em função das doses de cada radiação em função do aumento de mais de 10% da pigmentação da camada basal, avaliada por análise de imagem digital das lâminas coradas pelo Fontana‐Masson.25 A padronização foi concluída quando esses critérios fossem atingidos e reproduzidos.
ResultadosPadronizou‐se a cultura primária de pele em temperatura ambiente com meio DMEM. As doses de UVB, UVA e LV que induziram melanogênese diferencial foram: 166mJ/cm2, 1,524J/cm2 e 40J/cm2 (componente luz azul‐violeta). A absorbância dos frascos plásticos foi de cerca de 50% para todas as radiações.
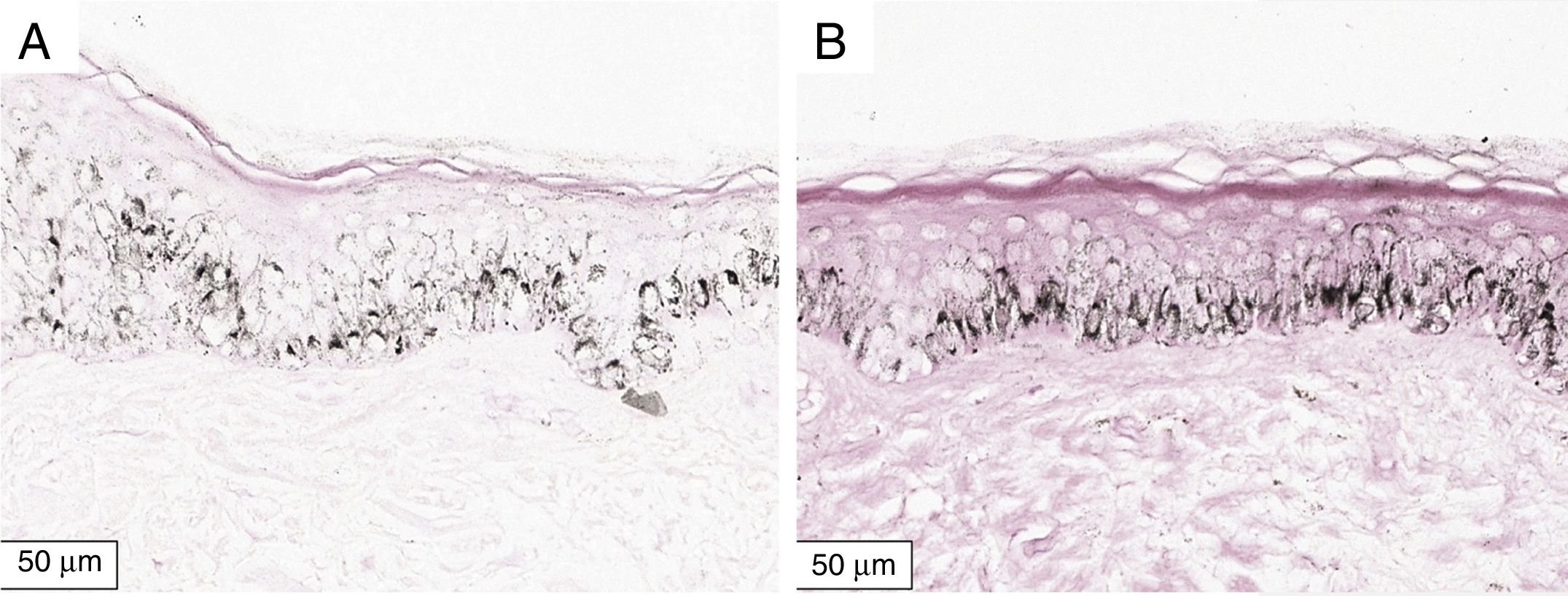
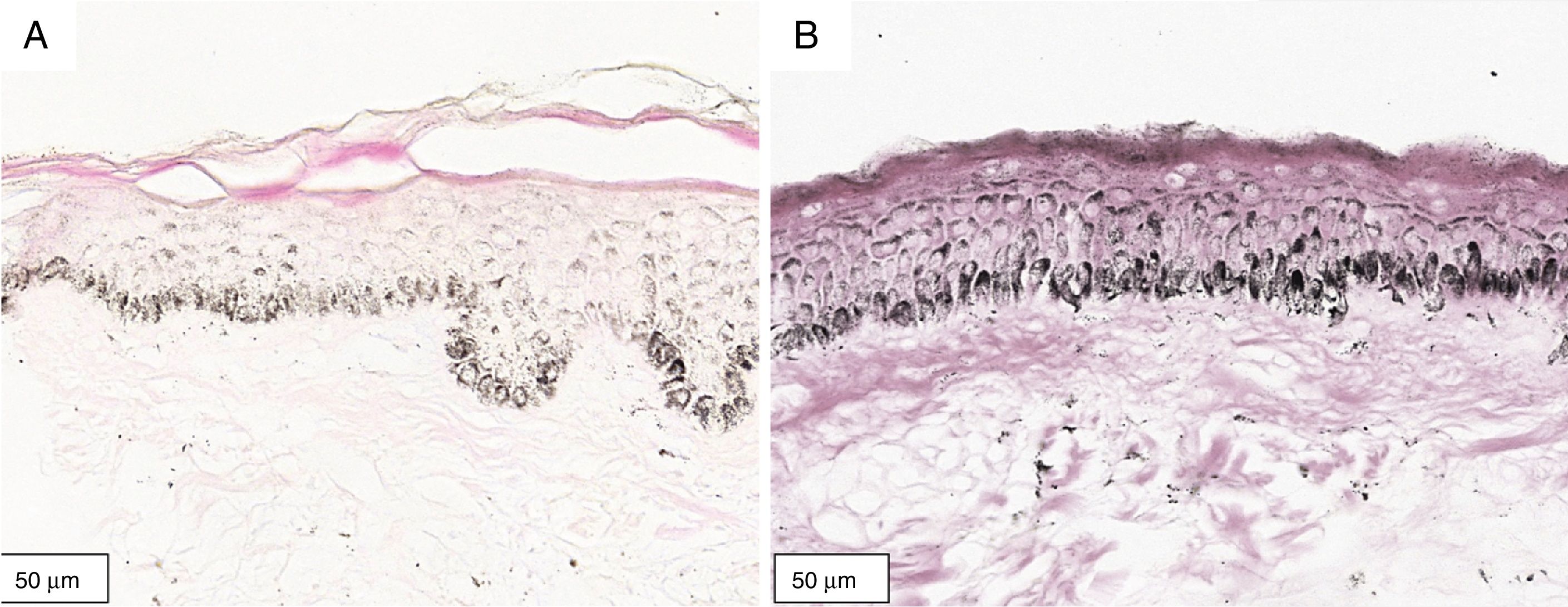
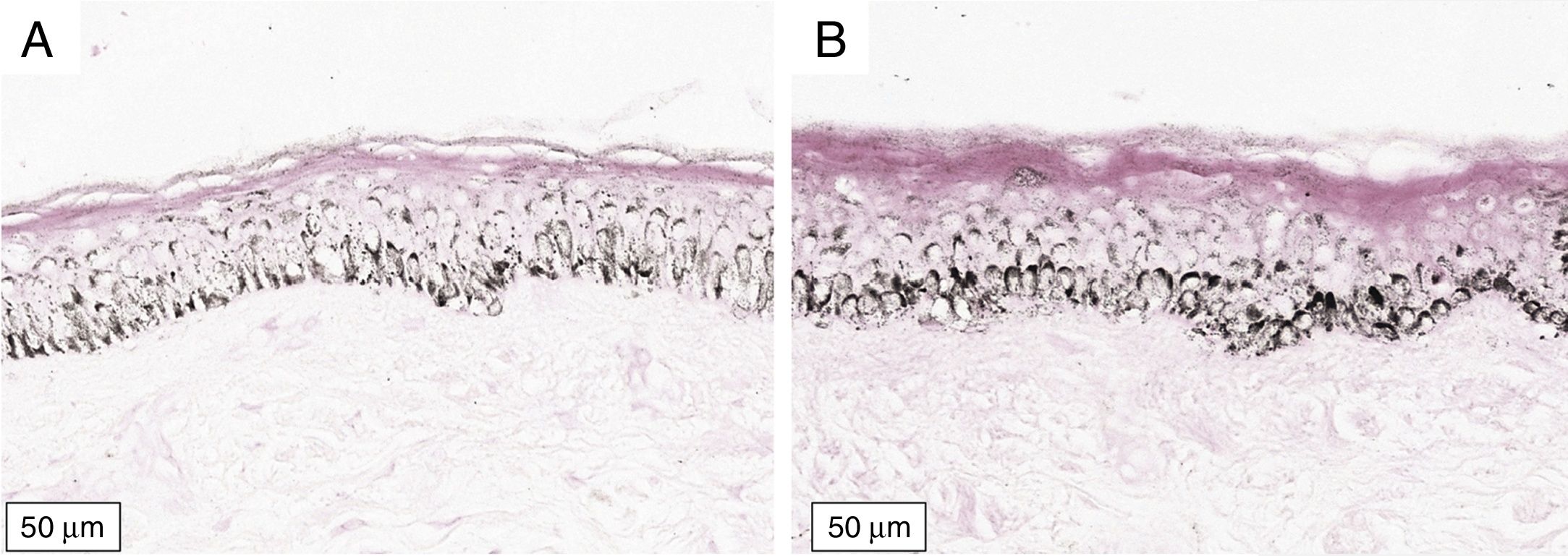
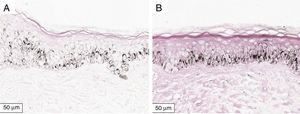
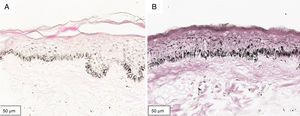
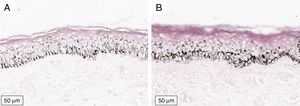
A melanogênese da camada basal pôde ser percebida pela coloração de Fontana‐Masson após 72 horas de cultura (figs. 1‐3).
No protocolo validado não foram observados destacamentos epidérmicos, picnose ou necrose de queratinócitos. Uma das culturas apresentou contaminação após 72 horas e foi descartada, total de nove pacientes para a padronização.
A expressão do gene constitucional GAPHD foi equivalente entre a amostra de pele processada imediatamente após a coleta do tecido e a amostra cultivada por 72 horas no protocolo padronizado (fig. 4).
DiscussãoO presente estudo valida uma opção reprodutível de baixo custo para cultura organoide da pele para o estudo da melanogênese. O modelo padronizado manteve viável a função melanocítica por 72 horas sob temperatura ambiente, permite a investigação da melanogênese induzida por diferentes radiações. Abundância tecidual da pele, fácil acessibilidade à coleta de material, manutenção arquitetural e funcional incentivam o uso de culturas cutâneas organoides na pesquisa dermatológica.6,15,18,25,26
Culturas de melanócitos são usadas para estudo de inibidores da melanogênese. Entretanto, em monoculturas, melanócitos irradiados sintetizam mais feomelanina do que eumelanina, que depende da interação com queratinócitos. A investigação de fenômenos ligados à eumelanogênese é favorecida, portanto, por modelos organoides que mantenham a influência de diferentes grupos celulares.24,27
Culturas organoides cutâneas que usam meios ar‐líquido são mais empregadas no estudo da queratinização, enquanto culturas em suspensão (como a usada neste estudo) permitem melhor perfusão e viabilidade.12
Fragmentos de menor dimensão (p.ex., 2 mm2) tendem a apresentar maior viabilidade e preservação arquitetural, devido à embebição mais homogênea pelo meio de cultura e distribuição de oxigênio ao tecido.19,26 Em nosso estudo, os fragmentos de 3mm foram seccionados ao meio, com adequada preservação da função. Um dos fragmentos que foi inadvertidamente cultivado sem a secção longitudinal apresentou evidente picnose nuclear no centro da peça (caso não incluído no estudo, dados não mostrados).
Modernos meios de conservação e transporte de tecidos fornecem subsídio para a formação de bancos de pele e também ao desenvolvimento de culturas organoides para a padronização de experimentos.28–31 O emprego de soro bovino aumenta o potencial de viabilidade das culturas, porém compromete a arquitetura do tecido em função do tempo.12 O cultivo em temperatura corporal (37°C) também aumenta a viabilidade do tecido, assim como sua taxa metabólica, potencializa a exploração de fenômenos oxidativos e mitogênicos como os envolvidos na carcinogênese.
Culturas organoides são mantidas fora da interação com o organismo, sem estímulos térmicos, neurológicos, hormonais, imunitários e sofrem hipóxia, o que penitencia suas propriedades teciduais em função do tempo.12,32 Os desafios e estímulos aos fragmentos devem ser impostos precocemente a fim de preservar as respostas de maneira mais verossímil.
A melanogênese da camada basal oriunda do estímulo precoce pôde ser percebida de maneira evidente no modelo proposto. A análise digital da melanogênese basal aumenta a sensibilidade da percepção do fenômeno. Curvas de dose‐resposta para cada tipo de radiação (isoladas ou em combinação) devem ser exploradas posteriormente, assim como a resposta melanogênica no melasma.
Uma limitação adicional ao uso de fragmentos de pele total para estudos genômicos acontece pela heterogeneidade das células presentes na amostra e o aumento da expressão de um gene não pode ser atribuído a um único tipo celular. Para isso, culturas primárias de células, single‐cell, ou técnicas de microdissecção a laser podem ser usadas.33
Culturas organoides cutâneas são mais disponíveis e de menor custo que culturas 3D, apresentam maior complexidade arquitetural, contemplam a totalidade de células residentes (p.ex., endotélio, nervos, mastócitos) e matriz extracelular, podem representar mais adequadamente diferenças topográficas, permitem de maneira semelhante manipulação genética e metabólica, assim como o isolamento celular, e podem ser oriundas primariamente da dermatose, com possibilidade de comparação com a pele normal do mesmo indivíduo. Por outro lado, apresentam cinética menos previsível e não podem ser constituídas a partir de engenharia genética (p.ex., CRISPR, knock‐out genes). Ambas as formas de cultura têm limitação experimental em função do tempo e não mantêm o microbioma cutâneo.12 Essas características devem ser ponderadas na escolha de modelos experimentais, que devem ser adequadamente padronizados e validados para cada intervenção.
A irradiação da luz solar, ao meio dia, no interior do Brasil (latitude: 22°53’09“S; longitude: 48°26’42”W; altitude: 804 m; dia 09‐dez‐2018), foi de 0,5 mW/cm2 (UVB), 1,7 mW/cm2 (UVA) e 0,2W/cm2 (luz azul‐violeta). Isso leva à hipótese de que menos de 15 minutos de exposição solar desprotegida potencialmente induziriam a pigmentação da camada basal, guardadas as limitações da comparação com as radiações independentes, enquanto o efeito das radiações combinadas, ou com diferentes regimes de fotoproteção, podem apresentar comportamentos diferentes.
Estudos experimentais in vivo resultaram em pigmentação cutânea efetiva a partir de 40J/cm2 em indivíduos melanodérmicos (Fitzpatrick IV e V), mas não em fototipos claros. Já a pigmentação por UVA1 (340‐400nm) pôde ser percebida a partir de 5J/cm2 em participantes com fototipos mais escuros.34
Radiações solares representam um continuum de frequências eletromagnéticas que interagem com os tecidos biológicos e promovem estímulos diversos.35 Por razões de sistematização, os efeitos biológicos das radiações são estudados a partir de comprimentos de onda separados, porém há certa interação entre eles.36 No caso da pigmentação cutânea, a LV promove maior intensidade e persistência à pigmentação induzida pelo UVA1.22,37
As fontes de UVA, UVB e LV deste estudo promoveram irradiações independentes, já que não apresentaram leituras significativas dos outros comprimentos de onda (dados não mostrados). Isso pode ser relevante porque estudos clássicos de pigmentação, como o de Mahmoud et al., empregaram fontes de LV que emitiam 0,19% de UVA e 1,5% de infravermelho; assim como fontes de UVA1, que apresentavam 0,12% de UVA2 e 0,0001% de UVB.34 O efeito da heterogeneidade das radiações nos grupos dificulta sua comparação com resultados de fontes homogêneas.
ConclusãoFoi padronizado um modelo de cultura organoide para avaliação da melanogênese induzida por UVB, UVA e LV.
Suporte financeiroFundo de Apoio à Dermatologia de São Paulo (Funader‐SP).
Contribuição dos autoresThainá Oliveira Felicio Olivatti: Aprovação da versão final do manuscrito; concepção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Giovana Piteri Alcantara: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; concepção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura.
Ana Cláudia Cavalcante Espósito Lemos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; composição do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Márcia Guimarães da Silva: Composição do manuscrito; concepção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Hélio Amante Miot: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; composição do manuscrito; concepção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Olivatti TOF, Alcantara GP, Lemos ACCE, Silva MG, Miot HA. Standardization of organoid culture for evaluation of melanogenesis induced by UVB, UVA and visible light. An Bras Dermatol. 2020;95:46–51.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.