Vitiligo é doença autoimune sistêmica caracterizada por despigmentação cutânea, que acomete 0,57% da população brasileira e corresponde a 1,6% dos atendimentos dermatológicos no Brasil.1 Sua patogênese envolve predisposição genética, sensibilidade dos melanócitos ao estresse oxidativo, falhas na adesão intercelular nos melanócitos e ativação da resposta imunológica, o que justifica a maior frequência de doenças autoimunes concomitantes, como tireoidopatias, diabetes mellitus e lúpus eritematoso sistêmico.2
A proteína de choque térmico 70, ou heat shock protein 70 (Hsp70), é molécula chave na resposta imune inata do vitiligo, constituindo‐se uma chaperona intracelular, responsável pelo dobramento correto das proteínas no retículo endoplasmático e por impedir a agregação de proteínas mal dobradas. Ela existe naturalmente nos tecidos e pode ser induzida pelo estresse celular. Na fisiopatologia do vitiligo, após um gatilho inicial (radiação ultravioleta, trauma ou exposição a compostos fenólicos), o melanócito sofre processo de estresse oxidativo, que induz a síntese da Hsp70. A partir disso, Hsp70 é secretada para o meio extracelular levando à ativação de células dendríticas, que se transformam em células apresentadoras de antígenos, estas que ativam os linfócitos T, dando início à resposta imune adaptativa. Portanto, no vitiligo, a Hsp70 é considerada um elo entre as respostas imunes inata e adaptativa.3 Estudos em modelos animais demonstraram que Hsp70 não só é necessária como também suficiente para desencadear a despigmentação em camundongos predispostos a vitiligo.4
Enquanto os níveis teciduais da Hsp70 são aumentados no vitiligo em atividade, não há estudos que tenham investigado os níveis circulantes da proteína nesses pacientes.5
Conduziu‐se estudo transversal em Curitiba, PR (Brasil), entre novembro de 2020 a fevereiro de 2022, objetivando determinar os níveis plasmáticos de Hsp70 em adultos com vitiligo não segmentar não submetidos a imunossupressão, nem portadores de outras doenças reumatológicas, câncer ou doença inflamatória intestinal (DII), para não haver confundimento dos níveis de Hsp70 por mediadores inflamatórios. Coletaram‐se dados clínicos e amostras de sangue periférico dos participantes durante a consulta. Utilizou‐se o kit Hsp70 ELISA (ADI‐EKS‐700B, Enzo Life Sciences, New York, USA) para estimativa do Hsp70 circulante. Os valores obtidos foram comparados entre os subgrupos quanto à atividade da doença: estável (> 1 ano), progressão, e regressão (em repigmentação); assim como em relação à extensão clínica. A atividade da doença foi determinada por meio do relato do próprio paciente. A extensão da doença foi estimada pelo aplicativo “Vitiligo Calculator” (https://www.vitiligo‐calculator.com), o qual utiliza o instrumento VES (Vitiligo Extent Score) validado por van Geel et al. O VES baseia‐se em imagens padronizadas com diferentes graus de acometimento cutâneo, em 19 diferentes topografias. Numericamente, o VES pode variar de zero a 100, e apresenta alta correlação com o VASI.6
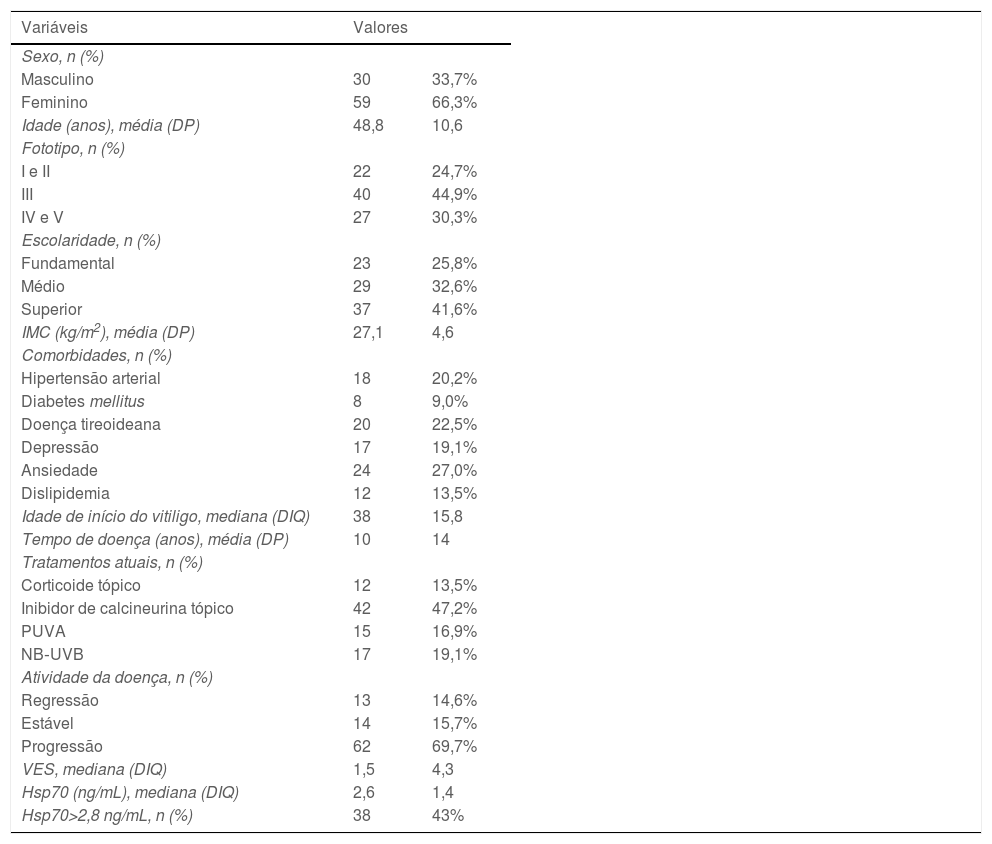
Foram incluídos no estudo 89 participantes; seus principais dados clínicos e demográficos estão dispostos na tabela 1. A maior parte dos indivíduos estava com a doença em progressão durante a inclusão, havendo ampla variabilidade da extensão clínica da doença (VES variou de 0,04 a 71,06), e dos níveis plasmáticos de Hsp70 (variaram de 1,82 a 27,8 ng/mL). Foi definido o valor de corte de Hsp70 como 2,8 ng/mL para comparação entre os subgrupos. Esse valor foi definido como a melhor separação entrópica entre os indivíduos com e sem atividade de doença, já que não há um padrão de normalidade na literatura, tanto na população geral quanto para portadores de vitiligo.
Principais dados clínicos e demográficos dos pacientes adultos com vitiligo não segmentar (n=89)
| Variáveis | Valores | |
|---|---|---|
| Sexo, n (%) | ||
| Masculino | 30 | 33,7% |
| Feminino | 59 | 66,3% |
| Idade (anos), média (DP) | 48,8 | 10,6 |
| Fototipo, n (%) | ||
| I e II | 22 | 24,7% |
| III | 40 | 44,9% |
| IV e V | 27 | 30,3% |
| Escolaridade, n (%) | ||
| Fundamental | 23 | 25,8% |
| Médio | 29 | 32,6% |
| Superior | 37 | 41,6% |
| IMC (kg/m2), média (DP) | 27,1 | 4,6 |
| Comorbidades, n (%) | ||
| Hipertensão arterial | 18 | 20,2% |
| Diabetes mellitus | 8 | 9,0% |
| Doença tireoideana | 20 | 22,5% |
| Depressão | 17 | 19,1% |
| Ansiedade | 24 | 27,0% |
| Dislipidemia | 12 | 13,5% |
| Idade de início do vitiligo, mediana (DIQ) | 38 | 15,8 |
| Tempo de doença (anos), média (DP) | 10 | 14 |
| Tratamentos atuais, n (%) | ||
| Corticoide tópico | 12 | 13,5% |
| Inibidor de calcineurina tópico | 42 | 47,2% |
| PUVA | 15 | 16,9% |
| NB‐UVB | 17 | 19,1% |
| Atividade da doença, n (%) | ||
| Regressão | 13 | 14,6% |
| Estável | 14 | 15,7% |
| Progressão | 62 | 69,7% |
| VES, mediana (DIQ) | 1,5 | 4,3 |
| Hsp70 (ng/mL), mediana (DIQ) | 2,6 | 1,4 |
| Hsp70>2,8 ng/mL, n (%) | 38 | 43% |
VES, Vitiligo Extent Score; IMC, índice de massa corporal; DP, desvio‐padrão; DIQ, desvio interquartílico; PUVA, psoraleno ultravioleta A; NB‐UVB, narrowband utravioleta B.
Não houve correlação direta entre os níveis de Hsp70 e VES (rho=0,08; p=0,461), assim como Hsp70 e tempo de doença, IMC, idade, fototipo (rho<0,16; p>0,1).
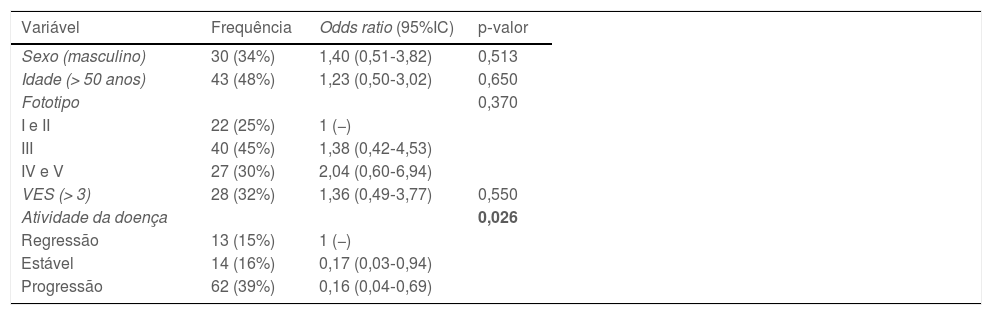
Quando considerado o valor de corte da normalidade para Hsp70 como 2,8 ng/mL, 76,9% dos vitiligos em regressão apresentaram valores alterados, enquanto isso ocorreu em apenas 35,7% dos estáveis e 37,1% dos em progressão (p=0,028). Esse comportamento se comprovou mesmo quando ajustado por sexo, idade, extensão da doença e fototipo (tabela 2).
Modelo logístico multivariado da associação entre valores plasmáticos elevados de Hsp70 (> 2,8 ng/mL) com dados clínicos e demográficos de pacientes adultos com vitiligo não segmentar (n=89)
| Variável | Frequência | Odds ratio (95%IC) | p‐valor |
|---|---|---|---|
| Sexo (masculino) | 30 (34%) | 1,40 (0,51‐3,82) | 0,513 |
| Idade (> 50 anos) | 43 (48%) | 1,23 (0,50‐3,02) | 0,650 |
| Fototipo | 0,370 | ||
| I e II | 22 (25%) | 1 (−) | |
| III | 40 (45%) | 1,38 (0,42‐4,53) | |
| IV e V | 27 (30%) | 2,04 (0,60‐6,94) | |
| VES (> 3) | 28 (32%) | 1,36 (0,49‐3,77) | 0,550 |
| Atividade da doença | 0,026 | ||
| Regressão | 13 (15%) | 1 (−) | |
| Estável | 14 (16%) | 0,17 (0,03‐0,94) | |
| Progressão | 62 (39%) | 0,16 (0,04‐0,69) |
VES, Vitiligo Extent Score; 95%IC, intervalo de confiança de 95%.
Valores alterados de Hsp70 não se associaram com as comorbidades avaliadas (p>0,40). Entre os tratamentos atuais, corticosteroides orais, metotrexato e PUVA não se associaram a Hsp70 (p>0,20); porém, os participantes sob fototerapia Nb‐UVB mostraram maior frequência de positividade para Hsp70: 71% vs. 36% (OR=4,2; 95%IC 1,3‐13,4; p=0,010).
Embora alguns estudos tenham demonstrado aumento da Hsp70 tecidual na pele lesional e perilesional de vitiligo em atividade, até o momento ainda não haviam sido avaliados os níveis plasmáticos dessa proteína nos portadores da doença, tampouco tentado correlacioná‐lo com a atividade da doença.5 Em nossa pesquisa, não encontramos correlação entre níveis plasmáticos de Hsp70 e extensão da doença; porém, a positividade do Hsp70 se associou às formas regressivas de vitiligo.
Esse achado sugere não haver alinhamento entre o comportamento da Hsp70 plasmática e sua expressão tecidual da Hsp70, limitando seu uso como marcador direto de gravidade da doença. De fato, outras dermatoses inflamatórias, como psoríase e dermatite atópica, também não apresentam forte correlação entre marcadores plasmáticos e extensão da doença. Até o momento, não há estudos em vitiligo no qual, em um mesmo indivíduo, tenha‐se dosado a Hsp70 plasmática e estimado a concentração de Hsp70 tecidual da pele afetada.
Deve‐se, porém, considerar que a Hsp70 possa desempenhar funções diferentes de acordo com a fase da doença. Por exemplo, na artrite reumatoide, diferentes estudos mostraram papéis contraditórios da Hsp70 – ou seja, tanto na promoção da inflamação, induzindo a produção de citocinas pró‐inflamatórias, quanto em sua modulação, estimulando a formação de células T reguladoras (Tregs) e interrompendo a atividade da doença.7 Nas DII, existem evidências de que a Hsp70 tenha sua expressão aumentada na mucosa intestinal, mas a maioria dos estudos aponta para um papel protetor, em que o aumento local da Hsp70 se associou à redução da atividade da doença, em modelos experimentais.8,9 Ademais, foi demonstrado papel importante da Hsp70 na supressão da resposta imunológica por meio da formação de células B reguladoras (Bregs), em um estudo experimental que utilizou modelos animais de tireoidite autoimune e DII.10
O modelo fisiopatológico do vitiligo é complexo. A disfunção das células Tregs é uma das vias de manutenção da autoimunidade no vitiligo. Porém, se existe algum papel das células Bregs no vitiligo e se a Hsp70 circulante participa dessa modulação, ainda não está elucidado.
Indivíduos em tratamento com Nb‐UVB apresentaram maior positividade de Hsp70. Além disso, quando utilizado o ponto de corte de 2,8 ng/mL, os níveis plasmáticos da Hsp70 se associaram ao vitiligo em regressão. É possível que a Hsp70 desempenhe diferentes papéis no vitiligo, dependendo da fase da doença, ou que a própria fototerapia Nb‐UVB induza o aumento dos níveis da Hsp70 circulantes. A associação entre a exposição UVB, níveis de vitamina D, estresse oxidativo induzido pela fototerapia e os níveis plasmáticos de Hsp70 devem ser explorados com desenhos adequados.
Este estudo apresenta limitações ligadas à falta da constatação da expressão da Hsp70 tecidual nos participantes. Investigações posteriores que explorem os níveis de Hsp70 plasmáticos e os mecanismos de tolerância imunológica em diferentes fases de atividade da doença são necessárias para esclarecer o papel da Hsp70 circulante no vitiligo.
Em conclusão, os níveis plasmáticos de Hsp70 não se correlacionaram diretamente com a extensão do vitiligo; entretanto, maior positividade foi identificada em participantes com formas regressivas da doença.
Aprovação pelo Comitê de ÉticaEste projeto foi aprovado pelo Comitê de Ética da Pontifícia Universidade Católica do Paraná (parecer número 4.333.389).
Suporte financeiroFUNADERM.
Contribuição dos autoresHelena Zenedin Marchioro: Concepção do estudo; coleta dos dados; análise dos resultados; escrita do texto; revisão e aprovação do texto final.
Caio César Silva de Castro: Concepção do estudo; análise dos resultados; escrita do texto; revisão e aprovação do texto final.
Isabella Gizzi Jiacomini: Coleta dos dados, análise dos resultados; revisão e aprovação final do texto.
Hélio Amante Miot: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; redação do artigo; revisão crítica de literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesHelena Zenedin Marchioro: Nenhum.
Caio César Silva de Castro: Ache – speaker, advisory board; Sun pharma – advisory board; Abbvie – advisory board; Pfizer – clinical trial.
Isabella Gizzi Jiacomini: Nenhum.
Hélio Amante Miot: Nenhum.
Como citar este artigo: Marchioro HZ, Castro CCS, Jiacomini IG, Miot HA. Association between clinical features and Hsp70 plasma levels in adults with non‐segmental vitiligo: a cross‐sectional study. An Bras Dermatol. 2023;98:373–5.
Trabalho realizado no Hospital Santa Casa de Misericórdia de Curitiba, Curitiba, PR, Brasil.