O lúpus eritematoso cutâneo é doença autoimune de expressão clínica variada, que pode apresentar‐se como doença exclusivamente cutânea ou ser uma das múltiplas manifestações do lúpus eritematoso sistêmico. Sua classificação engloba os subtipos agudo, subagudo, intermitente, crônico e bolhoso, que são usualmente identificados com base nas características clínicas e nos achados histopatológicos e laboratoriais. Outras manifestações cutâneas não específicas podem estar associadas ao lúpus eritematoso sistêmico e geralmente guardam relação com a atividade da doença. Fatores ambientais, genéticos e imunológicos participam da patogênese das lesões cutâneas do lúpus eritematoso. Recentemente, tem havido considerável progresso na elucidação dos mecanismos envolvidos no seu desenvolvimento, o que possibilita antever futuros alvos de tratamentos mais efetivos. Esta revisão se propõe a discutir os principais aspectos etiopatogênicos, clínicos, diagnósticos e terapêuticos do lúpus eritematoso cutâneo, visando à atualização de internistas e de especialistas de diferentes áreas.
O lúpus eritematoso (LE) é doença autoimune com amplo espectro de expressão clínica, que varia desde doença cutânea limitada até doença sistêmica grave e potencialmente fatal, por comprometimento de órgãos vitais.1 O LE cutâneo (LEC) apresenta‐se como doença cutânea exclusiva ou compõe uma das múltiplas manifestações do LE sistêmico (LES). Lesões cutâneas estão presentes em 70%‐80% dos casos de LES, em algum momento de sua evolução, e podem ser a manifestação inicial da doença em até 25% dos pacientes.1
Com base em características clínicas, achados histopatológicos, alterações laboratoriais e duração, as lesões cutâneas específicas do LE são subdivididas em três subtipos principais: o LEC agudo (LECA), o LEC subagudo (LECS) e o LEC crônico (LECC). A identificação desses subtipos é fundamental, porque eles costumam ocorrer em contextos clínicos distintos, com implicações diagnósticas, prognósticas e terapêuticas.2
O LEC exclusivo é 2‐3 vezes mais frequente que o LES, com incidência anual de 4,3/100.000 indivíduos na Europa e nos EUA.1–3 Há predominância de LE em mulheres, em que a incidência de LES adulto é 7‐15 vezes maior e de LES infantil, 3‐4 vezes maior. Essa preponderância feminina é menos evidente nas formas cutâneas isoladas de LE, com relação de 4:1, e é ainda menos expressiva, com relação de 3:1, no LE discoide (LED), forma mais comum de LECC.2,4
Há ainda diferenças raciais na ocorrência do LEC, com risco 5,4 vezes maior de LECC nos afro‐americanos em relação aos caucasianos.4 Na Nova Zelândia, quando comparados à população de origem europeia, os indígenas Maori mostram risco relativo de 2,47 para desenvolver todos os subtipos de LEC e 5,96 para LECC.5
O pico de incidência do LES acontece na meia‐idade adulta, porém mais tardiamente nos homens.6 Ainda que também acometa crianças e idosos, o LEC exclusivo é mais comum entre 20 e 40 anos, com idade média de instalação aos 43 anos, porém com variação conforme o subtipo.3
As lesões cutâneas do LE constituem considerável morbidade, sobretudo devido à natureza crônica, ao acometimento preferencial das partes expostas do corpo e caráter desfigurante de suas sequelas, que resultam em significante prejuízo da qualidade de vida dos pacientes.7
ClassificaçãoOs critérios diagnósticos para classificação do LES não são uniformes e universalmente aceitos; são precursores aqueles propostos em 1971 pelo American College of Rheumatology (ACR), revistos em 1997 (ACR 1997); posteriormente, surgiram mais dois sistemas de classificação – o da Systemic Lupus International Collaborating Clinics (SLICC 2012) e o conjunto entre a European League Against Rheumatism e o ACR (EULAR/ACR 2019), que estão discriminados e podem ser comparados na tabela 1.4,8,9 Cada um desses três sistemas contempla quatro achados dermatológicos como critérios diagnósticos do LES. Estudo australiano atual, que avaliou a performance dos diferentes critérios de classificação do LES, concluiu que o ACR 1997 detinha a maior especificidade, porém o SLICC 2012 era o que proporcionava a maior acurácia diagnóstica global (94,4%), com desempenho similar entre os pacientes com doença inicial.10
Critérios de classificação do lúpus eritematoso sistêmico – ACR 1997, SLICC 2012 e EULAR/ACR 2019
| ACR 19974 | SLICC 20128 | EULAR/ACR 20199 |
|---|---|---|
| Critério de entrada: nenhum | Critério de entrada: nenhum | Critério de entrada: FAN ≥ 1:80 |
| Critérios clínicos (= 9) | Critérios clínicos (= 11) | Critérios clínicos (pontos) |
| Erupção malar | LEC agudo, subagudo ou LE bolhoso | Constitucional |
| Erupção discoide | LEC crônico (inclui LEC túmido) | Febre (2) |
| Fotossensibilidade | Úlceras orais ou nasais | Hematológicos |
| Úlceras orais | Alopecia não cicatricial | Leucopenia (3) |
| Artrite não erosiva (≥ 2 articulações) | Sinovite (≥ 2 articulações) | Trombocitopenia (4) |
| Serosite | Serosite | Hemólise autoimune (4) |
| Pleurite | Pleurite | Neuropsiquiátricos |
| Pericardite | Pericardite | Delírio (2) |
| Derrame pleural ou pericárdico | Derrame pleural ou pericárdico | Psicose (3) |
| Acometimento renal | Doença renal | Convulsão (5) |
| Proteinúria> 0,5 g/24 horas | Proteinúria> 0,5 g/24 horas | Mucocutâneos |
| Cilindros celulares | Cilindros hemáticos | Alopecia não cicatricial (2) |
| Alterações neurológicas | Doença neurológica | Úlceras orais (2) |
| Convulsões | Convulsões | LEC subagudo ou LE (4) |
| Psicose | Psicose | LEC agudo (6) |
| Alterações hematológicas | Mononeurite múltipla | Serosite |
| Anemia hemolítica | Mielite | Derrame pleural ou pericárdico (5) |
| Leucopenia (< 4.000 mm3) | Neuropatia craniana ou periférica | Pericardite aguda (6) |
| Linfopenia (< 1.500 mm3) | Estado confusional agudo | Musculoesquelético |
| Trombocitopenia (< 100.000/mm3) | Alterações hematológicas | Acometimento articular (6) |
| Anemia hemolítica | ||
| Leucopenia (< 4.000 mm3) ou linfopenia (< 1.000 mm3)Trombocitopenia (< 100.000/mm3) | Renais | |
| Proteinúria> 0,5 g/24 horas (4) | ||
| Biópsia renal – nefrite lúpica | ||
| Classe II ou V (8) | ||
| Biópsia renal – nefrite lúpica | ||
| Classe III ou IV (10) | ||
| Critérios imunológicos (= 2) | Critérios imunológicos (= 6) | Critérios imunológicos (pontos) |
| FAN | FAN | Anticorpos antifosfolípides |
| Autoanticorpos | Anti‐DNAn | Anticardiolipina (2) |
| Anti‐DNAn | Anti‐Sm | Anti‐β2‐glicoproteína 1 (2) |
| Anti‐Sm | Anticorpo antifosfolípide | Anticoagulante lúpico (2) |
| Anticorpo antifosfolípide | Anticoagulante lúpico | Complemento |
| Teste não treponêmico falso‐positivo | C3 ou C4 baixo (3) | |
| Anticardiolipina | C3 e C4 baixos (4) | |
| Anti‐β2‐glicoproteína 1 | Anticorpos LES‐específicos | |
| Complemento baixo (C3, C4 ou CH50) | Anti‐DNAn (6) | |
| Coombs direto (na ausência de anemia hemolítica) | Anti‐Sm (6) |
ACR, American College of Rheumatology; EULAR, European League Against Rheumatism; SLICC, Systemic Lupus International Collaborating Clinics; FAN, fator antinúcleo; LEC, lúpus eritematoso cutâneo; LES, lúpus eritematoso sistêmico.
ACR 1997: LES ≥ 4 critérios.
SLICC 2012: LES ≥ 4 critérios, ao menos um clínico e um imunológico; quadro de nefrite lúpica comprovada por biópsia, com FAN ou anti‐DNAn, também pode ser classificado como LES.
EULAR/ACR 2019: LES = escore ≥ 10 pontos, ao menos um clínico (considera‐se somente o critério com a pontuação mais alta em cada domínio).
Os critérios dermatológicos estão destacados em negrito nos três sistemas de classificação.
Foi pioneira a classificação proposta por Gilliam & Sontheimer, em 1981, que discrimina as lesões cutâneas do LE entre específicas e inespecíficas. As específicas, definidas pela presença da dermatite de interface dermoepidérmica, são exclusivas do LE, com ou sem doença sistêmica. São subdivididas em três categorias, com base nas características clínicas: LECA, LECS e LECC. As lesões inespecíficas incluem as demais manifestações cutâneas associadas ao LES. Em 2004, a classificação de Düsseldorf acrescentou outro subtipo, o LEC intermitente (LECI), que corresponde ao LE túmido, anteriormente considerado variante de LECC.3
Algumas limitações das classificações anteriormente citadas podem ser destacadas: a) nem sempre as lesões de LEC podem ser classificadas como agudas, subagudas ou crônicas, com base na histologia; b) a dermatite de interface, utilizada como critério para definir as lesões específicas do LEC, na realidade, carece de especificidade, já que pode estar presente em outras condições, como dermatomiosite, doença do enxerto‐versus‐hospedeiro e reações medicamentosas; c) alguns subtipos incluídos como específicos, como o LE túmido e a paniculite lúpica, nem sempre apresentam dermatite de interface; d) termos como agudo, subagudo ou crônico, de natureza cronológica, são utilizados para definir variações morfológicas, além de serem associados a graus de extensão mal definidos, como localizado ou disseminado, referindo‐se à topografia. Por essas razões, em 2010, Lipsker propôs uma nova classificação das lesões cutâneas do LE, com base nas características clínicas e nos achados histológicos. As lesões cutâneas específicas, sem a presença obrigatória da dermatite de interface, são subdivididas em dermoepidérmicas, dérmicas e hipodérmicas. As lesões inespecíficas são subdivididas em trombóticas, neutrofílicas ou de natureza patogenética incerta.11
Na falta de classificação universalmente aceita, em 2013 foi constituída uma força‐tarefa, composta de especialistas no tema para propor uniformidade de critérios diagnósticos e classificação do LEC, por meio do método Delphi.12 Recentemente, foi apresentada a validação dos critérios de classificação do LED, forma mais comum de LEC, com base exclusivamente clínica. Foram incluídos os seguintes parâmetros, com pontuações distintas, referentes às lesões cutâneas: cicatriz atrófica (3 pontos), localização na concha auricular (2 pontos), preferência por cabeça e pescoço (2 pontos), discromia (1 ponto), ceratose folicular e tampões córneos (1 ponto), coloração eritematosa a violácea (1 ponto). Escore ≥ 5 garante sensibilidade de 84% e especificidade de 76% para classificação como LED, com maior especificidade quanto maior for a pontuação.13
EtiopatogêneseLES e LEC são doenças multifatoriais, em que está envolvida uma complexa interação entre carga genética e exposições ambientais, como radiação ultravioleta (RUV), fármacos, defensivos agrícolas e tabaco.14,15 Variações epigenéticas, como desregulação da expressão gênica, via metilação do DNA, ou modificações de histonas, causadas por esses fatores externos, podem ser o gatilho para a ativação das imunidades inata e adaptativa.4,14
Os estudos sobre os fatores genéticos envolvidos no LEC ainda são incipientes, se comparados aos descritos no LES.16 Apesar disso, polimorfismos genéticos, mutações e alelos de risco já foram identificados em diferentes populações de LEC, a maioria deles associados às vias das imunidades inata e adaptativa.1,14,17 Genes que atuam na apoptose, migração leucocitária, via do IFN tipo I, cascata do complemento, apresentação de antígenos e produção de anticorpos estão entre os mais frequentemente afetados.14,17 Os genes que codificam a produção de citocinas pró‐inflamatórias são os mais associados às vias da imunidade inata nas lesões de LEC.1 Como exemplos de associações descritas entre genes e manifestações cutâneas, podem ser citados o FCGR2A (risco para LECA), TYK2, IRF5, TNF‐α (risco para LECS) e ITGAM (risco para LED).15,17 Variantes de HLA também já foram correlacionadas à progressão da doença cutânea, dentre as quais se destacam o HLA‐B8, HLA‐DR e HLA‐DQ.16 Até o presente momento, apenas uma variante monogenética de LEC foi identificada, uma forma rara de LE perniótico familiar associada a mutações no gene TREX1.1,14,17,18
Dentre os fatores ambientais, a RUV é o mais bem estabelecido desencadeador do LEC.1 A irradiação da pele altera a morfologia e a função dos ceratinócitos, induzindo diretamente a produção de citocinas pró‐inflamatórias (IL‐1α, IL‐1β, IL‐6, TNF‐α e IFN‐α, k e ¿) e apoptose.4,14,17 O aumento de citocinas inflamatórias e a exposição a resíduos celulares, liberados pela morte celular, desencadeiam o recrutamento de linfócitos e células dendríticas plasmocitoides (CDP), que acionarão a ativação do sistema imune.1,18 As CDP são raras na pele normal e abundantes nas lesões de LEC.18 Resíduos celulares, especialmente nucleares, são capturados pelas CDP, que também podem servir como reservatório de autoantígenos frente a linfócitos B e T autorreativos.14
Já foi demonstrado que a apoptose dos ceratinócitos, como a mediada pela via do Fas/FasL, apresenta forte correlação com a atividade da doença.16 O papel dos ceratinócitos no surgimento e desenvolvimento das lesões de LEC também envolve retroalimentação positiva na produção de IFN, especialmente dos tipos I e III.1 O IFN produzido é capaz de ativar tanto o sistema imune inato quanto adaptativo, exercendo papel central na patogênese do LE.14,19
A ativação do sistema imune inato promove a inflamação tecidual, especialmente mediada pelas CDP e neutrófilos (incluindo as redes extracelulares de neutrófilos – NET; do inglês, neutrophil extracellular traps), e o aumento da expressão de autoantígenos, inclusive o Ro/SS‐A (proteína induzível pelo IFN).18,19 Esse aumento estimula o sistema imune adaptativo, como os linfócitos T citotóxicos e os plasmócitos.1 O aumento do IFN também perpetua a expressão de citocinas e quimiocinas, intimamente relacionadas à produção de anticorpos, os quais se depositam preferencialmente na junção dermoepidérmica e resultam em agressão citotóxica mediada principalmente por linfócitos T CD8+.4
A elevação dos níveis de IFN, especialmente do tipo I, também leva diretamente à infiltração de linfócitos Th1, acelerando a inflamação tecidual e a produção de IFN‐ γ e IL‐2, dentre outras citocinas.4 O aumento dessas citocinas estimula as vias de sinalização intracelulares, como a via JAK/STAT, e altera a transcrição gênica.14
Por fim, a elevação dos níveis de citocinas, o aumento da exposição de antígenos e a atividade das células Th1 estimulam a produção de anticorpos autorreativos, que se depositam principalmente na zona da membrana basal e estimulam a agressão por células T CD8+ e células natural killer (NK), por meio de enzimas, como a granzima B, que induzem apoptose pela ativação das caspases e dão continuidade ao ciclo inflamatório.4,19
O papel dos autoanticorpos permanece incerto no LEC. Pacientes com LECC apresentam ocorrência muito menor de autoanticorpos séricos, como os antinucleares, anti‐DNAn, anti‐Sm, anti‐Ro/SS‐A e anti‐La/SS‐B, se comparados aos pacientes com LES e LECS.19 Por outro lado, as imunoglobulinas estão fortemente envolvidas na patogênese local das lesões de LEC. As IgM são as primeiras a serem recrutadas para a pele, atraindo, em seguida, o C3 e outras imunoglobulinas. Diferentemente do LES, em que a IgM isolada ou em combinação com C3 é a forma mais frequente de formação de imunocomplexos, no LED, a IgG é a responsável pela maioria dos depósitos de imunocomplexos.16
Apesar do aumento dos níveis séricos de IL‐17 e aumento da expressão cutânea da IL‐17A nos pacientes com LES, poucos linfócitos T produtores de IL‐17 são encontrados nas lesões de LED, sugerindo um papel menos importante nesta manifestação clínica.16 Foi descrita também uma redução na porcentagem de linfócitos T reguladores na pele afetada pelo LEC. Outro relato recente é uma relação inversamente proporcional entre a porcentagem de linfócitos Th22 nas lesões e escores de gravidade clínica, indicando que a IL‐22 pode ser bom indicador da reparação cutânea.19
Os fármacos são descritos como outro possível gatilho para o LEC, especialmente para o subtipo subagudo.17 Fármacos classicamente reconhecidos como indutores de LEC, como anti‐hipertensivos, antifúngicos e inibidores da bomba de prótons, dentre outros mais de cem medicamentos, têm dividido importância com novas terapias‐alvo, como imunobiológicos, imunoterápicos e quimioterápicos, em decorrência da crescente ocorrência de casos relacionados a esses medicamentos.4,17 Acredita‐se que os fármacos causadores de LEC podem ativar diretamente o sistema imune inato ou, indiretamente, ao reduzir a remoção de autoantígenos.1 O tabagismo é outro importante fator de risco associado ao LEC, por estimular citocinas pró‐inflamatórias, a ativação neutrofílica, aumentar o estresse celular, a formação de radicais livres e a apoptose.1,14,18
Os hormônios sexuais parecem ser peça fundamental na patogênese do LES. Por outro lado, sua importância no LEC parece ser menor, especialmente no LED.16 Apesar disso, a incidência de LEC ainda é maior no sexo feminino. Como esse aumento ocorre mesmo fora da período fértil, postula‐se que possa haver outras explicações para a maior incidência nas mulheres.16 A ausência de piora significante do LEC durante a gestação ou o uso de anticoncepcionais orais também corroboram esse achado.16 Uma possível hipótese alternativa à influência hormonal seria um efeito de dose ligado ao cromossomo X, que poderia explicar, por exemplo, o aumento da incidência de LES em pacientes do sexo masculino portadores da síndrome de Klinefelter (genótipo XXY).16 Outra hipótese seria a reativação do cromossomo X inativado por um processo de demetilação nos linfócitos T CD4+.16
O papel da microbiota cutânea na patogênese do LEC ainda é pouco compreendido e tem atraído maior atenção por parte dos pesquisadores.16 Aumento significante de Staphylococcus e Corynebacterium, assim como redução de Cutibacterium, foram descritos nas lesões cutâneas de LES, porém ainda sem evidências que suportem uma relação direta.16,17
Apresentação clínica e diagnóstico diferencialA tabela 2 relaciona os subtipos clínicos de LEC e suas variantes, assim como as manifestações cutâneas inespecíficas que podem estar associadas ao LE.
Subtipos clínicos e manifestações cutâneas inespecíficas do lúpus eritematoso
| Subtipos de LE cutâneo | Variantes |
|---|---|
| LE cutâneo agudo | Localizado |
| Disseminado | |
| NET‐símile | |
| LE cutâneo subagudo | Anular policíclico |
| Papuloescamoso psoriasiforme | |
| Síndrome de Rowell | |
| LE neonatal | |
| LE cutâneo intermitente | LE túmido |
| LE cutâneo crônico | LE discoide |
| LE discoide mucoso | |
| LE hipertrófico/verrucoso | |
| LE profundo/paniculite lúpica | |
| LE perniótico | |
| LE líquen plano‐símile | |
| LE comedoniano | |
| LE bolhoso | – |
| Natureza da alteração | Manifestações inespecíficas |
|---|---|
| Vascular | Fenômeno de Raynaud |
| Livedo reticular | |
| Livedo racemoso | |
| Vasculites | |
| Vasculopatia livedoide | |
| Papulose do tipo doença de Degos | |
| Necrose cutânea | |
| Hemorragia em estilhaço | |
| Tromboflebite | |
| Neutrofílica | LE bolhoso |
| Urticária vasculite | |
| Dermatose urticariana neutrofílica | |
| Pustulose amicrobiana das dobras | |
| Síndrome de Sweet | |
| Pioderma gangrenoso | |
| Não definida | Alopecia não cicatricial difusa |
| Úlceras mucosas | |
| Nódulos reumatoides | |
| Dermatite granulomatosa intersticial | |
| Dermatofibroma eruptivo | |
LE, lúpus eritematoso; NET, necrólise epidérmica tóxica.
Representa 15% dos casos de LEC e sempre está associado ao LES, geralmente correlacionando com a atividade da doença.3 Presente no momento do diagnóstico em cerca de 50% dos casos de LES, pode ser desencadeado ou exacerbado pela exposição solar aguda.2
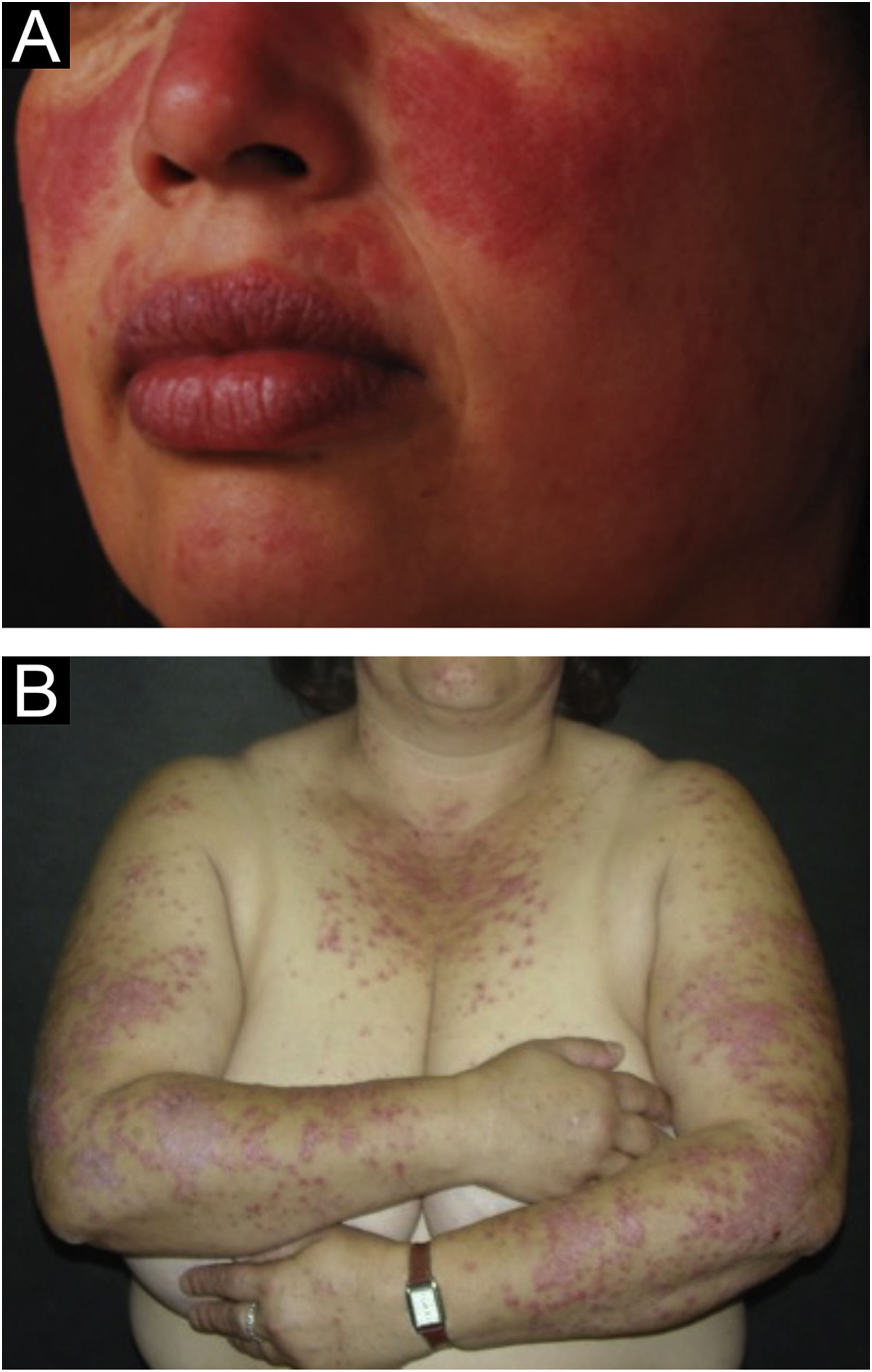
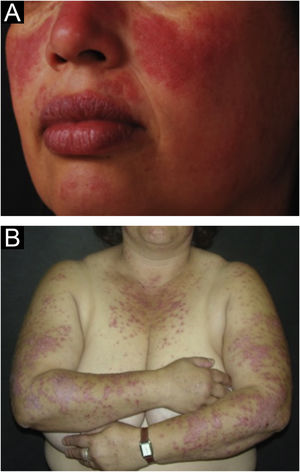
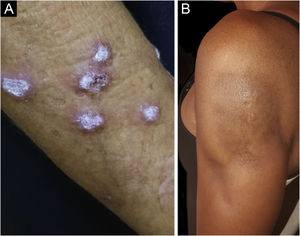
A forma localizada é a predominante (90%‐95%) e corresponde à típica erupção em vespertílio ou em asa de borboleta, que se manifesta como lesão eritematosa e finamente escamosa, acometendo de maneira simétrica as regiões malares e o dorso nasal, geralmente poupando os sulcos nasolabiais (fig. 1A). Edema facial também pode estar presente. O eritema costuma ser efêmero, resolvendo‐se em alguns dias ou semanas. Eventualmente, afeta a fronte, o mento, os pavilhões auriculares e a região cervical anterior. Seus principais diagnósticos diferenciais são dermatomiosite e rosácea, mas ainda devem ser consideradas dermatite seborreica, dermatite perioral e dermatite de contato fotoalérgica. O acometimento das dobras nasolabiais e das pálpebras, assim como fraqueza muscular proximal, favorecem a dermatomiosite.
A forma disseminada, menos comum (5%‐10%), manifesta‐se como erupção exantemática urticariforme ou maculopapular predominante nas áreas fotoexpostas (fig. 1B). Além de face e pescoço, afeta simetricamente o V do decote e a superfície extensora dos membros, sobretudo os superiores, mas pode estender‐se ao tronco e até mesmo palmas e plantas. Quando atinge o dorso de mãos e dedos, tende a poupar as articulações, ao contrário da dermatomiosite. Deve ser diferenciada de reações de hipersensibilidade a fármacos, exantemas virais e dermatites fototóxicas ou fotoalérgicas medicamentosas, além da dermatomiosite.
O acometimento mucoso é frequente em ambas as formas. A mucosa oral é a mais afetada, em 8%‐45% dos casos, atingindo principalmente as mucosas jugal, palatina e labial, na forma de placas enantematosas ou purpúricas, vesicobolhas, erosões e úlceras.20 Ulceração nasal é menos comum e outras mucosas são raramente afetadas.
Uma apresentação rara de LECA, que se assemelha à necrólise epidérmica tóxica (NET), por isso conhecida como variante NET‐símile, deve‐se à intensa dermatite de interface com necrose dos ceratinócitos, que resulta em descolamento epitelial de extensas áreas da pele. Pode haver comprometimento mucoso, que costuma ser mais limitado e poupar a conjuntiva ocular.21
Após resolução, as lesões de LECA podem deixar hipercromia residual, mas não costumam resultar em cicatrizes, exceto na forma NET‐símile, ou quando complicadas por infecção secundária.
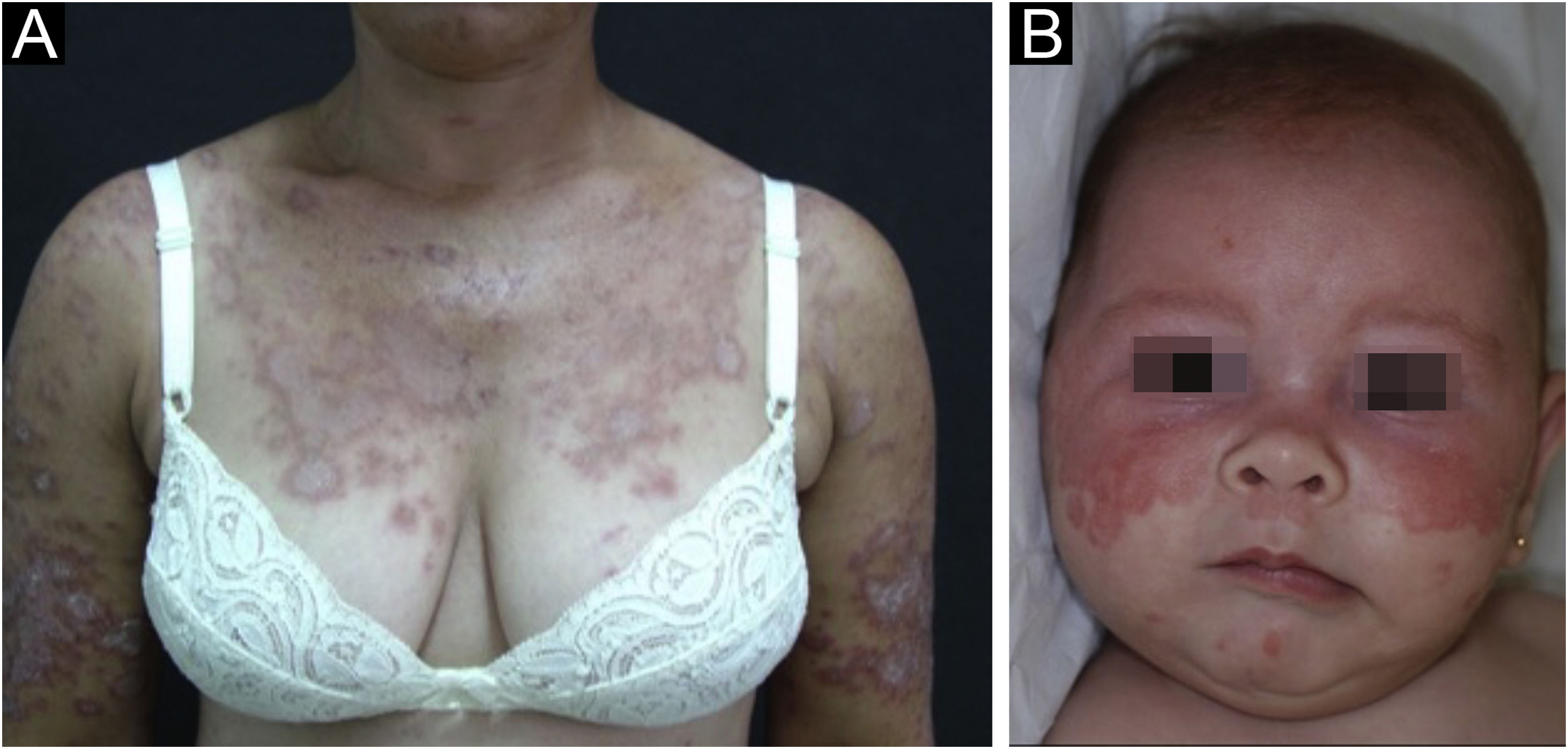
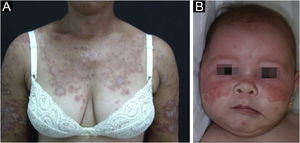
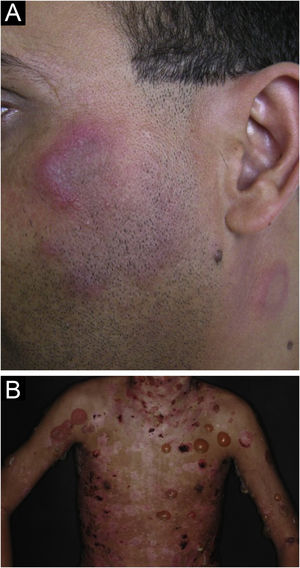
Lúpus eritematoso cutâneo subagudoResponde por cerca de 8% de todos os casos de LEC, tem duração mais prolongada que o LECA e apresenta extrema fotossensibilidade. Distribui‐se de maneira simétrica, preferencialmente nas áreas expostas do pescoço, tronco superior e membros superiores, porém costuma poupar a região central da face.3 Manifesta‐se sob duas formas, ambas com placas eritematosas, uma anular policíclica e outra papuloescamosa psoriasiforme (fig. 2A), que eventualmente podem coexistir no mesmo paciente. Atrofia e ceratose não são clinicamente evidentes nas lesões do LECS. Também tendem a ser menos edematosas que as lesões do LECA e menos infiltradas e discrômicas que aquelas do LED. Em ambas as formas, surgem ocasionalmente lesões vesicobolhosas e crostas na periferia das placas.6 Habitualmente, resolvem sem deixar cicatrizes, mas pode haver hipocromia residual, geralmente temporária, porém permanente em formas mais graves. Eventualmente, pode haver concomitância de lesões de LECA ou LED com lesões de LECS, mas nem sempre é possível uma distinção exata dessas lesões. É raro o acometimento da mucosa oral, com placas enantematosas circulares levemente atróficas.22 Deve ser diferenciado de granuloma anular, eritema anular centrífugo, erithema gyratum repens, psoríase, tinha do corpo, entre outros.
Cerca de 1/3 dos casos de LECS é desencadeado por fármacos. Em geral, o LECS medicamentoso é indistinguível do LECS idiopático, porém algumas particularidades devem levar à suspeição da etiologia medicamentosa – idade mais avançada, quadros mais disseminados e presença de lesões bolhosas ou do tipo alvo.23 O quadro costuma ser reversível, resolvendo em alguns meses após a suspensão da medicação responsável. Os fármacos mais frequentemente incriminados são hidroclorotiazida, inibidores do canal de cálcio, inibidores da enzima conversora da angiotensina, inibidores da bomba de prótons, terbinafina, agentes anti‐TNF e anticonvulsivantes, porém a incidência tende a variar com o desenvolvimento de novos medicamentos e a mudança na prescrição.23–25 Recente revisão da literatura, com foco na década passada (2010‐2020), revelou que os agentes anti‐TNF, os inibidores da bomba de prótons e os antineoplásicos, em particular os inibidores de checkpoint imune, destacam‐se como fármacos emergentes desencadeantes de LEC.26 A lista de medicamentos responsáveis é extensa, como pode ser observado na tabela 3.
Medicamentos referidos como desencadeantes de lúpus eritematoso cutâneo subagudo
| Classe | Subclasse | Medicamento |
|---|---|---|
| Anti‐hipertensivos | Diuréticos | Hidroclorotiazida |
| Inibidores da enzima conversora da angiotensina | Captopril | |
| Cilazapril | ||
| Enalapril | ||
| Lisinopril | ||
| Ramipril | ||
| Betabloqueadores | Acebutolol | |
| Bloqueadores do canal de cálcio | Diltiazem | |
| Nifedipina | ||
| Nitrendipina | ||
| Verapamil | ||
| Inibidores da bomba de prótons | Esomeprazola | |
| Lasanoprazol | ||
| Omeprazol | ||
| Pantoprazol | ||
| Antifúngicos | Griseofulvina | |
| Terbinafina | ||
| Anticonvulsivantes | Carbamazepina | |
| Fenitoína | ||
| Estatinas | Pravastatina | |
| Sinvastatina | ||
| Anti‐histamínicos | Bromofeniramina | |
| Cinarizina + tietilperazina | ||
| Ranitidina | ||
| Antibióticos | Amoxicilina + clavulanato | |
| Ciprofloxacina | ||
| Anti‐inflamatórios não esteroides | Naproxeno | |
| Piroxicam | ||
| Quimioterápicos | 5‐fluoruracila | |
| Capecitabinaa | ||
| Docetaxel | ||
| Doxorubicina | ||
| Gencitabina | ||
| Masitinibe | ||
| Mitotane | ||
| Nivolumabe | ||
| Paclitaxel | ||
| Palbociclibea | ||
| Pembrolizumabea | ||
| Tamoxifeno | ||
| Tegafur/uracila | ||
| Biológicos | Anti‐TNF | Adalimumabe |
| Etanercepte | ||
| Golimumabe | ||
| Infliximabea | ||
| Anti‐CD80/86 | Abatacepte | |
| Anti‐CD11a | Efalizumabe | |
| Anti‐IL12/23 | Ustekinumabe | |
| Anti‐IL17 | Secukinumabe | |
| Antidepressivos | Bupropiona | |
| Outras | Alopurinola | |
| Anastrazol | ||
| Interferon‐α e β | ||
| Imuglobulina intravenosa | ||
| Leflunomidaa | ||
| Leuprorrelina | ||
| Ticlopidina | ||
| Tiotrópio | ||
Adaptado de Borucki & Werth, 2020.23.
O primeiro caso de LECS associado a doença maligna foi descrito em 1982, como lúpus eritematoso gyratum repens em paciente com câncer de pulmão. Desde então, surgiram inúmeros relatos sugerindo uma relação entre LECS e várias neoplasias sólidas e não sólidas, com maior frequência de carcinoma de pulmão e adenocarcinoma da mama. Na maioria dos casos, o paralelismo entre o desenvolvimento tumoral e a atividade da dermatose possibilitou caracterizar a associação como síndrome paraneoplásica. Ainda que rara, é importante considerar essa possibilidade no LECS de início em idade avançada, em pacientes com maior risco de neoplasia e nos casos refratários ao tratamento convencional.27
A síndrome de Rowell foi originalmente descrita em 1963 como uma entidade distinta, pela associação de achados clínicos de LE e eritema multiforme, além da presença de algumas alterações imunológicas, como FAN salpicado, anticorpo anti‐SjT e fator reumatoide. À luz dos conhecimentos clínicos e imunológicos modernos, essa síndrome não deve ser vista com identidade nosológica, mas como variante rara do LECS, caracterizada por lesões cutâneas do tipo alvo e presença de anticorpos anti‐Ro/SS‐A.28
O LE neonatal também é considerado variante do LECS. Resulta da passagem transplacentária de autoanticorpos maternos contra antígenos Ro/SS‐A, La/SS‐B e, mais raramente, U1‐RNP. Em grande parte dos casos, a mãe é assintomática, mas pode ter síndrome de Sjögren, LECS, LES ou outras doenças do tecido conjuntivo. O risco é pequeno na primeira gestação ou na ausência da doença em gestações anteriores (2%), mas aumenta substancialmente (10 vezes) se tiver havido diagnóstico em gestação prévia. As lesões cutâneas ocorrem em até 40% dos casos de LE neonatal e podem estar presentes ao nascimento, mas geralmente surgem nos primeiros três meses de vida, após a exposição solar, resolvendo espontaneamente em 6‐12 meses. São eritematosas ou eritemato‐escamosas, circulares, anulares ou policíclicas e afetam principalmente a face, nas regiões frontal e periorbitária (fig. 2B), podendo estender‐se ao couro cabeludo, mas raramente atingem tronco e membros. Dermatite seborreica e tinha da face são os principais diagnósticos diferenciais. Outras manifestações possíveis, também reversíveis, são as citopenias (trombocitopenia, anemia hemolítica), doença hepatobiliar, esplenomegalia e, mais raras, as alterações neurológicas e pulmonares. Mais graves e irreversíveis são as alterações cardíacas, principalmente os distúrbios de condução, inclusive bloqueio atrioventricular total, miocardiopatia e valvulopatia, que podem ocorrer em 25% dos casos e ser detectadas antes do nascimento.2,29
Lúpus eritematoso cutâneo crônicoO LECC responde por mais de 70% dos casos de LEC e compreende diversas variantes, algumas mais comuns e outras mais raras.3
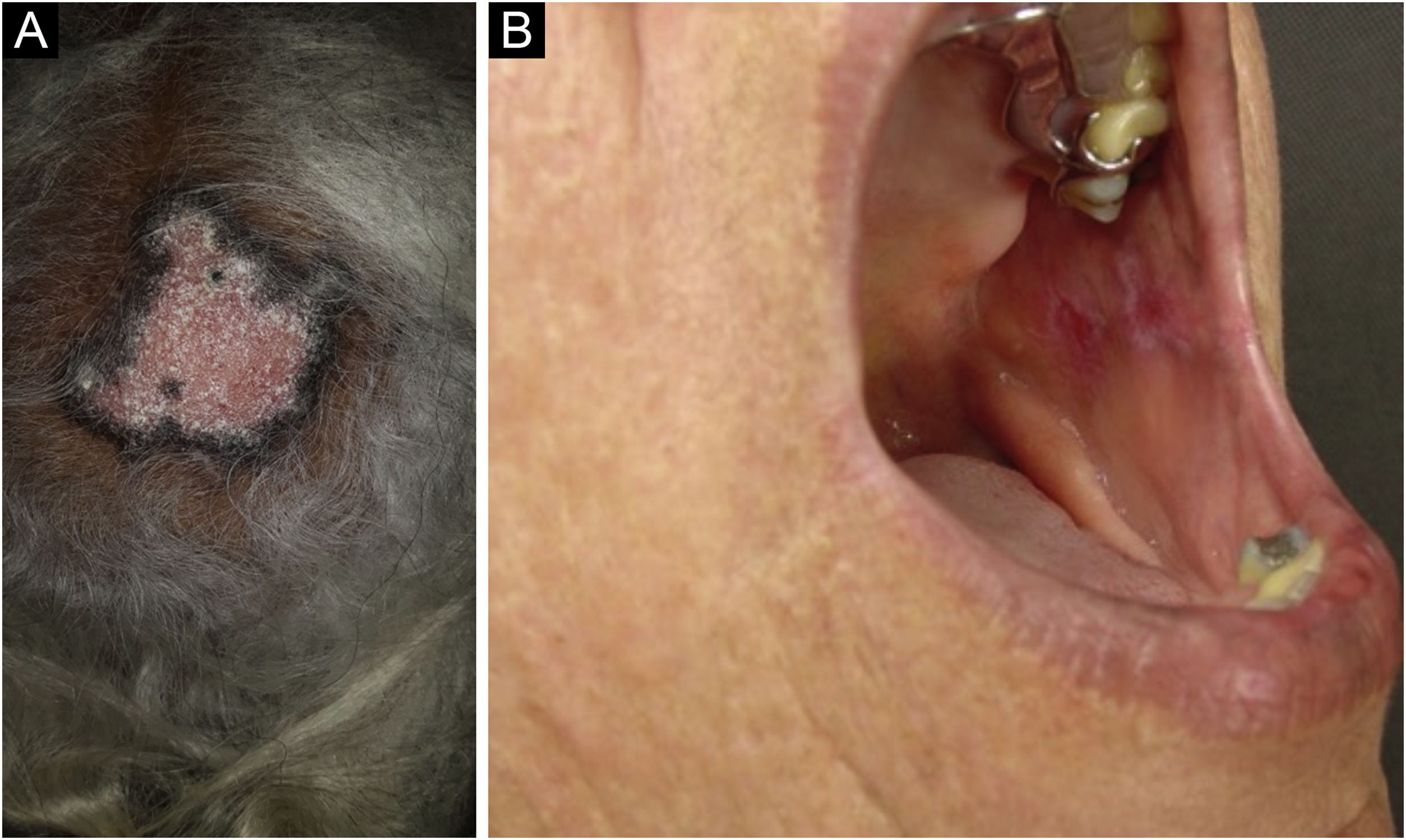
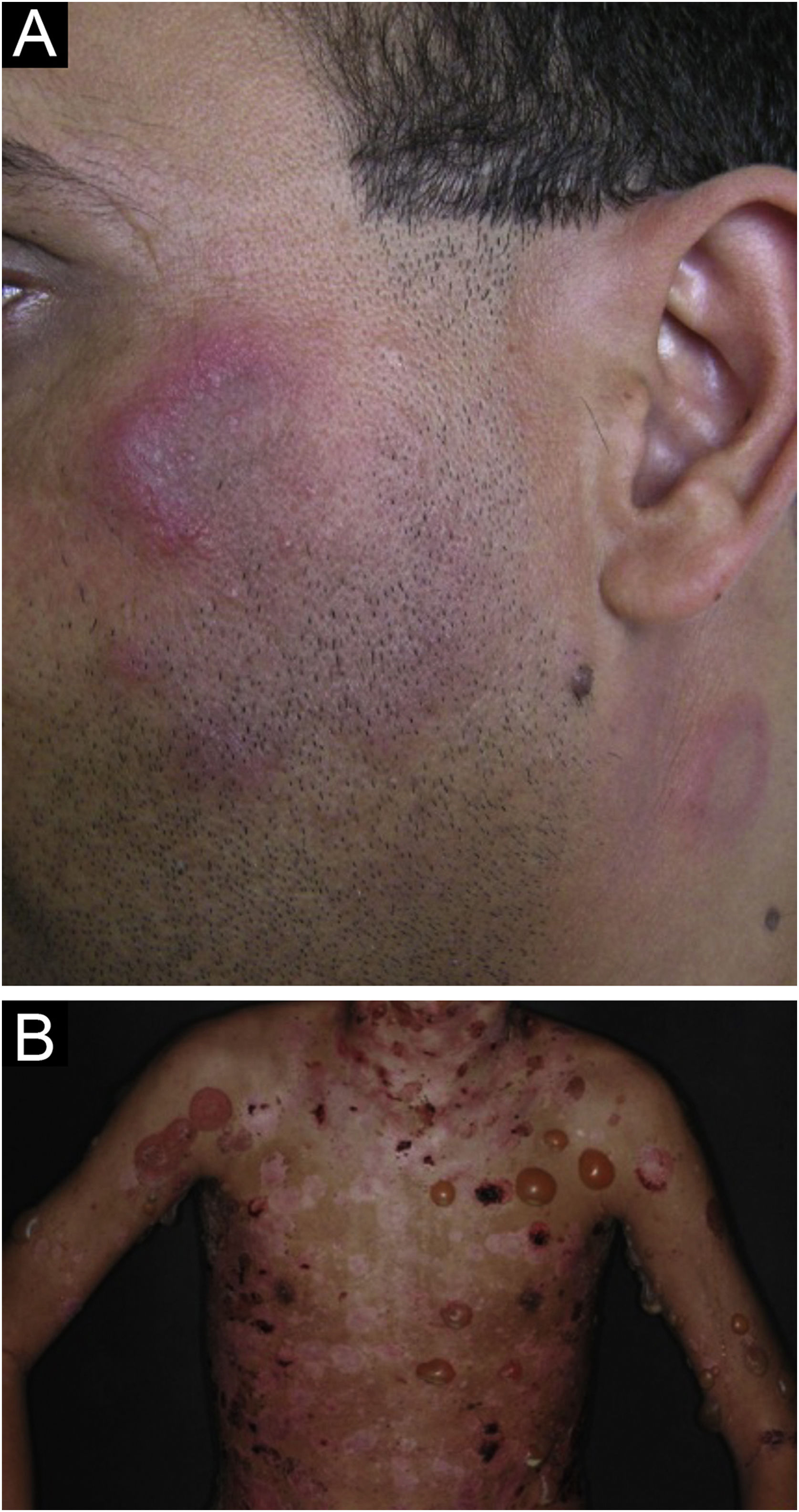
O LED é a forma clássica e mais comum de LECC, também presente em 20% dos casos de LES. Localiza‐se predominantemente na cabeça e pescoço, mas, em cerca de 30% dos casos, pode ser disseminado e acometer tronco e membros, com preferência pelas áreas fotoexpostas, como face, pavilhões auriculares, V do decote, lateral do pescoço, couro cabeludo e dorsal dos membros superiores. As lesões se iniciam como placas eritemato‐infiltradas, induradas à palpação, evoluindo com ceratose, principalmente folicular, atrofia e discromia, com hipocromia no centro e hipercromia na periferia. Costumam ser dolorosas à palpação. Podem deixar lesões vitiligoides, assim como resolver com cicatrizes, muitas vezes mutilantes, sobretudo quando acometem nariz, pavilhões auriculares e pálpebras. Lesões em diferentes estágios costumam ser concomitantes. Quando situadas nas áreas pilosas, como couro cabeludo, barba, cílios e supercílios, tendem a destruir os folículos, resultando em alopecia cicatricial (fig. 3A). Lesões palmoplantares são raras, costumam ser muito dolorosas e podem ulcerar‐se. Excepcionalmente, observam‐se lesões ungueais e periungueais. Além da radiação solar, as lesões de LED podem ser provocadas por traumatismos, configurando o fenômeno de Koebner.2,3,30 LED medicamentoso é muito raro, com relatos esporádicos associados a leflunomida, 5‐fluoruracil, capecitabina, palbociclibe, pembrolizumabe e mais comumente aos agentes anti‐TNF.31 As lesões recentes de LED devem ser diferenciadas da erupção polimorfa à luz, sarcoidose, pseudolinfomas, granuloma facial e LE túmido. As lesões crônicas merecem diferenciação com lúpus vulgar, ceratose actínica hipertrófica, carcinoma espinocelular e ceratoacantoma.
O LED mucoso é relatado em 3%‐25% dos pacientes com LED e costuma ser assintomático em 1/4 dos casos. Apresenta‐se classicamente como placas de enantema, com pápulas ceratósicas, atrofia ou erosão central e ceratose radiada ou reticulada na periferia. Pode ainda se manifestar como placas brancas estriadas ou homogêneas, erosões e ulcerações. É mais comum na mucosa oral, principalmente jugal (fig. 3B), palatina e labial, mas pode acometer a gengiva e a língua. As mucosas nasal, genital e anal também podem ser afetadas por lesões discoides. É característica a lesão da conjuntiva ocular, mais comum na margem palpebral inferior, que pode resultar em cicatriz, perda dos cílios e ectrópio. Há risco de transformação maligna em carcinoma escamocelular, com maior frequência nos lábios.2,22,32 Seu principal diagnóstico diferencial é o líquen plano oral.
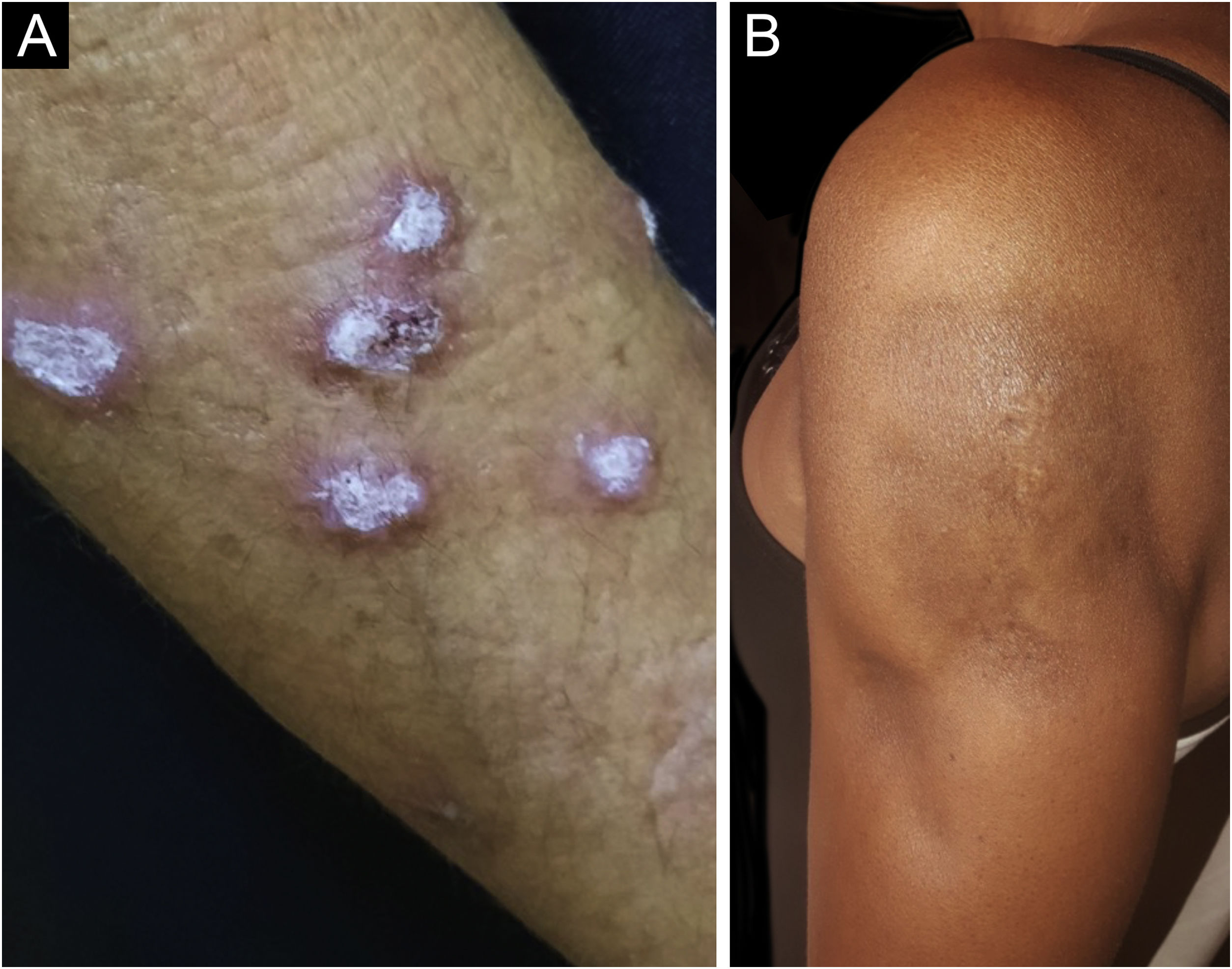
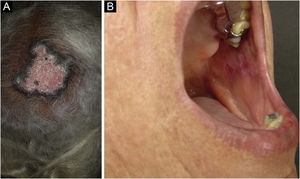
O LE hipertrófico, também conhecido como LE verrucoso, é variante bastante rara do LECC que se manifesta com lesões eritematosas, papulosas ou nodulares, de superfície ceratósica e algo verrucosa, localizadas principalmente nas regiões extensoras dos membros superiores (fig. 4A) e eventualmente na face e tronco superior. Costuma haver coexistência de lesões discoides típicas, que facilitam o diagnóstico.2 Deve ser diferenciado do líquen plano hipertrófico, do ceratoacantoma e das verrugas vulgares.
O LE líquen plano‐símile ou síndrome de superposição lúpus eritematoso‐líquen plano refere‐se à combinação de achados clínicos, histológicos e imunopatológicos de ambas as dermatoses. Trata‐se de condição muito rara, de evolução crônica e predominante em mulheres, que apresenta placas dolorosas vermelho‐azuladas, escamosas, com centro atrófico, localizadas nas extremidades superiores e menos frequentemente nas pernas, face e tronco; o acometimento palmoplantar é característico. Lesões hipertróficas também podem ocorrer. Há ainda relatos de acometimento mucoso, distrofia ungueal e alopecia cicatricial, assim como de casos desencadeados por medicamentos.2,33,34
O LE profundo ou paniculite lúpica responde apenas por 2%‐3% dos casos de LECC, é mais frequente em adultos e mulheres e se manifesta com placas e nódulos subcutâneos, endurecidos, aderidos à pele sobrejacente, geralmente dolorosos, que se localizam principalmente na face, ombros, braços, coxas, glúteos e mamas (fig. 4B). A pele da superfície pode ou não apresentar lesões de LED. Costumam causar intensa atrofia do subcutâneo, deixando áreas deprimidas, com desfiguração estética, sobretudo quando localizadas na face. Eventualmente, evoluem com calcificação e ulceração. A doença tem curso crônico, entrecortado por períodos de exacerbação e de remissão.2,30 Deve ser diferenciado principalmente de outros tipos de paniculite, do linfoma subcutâneo de células T paniculite‐símile e da sarcoidose subcutânea.
O LE perniótico é forma rara de LECC, que se assemelha à perniose e se manifesta por lesões dolorosas, papulosas, nodulares ou edematosas, de tonalidade eritemato‐violácea. Podem evoluir com erosão ou ulceração. São desencadeadas pela exposição ao frio e usualmente acometem quirodátilos e dorso das mãos. Pododáctilos, regiões plantares e calcanhares também podem ser acometidos. Nariz e pavilhões auriculares são menos afetados. Fenômeno de Raynaud pode estar presente em alguns casos. O quadro pode coexistir com lesões de LED ou ocorrer no contexto de LES. Estima‐se que 20% dos pacientes com LE perniótico venham a desenvolver doença sistêmica. Algumas alterações imunológicas podem ser observadas, como hipergamaglobulinemia, fator reumatoide e FAN positivos, assim como anticorpos antifosfolípides e antinucleares específicos, principalmente anti‐Ro/SS‐A.35 Há uma forma familiar da doença, que se manifesta na infância, de herança autossômica dominante, relacionada a mutações no gene TREX1 e menos frequentemente nos genes SAMHD1 ou TMEM173.2,36 O principal diagnóstico diferencial é a perniose idiopática, mas ainda devem ser considerados o lúpus pérnio, uma forma acral de sarcoidose, assim como as vasculites e vasculopatias acrais.
O LE comedoniano é outra variante rara do LECC, que se manifesta por comedos, pápulas, placas eritemato‐infiltradas e cistos em áreas seborreicas e fotoexpostas, deixando cicatrizes acneiformes deprimidas. Acomete preferencialmente mulheres jovens e de meia idade; o tabagismo é importante fator de risco, como em outras formas de LECC. Pode ser acompanhado de lesões típicas de LED, assim como associado ao LES. Costuma ser confundido com acne vulgar, nevo comedoniano e elastoidose nodular com cistos e comedões, o que geralmente retarda o diagnóstico e o tratamento, resultando em cicatrizes inestéticas.37–39
Lúpus eritematoso cutâneo intermitenteAnteriormente categorizado entre as variantes de LECC, o LE túmido foi reclassificado como LECI em razão de seu curso clínico, em que se alternam períodos de remissão e de recorrência. É variante rara do LEC, que acomete mais as mulheres (60% dos casos), mas a preponderância sobre os homens é menos evidente que nas outras formas de LEC. Uma característica marcante do LE túmido é a fotossensibilidade exacerbada, talvez a mais intensa entre todas as formas de LEC. Manifesta‐se por placas únicas ou múltiplas, eritemato‐edematosas, de superfície lisa, que podem assumir configuração anular ou arciforme (fig. 5A). Localizam‐se em áreas fotoexpostas, principalmente na face, pescoço, tronco superior e membros superiores. É usual a resolução espontânea das lesões em algumas semanas, sem deixar discromia ou cicatriz, mas sobrevêm episódios com novas lesões. É mais comum a ocorrência na forma isolada, mas pode estar associado a outras formas de LEC, principalmente LED, e raramente ao LES. Alterações imunológicas também são incomuns, como FAN e anticorpos antinucleares específicos. Deve ser diferenciado da erupção polimorfa à luz, LED inicial, mucinose reticular eritematosa e pseudolinfomas cutâneos, como a infiltração linfocitária de Jessner, considerada por muitos autores como o próprio LE túmido.2,40,41
Lúpus eritematoso bolhosoO LE bolhoso é dermatose bolhosa autoimune, subepidérmica, sempre associada ao LES, mediada por autoanticorpos contra o colágeno VII. Manifesta‐se por vesículas e bolhas tensas (fig. 5B) que surgem subitamente sobre pele sã ou sobre placas eritematosas e infiltradas, eventualmente assumindo configuração anular. Preferem face, tronco superior, pescoço, regiões supraclaviculares e flexuras axilares, mas podem disseminar‐se para outras áreas não expostas. Não costumam ser acompanhadas de lesões específicas de LEC, a não ser eritema malar, que pode surgir posteriormente, ao longo da evolução da doença. As mucosas oral e genital podem ser acometidas; são típicas as lesões labiais e periorais.42 É mais comum em mulheres negras, entre a segunda e quarta décadas de vida. O LE bolhoso se instala antes, concomitantemente e, menos frequentemente, após o diagnóstico do LES, podendo ser marcador de intensa atividade sistêmica, com maior risco de nefrite lúpica e manifestações neuropsiquiátricas.43 As lesões evoluem com erosão e crostas, regredindo sem cicatrizes e mílios, mas podem deixar discromia residual. É incomum a recorrência, mesmo com a persistência de doença sistêmica ativa.44 Deve ser diferenciado da epidermólise bolhosa adquirida, dermatose bolhosa por IgA linear, dermatite herpetiforme e penfigoide bolhoso.
Manifestações cutâneas inespecíficas do lúpus eritematosoExcluídos os subtipos clínicos e respectivas variantes anteriormente expostos, todas as demais manifestações cutâneas associadas ao LE devem ser consideradas inespecíficas. Estão associadas ao LES e geralmente guardam relação com a atividade da doença. No entanto, não são exclusivas do LES, podendo ocorrer em outras condições, geralmente de natureza autoimune ou autoinflamatória.45–47 O LE bolhoso, embora classificado como manifestação inespecífica, neutrofílica, associada ao LE, deveria ser considerado subtipo clínico específico de LEC, pelo fato de sempre estar associado ao LES.11 As manifestações inespecíficas mais comuns estão listadas na tabela 2.
DiagnósticoO diagnóstico do LEC se fundamenta nos dados colhidos na anamnese e no exame físico, em combinação com os achados da histopatologia e, eventualmente, da imuno‐histologia das lesões cutâneas, para definição do subtipo clínico.
O tipo e a abrangência da investigação laboratorial devem ser adequados a cada paciente, individualmente, a depender do subtipo de LEC definido com base nos achados clínicos e histopatológicos.
Devem ser realizados exames bioquímicos de rotina que auxiliem na identificação de possível doença sistêmica, além de exames específicos, conforme o tratamento proposto, antes de iniciar a medicação e para monitorar seus potenciais efeitos adversos. Exames adicionais podem ser necessários após a confirmação do diagnóstico e definição do subtipo de LEC, que incluem testes sorológicos para caracterizar o perfil de autoanticorpos e testes para avaliar a atividade sistêmica da doença, assim como exames complementares para investigar acometimento de órgãos específicos, que podem auxiliar na determinação do prognóstico. Os principais exames laboratoriais recomendados no LEC estão listados na tabela 4. Nos casos de LES, faz‐se necessária a intervenção do reumatologista e eventualmente de outros especialistas, que devem orientar a propedêutica complementar individualizada para cada paciente.48
Avaliação laboratorial recomendada no lúpus eritematoso cutâneo (LEC)
| Exames de rotina (suspeita de LEC) |
| Hemograma |
| Velocidade de hemossedimentação eritrocitária |
| Proteína C reativa |
| FAN (HEp‐2) |
| Enzimas hepáticas (TGO, TGP, FA, GGT) |
| Função renal (ureia, creatinina) |
| Urina (EAS) |
| Exames especiais (LEC confirmado) |
| Anticorpos específicos (anti‐DNAn, ‐Sm, ‐Ro/SS‐A, ‐La/SS‐B, ‐RNPn) |
| Complemento sérico (C3, C4) |
| Anticorpos antifosfolípides (anticardiolipinas IgG e IgM; |
| anticoagulante lúpico; β2‐glicoproteína I) |
| Fator reumatoide |
| Imunoglobulinas (imunoeletroforese) |
| TSH, T4, anticorpos antitireoidianos |
| Proteínas urinárias 24 horas |
| Clearance da creatinina |
| Glicose‐6‐fosfato desidrogenase |
Adaptado de Kuhn et al., 2014.48.
É importante que a definição de doença sistêmica não fique estritamente condicionada aos critérios diagnósticos incluídos nos sistemas de classificação, como o SLICC 2012 e o EULAR/ACR 2019, que foram primordialmente desenvolvidos com objetivo de se obter uniformidade diagnóstica na seleção de pacientes para ensaios clínicos, mas não são capazes de abranger todas as manifestações que podem ocorrer no LES.30
O uso de escores de atividade da doença, originalmente criados para mensuração de desfechos em ensaios clínicos, é recomendável na prática clínica, por permitir análise mais objetiva da evolução da doença no seguimento dos pacientes com LEC, podendo servir de parâmetro na avaliação da resposta ao tratamento indicado.
HistopatologiaAs diferentes formas de LEC, com exceção do LE profundo e do LE túmido, compartilham os achados histopatológicos, tornando indispensável uma estreita correlação clínico‐patológica para definição do subtipo. A diferenciação histopatológica depende da evolução e do estágio das lesões. Assim, do ponto de vista histológico, o LE poderia ser classificado em recente (LECA, LECS e LED inicial), completamente desenvolvido (LED) e tardio (LED atrófico‐cicatricial). As alterações tendem a ser mais sutis nas lesões recentes e bastante evidentes nas lesões totalmente desenvolvidas.19,49
Os principais achados são o infiltrado inflamatório linfocítico perivascular e perianexial na derme superficial e profunda, assim como a dermatite de interface, caracterizada pela agressão de linfócitos à junção dermoepidérmica. Como consequência, outras alterações ocorrem, como a degeneração vacuolar da camada basal e a necrose de ceratinócitos nas camadas inferiores da epiderme, seguidas por espessamento da membrana basal. A epiderme torna‐se atrófica e as cristas epiteliais, achatadas. A deposição de mucina na derme é um achado típico do LE, embora inespecífico, variando em intensidade conforme o tipo de lesão.47
No LED, protótipo das lesões completamente desenvolvidas, além das alterações já descritas, bastante proeminentes, são muito evidentes os achados de hiperceratose, tampões córneos foliculares e atrofia epidérmica. O estágio tardio e cicatricial do LED mostra incontinência pigmentar, ectasia vascular, fibrose dérmica e perda dos anexos.19,47
No LECA, as alterações costumam ser mais discretas, podendo haver edema e hemorragia na derme superficial. O infiltrado linfocítico é discreto, apenas perivascular e superficial, com presença de neutrófilos nas lesões mais recentes. A variante NET‐símile de LECA mostra intensa degeneração hidrópica da basal, que resulta em disceratose, clivagem subepidérmica e necrose completa da epiderme.19,47
No LECS, a dermatite de interface costuma ser intensa, havendo muitos corpos citoides. O infiltrado linfocítico é superficial e predominantemente perivascular. A atrofia da epiderme, a hiperceratose, os tampões foliculares, a deposição de mucina e o espessamento da membrana basal são menos proeminentes que no LED.19,47
O LE hipertrófico, além das alterações observadas no LED, mostra acantose e acentuada hiperplasia pseudoepiteliomatosa, além de intensa hiperceratose.47,49
O LE profundo apresenta‐se como paniculite linfocítica lobular, com nódulos linfoides parasseptais e necrose hialina dos adipócitos, presença de plasmócitos, além de deposição de mucina na derme reticular e ocasionalmente na hipoderme. Fibrose e calcificação podem ser observadas nos estágios finais das lesões. As alterações epidérmicas e dérmicas características do LE podem estar presentes em metade dos casos.47,49
O LE túmido caracteriza‐se por intenso infiltrado linfocítico perivascular na derme superficial e profunda, além de abundante deposição de mucina, sem a presença das alterações epidérmicas e da dermatite de interface.47,49
Nas lesões de LE perniótico, além dos achados característicos de LE, em menor intensidade que no LED, destacam‐se a presença de vasculite linfocítica, eventualmente com necrose fibrinoide e trombose, edema da derme papilar e infiltrado linfocítico periécrino.47,49
O LE bolhoso mostra infiltrado inflamatório predominante de neutrófilos, que costuma estar alinhado à junção dermoepidérmica e formar microabscessos nas papilas dérmicas, além de clivagem subepidérmica e bolha com neutrófilos no interior.47,49
Imuno‐histologiaO teste da imunofluorescência direta (IFD), realizado em cortes de tecido obtido por biópsia da lesão cutânea, visa identificar imunodepósitos na junção dermoepidérmica, conhecido como teste da banda lúpica (TBL). Geralmente, faz‐se a pesquisa de imunodepósitos de IgG, IgM, IgA e C3. O TBL é considerado positivo quando identificada a deposição de material granular em faixa junto à zona da membrana basal. É recurso que pode auxiliar no diagnóstico, se a histologia não é decisiva frente a lesões sugestivas de LE, porém não é específico para a doença, podendo ser observado em outras condições dermatológicas, como dermatomiosite, e mesmo na pele normal ou fotodanificada, principalmente da face.48,50 O tipo de depósito varia conforme a cronologia e a topografia da lesão, assim como o local biopsiado, se no centro ou periferia da lesão. IgM e IgG são os imunodepósitos mais detectados, em associação ou não com C3; IgA é menos comum. O TBL costuma ser positivo na pele lesada de quase 100% dos casos de LECA, em cerca de 60% dos casos de LECS e de 90% dos casos de LED.11,19,47
Estudo recente que avaliou 2.050 biópsias cutâneas submetidas à histologia e imunofluorescência direta, com hipóteses diagnósticas de diferentes dermatoses, concluiu que o valor da IFD no auxílio diagnóstico do LE é questionável e seu uso não é recomendado como rotina.50 Embora o TBL positivo na pele não lesada e não exposta seja altamente específico para LES, ele acrescenta pouca informação aos achados obtidos conjuntamente pelo exame clínico, histopatologia e sorologia. Além disso, foi demonstrada sua associação com a presença de anticorpos anti‐DNAn no soro, porém com taxas de sensibilidade e especificidade similares, sugerindo ser redundante a utilização de ambos os testes.50
No LE bolhoso, a IFD da pele perilesional demonstra depósito contínuo, de padrão linear ou granular, ao longo da zona da membrana basal, principalmente de IgG, além de IgM, IgA e C3. A imunofluorescência indireta, pela técnica de salt‐split skin, revela depósito do lado dérmico da clivagem.42,47
Anticorpos antinuclearesOs autoanticorpos antinucleares são marcadores imunológicos empregados tanto no diagnóstico quanto na monitoração da doença no LE. O teste de triagem mais usado é o fator antinúcleo (FAN), que utiliza a técnica da imunofluorescência indireta, tendo as células HEp‐2 como substrato. O FAN tem maior relevância no LECA/LES, em que é demonstrado em quase todos os pacientes (94%‐100%), geralmente em títulos elevados, superiores a 1/160. No entanto, mesmo em altos títulos, não são específicos para LES, já que podem ser detectados em várias condições, como outras doenças do tecido conjuntivo, doenças hematológicas e hepáticas, infecções virais, uso de vários medicamentos e até em indivíduos saudáveis.51 O FAN é demonstrado em menor proporção nas outras formas de LEC, em 52%‐80% dos pacientes de LECS e em 5%‐17% dos pacientes de LED.52
Por não ser um teste específico para LE, é fundamental que, frente a FAN positivo, a especificidade do anticorpo antinuclear seja determinada por meio de testes adicionais.
Os anticorpos anti‐DNAn e anti‐Sm são os mais relevantes por serem específicos para LES, embora apresentem menor sensibilidade, de 56%‐70% e 19%‐25%, respectivamente. Além do valor diagnóstico, o anticorpo anti‐DNAn pode ser usado para monitoração da doença, já que seus níveis séricos tendem a refletir a atividade da doença, em especial a nefropatia, sobretudo quando há concomitância com o anticorpo anti‐Sm.19,51 É baixa a prevalência dos anticorpos anti‐DNAn e anti‐Sm nos pacientes de LECS, e praticamente nula nos pacientes de LECC.19,25
Os anticorpos anti‐Ro/SS‐A e anti‐La/SS‐B não são específicos do LE e estão frequentemente associados à síndrome de Sjögren. Ocorrem, respectivamente, em 36%‐64% e 8%‐33% dos pacientes de LES e guardam relação com as manifestações cutâneas e hematológicas, como as citopenias. Os anticorpos anti‐Ro/SS‐A e anti‐La/SS‐B estão presentes entre 70%‐90% e 30%‐40%, respectivamente, dos casos de LECS, e em até 25% e 5%, respectivamente, dos casos de LED. Particularmente, os anticorpos anti‐Ro/SS‐A são considerados marcadores do LECS e estão relacionados com a extrema fotossensibilidade deste subtipo de LEC. Além disso, quando presentes na gestante, esses anticorpos atravessam a barreira placentária e podem causar LE neonatal. Os anticorpos especificamente dirigidos contra a subunidase 52 kD do antígeno Ro/SS‐A estão associados a maior risco de bloqueio cardíaco congênito. Adultos com esses anticorpos também podem apresentar prolongamento do intervalo QT, com maior risco de desenvolver arritmias ventriculares.51
Anticorpos anti‐RNP são característicos da doença mista do tecido conjuntivo, mas podem estar presentes em 23%‐49% dos pacientes de LES e não mostram correlação com quaisquer manifestações da doença.51 Podem ocorrer entre 8%‐10% dos casos de LECS e muito raramente no LECC.52
Avaliação da atividade e dano cutâneosPacientes diagnosticados com LEC devem ser submetidos a exame dermatológico completo, não apenas durante episódios de exacerbação da doença, mas também a intervalos regulares, com o objetivo de se avaliar a atividade e a progressão da doença, assim como identificar possíveis danos decorrentes do acometimento cutâneo.
Vários escores de atividade da doença estão bem estabelecidos na avaliação de pacientes com LES, para uso em ensaios clínicos e na prática cotidiana, como o SLEDAI (Systemic Lupus Erythematosus Disease Activity Index). Apesar de incluírem alguns critérios dermatológicos, esses escores carecem de sensibilidade para avaliar a atividade cutânea nos diferentes subtipos de LEC.12
Por essa razão, foi criado o CLASI (Cutaneous Lupus Area and Severity Index), um instrumento desenvolvido especificamente para quantificar o acometimento cutâneo no LE, com escores de atividade (CLASI‐A) e de dano (CLASI‐D). Esse instrumento avalia a morfologia (eritema, descamação/ceratose, discromia e cicatriz/atrofia) e a localização anatômica (13 sítios) das lesões cutâneas, assim como o acometimento de mucosas e couro cabeludo. Foi originalmente estabelecido como recurso para mensurar desfechos em ensaios clínicos e validado por dermatologistas e reumatologistas. O CLASI ainda demonstrou boa correlação com indicadores da qualidade de vida dos pacientes e revelou‐se instrumento útil e de fácil aplicação na prática clínica.11,12,53
Posteriormente, surgiu o CLASI revisado (RCLASI), que acrescentou novos parâmetros – edema/infiltração e placas/nódulos subcutâneos – com o intuito de melhorar a acurácia na avaliação da atividade da doença cutânea, sendo capaz de abranger aspectos importantes de alguns subtipos de LEC, como o LE túmido e o LE profundo.48
Entretanto, uma recente revisão sistemática constatou que, dentre os ensaios que utilizaram o CLASI como medida de desfecho de intervenções terapêuticas, são poucos com alta qualidade de evidência. Esse estudo concluiu que é necessária validação adicional para averiguar a efetividade do CLASI na avaliação dos diferentes subtipos de LEC. Os autores sugerem que o uso de medidas de desfecho padronizadas, referidas por paciente e médico, poderiam reduzir a heterogeneidade e permitir comparações entre pacientes incluídos em diferentes ensaios clínicos. Também recomendam que o CLASI‐50 (redução de 50% na pontuação do CLASI‐A) poderia ser mais efetivo como medida de resposta terapêutica que o CLASI‐20 (redução de 20% no CLASI‐A), usualmente utilizado como critério de boa resposta nos ensaios clínicos.54
Progressão de lúpus cutâneo a lúpus eritematoso sistêmicoDe 5%‐25% dos casos de LEC isolado, independentemente do subtipo, podem progredir para LES durante sua evolução, com tempo médio de oito anos entre o diagnóstico da doença cutânea e o desenvolvimento da doença sistêmica. Estudo de base populacional desenvolvido na Suécia mostrou que a maior possibilidade de desenvolver LES ocorre até três anos após o diagnóstico da doença cutânea, além de ser mais provável nas mulheres.52
Por outro lado, aproximadamente 50%‐60% dos pacientes de LECS experimentam transição ou já podem ser classificados como LES quando do diagnóstico da doença cutânea, geralmente preenchendo critérios cutâneos, musculoesqueléticos e sorológicos.52
Entretanto, os pacientes de LEC que progridem para LES tendem a apresentar sintomas sistêmicos mais leves; são raras as manifestações cardiopulmonares e neurológicas, assim como outras complicações graves da doença. Critérios relacionados à nefropatia são indicadores relevantes de diferenciação entre doença cutânea isolada e doença sistêmica. Quando presente, o acometimento renal tende a ser menos grave naqueles que evoluem de LEC a LES, porém faltam estudos mais consistentes para permitir essa conclusão.52
Há evidência de que LED e LECS com lesões disseminadas exibem maior probabilidade de evoluírem com manifestações sistêmicas que aqueles com lesões localizadas. Estudo retrospectivo, que comparou pacientes de LED com doença localizada e pacientes de LED e LECS com doença disseminada, mostrou que 30% dos casos com lesões disseminadas apresentaram manifestações extracutâneas, como nefrite, pleurite e poliartrite, enquanto aqueles com doença localizada não tiveram manifestações sistêmicas.52
As lesões cutâneas inespecíficas prevalecem no LES, principalmente com doença em atividade. Por isso, quando presentes, implica maior probabilidade de doença sistêmica, em particular a ocorrência de telangiectasias periungueais. A presença dessas lesões foi verificada em 76% dos pacientes de LES com LED concomitante e em nenhum paciente com LED exclusivo.52
Pacientes de LEC com potencial de desenvolver LES têm maior probabilidade de apresentar FAN com títulos elevados em comparação com aqueles de LEC exclusivo. Além de marcadores de acometimento sistêmico importante nos pacientes de LES, títulos elevados do FAN e a presença dos anticorpos específicos anti‐DNAn ou anti‐Sm também são indicativos de evolução para doença sistêmica nos pacientes com LEC.
Outras alterações laboratoriais persistentes, como anemia, leucopenia, trombocitopenia e elevação da velocidade de hemossedimentação, também são consideradas importantes marcadores de progressão para LES.52
Também é matéria de discussão se a administração precoce de antimaláricos em pacientes de LEC, com potencial de desenvolver doença sistêmica, poderia prevenir a progressão a LES ou atenuar danos a órgãos vitais, uma vez instalada a doença sistêmica.52
Recomenda‐se seguimento periódico, a intervalos mais curtos, de pacientes com LEC que apresentam fatores de risco para progressão a LES, com exame clínico minucioso e adequada revisão laboratorial.52
TratamentoO tratamento do LEC envolve medidas farmacológicas e não farmacológicas. Escolher a terapia mais eficaz para cada caso pode ser desafiador e exige atenção às manifestações clínicas e familiaridade com as terapias disponíveis. É importante avaliar a adesão do paciente ao tratamento em cada consulta.55 Embora existam apenas três fármacos aprovados pela agência norte‐americana Food and Drug Administration (FDA) para uso no LES – corticosteroides, hidroxicloroquina e belimumabe – e nenhuma aprovada especificamente para LEC, é possível encontrar dados na literatura que permitem racionalizar a abordagem terapêutica.56
Medidas geraisA fotoproteção é pilar fundamental do tratamento do LEC. Os fotoprotetores podem prevenir o surgimento de lesões nos pacientes com LEC.1,55–58 Entretanto, outras medidas de cuidado também se somam a seu uso, como mudanças comportamentais, uso de chapéus e vestes longas, preferencialmente com tecnologia para proteção à RUV.6,58,59
A cessação do tabagismo deve ser averiguada e encorajada a cada consulta, de preferência com referenciamento do paciente a programas e terapias de apoio.6,57 A suplementação de vitamina D nos pacientes com deficiência pode ser benéfica para o controle da doença.56,57,60 Em caso de LEC induzido por fármacos, a medicação suspeita deve ser prontamente suspensa.6
Contracepção pode ser necessária quando do uso de fármacos teratogênicos. Mulheres com LEC podem utilizar contraceptivos orais combinados, se não houver história de tromboembolismo ou altos níveis de anticorpos antifosfolípides; caso contrário, deve‐se optar por dispositivo intrauterino ou uso de progestágenos isolados.45,61
O uso de camuflagem cosmética e próteses de cabelos podem ocultar cicatrizes e alopecia, melhorando a qualidade de vida e a autoestima dos pacientes.59,62 É importante que pacientes com LEC sejam orientados a evitar intervenções que traumatizem a pele, pelo risco de koebnerização.62
Tratamento tópicoOs corticosteroides são considerados a primeira linha de tratamento tópico, por seu efeito anti‐inflamatório.1,6 Podem ser utilizados nos casos de lesões localizadas ou como terapia adjuvante nos pacientes em tratamento sistêmico. Corticosteroides potentes, como o clobetasol, são mais eficazes para o controle da doença que os de baixa potência.56,61 Entretanto, essas medicações estão associadas a maior risco de efeitos colaterais, como estrias e telangiectasias, por seu efeito nos fibroblastos e vasos sanguíneos, respectivamente, além de dermatite perioral rosaceiforme.6,60 Por isso, a terapia com corticosteroides tópicos potentes deve ser usada pelo menor tempo possível. A injeção intralesional de corticoide pode ser aplicada em lesões hipertróficas localizadas.6,55
Os inibidores tópicos da calcineurina – tacrolimo 0,03% ou 0,1% em pomada e pimecrolimo 1% em creme – podem ser utilizados como substitutos dos corticosteroides nos casos que exijam tratamento prolongado ou com maior risco de efeitos colaterais, como lesões na face de crianças.55,61 São menos eficazes que os corticoides tópicos potentes.1 Os efeitos colaterais relacionados ao uso dessas medicações incluem sensação de ardência, prurido e eritema no local da aplicação.57 Alguns estudos mostraram bons resultados com a aplicação combinada de clobetasol 0,05% e tacrolimo 0,03%.
O R‐salbutamol é um agonista do receptor β2‐adrenérgico que inibe a produção de IL‐2 e IFN‐γ, podendo melhorar lesões de LEC, quando utilizado a 0,5% em creme.55,60 Entretanto, não é comercialmente disponível para uso tópico.60 Os retinoides tópicos já foram utilizados com sucesso em algumas pequenas séries de casos.60
Tratamento sistêmicoPacientes com lesões localizadas refratárias ao tratamento tópico ou com lesões disseminadas geralmente necessitam de tratamento sistêmico.61 A tabela 5 mostra o nível de evidência e o grau de recomendação dos principais medicamentos de uso sistêmico no tratamento do LEC.
Nível de evidência e grau de recomendação dos principais medicamentos de uso sistêmico no lúpus eritematoso cutâneo
| Medicação | Nível de evidênciaa | Grau de recomendaçãob |
|---|---|---|
| Hidroxicloroquina | 1 | A |
| Acitretina | 2 | B |
| Isotretinoína | 2 | B |
| Metotrexato | 4 | |
| Dapsona | 4 | |
| Talidomida | 2 | A |
| Micofenolato de mofetila | 2 | B |
| Azatioprina | 4 | |
| Belimumabe | 2 | B |
Adaptado de Yan et al., 2020.[58].
Nível de evidência: 1 – Ensaio clínico randomizado (ECR), revisões sistemáticas (RS)/metanálise de ECR; 2 – RS de estudos de coorte, coortes; 3 – RS de estudos caso‐controle, estudos de caso‐controle; 4 – Série de casos, coorte e caso‐controle de baixa qualidade; 5 – Opinião de especialistas.
Grau de recomendação: A – Estudos observacionais ou experimentais de maior consistência (metanálises ou ECR); B – Estudos observacionais de menor consistência (outros ensaios clínicos não randomizados ou observacionais ou caso‐controle); C – Relatos ou séries de casos (estudos não controlados); D – Opinião desprovida de avaliação crítica, baseadas em consensos, estudos fisiológicos ou modelos animais.
Os antimaláricos (AM) constituem a primeira linha de tratamento sistêmico; é provável que previnam a progressão do LEC para doença sistêmica.6,59,61,63 São capazes de inibir a apresentação de antígenos pelas CDP, a formação de complexos antígeno‐anticorpo e a sinalização via receptores Toll‐like, reduzindo a produção de IFN tipo I.14,55,59 A hidroxicloroquina (HCQ) é o AM mais utilizado pelo melhor perfil de segurança quanto à toxicidade ocular em relação à cloroquina (CQ). A dose recomendada de HCQ, em parte da literatura, é de 6,5 mg/kg/dia.55 Contudo, em 2016, a American Academy of Ophthalmology recomendou que doses maiores que 5 mg/kg/dia de HCQ e 2,3 mg/kg/dia de CQ sejam evitadas, por risco aumentado de retinopatia.58
O índice de resposta dos AM é de cerca de 63% dentre os diversos subtipos de LEC e pode ser um pouco maior para a CQ em relação à HCQ.64 A taxa média de resposta foi de 91% nos casos de LECA, 57% no LED e apenas 31% no LE perniótico.64 Pacientes de LECC tendem a responder mais lentamente aos AM que aqueles de LECA.56
Em casos refratários, um AM pode ser substituído por outro – HCQ por CQ ou CQ por HCQ; nesses casos, a taxa de resposta ao segundo AM pode chegar a 56%, mas cair para 42% após um ano e 22% após dois anos.4,6,45,60,64 A adição de quinacrina, fármaco não disponível no Brasil, na dose de 100‐200 mg/dia, nos casos refratários aos AM em monoterapia, pode aumentar a taxa de resposta para 66%, sem aumentar o risco de retinopatia.45,57,58,61,64 O uso de AM durante a gestação e lactação é recomendado, especialmente nas pacientes com lesões cutâneas e LES, podendo reduzir o risco de acometimento cardíaco pelo LE neonatal.65
Os efeitos colaterais dos AM incluem náuseas, vômitos, pigmentação cutânea, tonteira, cefaleia, ototoxicidade e neuropatia periférica.6 A retinopatia é o efeito colateral mais relevante e ocorre em até 1% dos casos.6 Os pacientes devem ser avaliados no início do tratamento e, caso não tenham nenhum fator de risco adicional, anualmente, após o quinto ano de uso do medicamento.61 Pacientes com doses acima de 5,0 mg/kg/dia, insuficiência renal, uso concomitante de tamoxifeno e maculopatia retiniana preexistente estão sob maior risco de retinopatia e devem ser monitorados com maior frequência.56 A campimetria e o exame de fundo de olho podem não detectar alterações iniciais; a tomografia de coerência óptica é recomendada para auxiliar no diagnóstico precoce.65 Existem raros relatos de toxicidade cardíaca, com prolongamento do intervalo QT.65
Quando disponível, a dosagem sérica de HCQ pode ser utilizada para avaliação do tratamento após seis meses de uso sem resposta.45,60 Valores inferiores a 200 ng/mL indicam má‐adesão ao tratamento, enquanto valores acima de 750 ng/mL estão correlacionados a melhores taxas de controle da atividade da doença.45,56 Pacientes com contraindicação aos AM ou com dose otimizada de AM, mas sem resposta ou com resposta parcial, têm indicação de fármacos de segunda linha de tratamento. Tabagistas são mais propensos a não responderem aos AM.57
MetotrexatoO metotrexato (MTX) é a primeira escolha dentre os fármacos de segunda linha para pacientes refratários ou com contraindicação ao uso dos AM.55,66 É um inibidor da diidrofolato‐redutase, que afeta a replicação celular e suprime a produção de anticorpos.59 A dose recomendada pode variar de 7,5‐25 mg/semana, via oral ou subcutânea. Os efeitos colaterais são náuseas, vômitos, dor abdominal, hepatotoxidade, ulceração de mucosas, supressão medular.4,55,60 A aplicação subcutânea e a administração de ácido fólico nos dias posteriores ao uso da medicação podem reduzir significantemente os efeitos colaterais gastrintestinais.58,61 Os pacientes devem ser monitorados laboratorialmente nas primeiras semanas de uso, após aumento das doses e, trimestralmente, no acompanhamento regular.
O uso de MTX deve ser evitado em pacientes etilistas, naqueles em uso concomitante de fármacos hepatotóxicos, com esteatose hepática grave, insuficiência renal ou doença hepática de base, incluindo hepatites virais, condições que devem ser pesquisadas antes do início do tratamento com MTX.58,61 O risco de hepatoxicidade fora dessas condições é baixo.61 Pneumonite intersticial é complicação rara e potencialmente fatal.4,55 MTX é teratogênico e deve ser recomendada contracepção adequada.60
Retinoides sistêmicosOs retinoides são utilizados com sucesso no tratamento de LEC refratário, especialmente nas formas verrucosas.6,55,61 Eles inibem a produção de citocinas pró‐inflamatórias, como a IL‐6 e o IFN‐γ, além de regular e normalizar a diferenciação dos ceratinócitos.55 Dados da literatura não mostram diferença significante de eficácia entre HCQ e acitretina em pacientes com diferentes subtipos de LEC.57 A isotretinoína também já foi utilizada em pequenas séries de casos.6
A dose de acitretina e isotretinoína é de 0,2‐1,0 mg/kg/dia. A resposta, em geral, é rápida e ocorre em duas a seis semanas. A recidiva também costuma sobrevir logo após a interrupção da medicação.61
Pacientes em uso de retinoides devem ser monitorados regularmente pelo risco de hepatotoxicidade e aumento dos níveis séricos de triglicérides.6 Outros efeitos colaterais incluem xerose mucocutânea e alterações ósseas, como a hiperostose.67 O uso de fotoprotetores deve ser intensificado, pelo risco de agravamento da fotossensibilidade.67 Em decorrência do risco de teratogenicidade, mulheres em idade fértil devem ser submetidas a contracepção adequada durante e após o término do tratamento (isotretinoína, até um mês, e acitretina, até dois a três anos).6,55
DapsonaA dapsona é agente imunomodulador e antimicrobiano que inibe a mieloperoxidase presente em neutrófilos e monócitos.6,59,68 Pode ser usada isoladamente ou em combinação com os AM. Mais de 50% dos pacientes com LEC respondem favoravelmente ao uso da dapsona, inclusive aqueles com LED, subtipo classicamente mais resistente, em que a taxa de resposta se aproxima de 60%.6,68 A dapsona é considerada fármaco de primeira escolha no tratamento do LE bolhoso e de outras manifestações neutrofílicas no LE, como a urticária vasculite.56,61 As variantes hiperceratósicas usualmente não respondem bem à dapsona.55
A dose inicial é de 50 mg/dia e pode ser aumentada até 200 mg/dia.55,61 Os pacientes devem ser avaliados quanto à deficiência de glicose‐6‐fosfatodesidrogenase antes do início do tratamento.58
Os efeitos colaterais podem ser graves, como erupção ao fármaco com eosinofilia e sintomas sistêmicos, a síndrome DRESS (do inglês, drug reaction with eosinophilia and systemic symptoms), meta‐hemoglobinemia e agranulocitose.55,57 Anemia hemolítica pode ocorrer em até 50% dos pacientes.57,68 Os níveis de hemoglobina devem ser monitorados durante o primeiro mês de tratamento e, então, a cada três meses. Os níveis de meta‐hemoglobina podem ser avaliados entre o 8° e 14° dia após a introdução da medicação.60 A dapsona é o único fármaco de segunda linha que pode ser utilizado durante a gestação e a amamentação.60,61
Micofenolato de mofetilaO micofenolato de mofetila (MFM) é considerado agente de terceira linha para o tratamento do LEC.55 O MFM causa depleção do trifosfato de guanosina, necessário para adesão de linfócitos e monócitos ao endotélio durante o processo de inflamação, além de induzir apoptose de linfócitos T e reduzir a ativação dos linfócitos B.55 Foi relatada uma taxa de resposta completa ou significante em 62% dos pacientes de LEC.6 MFM pode ser usado isoladamente ou em combinação com AM.4 A dose inicial é de 500 mg/dia e pode ser aumentada até 3 g/dia.61
Os efeitos colaterais mais frequentes são gastrintestinais, citopenias, hepatotoxicidade e infecções virais e urinárias.55 Os pacientes devem realizar revisões laboratoriais mensalmente.61 O fármaco é da categoria X e não pode ser utilizado durante a gestação.55
AzatioprinaA azatioprina é um análogo da purina que deprime a função dos linfócitos T e B e reduz a apresentação de antígenos.59 Pode ser indicada no LEC em caso de insucesso dos tratamentos descritos anteriormente.6 Séries de caso têm mostrado sucesso no tratamento do LEC, embora não existam grandes estudos que suportem essa recomendação.6 Pode ser usada nas gestantes com LES, mas sua relação risco‐benefício deve ser ponderada.6 A dose recomendada é de 1‐3 mg/kg/dia. Os efeitos adversos são gastrintestinais, infecções oportunistas e citopenias.58
TalidomidaA talidomida é um fármaco utilizado como terapia de resgate nos casos graves, refratários e com alto risco de formação de cicatrizes.66 Atua inibindo a síntese de TNF‐α, a angiogênese e a apoptose de ceratinócitos induzida pela RUV, reduzindo a produção de IFN‐γ e a fagocitose por polimorfonucleares.55,69 A taxa de resposta é superior a 90% nos diferentes subtipos de LEC, a mais alta dentre todos os tratamentos disponíveis.6,57,70 Porém, com alto risco de recaídas, de até 70%, após a suspensão da medicação, especialmente no LED.6,56,70 A dose inicial recomendada é de 100 mg/dia, que deve ser reduzida assim que a resposta clínica for alcançada.61
A alta frequência de eventos adversos pode limitar seu uso, afetando 24% dos pacientes (16% com neuropatia periférica e 2% com eventos tromboembólicos).56,70 A polineuropatia é classicamente simétrica, dolorosa e afeta mãos e pés. É usualmente acompanhada de perda sensorial e preservação da força muscular.69 Deve ser realizada eletroneuromiografia no início do tratamento e, como controle, a cada seis meses.69 Outros efeitos colaterais são sedação, hipotensão ortostática, erupção maculopapular, constipação e xerostomia.67,69
A teratogenicidade é um dos efeitos colaterais mais temíveis relacionados ao uso da talidomida.69 Seu uso em mulheres em idade fértil deve ser excepcional e apenas após falha de todos os tratamentos disponíveis. Nesses casos, recomenda‐se a adoção de dois métodos contraceptivos, um de alta efetividade e o outro de barreira. Deve ser realizado teste de gravidez 24 horas antes do início do tratamento, repetido semanalmente no primeiro mês e, posteriormente, a cada duas a quatro semanas.69
Ácido acetilsalicílico, em baixas doses, pode ser associado à talidomida em pacientes com alto risco cardiovascular ou presença de anticorpos antifosfolípides.60,69
A lenalidomida, um derivado da talidomida, exibe melhor perfil de segurança quanto ao risco de neuropatia, porém ainda existem poucos dados na literatura sobre seu uso em pacientes com LEC.6,61 Alguns autores contraindicam seu uso no LEC devido ao risco de induzir LES.61
Corticosteroides sistêmicosOs corticosteroides sistêmicos podem ser utilizados no início do tratamento das formas agressivas e disseminadas de LEC, até que as outras medicações iniciem sua ação terapêutica. Devem ser reduzidos e suspensos o mais brevemente possível.1,6 Apresentam maior taxa de resposta no LECA, provavelmente pela associação com LES.61 A dose usual é de 0,5‐1 mg/kg/dia de prednisona e deve ser reduzida, logo que possível, até atingir doses diárias inferiores a 7,5 mg. A terapia de longo prazo com corticosteroides sistêmicos não é indicada no LEC.60,61
Outros tratamentosA clofazimina apresenta propriedades antimicrobianas, anti‐inflamatórias e imunossupressoras.59 A dose é de 100‐200 mg/dia e pode ser utilizada como tratamento adjuvante.55 Os principais efeitos colaterais são hiperpigmentação cinza‐acastanhada, xerose cutânea, náuseas e vômitos.55 Os ésteres do ácido fumárico já foram usados com sucesso no LED, porém os dados ainda são limitados na literatura.6,57
O uso de antiagregantes plaquetários é recomendado nos pacientes com livedo racemoso, lesões do tipo papulose maligna atrófica (doença de Degos), ulceração, tromboflebite e anetodermia.45
O uso de pulsed‐dye‐laser (laser pulsado de corante) é descrito como tratamento de cicatrizes. Entretanto, dado o risco de fotossensibilidade, seu uso não é recomendado na presença de lesões cutâneas ativas.6,7,61
Ciclosporina, ciclofosfamida e imunoglobulina endovenosa não são indicadas no tratamento do LEC sem acometimento sistêmico.1,61
Terapias‐alvoOs avanços na compreensão da patogênese, especialmente das vias de ativação dos sistemas imunes inato e adaptativo, abriram um novo campo de pesquisa para uma nova geração de fármacos, os chamados imunobiológicos.56 Os principais alvos terapêuticos são as vias de ativação das células B, células T e CDP, além das citocinas pró‐inflamatórias, seus receptores e vias de sinalização intracelular, como IL‐6, IL‐12, IL‐23, IFN e via de sinalização JAK/STAT.1,14,60
Alvo nas células B: o belimumabe é um anticorpo monoclonal contra o fator de ativação de células B (Blys), aprovado pelo FDA para uso no LES. Os estudos originais não incluíram análise específica do desfecho das lesões cutâneas, embora análises posteriores tenham demonstrado melhora do quadro cutâneo. A eficácia no LEC está em investigação em estudos de fase III.1 Três estudos observacionais, com uso do rituximabe, anticorpo monoclonal anti‐CD20, nas manifestações mucocutâneas do LE, apresentaram taxas de resposta variando entre 35% e 76%. Resposta mais favorável foi verificada no LECA – no entanto, sem evidência de efeito benéfico nos subtipos subagudo e crônico do LEC.57
Alvo nas vias do interferon: as tentativas de inibição específica dos IFN não apresentaram resultados satisfatórios nos ensaios clínicos, provavelmente pela grande redundância entre os diferentes tipos de IFN.1 O bloqueio do receptor de IFN apresenta uma perspectiva mais animadora. O anifrolumabe, um anticorpo monoclonal contra o receptor do IFN tipo I, reduziu os escores de atividade das lesões cutâneas em pacientes com LES em ensaio clínico de fase IIb.1
Alvo na via JAK/STAT: essa via é importante para o mecanismo de retroalimentação positiva do IFN. A primeira geração de inibidores – baricitinibe e ruxolitinibe – mostrou eficácia em pequeno número de pacientes com LE perniótico. A segunda geração de inibidores está sendo testada em ensaios clínicos.14
Considerações finaisLEC é doença autoimune multifatorial, resultante da interação de fatores ambientais, genéticos e imunológicos, que se apresenta com variada manifestação dermatológica. O reconhecimento do subtipo clínico é importante na abordagem diagnóstica, na decisão terapêutica e na determinação do prognóstico, tanto na doença exclusivamente cutânea quanto no contexto do LES.
Critérios diagnósticos para definição dos diferentes subtipos de LEC ainda são incipientes. Aguardam‐se critérios mais assertivos que possam ser futuramente incorporados na prática clínica e nos ensaios terapêuticos, auxiliando na avaliação das manifestações cutâneas do LE.
Fotoproteção, corticosteroides tópicos e antimaláricos ainda permanecem como primeira linha no tratamento do LEC. Medicações alternativas de uso sistêmico incluem MTX, retinoides orais, dapsona e talidomida, entre outros. Com o avanço no conhecimento da patogênese da doença, novas estratégias terapêuticas vêm sendo desenvolvidas, tendo como alvos as diferentes vias de ativação imune que têm sido identificadas.
Suporte financeiroNenhum.
Contribuição dos autoresEverton Carlos Siviero do Vale: Concepção e desenho do estudo; Revisão crítica da literatura; Elaboração e redação do manuscrito; Revisão crítica do manuscrito; Aprovação da versão final do manuscrito.
Lucas Campos Garcia: Revisão crítica da literatura; Elaboração e redação do manuscrito; Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Vale EC, Garcia LC. Cutaneous lupus erythematosus: a review of etiopathogenic, clinical, diagnostic and therapeutic aspects. An Bras Dermatol. 2023;98:355–72.
Trabalho realizado no Serviço de Dermatologia, Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.