As reações adversas a medicamentos são frequentes, e a manifestação cutânea (farmacodermia) é a forma mais comum. No ambiente hospitalar, a incidência das farmacodermias varia de 2 a 3%.
ObjetivoAnalisar o perfil das farmacodermias, relacionando formas clínicas, medicações suspeitas, alterações histopatológicas, repercussões sistêmicas, tratamento e evolução.
MétodosEstudo clínico, retrospectivo e observacional, de pacientes atendidos pela equipe de Interconsulta de Dermatologia no período de janeiro de 2013 a dezembro de 2016.
ResultadosA frequência de farmacodermias entre os pacientes avaliados foi de 13,6%, com 219 casos diagnosticados. Em 65,7% a reação foi considerada leve (a mais comum delas foi o exantema), enquanto em 34,2% a reação foi considerada grave (DRESS foi a principal forma [18,2%]). Dos medicamentos envolvidos, destacaram‐se antibióticos (36,5%) e anticonvulsivantes (10%). Como tratamento, além da suspensão do medicamento, em 47% dos casos foi prescrito corticosteroide sistêmico, e em 4,5%, imunoglobulina intravenosa (IgIV). Dentre as formas leves, em 62% foi adotada conduta expectante e/ou uso exclusivo de sintomáticos.
Limitações do estudoEstudo retrospectivo, com limitações inerentes a esse tipo de estudo; falta de algumas informações em prontuários; período de avaliação antigo, com possível mudança na validade externa.
ConclusãoA forma clínica mais frequentemente encontrada foi o exantema, e antibióticos e anticonvulsivantes foram as classes medicamentosas mais envolvidas. Cerca de 1/3 dos pacientes apresentou formas graves de farmacodermia – DRESS foi a principal. Farmacodermias são frequentes na prática clínica, e o dermatologista deve ser convocado o quanto antes para auxiliar no diagnóstico e na condução desses casos.
Segundo a Organização Mundial da Saúde (OMS), reação adversa a medicamento é definida como qualquer resposta nociva e não intencional ao uso de medicamento e que ocorre em doses normalmente utilizadas em seres humanos para profilaxia, diagnóstico ou tratamento de doenças.1 As reações cutâneas adversas a medicamentos, ou farmacodermias, são frequentes, correspondendo a 10 a 15% de todos os casos reportados de reações adversas a medicamentos.2 No ambiente hospitalar, a incidência relatada varia de 2 a 3% e contempla desde casos leves e autolimitados a reações graves, podendo causar morbidade e mortalidade significativas.3
No Brasil, poucos trabalhos foram publicados acerca do tema e apenas dois deles avaliaram a prevalência e as formas clínicas das farmacodermias no ambiente hospitalar. No primeiro estudo, publicado em 1984 por Weissbluth et al.,4 12,3% dos pacientes avaliados por serviço de interconsulta tinham diagnóstico de farmacodermia, enquanto na segunda pesquisa, publicada em 2015 por Botelho et al.,5 esta porcentagem foi de 8,2%.
Este estudo visa analisar o perfil das farmacodermias em pacientes internados em um hospital quaternário, com caracterização de: perfil demográfico (gênero, idade e fototipo), formas clínicas, medicações suspeitas, alterações histopatológicas, presença de repercussões sistêmicas, tratamento instituído e evolução dos pacientes.
MétodosTrata‐se de estudo clínico, retrospectivo, observacional e descritivo, cujo início se deu após aprovação do Comitê de Ética em Pesquisa da Instituição (número de protocolo CAAE 59323616.0.0000.5505). Foram incluídos todos os pacientes atendidos por serviço de Interconsulta de Dermatologia de hospital quaternário com diagnóstico de farmacodermia no período de janeiro de 2013 a dezembro de 2016, totalizando 48 meses de atendimento na análise.
A amostra coletada foi de 219 pacientes. Foram excluídos casos em que dados essenciais estavam incompletos e cuja recuperação não foi possível por extravio dos prontuários ou outros motivos. A coleta de dados foi realizada por meio de revisão do banco de dados eletrônico organizado pelo Setor de Dermatologia Hospitalar da Instituição e da pesquisa a prontuários manuais e eletrônicos dos pacientes no servidor do Hospital. Quando necessário, foram levantados exames complementares realizados durante a internação e revisão histológica das biópsias de pele. Fotografias também foram consultadas para melhor caracterização da forma clínica de farmacodermia. Para definição de causas da farmacodermia, foram levados em consideração os medicamentos utilizados pelo paciente em período de até 14 dias antes do início das lesões cutâneas.
ResultadosDados demográficosDentre os 1.607 pacientes atendidos pela interconsulta da dermatologia no período de 48 meses, 219 casos foram diagnosticados com farmacodermia, correspondendo a 13,6%. Dos 219 pacientes incluídos na amostra, 111 eram mulheres (50,6%) e 108 homens (49,6%). A idade média dos pacientes atendidos foi de 47 anos, e a mediana de 49 – mínima de 1 e máxima de 95 anos. O fototipo III foi o mais prevalente.
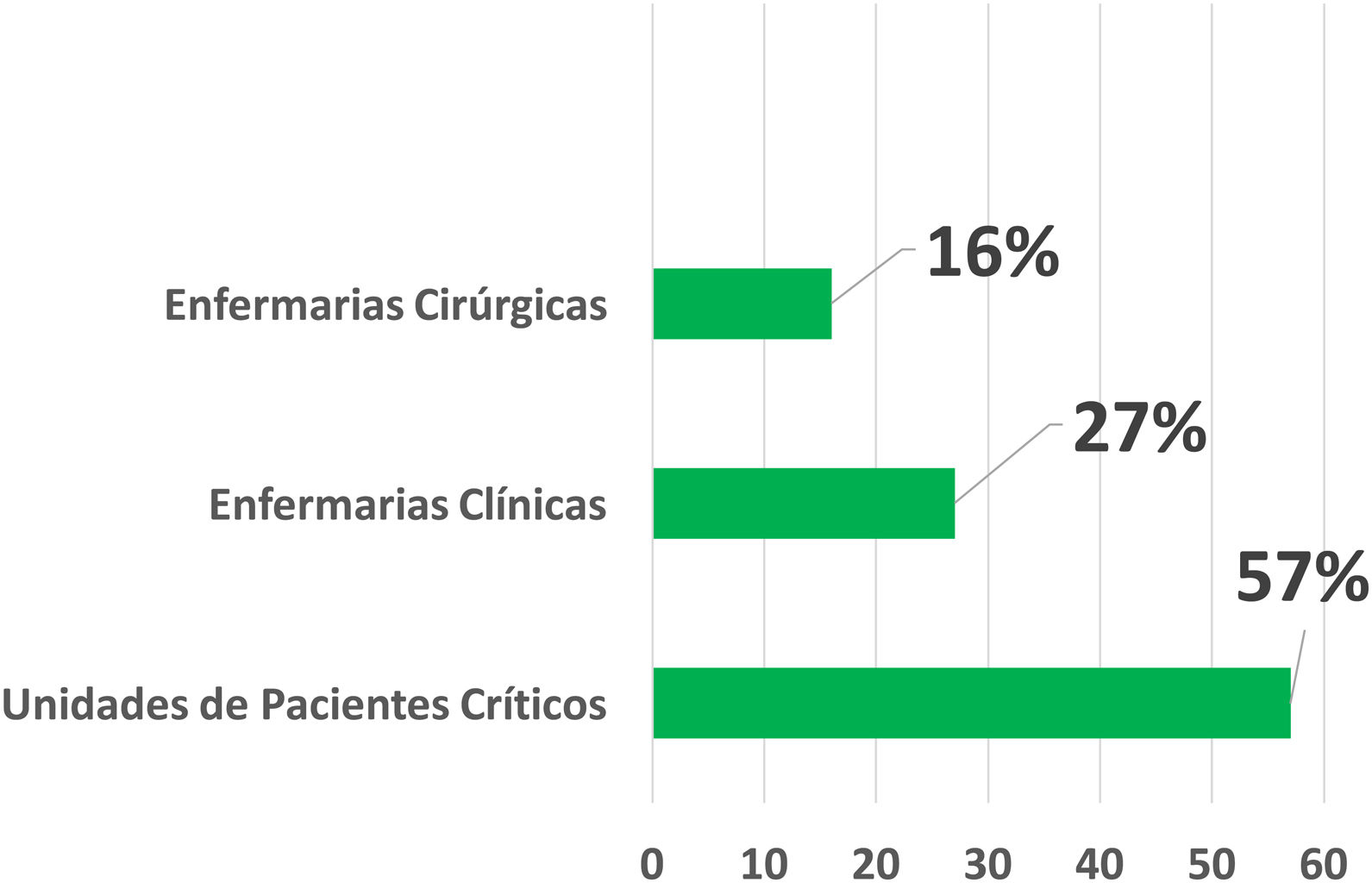
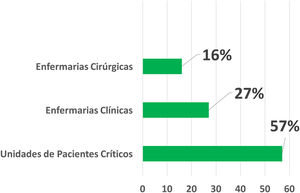
Unidade de internaçãoNa amostra analisada, a maior parte das interconsultas para os casos de farmacodermia (57%) foi solicitada por unidades de internação de pacientes críticos, das quais 61 (48,8%) partiram do pronto‐socorro, 42 (33,6%) de unidades de terapia intensiva, 13 (10,4%) do Hospital de Rim e Hipertensão e 9 (7,2%) de unidades de transplantados.
As solicitações que partiram de enfermarias clínicas foram responsáveis por 26,9% do total, a maioria recebida da enfermaria de clínica médica (35,6%). O total de solicitações recebido por enfermarias cirúrgicas foi de 35 (15,9%), e dentre as especialidades, destacaram‐se a neurocirurgia e ortopedia, com sete solicitações cada (fig. 1).
Solicitação de interconsulta da dermatologia de acordo com a unidade de internação. Unidades de pacientes críticos: hospital do rim e hipertensão, pronto‐socorro, unidades de terapia intensiva e unidades de transplante. Enfermarias clínicas: medicina interna, hematologia, infectologia, endocrinologia, gastroenterologia, geriatria, nefrologia, neurologia, pediatria, reumatologia e unidade de atendimento por convênio. Enfermarias cirúrgicas: neurocirurgia, ortopedia, urologia, gastrocirurgia, cir. cardíaca, cir. pediátrica, cir. plástica, cir. vascular, ginecologia, obstetrícia, oftalmologia e otorrinolaringologia.
O tempo decorrido desde o início dos sintomas variou de um dia a sete semanas; na média, os pacientes apresentavam seis dias de manifestação cutânea quando a interconsulta da dermatologia foi solicitada.
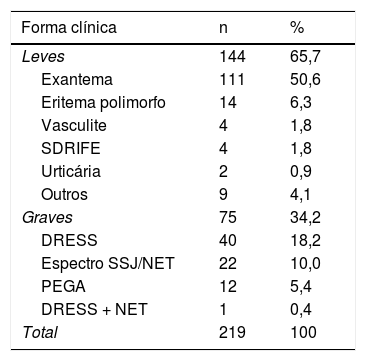
Quanto às formas clínicas, as reações cutâneas induzidas por drogas foram divididas em leves (exantema, eritema polimorfo, vasculite, urticária, SDRIFE, eritrodisestesia palmo plantar) e graves (reação a droga com eosinofilia e sintomas sistêmicos – DRESS; espectro Síndrome de Stevens‐Jonhson – SSJ / necrólise epidérmica tóxica – NET; pustulose exantemática generalizada aguda – PEGA).1 Em 144 casos (65,7%) a reação foi considerada leve, enquanto em 75 (34,2%) foi considerada grave. A distribuição dos casos encontra‐se na tabela 1.
Formas clínicas das farmacodermias
| Forma clínica | n | % |
|---|---|---|
| Leves | 144 | 65,7 |
| Exantema | 111 | 50,6 |
| Eritema polimorfo | 14 | 6,3 |
| Vasculite | 4 | 1,8 |
| SDRIFE | 4 | 1,8 |
| Urticária | 2 | 0,9 |
| Outros | 9 | 4,1 |
| Graves | 75 | 34,2 |
| DRESS | 40 | 18,2 |
| Espectro SSJ/NET | 22 | 10,0 |
| PEGA | 12 | 5,4 |
| DRESS + NET | 1 | 0,4 |
| Total | 219 | 100 |
SDRIFE, exantema flexural e intertriginoso simétrico relacionado a droga; DRESS, reação a droga com eosinofilia e sintomas sistêmicos; SSJ, síndrome de Stevens‐Johnson; NET, necrólise epidérmica tóxica; PEGA, pustulose exantemática generalizada aguda.
Dos pacientes que apresentaram reações leves, a forma clínica mais frequente foi o exantema, que correspondeu a mais de 50% da amostra total de pacientes. Outras formas menos prevalentes foram: eritema polimorfo (6,3%), exantema flexural e intertriginoso simétrico relacionado a droga (“symmetrical drug related intertriginous and flexural exanthema” – SDRIFE) (1,8%), vasculite (1,8%) e urticária (0,9%).
Em relação às formas graves de farmacodermia, o diagnóstico mais prevalente foi DRESS (40 casos – 18,2%), seguido pelo espectro SSJ/NET (22 casos – 10%) e PEGA (12 casos – 5,4%). Em um caso, verificou‐se sobreposição de DRESS e NET.
Os pacientes que não se incluíam em nenhuma das categorias acima e apresentavam formas clínicas leves foram agrupados em “outros” – dois destes apresentaram eczema, três reações específicas por quimioterápicos, uma erupção disidrosiforme, uma erupção liquenóide, um púrpura e um úlcera por everolimus.
Medicamentos envolvidosDentre os medicamentos atribuídos como causa das farmacodermias destacaram‐se os antibióticos (36,5%). Os mais frequentes foram: vancomicina (71 casos), meropenem (70 casos), ceftriaxone (36 casos) e polimixina B (29 casos). Outros antibióticos envolvidos com frequência considerável (dez ou mais casos) foram teicoplanina, clindamicina, tazocin, metronidazol, ciprofloxacina, cefepime, amicacina, sulfametoxazol‐trimetoprim, cefalotina e linezolida. Houve envolvimento episódico (menos de dez casos) de oxacilina, amoxicilina + clavulanato, claritromicina, ampicilina, gentamicina, rifampicina, levofloxacina, azitromicina, penicilina, pirimetamina e eritromicina.
A segunda classe de medicamentos mais associados à farmacodermia foi a dos anticonvulsivantes (10%), dentre os quais destacam‐se fenitoína (26 casos), carbamazepina (nove casos) e fenobarbital (quatro casos).
Medicações de outras classes associadas aos casos de farmacodermia foram antifúngicos (fluconazol, anfotericina B e voriconazol), anti‐inflamatórios não hormonais (diclofenaco, ibuprofeno, meloxicam), analgésicos (dipirona, tramadol, morfina), neurolépticos (quetiapina, clonazepam, diazepam, risperidona, haloperidol), quimioterápicos e outros (alopurinol, hidroclorotiazida, furosemida, amiodarona, everolimus e oseltamivir), todas com envolvimento episódico.
As mesmas classes estavam presentes e com distribuição semelhante quando foram analisadas isoladamente as formas graves de farmacodermias (tabela 2).
Medicamentos suspeitos nas reações adversas a medicamentos
| Classe terapêutica | Todas as formas de farmacodermia | % | Formas graves | % |
|---|---|---|---|---|
| Antibióticos | 80 | 36,5 | 24 | 32 |
| Anticonvulsivantes | 22 | 10,0 | 16 | 21,3 |
| Derivados pirazolônicos (dipirona) | 4 | 1,8 | 2 | 2,6 |
| Quimioterápicos | 4 | 1,8 | ||
| AINEs (anti‐inflamatórios não esteroidais) | 3 | 1,3 | 1 | 1,3 |
| Alopurinol | 1 | 1,3 | ||
| Outros | 13 | 5,9 | 2 | 2,6 |
| Não identificável | 93 | 42,3 | 29 | 38,6 |
| Total | 219 | 100 | 75 | 100 |
Em 93 casos (42,3%), não foi possível identificar o medicamento responsável pela farmacodermia, seja por uso prévio à internação ou por uso de duas ou mais classes de medicamentos correlacionados temporalmente à manifestação cutânea.
Exames complementaresDentre a amostra total de 219 pacientes, constatou‐se aumento de eosinófilos no hemograma (valor de referência acima de 500 uL) em 115 casos, correspondendo a um total de 52,5%. A distribuição dos casos em que houve eosinofilia foi semelhante entre as formas leves (54%) e graves (46%) de farmacodermia. No entanto, o nível médio de eosinófilos nas formas leves foi de 514,22 uL, enquanto nas formas graves foi de 1925,84 uL. Nas formas leves tal alteração laboratorial foi mais prevalente nos quadros de exantema (87%), enquanto nas formas graves houve predomínio nos quadros de DRESS (74%), embora tenham ocorrido também em sete casos do espectro SSJ/NET (31,8%) e sete casos de PEGA (58,3%). Considerando somente os casos de DRESS, a eosinofilia média foi ainda mais expressiva (3267,55/uL), com variação de 654 a 17.280 uL.
Em 82,6% dos casos foi realizado exame histopatológico por meio de biópsia das lesões cutâneas para confirmação do diagnóstico de farmacodermia. Nas formas leves (144 casos), o principal achado histológico foi dermatite de interface com infiltrado inflamatório (40% – 58 casos), seguido de vasculite (8% – 12 casos), eritema multiforme (sete casos) e dermatite urticariforme (seis casos). Os achados inespecíficos somaram 18% (27 casos). Em 34 dos 144 pacientes (23,6%) o exame não foi realizado. Dentre as formas graves de farmacodermias (75 casos), o achado mais prevalente também foi dermatite de interface com ou sem necrose de ceratinócitos (81% – 47 casos), seguidos dos achados compatíveis com PEGA (sete casos), eritema multiforme (dois casos) e urticária (dois casos). Em 13 pacientes o estudo histológico foi inespecífico (17%), sendo que em sua maioria eram casos de DRESS (9/13 casos). O exame não foi realizado em quatro pacientes dentre os que apresentaram formas graves.
CondutaQuanto à conduta adotada pela equipe da dermatologia, em todos os casos foi orientada a retirada da medicação suspeita, apesar de nem sempre ser possível, e a redução da prescrição ao mínimo necessário, a critério da equipe responsável.
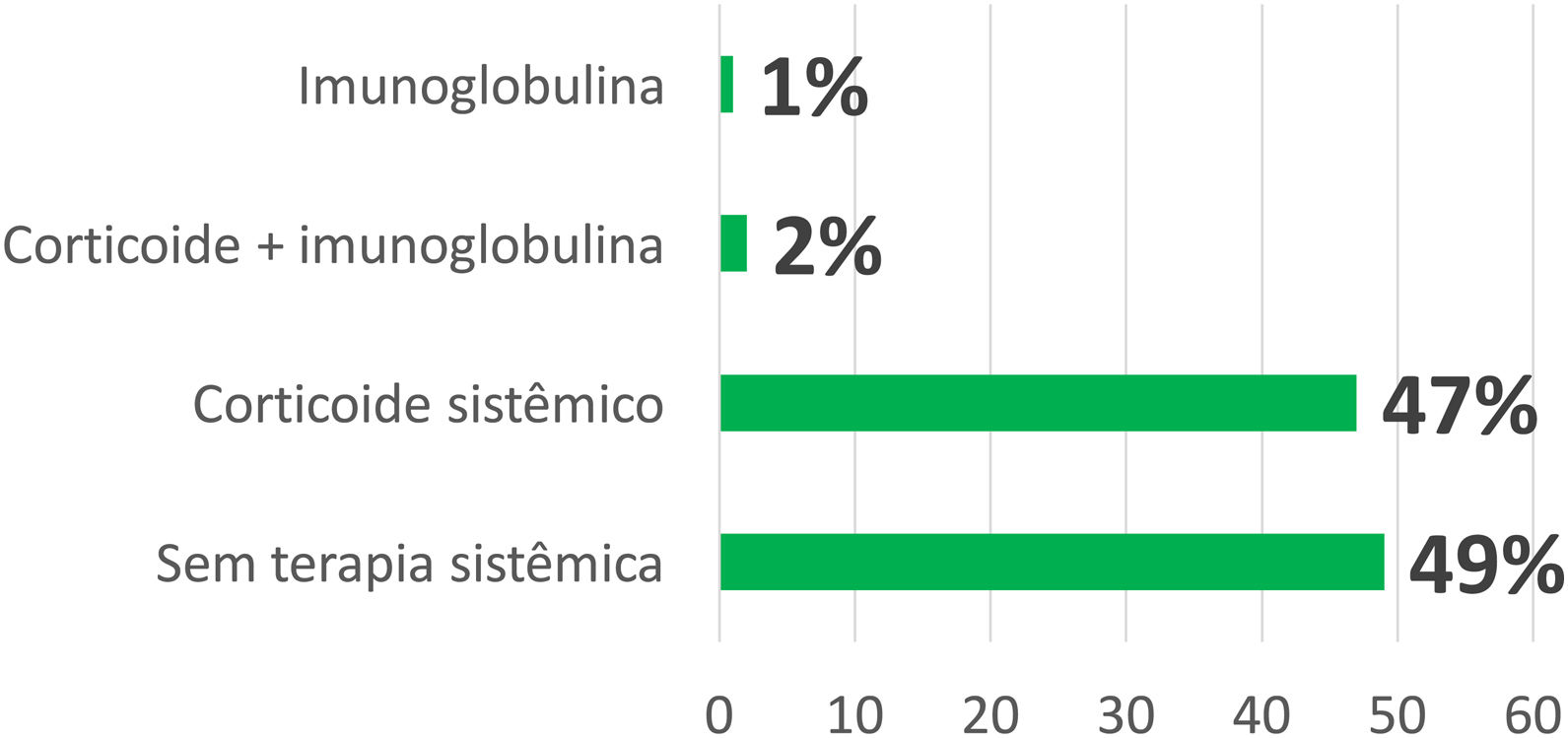
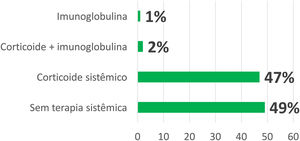
Além da suspensão do medicamento, em 103 casos (47%) foi prescrito corticosteroide sistêmico; em cinco casos (2,2%), imunoglobulina intravenosa (IgIV) associada a corticoide sistêmico; e em três casos (1,3%), somente IgIV (fig. 2). Alguns pacientes receberam sintomáticos como anti‐histamínicos e/ou corticosteroide tópico, dependendo da forma clínica da farmacodermia e dos sintomas apresentados.
Dentre as formas leves de farmacodermia, na maioria dos casos (43%) a conduta instituída foi expectante, somente com suspensão da medicação suspeita. Uso exclusivo de sintomáticos ocorreu em 19% dos casos. Em 28% foi realizada corticoterapia sistêmica com prednisona em doses inferiores a 1 mg/kg e em 10%, na dose de 1 mg/kg. Não houve indicação de IgIV nesse grupo.
Já nas formas graves, a principal conduta instituída foi a corticoterapia sistêmica com prednisona na dose de 1 mg/kg ou equivalente (55%). Em 11% foi utilizada corticoterapia sistêmica com prednisona em doses inferiores a 1 mg/kg. Todos os oito casos que receberam IgIV em associação ou não à corticoterapia sistêmica apresentaram formas graves de farmacodermia do espectro SSJ/NET – entre eles, cinco casos foram caracterizados como NET. No grupo das formas graves, somente 24% foram abordados por conduta expectante ou uso exclusivo de sintomáticos.
EvoluçãoNa evolução, 163 pacientes apresentaram melhora ou resolução do quadro (74,4%), nove foram transferidos para a enfermaria da dermatologia (4,1%) e 14 (6,4%) foram a óbito.
Dentre os nove pacientes que foram transferidos para a enfermaria de dermatologia, todos receberam alta após melhora clínica e foram encaminhados para seguimento ambulatorial.
A maior parte dos óbitos concentrou‐se entre as formas graves de farmacodermia (10 casos); em quatro pacientes a causa do óbito foi choque séptico diretamente relacionado a foco infeccioso cutâneo por perda da integridade da barreira (SSJ/NET) ou a complicações do tratamento por IgIV, como anafilaxia (um caso).
Todos os óbitos entre as formas leves (quatro casos) foram por causas não relacionadas ao diagnóstico dermatológico.
DiscussãoAnalisando‐se os dados demográficos deste estudo, observou‐se discreta predominância feminina (50,6%), diferentemente do evidenciado na literatura mais recente, cuja proporção variou de 1,14 e 1,55 homens para cada mulher.3,6,7 Com relação à idade dos pacientes, a média de 47 anos encontrada foi compatível com os dados da literatura, entre 45 e 55 anos.2,3,5,8,9
O tempo médio decorrido entre o início dos sintomas e a solicitação da Interconsulta foi de seis dias, muito semelhante ao resultado de 5,9 dias encontrado em trabalho publicado pelo mesmo grupo em 2016.5 Tal intervalo de tempo pode refletir o não reconhecimento ou a não valorização das alterações cutâneas pela equipe assistente, o que retarda a solicitação da avaliação dermatológica. É importante destacar que o atraso no diagnóstico de reação à droga pode ser fatal, especialmente nas formas graves como SSJ/NET e DRESS, nas quais o prognóstico está diretamente relacionado à suspensão precoce do medicamento suspeito e instituição do tratamento específico, quando indicado.10,11
A classe de medicamentos que mais frequentemente causou farmacodermia foi a dos antibióticos, em 36,5%, seguida pela dos anticonvulsivantes, em 10%, dados muito semelhantes aos da literatura.2–4,7,8,12 Dentre os antibióticos destacaram‐se os de amplo espectro (vancomicina, meropenem, polimixina B), comumente prescritos em ambiente hospitalar quaternário de alta complexidade e raramente utilizados em serviços de atenção primária e secundária, delineando um perfil distinto de fármacos eliclitantes em comparação a ambientes não hospitalares.
O mesmo observou‐se entre as farmacodermias graves (SSJ/NET, DRESS e PEGA), cujas maiores causas foram os antibióticos (32%) e anticonvulsivantes (21%), em concordância com estudo recente que incluiu 928 casos da população chinesa, no qual os principais fármacos elicitantes foram os antibióticos (26%), seguido dos anticonvulsivantes (21,6%).13
Entretanto, há dados divergentes na literatura: em estudos realizados em população brasileira, encontrou‐se associação estatística entre o uso de anticonvulsivantes e formas graves de farmacodermias.5 Nesses estudos, os anticonvulsivantes ainda foram identificados como os principais agentes (40,4%) das farmacodermias graves, seguidos dos antibióticos (22,8%).14 Em estudo realizado na China em 2008,12 a classe dos anticonvulsivantes foi também a mais frequentemente causadora de reações cutâneas graves, responsável por 38,5% dos casos.
Sobre os anticonvulsivantes, vale ressaltar que as três medicações mais envolvidas no presente estudo (fenitoína, carbamazepina, fenobarbital) são anticonvulsivantes aromáticos pertencentes à mesma classe. Portanto, nesses casos, a terapia de substituição deve se basear em anticonvulsivante não aromático, como o ácido valproico ou levetiracetam, já que a troca por medicamentos da mesma classe perpetuará o processo imunológico desencadeado na farmacodermia.15,16
Em nossa amostra, contudo, cabe ressaltar que, dentre os 93 pacientes (42,3%) em que não foi possível identificar o fármaco elicitante, 86 faziam uso de duas ou mais classes de medicamentos. Isso provavelmente reflete a complexidade dos casos internados em um hospital quaternário.
Quanto à manifestação clínica da reação adversa medicamentosa, 65,7% dos pacientes apresentaram formas leves, sendo o exantema a mais comum (77% das formas leves e 50,6% do total da amostra). Essa forma clínica de farmacodermia também foi isoladamente a mais encontrada em outros estudos na literatura.4,5,7–9,11,17–19 Interessante salientar que não houve nenhum caso de erupção medicamentosa fixa na amostra avaliada. É possível que lesões muito localizadas não tenham sido observadas pela equipe assistente, que possivelmente deixou de solicitar a avaliação da dermatologia.
Já as formas graves representaram 34,3% dos casos, frequência elevada quando comparada a maior parte dos outros estudos, em que as formas graves representaram 3% a 25% dos casos,2,3,7–9,19 justificada pelo perfil quaternário de alta complexidade hospitalar. Dentre as formas graves, DRESS foi a mais prevalente (53,3% das formas graves e 18,2% do total), concordante com estudo prévio no mesmo país (45,6% das formas graves)14 e com estudo realizado na Malásia em 2017 (63,6% das formas graves).3 Esse dado, entretanto, foi discrepante de outros encontrados na literatura, em que DRESS apresentou prevalências expressivamente menores (0,03% a 14,5%).2,5,6,9,17
Os achados histopatológicos em estudos retrospectivos sobre frequência e aspectos clínicos das farmacodermias são pouco descritos. Em uma série de 25 casos de DRESS somente sete (28%) foram submetidos a biopsia de pele e análise histopatológica.20 Este estudo apresenta dados histológicos da ampla maioria dos casos (82,6%), em que o principal achado é a dermatite de interface, tanto nas formas leves como nas formas graves de farmacodermias. Entretanto, em 17% dos pacientes tal estudo foi inespecífico – em sua maioria, casos de DRESS.
Dentre os achados histopatológicos das farmacodermias, os relacionados a DRESS suscitam maior discussão na literatura. A presença de linfócitos atípicos no infiltrado dérmico já foi associada ao uso de anticonvulsivantes e mais frequentemente observada dos quadros de DRESS.5 Além disso, a intensidade da necrose de ceratinócitos, do infiltrado inflamatório e presença de vasculite relacionaram‐se mais a DRESS, em comparação ao exantema com ou sem repercussão sistêmica.21 Postula‐se que achados histológicos teriam, inclusive, valor prognóstico. O padrão histológico tipo eritema multiforme poderia indicar maior gravidade do acometimento hepático nos casos de DRESS.22
Quanto à abordagem terapêutica, além da suspensão do(s) fármaco(s) suspeito(s) em todos os casos, em quase 50% foi indicada corticoterapia sistêmica. É importante destacar que mesmo dentre as farmacodermias graves o uso de corticosteroide sistêmico é controverso.
Em relação ao DRESS, a corticoterapia sistêmica tem sido considerada o principal tratamento, especialmente quando há envolvimento grave de um ou mais órgãos vitais (fígado, rim, pulmão, coração). Dentre os 40 casos com diagnóstico de DRESS, 34 (85%) receberam corticoide sistêmico, dos quais 29 (72,5%) em dose imunossupressora (prednisona 1 mg/kg/dia ou equivalente). Em outros estudos, a corticoterapia sistêmica foi prescrita em 34% a 52% dos casos, enquanto casos com acometimento cutâneo e visceral leve foram tratados somente com corticoides tópicos de alta potência.20,23
Dentre os pacientes do espectro SSJ/NET, a corticoterapia sistêmica foi instituída a todos os pacientes do grupo classificado como SSJ e a IgIV em associação ou não ao corticoide em 58% dos casos de NET, dados semelhantes a estudo coreano em que 87% dos pacientes com SSJ foram tratados com corticoterapia e 80% dos casos de NET com IgIV.24
Na literatura, o tratamento sistêmico da SSJ/NET permanece controverso. Dois estudos de coorte e uma revisão de literatura não demonstraram benefício com uso de corticoides sistêmicos no tratamento de farmacodermias do espectro SSJ/NET.25–27 Encontra‐se, ainda, evidências crescentes sobre o uso de ciclosporina na SSJ/NET, sugerindo benefícios como redução de mortalidade, do tempo necessário para reepitelização e da duração da internação.27–29 Já em revisão sistemática publicada em 2021, que incluiu 67 estudos e 2.079 pacientes, o uso combinado de corticoide e IgIV mostrou possível redução de mortalidade em pacientes com farmacodermia do espectro SSJ/NET.30
ConclusãoA frequência de farmacodermias entre os pacientes avaliados foi de 13,6%, com média de seis dias entre o início do quadro e a solicitação da interconsulta pela equipe assistente.
Os antibióticos e anticonvulsivantes foram as principais classes de fármacos envolvidos, e a forma clínica mais frequente foi o exantema. Um terço dos casos foi considerado grave (53,3% DRESS) e houve 10 óbitos relacionados ao quadro cutâneo, o que reforça o papel da dermatologia no acompanhamento das farmacodermias no ambiente hospitalar.
A ampla maioria dos casos (82,6%) contou com análise histopatológica das lesões, corroborando para o diagnóstico e reunindo seus principais achados entre as distintas formas clínicas.
Dado o importante papel do dermatologista no diagnóstico das farmacodermias, identificação do fármaco suspeito, distinção das formas potencialmente graves, investigação de possível acometimento sistêmico e instituição do tratamento adequado, o ideal seria que este fosse chamado o quanto antes para avaliação dos pacientes. No entanto, o intervalo verificado nesta amostra foi de quase uma semana entre o surgimento dos primeiros sintomas e a avaliação do especialista.
Suporte financeiroNenhum.
Contribuição dos autoresJúlia Chain Martins: Concepção e desenho do estudo; levantamento de dados, análise e interpretação dos dados; análise estatística; redação do artigo; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Camila Arai Seque: Análise e interpretação dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; participação na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão do manuscrito.
Adriana Maria Porro: Concepção e desenho do estudo; análise e interpretação dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; participação na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Martins JC, Seque CA, Porro AM. Clinical aspects and therapeutic approach of drug‐induced adverse skin reactions in a quaternary hospital: a retrospective study with 219 cases. An Bras Dermatol. 2022;97. http://dx.doi/10.1016/j.abd.2021.06.008
Trabalho realizado no Departamento de Dermatologia, Universidade Federal de São Paulo, São Paulo, SP, Brasil.