Na primeira metade do século XX houve relatos1 da redução do tamanho em diferentes tipos de tumores tratados com altas doses de insulina, incluindo um caso de melanoma metastático.2 Como esses tratamentos induziam estados hipoglicêmicos2 e em virtude da íntima relação entre neoplasias e glicemia,3 estipulou‐se que essa resposta ocorresse em decorrência dos baixos níveis de glicose sanguínea dos pacientes. No entanto, a mecanística dessa interação parece ser a expressão do fator 4 ativador da transcrição (F4AT) e outras proteínas associadas, a exemplo do fator de transcrição CHOP (FTCHOP).
Diante disso, o presente estudo buscou demonstrar os efeitos da insulina administrada em camundongos com melanoma, a relação da resposta tumoral com a glicemia sanguínea e a expressão proteica possivelmente envolvida nesse mecanismo.
Todos os procedimentos foram aprovados pelo Comitê de Ética em Uso de Animais (n° 23075.067738/2019‐05). Linhagens celulares de melanoma murino (B16‐F10) foram obtidas da American Type Culture Collection (ATCC – Manassas, VA, EUA), cultivadas em meio DMEM e injetados subcutaneamente (6×106 células por animal) em camundongos C57BL/6, machos, com 8 a 12 semanas (obtidos junto ao Instituto Carlos Chagas, FioCruz – Paraná), totalizando 50 animais. Os camundongos foram alimentados com dieta padrão (Purina) durante os experimentos. Após cinco dias, percebeu‐se o desenvolvimento de tumor sólido de tamanho variável no local da aplicação. Insulina regular humana 100 UI/mL (Novolin R®) foi utilizada para o tratamento dos animais, diluída em soro glicosado 50%. Os camundongos foram divididos em quatro grupos, de acordo com o tratamento: 15 camundongos no grupo controle (0,1 mL de soro glicosado 50%); 10 camundongos grupo 1UI/kg (0,1 mL de solução a 0,1 UI/mL); 10 camundongos grupo 2UI/kg (0,1 mL de solução a 0,2 UI/kg); e 15 camundongos grupo 4UI/kg (0,1 de solução a 0,4 UI/mL). Foi administrada insulina intraperitonealmente por um total de 15 dias, divididos em três ciclos de cinco dias, com intervalos de dois dias sem a administração do hormônio (Material Suplementar 1). Os níveis glicêmicos foram medidos usando medidor de glicose (Accu Check Active, Roche Diagnostic, Alemanha), por meio de amostra sanguínea obtida através de um pequeno corte na cauda. A coleta ocorreu apenas nos grupos controle, grupo 2UI e grupo 4UI, três vezes por semana. Após o fim do tratamento, os animais foram sacrificados, utilizando‐se a combinação de cloridrato de xilazina e cloridrato de quetamina (10%) em 50 mcL (1:1).
O tecido tumoral foi extraído e a análise imuno‐histoquímica foi realizada a partir de lâminas de secções tumorais dos tumores de B16‐F10 obtidos nos experimentos in vivo. Foi realizada a preparação das lâminas de imuno‐histoquímica segundo protocolo indexado (Material Suplementar 2) e utilizado anticorpos primários, anti‐FTCHOP para ratos (Santa Cruz Biotechnology, cat.sc 7351) e anti‐F4AT para ratos (Santa Cruz Biotechnology, cat.sc 390063). A quantificação imuno‐histoquímica foi realizado no programa ImageJ Analisys Software, com o protocolo de Crowe and Yue.4 Lâminas de controle foram utilizadas para determinar parâmetros básicos e serviram como referencial para a expressão relativa. Também se avaliou área de imuno‐histoquímica expressa e o número de núcleos por campo de lâmina avaliado. Foram utilizados três campos com ampliação de 20×por lâmina para a análise.
A análise estatística e os gráficos foram feitos no programa R (R Development Core Team). Foi realizada a comparação pelo teste de Kruskal‐Wallis e revisado pelo teste de Dunn para os tamanhos tumorais e para a expressão de proteínas, a contagem de núcleos e a área corada nas lâminas. Os níveis glicêmicos não foram contemplados pela análise estatística, uma vez que o objetivo do estudo não era demonstrar diferenças entre os grupos nessa variável, mas sim a ausência de hipoglicemia grave.
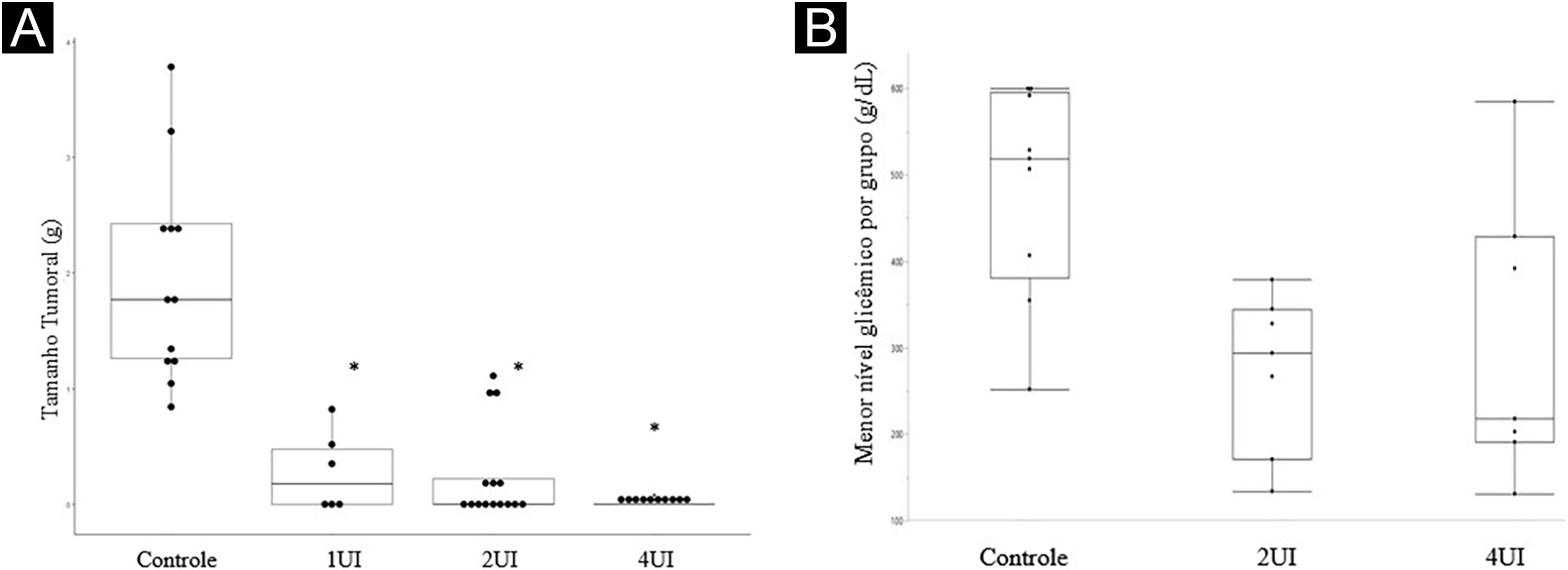
Os efeitos da insulina in vivo foram analisados a partir do modelo animal, com a mensuração do tamanho dos tumores ao final do tratamento. O gráfico de box‐plot do tamanho dos tumores está representado na figura 1A, enquanto os níveis glicêmico obtidos nos animais estão representados na figura 1B, considerando os valores de referência para os camundongos (150 mg/dL).
Insulina inibe o crescimento tumoral em modelo murino de melanoma (C57BL6/B16F10), sem causar hipoglicemia. (A) Boxplot representando a média dos tamanhos tumorais excisados em cada grupo experimental. A avaliação estatística foi realizada pelo teste de Kruskall‐Wallis, seguido pelo teste de Dunn. (B) Representação em boxplot dos níveis glicêmicos aferidos nos camundongos. O grupo 1UI não teve a glicemia avaliada por ser dose padrão utilizada na prática médica. Os menores níveis de glicemia, em quaisquer grupos, não foram inferiores a 136 mg/dL, mostrando a ausência de hipoglicemia nos camundongos. *Valor de p < 0,05 em relação ao grupo controle.
O número de animais mortos durante os experimentos foi de dois do grupo controle e quatro do grupo 1UI/kg. As mortes foram decorrentes da progressão tumoral nos animais. Essas mortes foram observadas ao longo da segunda semana dos experimentos, e os tumores desses animais não foram analisados.
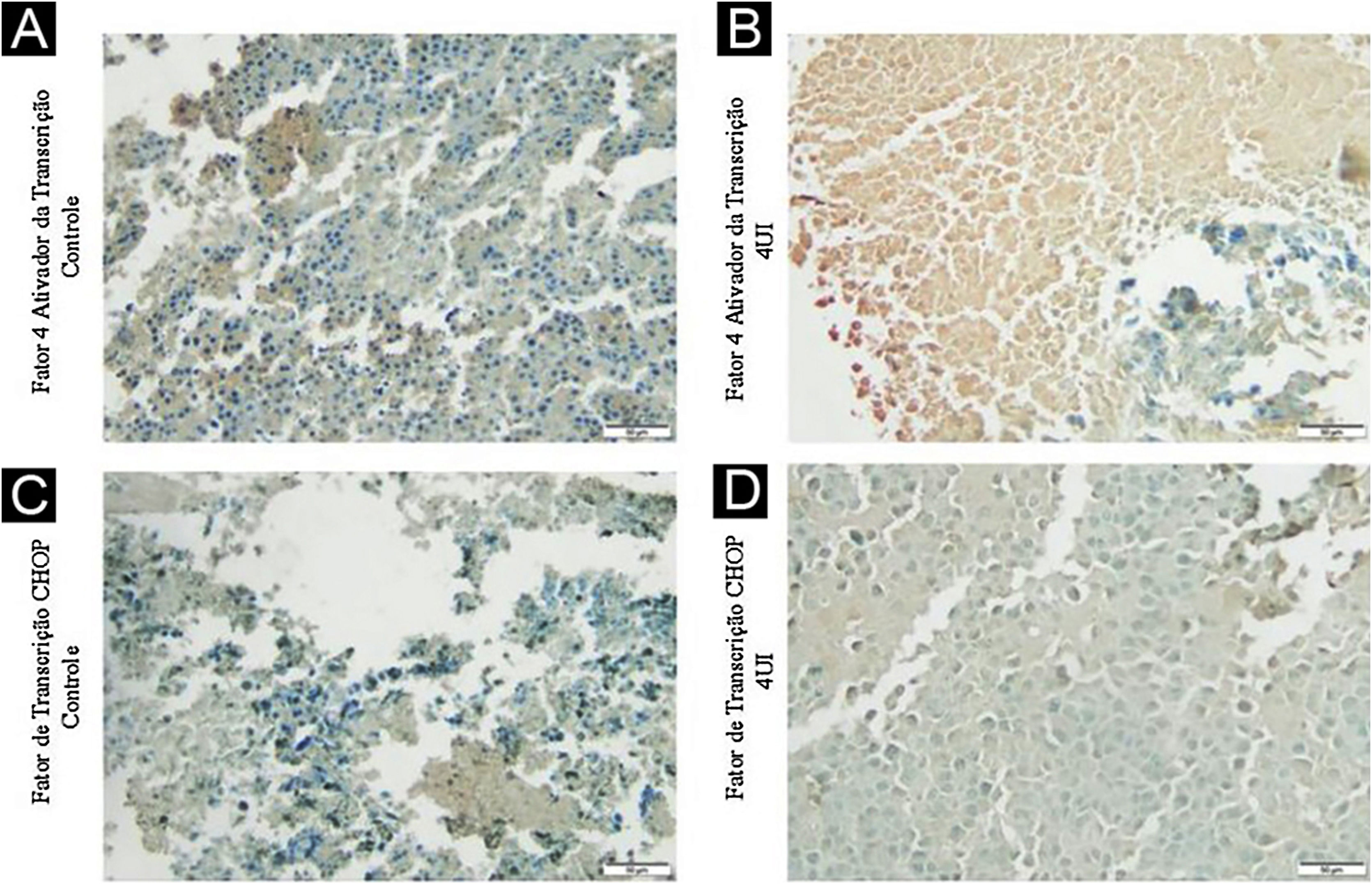
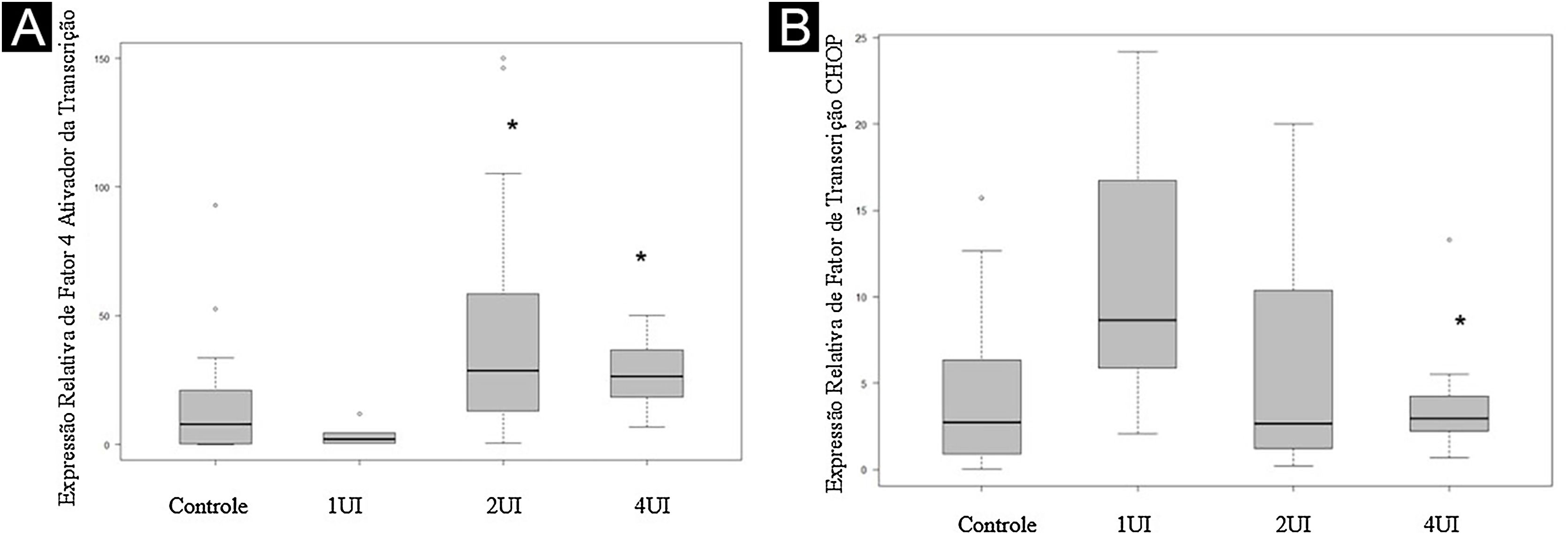
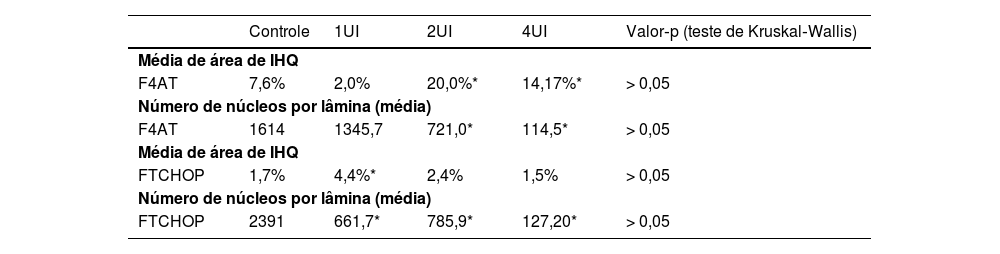
A expressão de F4AT (fig. 2A‐B) estava aumentada nos grupos 2UI/kg e 4UI/kg quando comparada com o grupo controle, com relevância estatística. As imagens obtidas para avaliação de FTCHOP (fig. 2C‐D) demonstraram diferença estatística com o grupo 4UI em comparação com o grupo controle (fig. 3). Na análise qualitativa das lâminas, observou‐se ma menor contagem de núcleos nos grupos tratados e maior área corada nos grupos 4UI (F4AT) e 1UI (FTCHOP) – tabela 1.
Análise imuno‐histoquímica da expressão do F4AT e do FTCHOP. Os tecidos obtidos a partir de material tumoral dos grupos controle (A e C) e 4 UI/kg (B e D) foram avaliados a partir da expressão imuno‐histoquímica de suas proteínas. As fotografias foram obtidas pelo microscópio Axiolab 5 microscopy (Zeiss) e analisadas com o programa ImageJ FIJI software. Os grupos controle e 4 UI/kg foram escolhidos para representar os extremos de dose.
Expressão relativa do F4AT e do FTCHOP. Lâminas de controle foram utilizadas para definir os parâmetros de comparação. (A) Quantificação do sinal expresso pelo F4AT nas lâminas de diferentes grupos. (B) Quantificação do sinal expresso pelo FTCHOP nas lâminas de diferentes grupos. A dispersão dos valores relativos foi representada no gráfico. A avaliação estatística foi realizada pelo teste de Kruskall‐Wallis, seguido pelo teste de Dunn. *Valor de p < 0,05 em relação ao grupo controle.
Análise imuno‐histoquímica da expressão de fator de transcrição CHOP e fator 4 ativador da transcrição nos tecidos obtidos a partir de material tumoral dos grupos controles, 1UI/kg, 2UI/kg e 4UI/kg. Os dados demonstraram menor número de núcleos nos grupos tratados com insulina, enquanto maior área corada só foi observada na avaliação de F4AT e do grupo 1UI do FTCHOP
| Controle | 1UI | 2UI | 4UI | Valor‐p (teste de Kruskal‐Wallis) | |
|---|---|---|---|---|---|
| Média de área de IHQ | |||||
| F4AT | 7,6% | 2,0% | 20,0%* | 14,17%* | > 0,05 |
| Número de núcleos por lâmina (média) | |||||
| F4AT | 1614 | 1345,7 | 721,0* | 114,5* | > 0,05 |
| Média de área de IHQ | |||||
| FTCHOP | 1,7% | 4,4%* | 2,4% | 1,5% | > 0,05 |
| Número de núcleos por lâmina (média) | |||||
| FTCHOP | 2391 | 661,7* | 785,9* | 127,20* | > 0,05 |
Apesar de a literatura moderna estabelecer um papel neoplásico para a insulina, de modo que o uso do hormônio esteja relacionado ao surgimento/crescimento tumoral,5,6 o presente estudo encontra respaldo em dados do início do século XX,1 em que a insulina apresentou atividade antineoplásica.
A expressão proteica de F4AT mediada pela insulina parece estar relacionada à ação antineoplásica, em vez da hipoglicemia. O F4AT desempenha papel dual dentro da célula em situações de estresse do retículo endoplasmático (ERS),7 promovendo a sobrevivência celular ou iniciando a apoptose, sobretudo pela via PERK/eIF2a/F4AT/FTCHOP. A literatura estipula que a insulina esteja ligada à expressão do F4AT em células saudáveis8 e tumorais,9 e esses dados são corroborados com achados do presente artigo. A expressão do FTCHOP apenas no grupo 4UI pode estar relacionada à quantidade de material tumoral nas lâminas do grupo 2UI, observada pelo percentual corado, bem como por outras vias para indução da apoptose nas células, como pela proteína TRAIL.10
As limitações do presente estudo correspondem ao fato de não ser avaliado se os tumores se tornariam refratários ao uso de insulina ou se haveria recidivas. Não foram avaliados o peso dos animais, o possível aumento da massa corporal nos grupos tratados com insulina, o tempo de sobrevida dos animais após o tratamento nem a presença de outros marcadores celulares que poderiam estar envolvidos nos processos, como a proteína TRAIL. Outra limitação é a avaliação da expressão de proteínas por meio de lâminas imuno‐histoquímicas.
Suporte financeiroNenhum.
Contribuição dos autoresDaniel do Prado: Concebeu a ideia deste trabalho; desenvolveu a teoria por trás dos experimentos; planejou o trabalho; escreveu o manuscrito; realizou a análise estatística e analisou os dados.
Marianna Boia: Cuidou dos experimentos; Contribuiu para a preparação das amostras e para interpretação dos dados.
Hanna Camara da Justa: Participou dos experimentos.
Andrea Senff Ribeiro: Contribuiu para a interpretação dos resultados e supervisionou o projeto.
Sergio Lunardon Padilha: Contribuiu para a interpretação dos resultados e supervisionou o projeto.
Conflito de interessesNenhum.
Como citar este artigo: do Prado D, Boia‐Ferreia M, da Justa HC, Senff‐Ribeiro A, Padilha SL. Insulin inhibits melanoma tumor growth through the expression of activating transcription factor 4, without detectable expression of transcription factor CHOP: an in vivo model. An Bras Dermatol. 2024;99:590–3.
Trabalho realizado no Laboratório de Matriz Extracelular e Biotecnologia de Venenos, Departamento de Biologia Celular, Universidade Federal do Paraná, Curitiba, PR, Brasil.