Na reconstrução com enxerto de pele após excisão de neoplasia maligna cutânea pode ocorrer falha do enxerto, apesar da melhor técnica cirúrgica.1,2 Está bem estabelecido que um leito receptor mal perfundido apresenta maior risco de falha do enxerto de pele.3
O suprimento vascular para enxertos de pele no couro cabeludo deriva principalmente da gálea aponeurótica, mas em um cenário dermato‐oncológico, sua integridade é frequentemente comprometida.4 Na quarta semana, a taxa de falha dos enxertos de pele de espessura total (FTSG, do inglês full‐thickness skin grafts) no couro cabeludo pode chegar a 22%.1
O impacto do estado de perfusão do leito receptor na viabilidade do enxerto na quarta semana ainda precisava ser quantificado em humanos in vivo.3
Laser speckle contrast imaging (LSCI) é uma técnica não invasiva, em tempo real e sem contato, que torna possível o estudo da microcirculação em grandes áreas de superfície nos períodos intra e perioperatório.5 Em pesquisas anteriores, foi validado o estudo da microcirculação de diferentes tipos de enxertos de pele por meio da análise com LSCI.6 Seu papel na identificação de pacientes de alto risco para necrose do enxerto ainda precisa ser explorado.
Neste estudo piloto, os autores pretendem comparar os resultados dos FTSG no couro cabeludo com a estado da perfusão basal do leito do enxerto avaliada por LSCI. Também serão descritas as mudanças na perfusão do FTSG ao longo de quatro semanas.
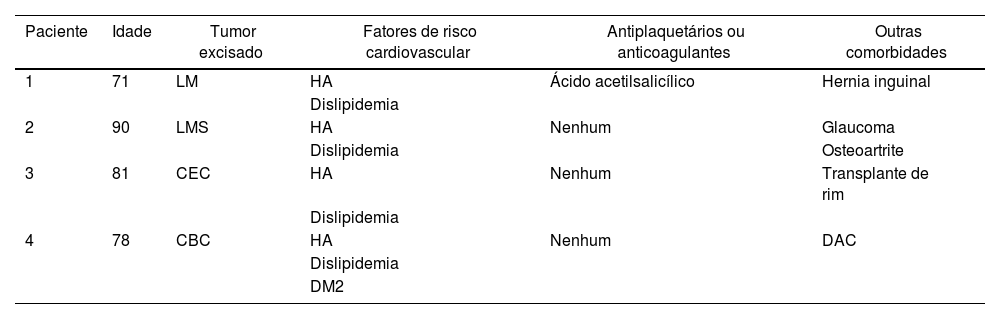
Após aprovação do comitê de ética local e consentimento informado, quatro pacientes consecutivos com câncer de pele não melanoma no couro cabeludo foram incluídos: todos masculinos, com 71 anos (paciente 1), 90 anos (paciente 2), 81 anos (paciente 3) e 78 anos (paciente 4). As principais características e comorbidades dos pacientes são apresentadas na tabela 1. Os tumores foram excisados após uso de lidocaína com infiltração de epinefrina, e FTSG foram colhidos da região infraclavicular. Vinte minutos após a remoção da lesão e antes da sutura do enxerto de pele, a perfusão basal do leito da ferida cirúrgica (em unidades de perfusão arbitrária, UPA) foi medida com LSCI por 1 minuto, e a pressão arterial média (PAM, em mmHg) foi registrada. A relação UPA/PAM resultou na condutância vascular cutânea (CVC), em UPA/mmHg, possibilitando a comparação dos valores de perfusão dos pacientes. Por fim, o FTSG foi suturado e o curativo foi aplicado por uma semana.
Características e comorbidades dos pacientes (do gênero masculino) submetidos a enxerto de pele no couro cabeludo
| Paciente | Idade | Tumor excisado | Fatores de risco cardiovascular | Antiplaquetários ou anticoagulantes | Outras comorbidades |
|---|---|---|---|---|---|
| 1 | 71 | LM | HA | Ácido acetilsalicílico | Hernia inguinal |
| Dislipidemia | |||||
| 2 | 90 | LMS | HA | Nenhum | Glaucoma |
| Dislipidemia | Osteoartrite | ||||
| 3 | 81 | CEC | HA | Nenhum | Transplante de rim |
| Dislipidemia | |||||
| 4 | 78 | CBC | HA | Nenhum | DAC |
| Dislipidemia | |||||
| DM2 |
HA, hipertensão arterial; CBC, carcinoma basocelular; DAC, doença arterial coronariana; LM, lentigo maligno; LMS, leiomiossarcoma; CEC, carcinoma espinocelular; DM2, diabetes mellitus tipo 2.
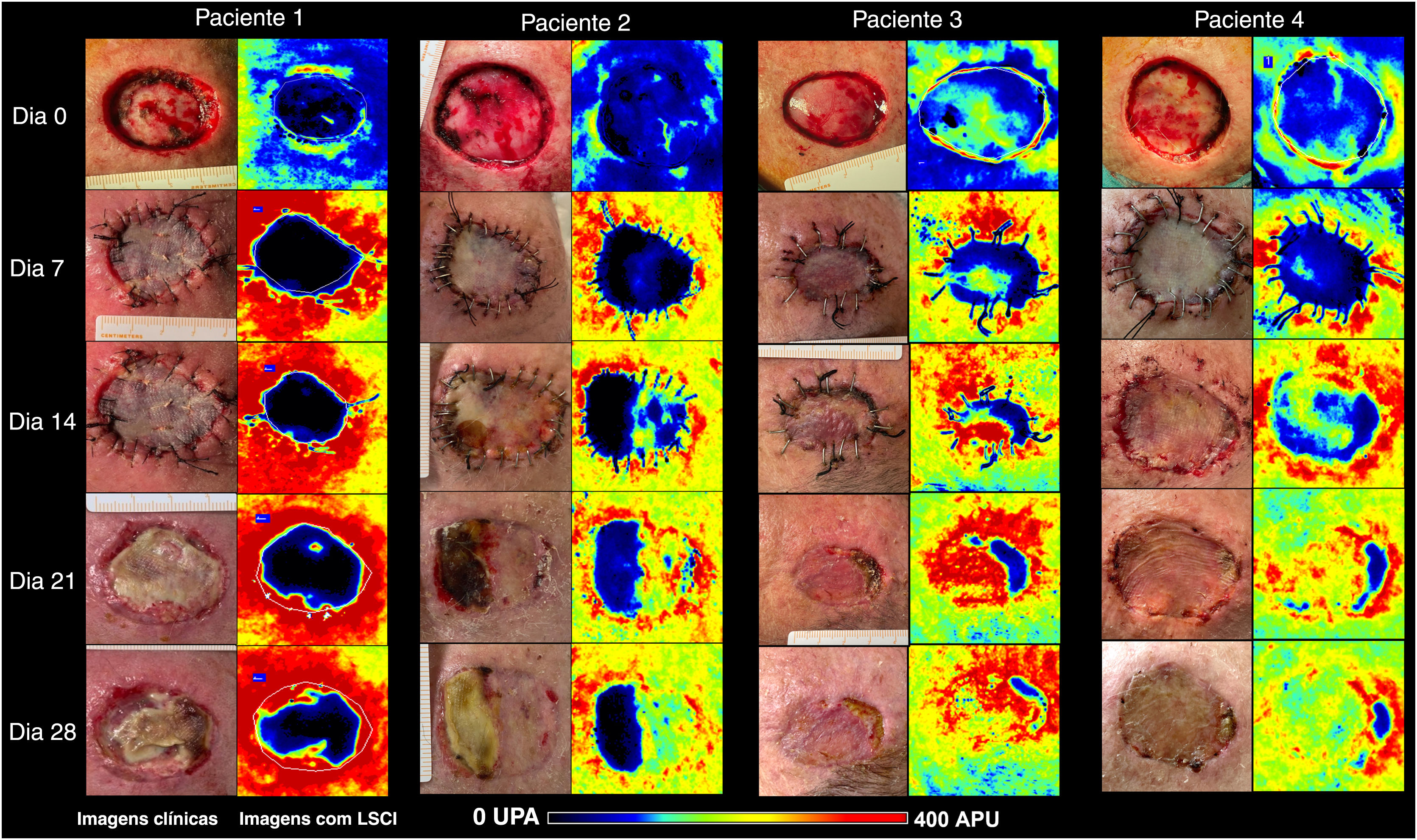
Nos dias (D) 7, D14, D21 e D28, a perfusão do enxerto foi avaliada e comparada com a perfusão basal do leito do enxerto no D0. Também foram registradas imagens clínicas. As áreas de necrose foram calculadas com SketchAndCalc Area Calculator™ (versão 6.2.5, 2018).
Em todos os pacientes, a remoção do câncer de pele possibilitou a preservação de alguma gálea aponeurótica subjacente para suprimento vascular do enxerto de pele. Nenhum dos pacientes desenvolveu infecção, hematoma ou hemorragia pós‐operatória.
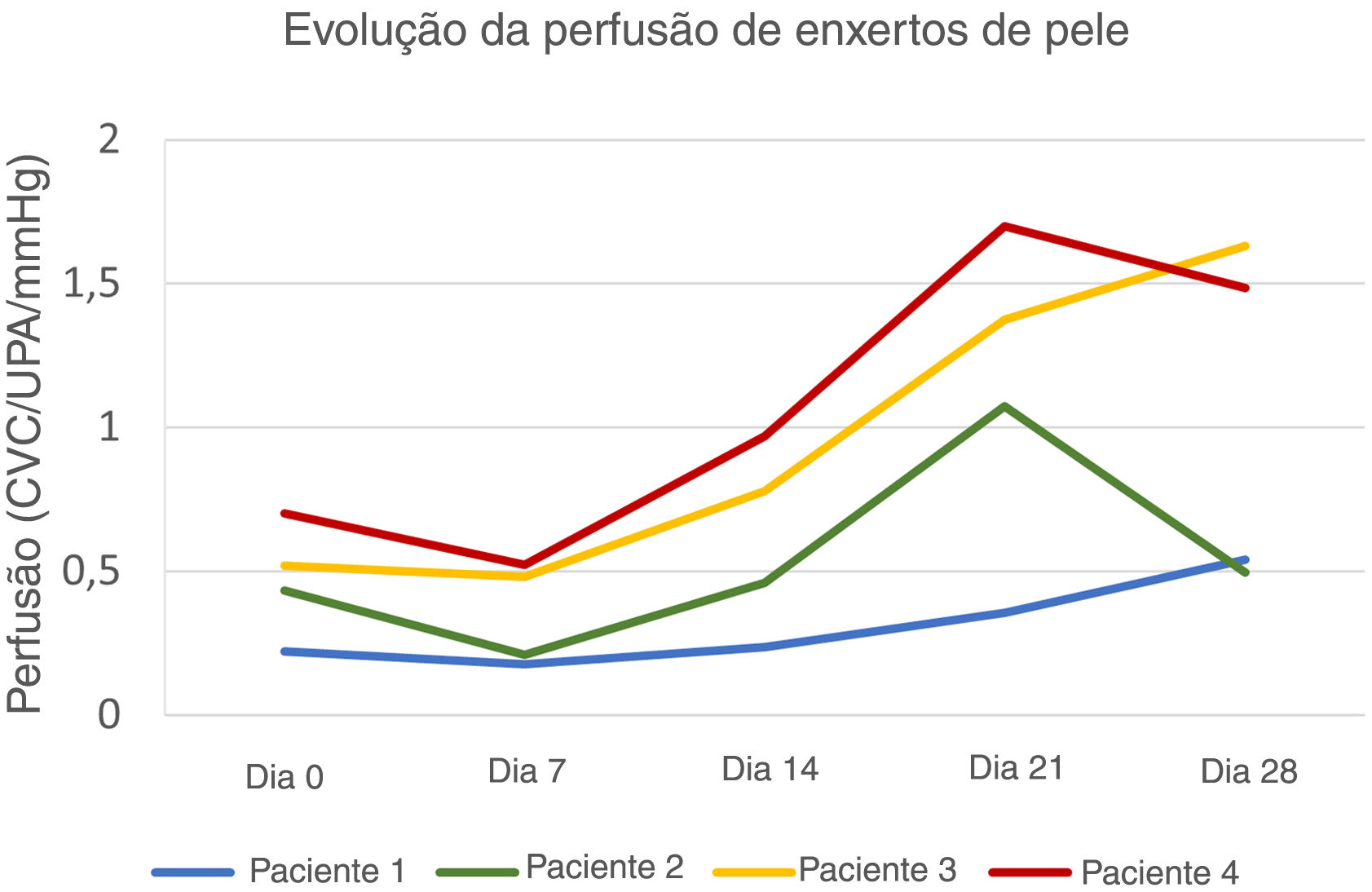
As áreas do defeito primário mediam 8,4 cm2 (paciente 1), 12,3 cm2 (paciente 2), 5,8 cm2 (paciente 3) e 8,7 cm2 (paciente 4). A evolução dos valores da CVC ao longo das quatro semanas é mostrada na figura 1. As imagens clínicas e LSCI sequenciais registradas no mesmo período são apresentadas na figura 2.
Evolução da perfusão de enxertos de pele de espessura total no couro cabeludo. A perfusão do enxerto de pele no D7 foi inferior à perfusão basal do leito do enxerto em todos os pacientes. Os pacientes 3 e 4 apresentaram maior perfusão basal e atingiram valores de pico no D21 e no D28, respectivamente. O paciente 1, com pior evolução clínica, apresentou curva ascendente até o D28, mas com valores de perfusão persistentemente mais baixos.
Imagens clínicas (painéis à esquerda) e LSCI (painéis à direita) de enxertos de pele de espessura total no couro cabeludo dos quatro pacientes. As imagens de LSCI mostram diferenças na perfusão em escala semiquantitativa, do preto (sem perfusão) ao vermelho (perfusão intensa). O paciente 1 apresentava leito receptor azulado a preto no D0, e o enxerto permaneceu mal perfundido até o D28, culminando com necrose subtotal do enxerto. O paciente 2 apresentava leito de enxerto azulado (baixa perfusão), mas recuperou‐se gradualmente ao longo de quatro semanas, e a área de necrose do enxerto foi inferior a 50%. Os pacientes 3 e 4 apresentaram leitos de enxerto melhor perfundidos e apresentaram perfusão acentuada a partir do D14. No D28, a extensão da necrose era de 16% e 9%, respectivamente. LSCI, laser speckle contrast imaging; UPA, unidades de perfusão arbitrária.
Os valores basais de CVC do leito receptor foram 0,22 UPA/mmHg, 0,43 UPA/mmHg, 0,51 UPA/mmHg e 0,70 UPA/mmHg, respectivamente, nos pacientes 1, 2, 3 e 4. A extensão da necrose do enxerto no D28 diminuiu com o aumento da perfusão no leito receptor (CVC) no D0 – 82% no paciente 1, 48% no paciente 2, 16% no paciente 3 e 9% no paciente 4.
Após diminuição inicial do D0 ao D7, no D14 a CVC do enxerto superou a CVC basal do leito receptor em todos os pacientes. O aumento da perfusão do enxerto foi mais acentuado do D7 ao D21, com posterior tendência de diminuição (nos pacientes 2 e 4) ou pequeno aumento (nos pacientes 1 e 3). Quanto menor a área sob as curvas de perfusão, maior a extensão da necrose do enxerto no D28 em todos os pacientes.
A partir da análise das imagens de LSCI, foi observado que a partir do D14 as regiões do enxerto de pele mal perfundidas (preto a azulado) permaneceram relativamente estáveis em extensão. Essas regiões mal perfundidas no D14 sobrepuseram‐se às regiões de necrose clínica no D28.
Existem algumas maneiras de avaliar a perfusão da pele de modo não invasivo, mas faltam evidências que apoiem seu uso no monitoramento da vascularização de enxertos de pele. A tomografia de coerência óptica requer avaliações sequenciais de menos de 1 cm2 ao longo da superfície do enxerto de pele. Além disso, o contato direto com o enxerto de pele pode ser inadequado em ambiente intraoperatório asséptico.7 A imagem por laser Doppler (LDI, do inglês laser Doppler imaging) possibilita a avaliação sem contato do fluxo sanguíneo cutâneo, com excelente resolução espacial, mas baixa resolução temporal, especialmente ao avaliar áreas extensas.8 O LDI tem profundidade de penetração de 0,5 a 1,0 mm, mais profunda que o plexo dérmico superficial que compõe a microcirculação cutânea.9 O LSCI supera a maioria das limitações das outras técnicas. Ele torna possível a aquisição rápida de imagens de perfusão de alta resolução de extensas áreas da superfície do enxerto sem contato.10 A curta penetração da radiação laser (0,3 mm) abrange capilares, vênulas e arteríolas do plexo capilar superficial, incluindo a vasculatura do enxerto.9
A despeito das variáveis individuais não analisadas e do pequeno tamanho da amostra não permitir qualquer estimativa de correlação estatística, foi demostrado que a área de necrose do FTSG aumentou com a diminuição da perfusão basal. Os enxertos com piores resultados, 82% e 48% de necrose, tiveram as menores perfusões basais, como observado nos pacientes 1 e 2, respectivamente. Além disso, no paciente 1, com necrose subtotal do enxerto, a inclinação da curva de perfusão foi mais descendente do que as demais.
Foi demonstrado que o estado de perfusão do leito do enxerto pode afetar o resultado do FTSG, corroborando assim o conhecimento empírico estabelecido. Que seja de conhecimento dos autores, este é o primeiro relato do uso de LSCI no intraoperatório para identificar pacientes com leitos receptores de enxerto mal perfundidos que apresentam, em teoria, risco aumentado de necrose do enxerto. Essa metodologia deve ser expandida em amostras maiores e em áreas de alto risco para necrose de enxertos de pele além do couro cabeludo, como superfícies plantares ou membros inferiores.3 Com dados mais robustos, a identificação de um limiar de perfusão (CVC) pode tornar o enxerto de pele tardio opção melhor do que o enxerto de pele imediato após a excisão do tumor. Também se especula que as diferenças nas curvas de CVC ao longo da cicatrização inicial do enxerto podem ajudar a prever maior risco de necrose tardia.
LSCI pode ser promissor na seleção dos melhores candidatos para reconstrução cirúrgica com FTSG e na predição intraoperatória de necrose tardia.
Suporte financeiroNenhum.
Contribuição dos autoresAndré Pinho: Concepção, investigação (líder), análise formal e elaboração‐redação original (líder).
Ana Brinca: Concepção e redação‐revisão e edição (líder).
Ana Figueiredo: Investigação (suporte).
Duarte Flor: Investigação (suporte), análise formal (suporte).
Ricardo Vieira: Concepção (suporte) e redação‐revisão e edição (suporte).
Conflito de interessesNenhum.
Como citar este artigo: Pinho A, Brinca A, Figueiredo C, Flor D, Vieira R. Predicting skin graft failure on the scalp by intraoperative laser speckle analysis. An Bras Dermatol. 2024;99:594–6.
Trabalho realizado no Departamento de Dermatologia, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal.