O carcinoma espinocelular cutâneo (CECC) se desenvolve a partir dos queratinócitos por meio da desregulação da autorrenovação e diferenciação celular. Estudos recentes mostraram que o tamanho e o número de CECCs diminuem gradualmente ou até desaparecem após a vacinação contra o HPV. Entretanto, o papel da vacina contra o HPV no mecanismo do CECC é pouco compreendido.
ObjetivoO objetivo deste estudo é investigar o efeito e mecanismo da vacina contra o HPV no CECC.
MétodosImunofluorescência foi utilizada para estudar as células imunológicas que infiltram o tecido tumoral de pacientes com CECC. Os efeitos da vacina contra HPV em células e tecidos de CECC foram estudados por cultura celular, PCR em tempo real, western blot, ensaio de citotoxicidade, ensaio imunoabsorvente ligado à enzima (ELISA), m6A blotting, ensaio CCK‐8, quantificação de metilação de ácido ribonucleico m6A e transplante de tumor.
ResultadosA vacina contra o HPV aumentou o efeito tóxico das células T CD8+ nas células do CECC e promoveu a produção de múltiplas citocinas pelas células T CD8+. Além disso, as vacinas contra o HPV podem aumentar a sensibilidade do tumor à terapia anti‐PD‐1, regulando negativamente METTL3 no tecido tumoral, com a combinação da vacina contra o HPV e dos anticorpos monoclonais PD‐1 produzindo maior infiltração de células imunes em comparação com o bloqueio de PD‐1 isoladamente.
Limitações do estudoÉ importante observar as limitações deste estudo, incluindo o pequeno tamanho da amostra, a construção do modelo em camundongo e a escolha da vacina contra HPV e do anticorpo monoclonal PD‐1, o que pode limitar a generalização dos achados para uma população mais ampla.
ConclusõesEspera‐se que esta pesquisa contribua para uma compreensão mais profunda do papel da vacina contra o HPV no tratamento do CECC. Espera‐se que a vacina contra o HPV se torne uma abordagem importante para atenuar o desenvolvimento do CECC.
O carcinoma espinocelular cutâneo (CECC) é um tumor maligno epitelial originado em queratinócitos, ficando sua incidência atrás apenas do carcinoma basocelular entre os cânceres de pele não melanoma.1,2 A patogênese do CECC ainda é discutível, mas há evidências crescentes de que o papilomavírus humano (HPV), especialmente HPV16 ou HPV18, esteja envolvido na patogênese de alguns carcinomas espinocelulares.3,4 As infecções por HPV de baixo risco estão implicadas cerca de 5% de todos os casos de câncer no mundo, e as infecções por HPV de alto risco têm maior duração do que as infecções por HPV de baixo risco.5 De acordo com uma metanálise, o risco de CECC em indivíduos imunocompetentes aumenta 42% em decorrência da infecção por HPV.6
Atualmente, os principais métodos de tratamento para CECC são cirurgia e quimioterapia.7 Quando a cirurgia é arriscada ou impossível, ainda é um desafio encontrar tratamento seguro e eficaz. Em 2017‐2018, três casos publicados no JAMA Dermatology mostraram diminuição gradual no tamanho e número de CECCs ou mesmo seu desaparecimento após a vacinação contra o HPV,8,9 sugerindo que a vacina contra o HPV desempenhe papel inibitório no desenvolvimento do CECC. Embora a utilidade preventiva da vacina contra o HPV seja bem compreendida, seu mecanismo de ação no tratamento de doenças malignas cutâneas não é claro.
Nos últimos anos, tem‐se acreditado que a imunoterapia tumoral se tornará uma nova abordagem no campo da terapia tumoral.10 As células T CD8+ são as células reguladoras mais importantes na imunidade adquirida contra tumores, realizando a mediação da imunidade antitumoral e destruindo diretamente as células cancerígenas; portanto, a ativação das células T CD8+ pode ser a chave para a imunoterapia no CECC. Estudos demonstraram que o ligante de morte programada 1 (PD‐1, do inglês programmed death ligand‐1) é altamente expresso em células T CD8+ no CECC, e o bloqueio de PD‐1 com anticorpo monoclonal é um método eficaz.11,12 Os inibidores de PD‐1 podem bloquear a ligação de PD‐1 e PD‐L1, resultando na transdução de sinais imunossupressores na via PD‐1/PD‐L1 e, consequentemente restaurando e promovendo a função imunológica das células T CD8+,10,13 fazendo com que desempenhem poderoso papel antitumoral. Foi relatado que a vacina da proteína de fusão HPV16 L2E7E6 chamada antígeno tecidual – neoplasia intraepitelial cervical e o bloqueador de PD‐1 têm efeitos sinérgicos para melhor controle dos tumores TC‐1.5,14,15
A epigenética tornou‐se tema importante na pesquisa científica.2 A N6‐metiladenosina (m6A) é uma modificação reversível de metilação no sexto átomo N da adenina,16,17 que demonstrou desempenhar papel importante em muitos processos biológicos, como adipogênese, linha germinativa de espermatozoides, tumores e outras doenças.18–20 No entanto, até o momento, houve poucos estudos sobre como as modificações de m6A afetam a progressão do CECC. Embora m6A tenha sido o foco de muitos estudos nos últimos anos, uma compreensão abrangente de m6A ainda não foi alcançada, e os mecanismos subjacentes à modificação de m6A no câncer devem ser melhor investigados. Estudos recentes mostraram que a modificação de m6A está intimamente relacionada à remodelação do microambiente imunológico do tumor, o que pode influenciar seu desenvolvimento.21
Neste estudo, foi levantada a hipótese de que a vacina contra o HPV e a injeção anti‐PD‐1 poderiam aumentar significantemente o número de células T CD8+ que infiltram o tecido tumoral em camundongos com CECC, provocando resposta imune significante em sinergia com o bloqueio de PD‐1. Assim obteríamos informações sobre o impacto potencial da vacinação contra o HPV em neoplasias malignas associadas ao HPV atualmente pouco estudadas. A ideia de que a vacina contra o HPV aumente o efeito anti‐PD‐1 via METTL3 para o tratamento do CECC também foi proposta por meio de amostras antropológicas, experimentos citológicos e experimentos com animais. Os presentes achados revelam mecanismo de metilação de mRNA anteriormente não reconhecido em CECC sensibilizado ao bloqueio de PD‐1, proporcionando assim potencial caminho terapêutico para essa neoplasia maligna.
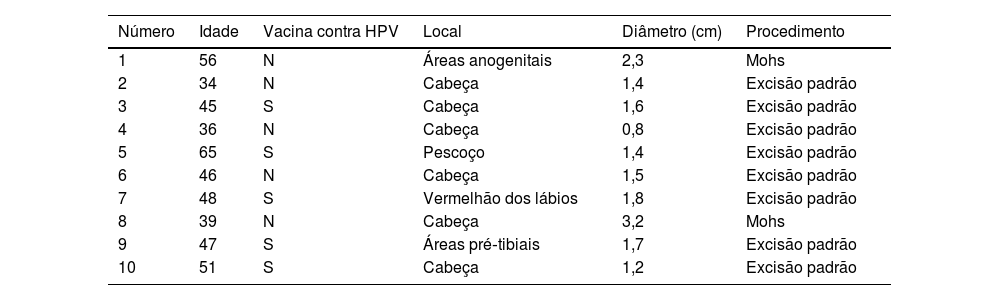
Materiais e métodosAmostras de tecidosPara a coleta de amostras de CECC de pacientes foi obtida a aprovação do Comitê de Ética do First Hospital of Shanxi Medical University. O tecido de CECC foi coletado de dez pacientes após a cirurgia, e os detalhes cirúrgicos desses pacientes são mostrados na tabela 1. O patologista confirmou o diagnóstico na amostra.
Detalhes de estudos em humanos
| Número | Idade | Vacina contra HPV | Local | Diâmetro (cm) | Procedimento |
|---|---|---|---|---|---|
| 1 | 56 | N | Áreas anogenitais | 2,3 | Mohs |
| 2 | 34 | N | Cabeça | 1,4 | Excisão padrão |
| 3 | 45 | S | Cabeça | 1,6 | Excisão padrão |
| 4 | 36 | N | Cabeça | 0,8 | Excisão padrão |
| 5 | 65 | S | Pescoço | 1,4 | Excisão padrão |
| 6 | 46 | N | Cabeça | 1,5 | Excisão padrão |
| 7 | 48 | S | Vermelhão dos lábios | 1,8 | Excisão padrão |
| 8 | 39 | N | Cabeça | 3,2 | Mohs |
| 9 | 47 | S | Áreas pré‐tibiais | 1,7 | Excisão padrão |
| 10 | 51 | S | Cabeça | 1,2 | Excisão padrão |
Cortes histológicos de tecido tumoral emblocado em parafina foram secos a 90°C durante 4 horas, desparafinizados em xileno e depois reidratados em soluções graduadas de etanol. Os cortes histológicos resfriados foram imersos em solução de peróxido de hidrogênio a 0,3% durante 15 minutos para bloquear a atividade da peroxidase endógena, enxaguados com PBS durante 5 minutos e bloqueadas com solução de BSA a 3% à temperatura ambiente durante 30 minutos. Após lavagem com PBS, os cortes foram incubados com anticorpos (Abcam, Cambridge, MA, EUA) por 1 hora em tampão de bloqueio BSA a 1%, seguido de incubação por 1,5 hora com anticorpo secundário conjugado com Alexa Fluro 549 (Thermal Fischer) e DAPI. A reação de imunofluorescência foi avaliada através de microscópio confocal Zeiss LSM510 equipado com objetiva de imersão de 63×.
Cultura de célulasCélulas A431 (células de CECC humano) e SCC7 (células de CECC de camundongo) foram obtidas do Cell Bank of Shanghai Institute of Cell Biology (Xangai, China). Essas células foram mantidas em meio de cultura DMEM (Thermo Fisher Scientific, Waltham, MA, EUA), que é suplementado com 10% de FBS e 1% de penicilina‐estreptomicina. As células foram cultivadas em incubadora umidificada a 37°C com 5% de CO2 (Sanyo Osaka, Japão).
Preparação de células T CD8+Células mononucleares do sangue periférico (CMSP) de doadores de sangue foram isoladas utilizando o método de gradiente de Ficoll, e as células T CD8+ foram isoladas de 1,25×107 CMSP utilizando o kit Easy Sep Human CD8+ T Cell Isolation.
PCR em tempo realA extração do RNA total foi realizada utilizando o reagente TRIzol (Invitrogen, Carlsbad, CA, EUA) e a transcrição reversa utilizando o kit cDNA Synthesis (Takara, Japão). A quantidade e a densidade do RNA foram verificadas por espectrofotômetro. O QRT‐PCR foi realizado utilizando o kit SYBR Green Master MIX (Takara, Japão), de acordo com as instruções do fabricante. Os ensaios foram realizados em triplicata e a expressão gênica relativa foi determinada pelo método 2−ΔΔCt.
METTL3 forward: 5’‐ CATCCGTCTTGCCATCTCTAC‐3’
METTL3 reverse: 5’‐ GACCTCGCTTTACCTCAATCA‐3’
METTL14 forward: 5’‐ GCATCACTGCGAATGAGAAATG‐3’
METTL14 reverse: 5’‐ CAGAACCGCACCAGAGAAATA‐3’
RMB15 forward: 5’‐ GCCCAACTCAAGATCACTCA‐3’
RBM15 reverse: 5’‐ AGCCAGGAGAATGGCATAAC‐3’
WTAP forward: 5’‐ AATGGTAGACCCAGCAATCAA‐3’
WTAP reverse: 5’‐ CGTAAACTTCCAGGCACTCA‐3’
VIRMA forward: 5’‐ GAGGCGGATCCTTTGAGTTT‐3’
VIRMA reverse: 5’‐ AACGACCTGAGAGAGGGATAG‐3’
FTO forward: 5’‐ AGAGCGGGAAGCTAAGAAAC‐3’
FTO reverse: 5’‐ GCCACTGCTGATAGAACTCAT‐3’
ALKBH5 forward: 5’‐ GTGGGTATGCTGCTGATGAA‐3’
ALKBH5 reverse: 5’‐ TCGCGGTGCATCTAATCTTG‐3’
Western blotPara extrair proteínas totais, os lisados celulares foram obtidos utilizando tampão RIPA (Beyotime, Xangai, China) suplementado com fosfatase e inibidores de protease (Yeasen, Xangai, China). Um total de 15μL de proteína foi injetado em um gel Bis‐Tris SDS/PAGE e transferido para membranas de PVDF. Após bloqueio com BSA a 5%, as membranas foram incubadas com anticorpo primário durante a noite a 4°C. As membranas foram então expostas ao anticorpo secundário durante 60 minutos. As tiras foram incubadas com kit ECL e analisadas por sistema de imagem. A análise densitométrica foi realizada com o software Adobe Photoshop CS6.
Ensaio citolíticoCélulas T CD8+ purificadas foram obtidas por seleção negativa. As células de CECC foram adicionadas a células T CD8+ purificadas na proporção de 1:10‐50 e cultivadas em placas de 48 poços (Costar 3548, Cambridge, MA) em meio RPMI 1640. IL‐2 (50 unidades/mL, Chiron, Emeryville, CA) foi adicionado a cada poço começando no 1° dia e a cada 2 a 3 dias depois disso. As células de CECC foram colhidas no dia 7 e analisadas em relação à atividade lítica em triplicata utilizando o ensaio CCK‐8.
Ensaio imunoabsorvente ligado a enzimaO ensaio imunoenzimático (ELISA) para detecção de citocinas foi realizado com kits (Boster Bio, Wuhan, China).
Ensaio CCK‐8Um total de 103 células foi inoculado em cada poço das placas de 96 poços. Em cada intervalo (24, 48, 72 e 96 horas), 10μL de solução CCK‐8 (Yeasen, Shanghai, China) foram adicionados aos poços em sextuplicata. Os poços foram incubados durante 3 horas, e a absorbância de cada poço foi determinada a 450nm.
Ensaios in vivoTodos os experimentos com animais foram aprovados pelo Comitê de Ética em Experimentação Animal do First Hospital, Shanxi Medical University. Camundongos C57BL/6 com 8 semanas de idade foram mantidos de acordo com as diretrizes dos 3Rs (reduzir, reutilizar e reciclar). Um total de 1×107 células SCC7 ressuspensas em 100μL de PBS foi inoculado por via subcutânea no flanco esquerdo dos camundongos. Quando o volume do tumor atingiu 50‐100 mm3, foi injetado anticorpo anti‐PD‐1 (200μg/camundongo) isolado ou combinado com vacina contra HPV (0,25μL/camundongo). Após a detecção do tumor, seu tamanho foi medido com paquímetro a cada cinco dias, e o volume do tumor foi calculado como volume (cm3)=C×L2×0,5, com C e L representando os diâmetros maior e menor, respectivamente.
Quantificação da metilação de RNA m6AO kit de ensaio de metilação de RNA m6A (Abcam, ab185912) foi utilizado para avaliar o conteúdo de m6A no RNA total.
Dot blotOs poli (A) + RNAs (400 ng) foram diluídos duas vezes e colocados em membrana de náilon (GE Healthcare, EUA). Resumidamente, as membranas foram então submetidas a reação cruzada com UV, bloqueadas, incubadas com anticorpo m6A e conjugado anti‐IgG de coelho com peroxidase de rábano, e finalmente detectadas com um kit de substrato de 3,3’‐diaminobenzidina peroxidase. Os mesmos 400 ng de poli(A)+ RNAs foram colocados na membrana, corados com azul de metileno 0,02% em acetato de sódio 0,3M por 2 horas e lavados com água livre de ribonuclease por 5 horas.
Análise estatísticaAs análises estatísticas foram realizadas utilizando o software SPSS versão 19.0 (SPSS, Inc., Chicago, IL, EUA) ou GraphPad Prism 7.0 (GraphPad Software, EUA), como descrito anteriormente. Os valores são apresentados como média±desvio padrão (DP). Para comparações, foram realizados o teste t de Student e o teste ANOVA unidirecional pelo teste de diferença mínima significante, como apropriado. Valor de p<0,05 foi considerado estatisticamente significante.
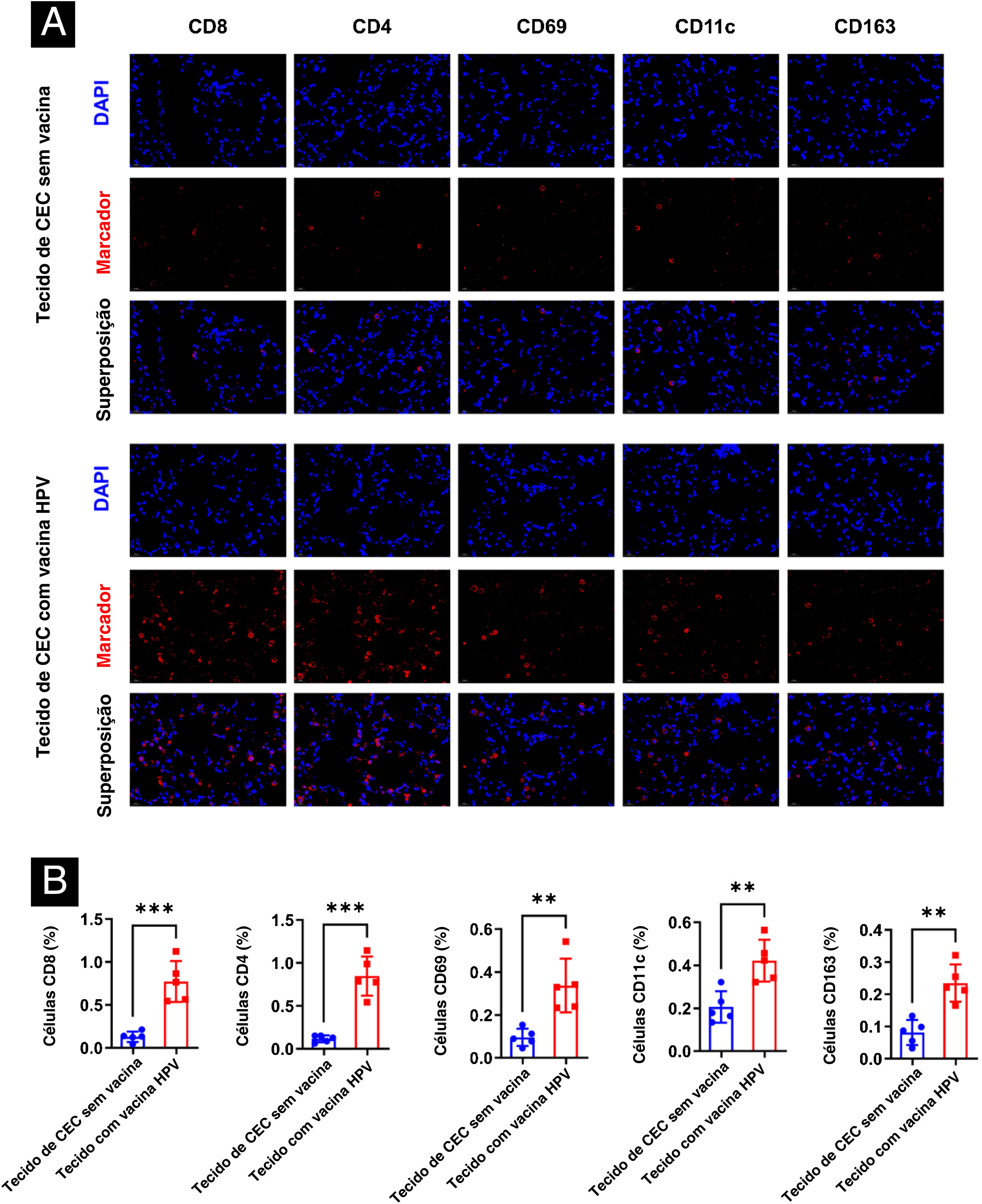
ResultadosVacina contra o HPV aumenta a infiltração de células imunes em tecidos de CECC em humanosForam selecionados cinco amostras de tecido tumoral de pacientes com CECC vacinados contra HPV e outras cinco não vacinados contra HPV, a fim de determinar o efeito da vacina contra HPV nas células imunes em tecidos humanos de CECC, e foi analisada a infiltração de CD8, CD4, NK, DC e macrófagos em tumores de CECC por imunofluorescência. Houve diferença estatística significante entre os dois grupos nos cinco tipos de células imune. A expressão de CD8, CD4, CD69, CD11c e CD163 nos tumores humanos no grupo vacinado estava significantemente aumentada (fig. 1).
Diferenças no microambiente imunológico em tecidos de CECC de pacientes vacinados e não vacinados contra HPV. (A) Diferenças no microambiente imunológico (CD8, CD4, NK, DC, macrófago) em tecidos de CECC. (B) Análise estatística com uso do software Image J da porcentagem de células imunológicas positivas. **p<0,01, ***p<0,001.
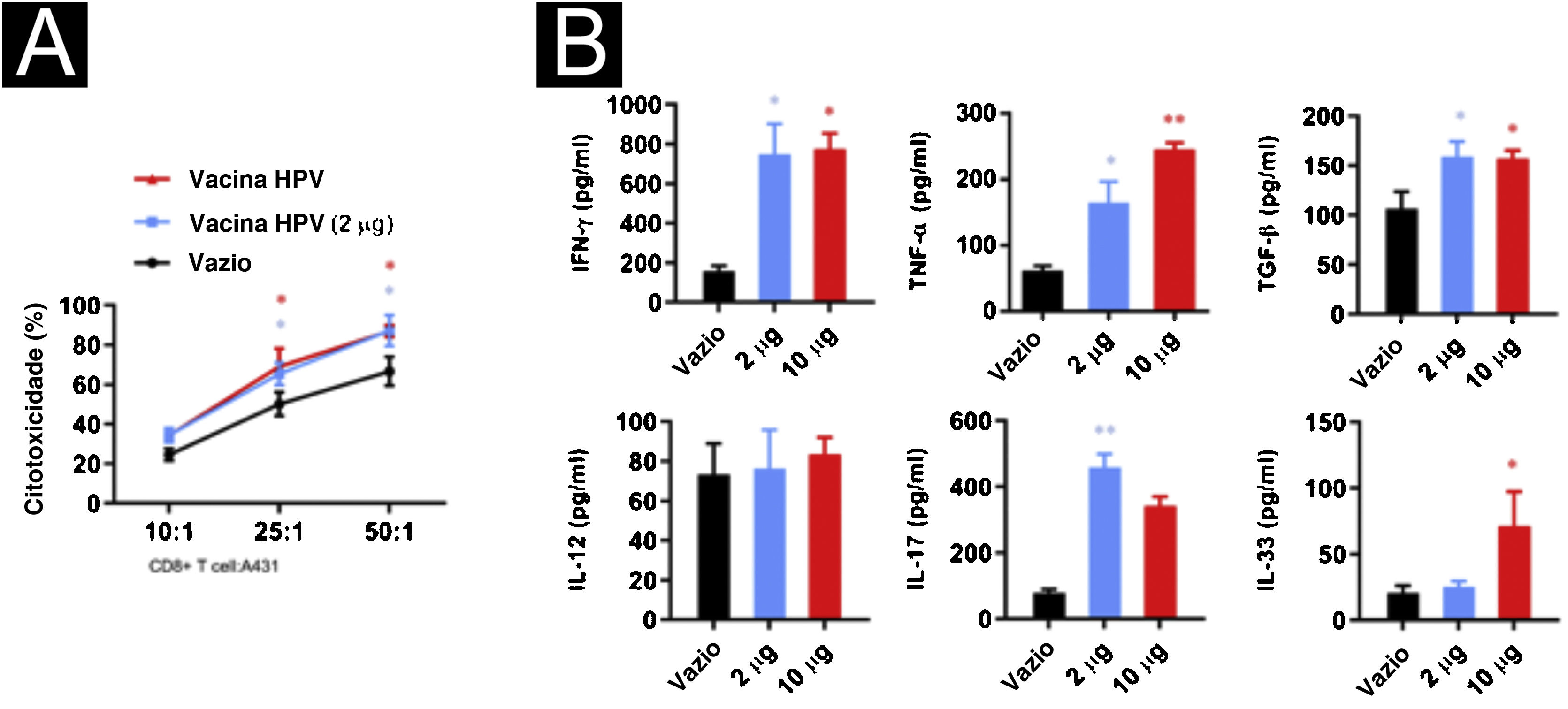
Para investigar o efeito da vacina contra o HPV na atividade das células T CD8+, foi realizada cocultura de células T CD8+ com células A431 nas proporções 10:1, 25:1 e 50:1 e adicionados 2μg ou 10μg da vacina bivalente contra o HPV Cervarix (GSK, 0,5μg/mL). As células T CD8+ mostraram maior atividade citotóxica após a adição da vacina contra o HPV; entretanto, as diferenças na atividade indutora de morte celular da vacina contra o HPV em diferentes concentrações nas células A431 não foram estatisticamente significantes em determinada razão potência‐alvo (fig. 2A). Para explorar o efeito da vacina contra HPV na produção de citocinas no sistema de cocultura, foram examinados IFN‐γ, TNF‐α, TGF‐β, IL‐17, IL‐12 e IL‐33 no sobrenadante. A secreção de IFN‐γ, TNF‐α, TGF‐β e IL‐17 aumentou significantemente após a adição de 2μg de vacina contra o HPV, enquanto a produção de IFN‐γ, TNF‐α, TGF‐β e IL‐33 aumentou após a adição de 10μg de vacina contra HPV (fig. 2B).
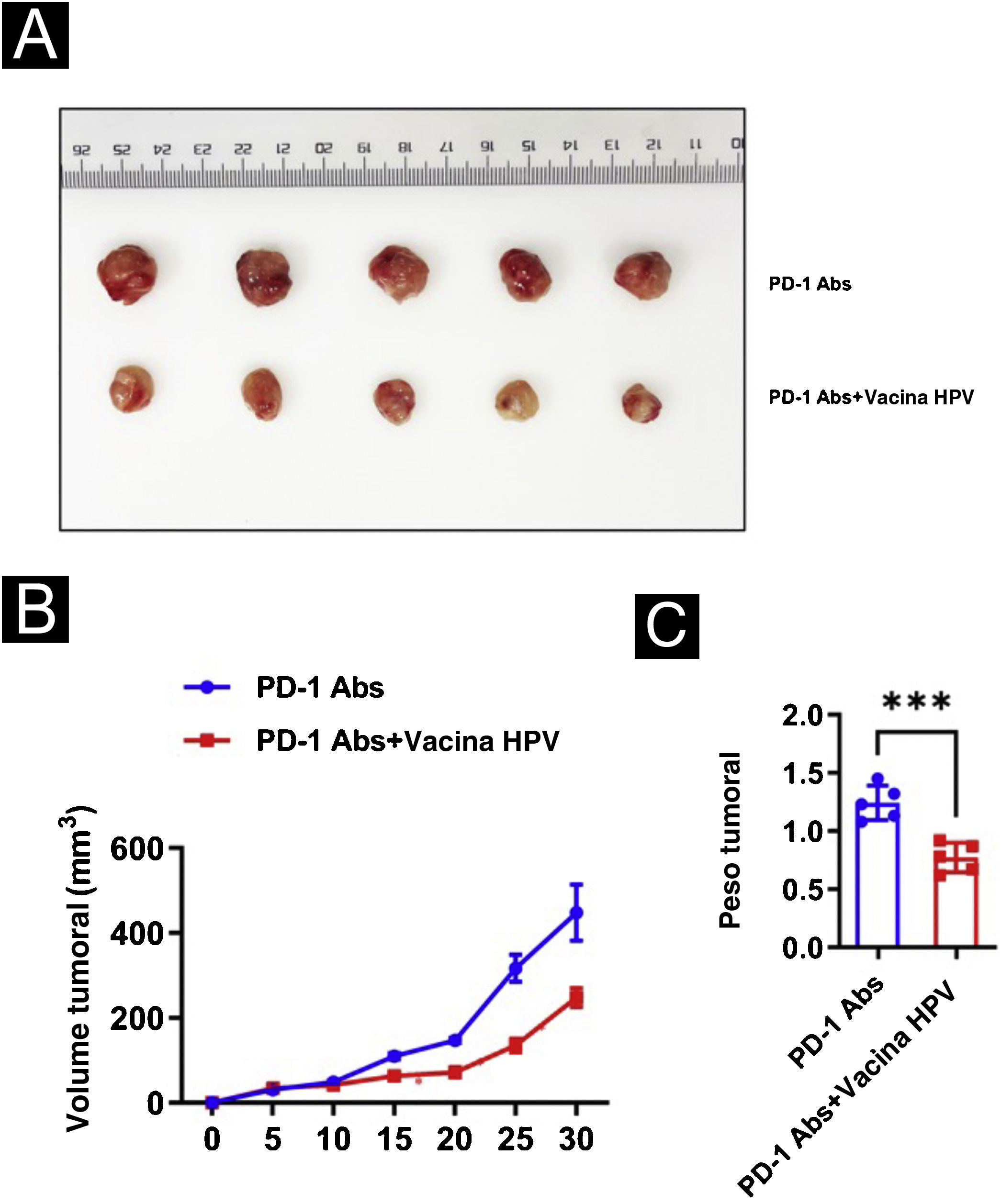
Vacina contra o HPV combinada com tratamento com anticorpos monoclonais anti‐PD‐1 inibe o desenvolvimento de tumores em camundongos in vivoPara analisar melhor o efeito da vacina contra o HPV no CECC em modelo animal, foi levantada a hipótese de que a adição da vacina contra o HPV aumentaria a imunogenicidade e os efeitos antitumorais do tratamento com PD‐1 em camundongos. Para testar essa hipótese, dez camundongos com CECC foram divididos em dois grupos de cinco camundongos cada e foi injetado PD‐1 Abs (10377‐M94, SinoBiological) ou PD‐1Abs + vacina contra o HPV. Não foi criado um grupo sem tratamento que refletisse o efeito terapêutico do PD‐1 no CECC, porque em outros estudos concluiu‐se que o anticorpo monoclonal PD‐1 tem efeito inibitório significante no CECC.22‐25 Para monitorar a resposta antitumoral, o volume do tumor foi medido a cada cinco dias e os camundongos foram submetidos a eutanásia no 30° dia; o tecido tumoral foi então isolado e pesado (fig. 3A). Em comparação com o grupo PD‐1Abs, os tumores no grupo PD‐1Abs+vacina HPV diminuíram de peso (fig. 3B) e volume (fig. 3C) no 30° dia, o que demonstrou que regressão estável foi observada nos tumores em todos os grupos. A análise dos tecidos tumorais de camundongos com imunofluorescência mostrou aumento significante na infiltração intratumoral de CD8, CD4, NK, DC e macrófagos em camundongos que receberam anticorpo monoclonal PD‐1 combinado com vacina contra o HPV (fig. 4).
Efeito da vacina contra HPV combinada com anticorpo monoclonal PD‐1 na imunofluorescência em camundongos. (A) Observação por imunofluorescência de diferenças no microambiente imunológico (CD8, CD4, NK, DC, macrófago). (B) Análise estatística utilizando o software Image J da porcentagem de células imunológicas positivas. ***p<0,001.
A fim de observar o efeito da vacina contra HPV em m6A em tecidos tumorais, foi analisado o conteúdo de m6A em tecidos tumorais de camundongos usando método colorimétrico e Dot blot, e observou‐se que o conteúdo de m6A no grupo de PD‐1Abs+vacina contra o HPV foi significantemente menor do que no grupo PD‐1Abs (fig. 5). Avaliou‐se também a expressão de m6A metil‐esterase e desmetilase por qPCR, e os resultados foram mostrados em 3H. METTL3 foi regulado negativamente de maneira significante na presença da vacina contra o HPV, enquanto as diferenças de METTL14, RBM15, WTAP, VIRMA, FTO e ALKBH5 não foram estatisticamente significantes (fig. 6A). A regulação negativa da expressão de METTL3 ao nível de proteína no grupo PD‐1Abs+vacina contra o HPV foi também verificada por Western blot (fig. 6B).
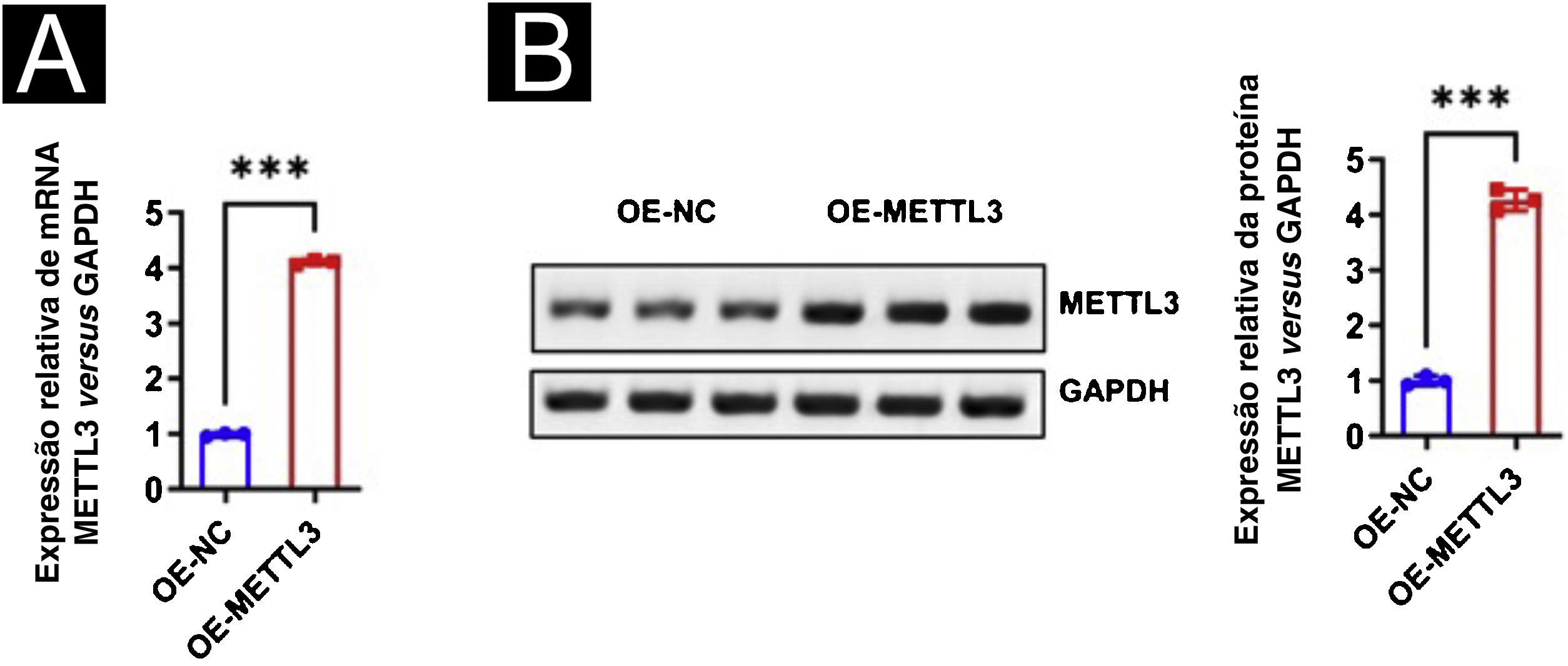
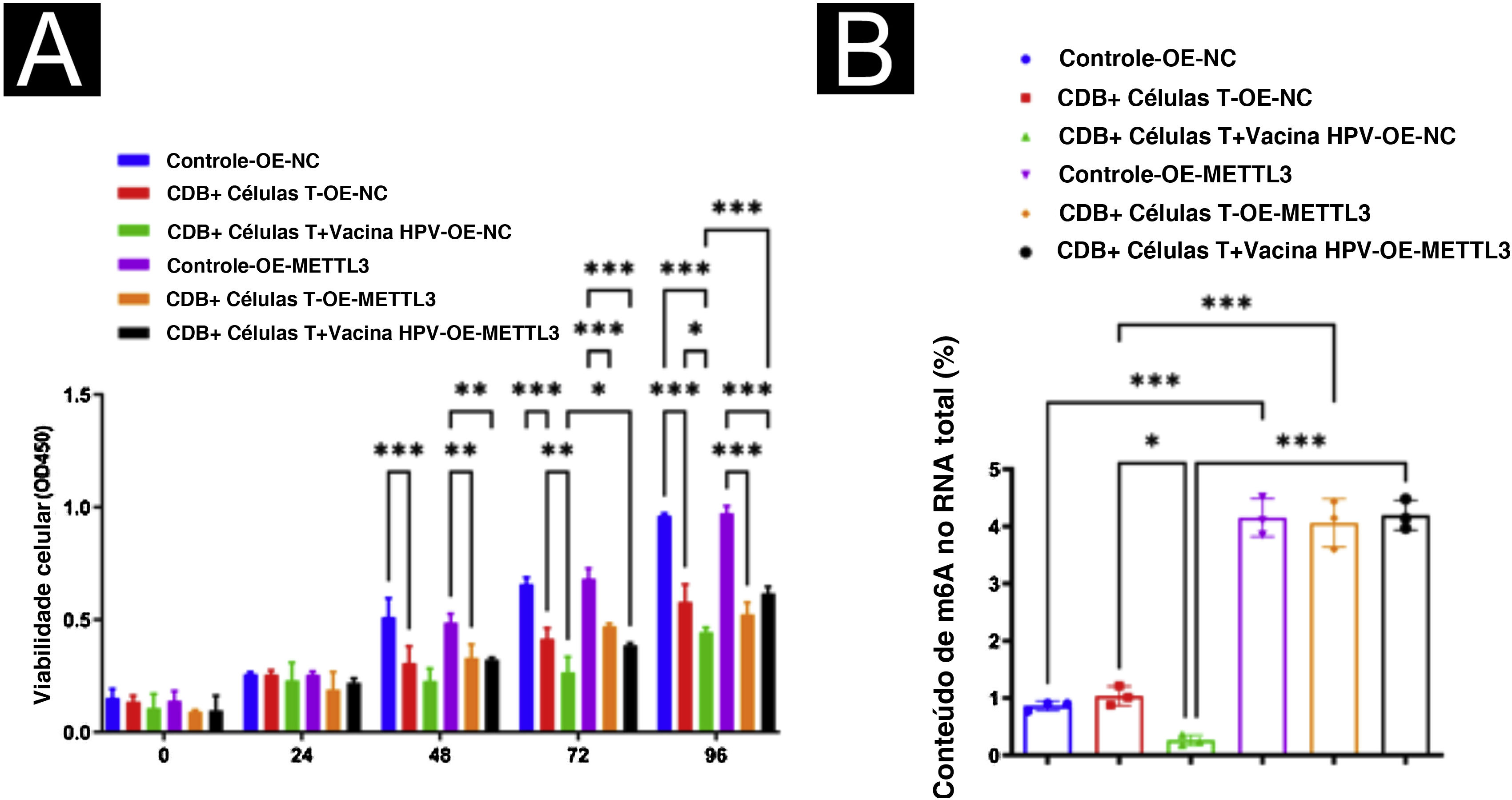
Para estudos adicionais sobre o efeito da vacina contra HPV na expressão de METTL3 no CECC, foi realizada a superexpressão de METTL3, e qPCR e Western blot foram realizados para detectar a eficiência de superexpressão nos níveis de mRNA e proteína (fig. 7). O ensaio CCK‐8 revelou que não houve diferença significante na atividade celular entre os seis grupos após 24 horas de incubação. Após 96 horas de cultura, a atividade celular foi significantemente reduzida quando cocultivada com células T CD8+ e células A431 em comparação com o grupo controle, com maior redução na atividade das células A431 após a adição da vacina contra HPV, com diferenças estatísticas em todos os grupos. Após a superexpressão de METTL3, demonstrou‐se o efeito inibitório das células T CD8+ e da vacina contra o HPV na atividade das células A431, e a atividade das células A431 foi significantemente maior no grupo de células T CD8++vacina contra HPV‐OE‐METTL3 do que no grupo células T CD8++vacina contra o HPV‐OE‐NC (fig. 8A). Além disso, m6A foi avaliado em cada grupo e observou‐se que a vacina contra o HPV reduziu significantemente o conteúdo total de m6A no sistema de cocultura, enquanto a superexpressão de METTL3 aboliu significantemente esse efeito. Curiosamente, o conteúdo de m6A no grupo de células T CD8++vacina contra HPV‐OE‐NC não foi estatisticamente diferente de modo significante do grupo Controle‐OE‐NC, enquanto o conteúdo de m6A no grupo de células T CD8+‐OE‐NC foi elevado em comparação com o grupo Controle‐OE‐NC, embora sem diferença estatística (fig. 8B).
Mecanismos da suscetibilidade aumentada do CECC à imunoterapia, induzida pela vacina contra HPV. (A) Ensaio CCK8 revelou que a vacina contra o HPV promoveu significantemente o efeito supressor das células T CD8+ nas células A431, enquanto a superexpressão de METTL3 atenuou o efeito supressor do tratamento com a vacina contra o HPV nas células A431 pelas células T CD8+. (B) O ensaio m6A revelou que a vacina contra o HPV reduziu significantemente o conteúdo total de m6A no sistema de cocultura de células T CD8++células A431, enquanto o knockdown de METTL3 aboliu significantemente este efeito. *p<0,05, **p<0,01, ***p<0,001.
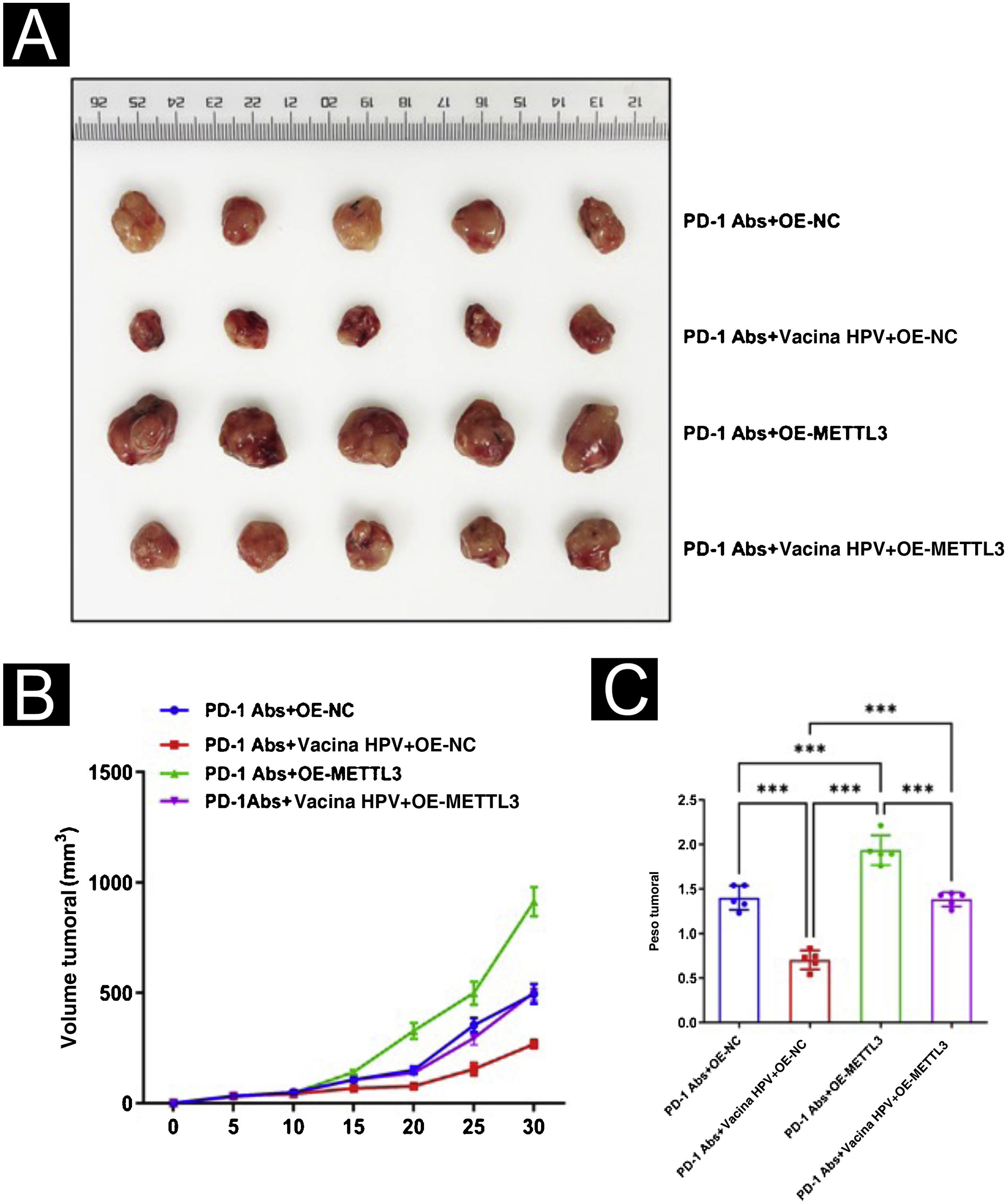
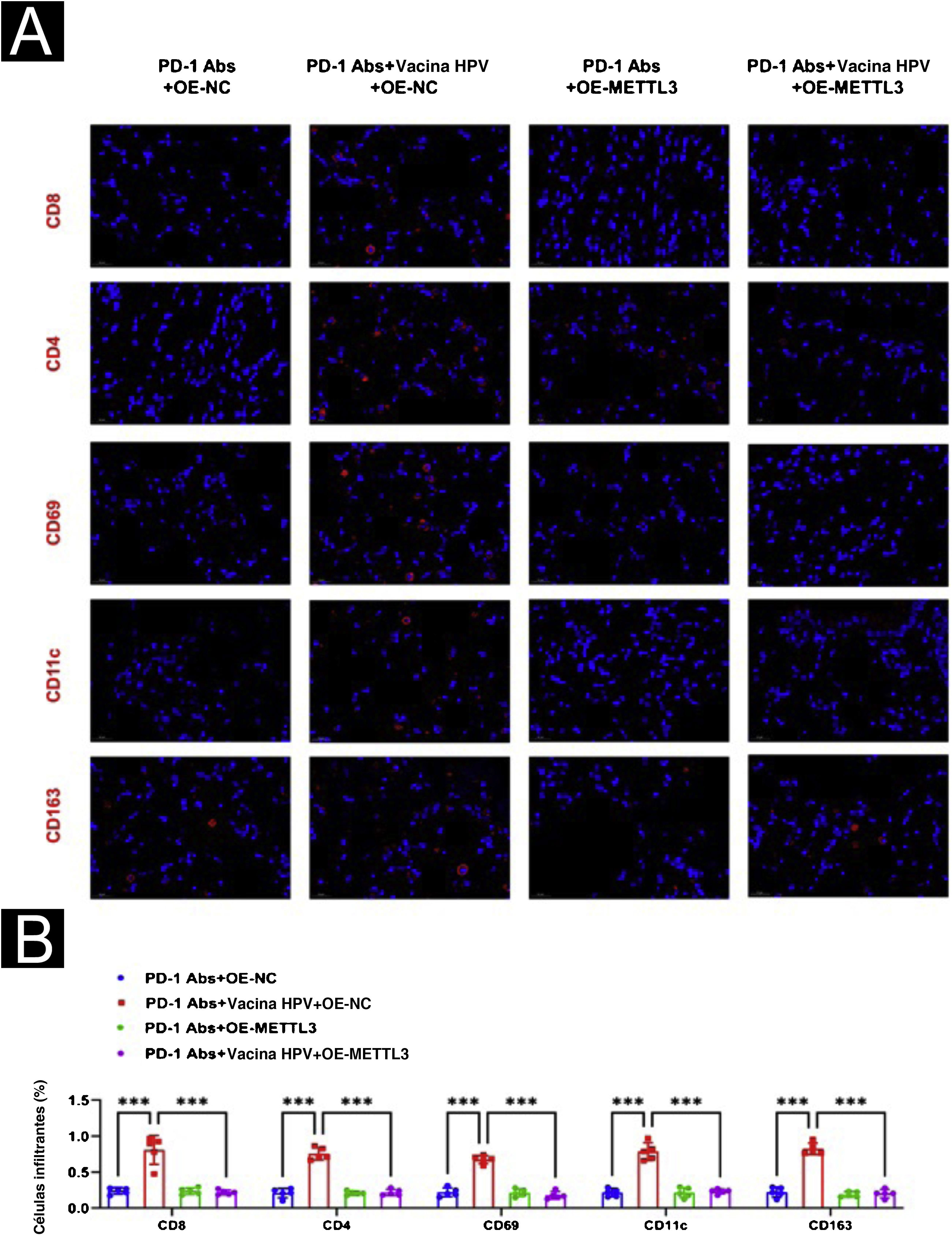
Para avaliação adicional do efeito de METTL3 na vacina contra o HPV no CECC, foram realizadas experiências de xenoenxerto de tumor. Os modelos de camundongos com CECC foram divididos em quatro grupos de cinco camundongos cada e foi administrado tratamento com PD‐1Abs+OE‐NC, PD‐1Abs+vacina contra o HPV+OE‐NC, PD‐1Abs+OE‐METTL3 e PD‐1Abs+vacina contra o HPV+OE‐METTL3, respectivamente. Na combinação do anticorpo anti‐PD‐1 com a vacina contra o HPV, o volume e o peso do tumor foram significantemente reduzidos, e o cotratamento com a vacina contra o HPV e o anticorpo anti‐PD‐1 de camundongo resultou na inibição completa do crescimento do tumor, enquanto o efeito inibitório do anticorpo anti‐PD‐1 no volume e peso do tumor foi atenuado após superexpressão de METTL3 (fig. 9). Histologicamente, verificou‐se que o grupo PD‐1Abs+vacina contra HPV+OE‐NC apresentou infiltrados intratumorais significantemente maiores de CD8, CD4, NK, DC e macrófagos do que os outros grupos (fig. 10).
Efeito da superexpressão de METTL3 na terapia combinada avaliado na imunofluorescência. (A) Observação por imunofluorescência de diferenças no microambiente imunológico (CD8, CD4, NK, DC, macrófago). (B) Análise estatística com o software Image J da proporção de células imunes positivas.***p<0,001.
A imunossupressão se manifesta principalmente pela capacidade proliferativa diminuída ou ausente dos linfócitos T e pela produção disfuncional de citocinas.26,27 As células T CD8+ são células imunológicas que podem reconhecer e matar células cancerígenas, sendo consideradas células com potencial de erradicação tumoral.28 O presente estudo descobriu que a vacina contra o HPV aumentou os efeitos tóxicos das células T CD8+ no CECC. As células T CD8+ são produtoras de múltiplas citocinas, e a vacina contra o HPV resultou no aumento da produção de IFN‐γ, TNF‐α, TGF‐β, IL‐17 e IL‐33 pelas células T CD8+. Yunyan Sun concluiu que ambas as vacinas cervicovaginais com TA‐HPV poderiam induzir forte resposta imune local de células T CD8+ antígeno‐específicas para o HPV‐16E7.29 Os presentes resultados sugerem que após a vacinação contra o HPV em humanos, o corpo produz certa resposta imune específica de células T juntamente com a resposta antígeno‐anticorpo, e as citocinas resultantes atuam na supressão de células do carcinoma espinocelular cutâneo, sugerindo que a vacina contra o HPV possa ser útil na estimulação da resposta imune antitumoral.
As enzimas modificadoras de RNA são cruciais para a sobrevivência do tumor à imunoterapia, e as modificações do m6A desempenham papéis oncogênicos em muitos tipos de câncer.30 Os resultados do presente estudo mostraram que a superexpressão de METTL3 em células de CECC aumentou o nível de modificação de m6A em células de CECC, o que confirma o estudo de Renpeng Zhou, adicionalmente,31 indicando que METTL3 manteve a modificação de m6A em células tumorais e promoveu a atividade proliferativa das células neoplásicas no CECC. Portanto, conclui‐se que a vacina contra o HPV inibe o desenvolvimento do CEC ao regular negativamente METTL3, provavelmente porque a regulação negativa da expressão de METTL3 aumenta a sensibilidade das células tumorais às citocinas. Lingling Wang sugeriu que o alto status de expressão de METTL3 estava negativamente correlacionado com a infiltração de células imunes tumorais.32 De maneira similar, os resultados mostraram que as células infiltrantes imunes em tecidos de CECC estavam significantemente reduzidas após a superexpressão de METTL3 no modelo animal deste estudo.
METTL3 pode ser alvo potencial para tratamento clínico de CECC.33 Eliza Yankova demonstrou que um inibidor de METTL3 (STM2457) inibe os efeitos carcinogênicos causados pela superexpressão da enzima METTL3 em experimentos celulares in vitro e in vivo em animais.34 Lingling Wang demonstrou que a depleção das metiltransferases METTL3 e METTL14 melhorou a resposta ao tratamento com anti‐PD‐1 no câncer colorretal e no melanoma.32 A superexpressão de METTL3 seguida de tratamento com anticorpos monoclonais PD‐1 não mostrou tendência significante de regressão tumoral no presente estudo, enquanto a vacina contra o HPV tem potencial para atuar como inibidor de METTL3, e a combinação com anticorpos monoclonais PD‐1 para CECC desempenhou papel sinérgico para desacelerar ainda mais o crescimento do tumor.
Há urgente necessidade de descobrir alvos precisos e eficazes para as abordagens terapêuticas atuais no CECC. A principal descoberta deste estudo foi que o tratamento do CEC com vacina contra o HPV está correlacionado com a expressão de METTL3 e também inibiu a formação de microambiente tumoral imunossupressor. Existem certas deficiências neste estudo: o número de amostras clínicas é pequeno, e pode ser necessário coletar amostras suficientes para estudos futuros, enquanto o uso adicional do sequenciamento de m6A e sequenciamento do transcriptoma podem ser necessários para explorar profundamente os mecanismos regulatórios moleculares do tratamento com vacina contra o HPV mediado por METTL3 para CECC. Em conclusão, os resultados do presente estudo sugerem que METTL3, que pode ser regulado negativamente pelas vacinas contra o HPV, é alvo promissor para o tratamento de CECC.
ConclusõesA vacina contra o HPV aumenta a sensibilidade ao tratamento com anti‐PD‐1 ao regular negativamente METTL3 no CECC. A combinação da vacina contra o HPV e do tratamento com anticorpos monoclonais PD‐1 produz aumento da infiltração de células imunológicas, resultando em melhor controle do tumor e promovendo sua eliminação. No geral, este estudo fornece informaçõe de referência para a exploração e pesquisa aprofundadas da vacina contra o HPV. Em estudos futuros, a investigação sobre os mecanismos de ação do METTL3 deverá ser aprofundada.
Suporte financeiroNenhum.
Contribuição dos autoresYingjie Zhang: Concepção e planejamento do estudo; obtenção de dados, ou análise e interpretação dos dados; redação do manuscrito; obtenção, análise e interpretação dos dados.
Yiru Wang: Obtenção dos dados, ou análise e interpretação dos dados; obtenção, análise e interpretação dos dados.
Shuping Guo: Análise estatística; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Hongzhou Cui: Revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Este trabalho recebeu apoio do First Hospital of Shanxi Medical.
Como citar este artigo: Zhang Y, Wang Y, Guo S, Cui H. METTL3‐mediated HPV vaccine enhances the effect of anti PD‐1 immunotherapy to alleviate the development of cutaneous squamous cell carcinoma. An Bras Dermatol. 2024;99:210–22.
Trabalho realizado no First Hospital of Shanxi Medical University, Taiyuan, China.