Danos imunomediados parainfecciosos relacionados à hanseníase nos nervos periféricos podem causar incapacidades físicas permanentes.1 A neurite hansênica (NH) é inflamação aguda dos nervos periféricos que ocorre em alguns casos de hanseníase. O tratamento atual de escolha são doses imunossupressoras de corticosteroides. Há evidências crescentes de que os corticosteroides podem não ser suficientes para um número considerável de pacientes com hanseníase que apresentam NH refratária.2
O presente relato descreve uma série de casos de pacientes com diagnóstico de NH refratária a corticosteroides sistêmicos que foram tratados com imunoglobulina intravenosa (IGIV) como terapia de resgate para recuperação da função dos nervos periféricos.
Os pacientes foram avaliados no Ambulatório de Dermatologia do Hospital Universitário de Brasília, no período de 2016 a 2022. Todos os pacientes receberam IGIV para o tratamento de reações hansênicas refratárias. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina da Universidade de Brasília (CEP‐FM/UnB; 72312117.4.0000.5558).
Todos os pacientes tiveram o diagnóstico de hanseníase confirmado por dois dermatologistas certificados, seguindo os critérios da Organização Mundial da Saúde (OMS), apoiados pela reação em cadeia de polimerase, como descrito por Sevilha‐Santos et al.3 Antes da prescrição da IGIV, todos os pacientes foram avaliados por neurologista certificado. Avaliações clínicas e laboratoriais detalhadas foram realizadas, incluindo avaliações para tuberculose, infecções sexualmente transmissíveis e tripanossomíase americana. Essas condições representaram critérios de exclusão para o uso da IGIV. Para a avaliação da dor foram utilizados o Universal Pain Assessment Tool (UPAT), com escala de 1 a 10, e o Disability Grading System da OMS, com escala de 0 a 2. Os testes de sensibilidade foram realizados utilizando os monofilamentos de Semmes‐Weinstein segundo as recomendações do Ministério da Saúde do Brasil. A eletroneuromiografia foi realizada uma semana antes e um mês após o quinto ciclo de infusão de IGIV.
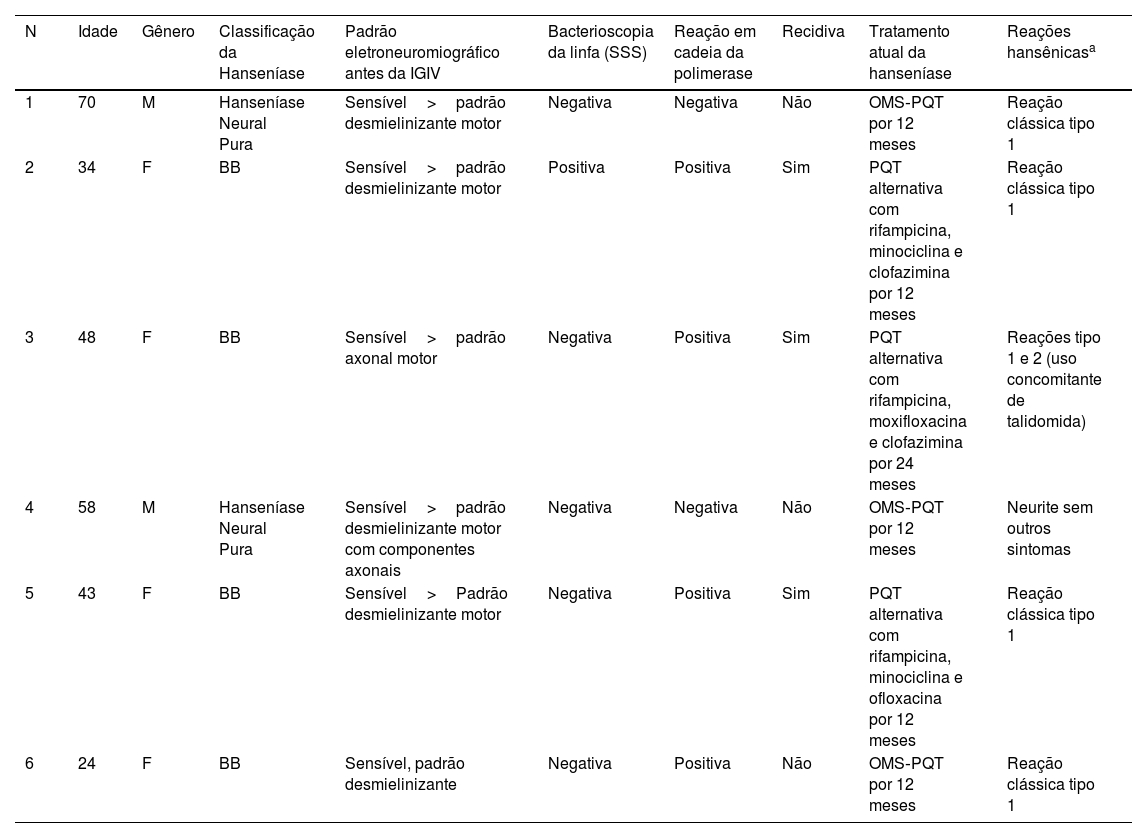
Seis pacientes foram incluídos (tabela 1). Em apenas dois casos, os resultados da bacterioscopia da linfa e do PCR foram negativos. Três pacientes foram classificados como recidiva de hanseníase (tabela 1). Todos os pacientes tiveram diagnóstico de neurite relacionada à hanseníase com deterioração aguda da função nervosa, diagnosticada por avaliação neurológica simplificada seriada e por avaliação neurológica especializada.
Características demográficas e clínicas dos seis pacientes com hanseníase e neurite refratária que receberam imunoglobulina intravenosa
| N | Idade | Gênero | Classificação da Hanseníase | Padrão eletroneuromiográfico antes da IGIV | Bacterioscopia da linfa (SSS) | Reação em cadeia da polimerase | Recidiva | Tratamento atual da hanseníase | Reações hansênicasa |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 70 | M | Hanseníase Neural Pura | Sensível>padrão desmielinizante motor | Negativa | Negativa | Não | OMS‐PQT por 12 meses | Reação clássica tipo 1 |
| 2 | 34 | F | BB | Sensível>padrão desmielinizante motor | Positiva | Positiva | Sim | PQT alternativa com rifampicina, minociclina e clofazimina por 12 meses | Reação clássica tipo 1 |
| 3 | 48 | F | BB | Sensível>padrão axonal motor | Negativa | Positiva | Sim | PQT alternativa com rifampicina, moxifloxacina e clofazimina por 24 meses | Reações tipo 1 e 2 (uso concomitante de talidomida) |
| 4 | 58 | M | Hanseníase Neural Pura | Sensível>padrão desmielinizante motor com componentes axonais | Negativa | Negativa | Não | OMS‐PQT por 12 meses | Neurite sem outros sintomas |
| 5 | 43 | F | BB | Sensível>Padrão desmielinizante motor | Negativa | Positiva | Sim | PQT alternativa com rifampicina, minociclina e ofloxacina por 12 meses | Reação clássica tipo 1 |
| 6 | 24 | F | BB | Sensível, padrão desmielinizante | Negativa | Positiva | Não | OMS‐PQT por 12 meses | Reação clássica tipo 1 |
N, número do paciente; IGIV, imunoglobulina intravenosa; M, masculino; F, feminino; BB, hanseníase borderline‐borderline; OMS, Organização Mundial da Saúde; PQT, poliquimioterapia.
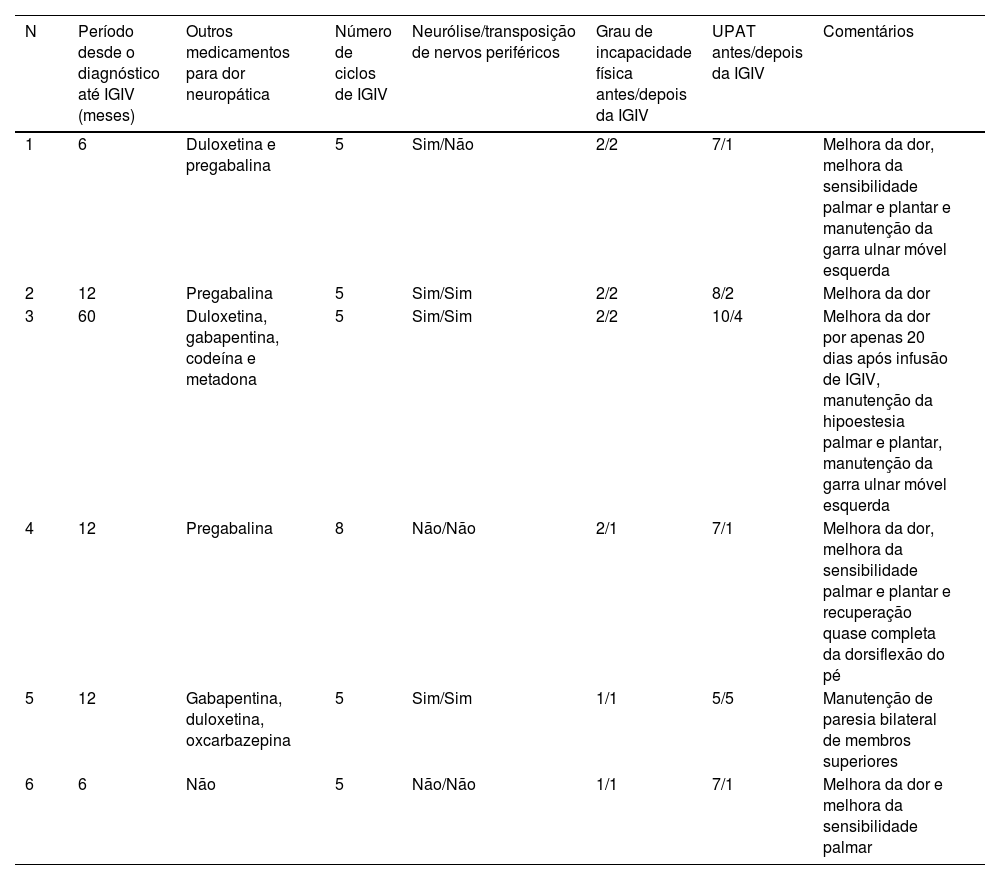
Todos os pacientes receberam mais de três ciclos de prednisona por pelo menos seis meses, com dose inicial mínima de 1mg/kg/dia (tabela 2). Um paciente também recebeu altas doses de metilprednisolona IV (N4). Quatro pacientes foram submetidos à descompressão cirúrgica dos nervos periféricos afetados (neurólise), e três também foram submetidos à transposição dos nervos periféricos. Todos os procedimentos cirúrgicos ocorreram pelo menos dois meses antes da primeira infusão de IGIV. Os pacientes receberam tratamento adjuvante com pregabalina, gabapentina, duloxetina ou opioides (codeína ou metadona).
Terapêutica e resposta clínica dos seis casos de hanseníase com neurite refratária que receberam imunoglobulina intravenosa
| N | Período desde o diagnóstico até IGIV (meses) | Outros medicamentos para dor neuropática | Número de ciclos de IGIV | Neurólise/transposição de nervos periféricos | Grau de incapacidade física antes/depois da IGIV | UPAT antes/depois da IGIV | Comentários |
|---|---|---|---|---|---|---|---|
| 1 | 6 | Duloxetina e pregabalina | 5 | Sim/Não | 2/2 | 7/1 | Melhora da dor, melhora da sensibilidade palmar e plantar e manutenção da garra ulnar móvel esquerda |
| 2 | 12 | Pregabalina | 5 | Sim/Sim | 2/2 | 8/2 | Melhora da dor |
| 3 | 60 | Duloxetina, gabapentina, codeína e metadona | 5 | Sim/Sim | 2/2 | 10/4 | Melhora da dor por apenas 20 dias após infusão de IGIV, manutenção da hipoestesia palmar e plantar, manutenção da garra ulnar móvel esquerda |
| 4 | 12 | Pregabalina | 8 | Não/Não | 2/1 | 7/1 | Melhora da dor, melhora da sensibilidade palmar e plantar e recuperação quase completa da dorsiflexão do pé |
| 5 | 12 | Gabapentina, duloxetina, oxcarbazepina | 5 | Sim/Sim | 1/1 | 5/5 | Manutenção de paresia bilateral de membros superiores |
| 6 | 6 | Não | 5 | Não/Não | 1/1 | 7/1 | Melhora da dor e melhora da sensibilidade palmar |
N, número do paciente; UPAT, Universal Pain Assessment Tool; IGIV, imunoglobulina intravenosa.
Apesar da terapia, a doença em todos os pacientes evoluiu com piora das queixas álgicas e comprometimento da sensibilidade e da função motora. Todos os pacientes já apresentavam eventos adversos relacionados ao uso de corticoides, incluindo fácies cushingoide e hipertensão arterial. O paciente 3 apresentou rápida evolução de catarata. Um paciente também apresentou transtorno por uso de opioides.
A dose de indução de IGIV (Gamunex, Grifols Therapeutics LLC, Los Angeles, EUA) foi de 2g/kg dividida em cinco dias para todos os ciclos de infusão. As infusões foram repetidas por cinco ciclos em intervalos mensais. Doses adicionais foram prescritas dependendo da resposta clínica. Todos os pacientes iniciaram infusões de imunoglobulina com prednisona adjuvante 1mg/kg/dia ou doses equivalentes, e as dosagens foram reduzidas semanalmente de acordo com a resposta.
A mediana do tempo desde o diagnóstico até a primeira infusão de IGIV foi de 12 meses (variação=6‐60). Todos os pacientes (incluindo casos de recidiva) receberam a primeira dose da poliquimioterapia no mesmo dia do diagnóstico de hanseníase. Todos os pacientes foram acompanhados por pelo menos 12 meses após o primeiro ciclo de IGIV. Na maioria dos casos, foi obtida redução dramática da dor e melhora evidente na sensibilidade e nas funções motoras (tabela 2). Os pacientes relataram um UPAT mediano de 7 (intervalo=5–10) antes e um valor mediano de 1,5 (intervalo=1–5) após a quinta infusão de IGIV. Resposta sustentada após cinco doses de IGIV foi apresentada por quatro pacientes (N1, N2, N5 e N6), mesmo seis meses após a última infusão de IGIV. Um paciente precisou de um total de oito infusões para atingir a remissão (N4). O paciente N3, único que apresentou reação tipo 2 concomitante e estava em uso de talidomida, apresentou melhora da dor por apenas 20 dias, aparentemente sem melhora da sensibilidade e das funções motoras. Esse paciente iniciou a terapia com IGIV consideravelmente mais tarde que os demais, e a doença nos pacientes 3 e 4 evoluiu com padrões de neuropatia axonal consideravelmente maiores, demonstrados pela eletroneuromiografia, em comparação com os demais pacientes (tabela 1).
De acordo com a escala UPAT, quatro dos seis pacientes apresentaram alívio significante e duradouro da dor, enquanto um permaneceu estável (N5). Com exceção do paciente N3, todos os pacientes apresentaram melhora variável na velocidade de condução e/ou amplitude dos potenciais no exame de eletroneuromiografia realizado um mês após a quinta infusão de IGIV.
A IGIV é tratamento bem estabelecido para neuropatias desmielinizantes e tem forte efeito anti‐inflamatório. Estudos anteriores revelaram que os níveis de IL‐1β, TNF, IL‐6 TGF‐β e IL‐17 estão elevados no soro e no sangue de pacientes com hanseníase que apresentam NH.4 O efeito significante da IGIV no alívio da dor pode estar ligado à redução na inflamação e danos à mielina e aos nervos.
Em dois pacientes, a bacterioscopia da linfa e a PCR não revelaram presença de Mycobacterium leprae. A exclusão sistemática de outras causas de neuropatia periférica é obrigatória. Uma importante limitação relacionada ao tratamento com IGIV é que existem diferentes métodos utilizados para produzir diferentes marcas de IGIV. Estudos anteriores mostraram que marcas diferentes podem ter efeitos clínicos diferentes.5
A IGIV também atua reduzindo os níveis de subconjuntos pró‐inflamatórios de monócitos do sangue periférico (CD14+CD16++).6 Além disso, em um modelo de esclerose múltipla em camundongos, a IGIV anulou a progressão da doença ao inibir a via pró‐inflamatória Th17.7 Aparentemente, a IL17 exerce papel importante na NH.2
Pode‐se concluir que a IGIV é uma opção interessante para o tratamento da NH refratária, podendo reduzir os efeitos deletérios de altas doses de corticosteroides. Atualmente, não existem abordagens alternativas para o tratamento da NH que não responde aos corticosteroides. Os resultados a longo prazo da medicação e a segurança da IGIV para a NH devem ser avaliados urgentemente por meio de ensaios clínicos.
Suporte financeiroFUNADERM – Fundo de Apoio à Dermatologia.
Contribuição dos autoresJoão Guilherme Pessôa Léo: Redação do artigo ou revisão crítica do conteúdo intelectual importante.
Camila Bocchi Siqueira: Concepção e o desenho do estudo.
Jorgeth de Oliveira Carneiro da Motta: Obtenção, análise e interpretação dos dados.
Ingrid Faber de Vasconcellos: Redação do artigo ou revisão crítica do conteúdo intelectual importante.
Yuna Ribeiro de Araujo: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Felipe Von Glehn: Redação do artigo ou revisão crítica do conteúdo intelectual importante.
Patrícia Shu Kurizky: Obtenção, análise e interpretação dos dados e revisão crítica da literature.
Ciro Martins Gomes: Análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Cláudia Porto: Redação do artigo ou revisão crítica do conteúdo intelectual importante.
Maria Stella Cochrane Feitosa: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa e aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos a todos os funcionários do Hospital Universitário de Brasília, DF.
Como citar este artigo: Léo JGP, Siqueira CB, Motta JCO, Vasconcellos IF, Araujo YR, Glenh FV, et al. The use of intravenous immunoglobulin as a rescue therapy for refractory parainfectious leprosy‐related neuritis: a case series. An Bras Dermatol. 2024;99:736–9.
Trabalho realizado no Hospital Universitário de Brasília, Brasília, DF, Brasil.