Apesar de corresponder a apenas cerca de 1% de todos os cânceres de pele, o melanoma é responsável por 90% da mortalidade por malignidades cutâneas, e o tratamento das formas avançadas inflige importante impacto orçamentário ao sistema de saúde.1 Nas últimas décadas, houve consistente aumento de sua incidência em todo o mundo; entretanto, sua mortalidade específica permaneceu estável ou sofreu leve redução na maioria das séries históricas.2
No triênio 2020–2022, o Instituto Nacional de Câncer (INCA) estimou o diagnóstico de 8.400 melanomas no Brasil (4 casos/100.000 habitantes). Como os dados epidemiológicos longitudinais brasileiros são escassos, neste trabalho objetivamos verificar a transição na epidemiologia dos melanomas cutâneos primários, em 21 anos, diagnosticados em serviço público universitário no interior do Brasil.
Conduziu‐se estudo retrospectivo e analítico de pacientes diagnosticados com melanoma in situ ou invasivos no período entre janeiro de 1999 e dezembro de 2019, no laboratório de patologia do Hospital das Clínicas da Faculdade de Medicina de Botucatu (FMB‐Unesp). Procedeu‐se a coleta de dados demográficos dos pacientes e histopatológicos, referentes às características da neoplasia. Os subgrupos foram comparados por modelos logísticos (binários ou ordinais), a dimensão do efeito foi estimada pela razão de chances (Odds Ratio) com seu intervalo de confiança de 95% (IC 95%), e a significância foi definida como p <0,05. O projeto foi aprovado pelo Comitê de Ética em Pesquisa da instituição.
Nesse intervalo, foram diagnosticados 615 melanomas cutâneos primários em 590 pacientes, dos quais 300 (50,8%) eram mulheres e 24 (4,1%) apresentaram mais de um melanoma durante o período. A idade média (desvio‐padrão) ao diagnóstico foi de 61,3 (15,8) anos, variando entre 12 e 92 anos. A incidência de melanoma cutâneo primário, na instituição, apresentou crescimento médio anual de 4,0% (IC 95% de 2,0% a 5,7%) ao ano, nos últimos 21 anos. Não houve diferença na proporção de idosos ou quanto ao sexo, em função dos anos (p> 0,68).
A tabela 1 exibe as principais características dos melanomas e sua associação com sexo e faixa etária. Houve predominância de casos no tórax e região cefálica. Os tumores dos membros foram mais frequentes em mulheres, enquanto os cefálicos foram em idosos e homens. Formas extensivas superficiais foram as mais comuns, além de serem associadas ao sexo feminino e idades <60 anos. Já os melanomas nodulares prevaleceram em homens. Pacientes <60 anos também apresentaram maiores níveis de invasão histológica (1–3mm).
Principais características quanto ao sexo e faixa etária dos melanomas cutâneos primários diagnosticados em hospital universitário: 1999 a 2019 (n=615)
| Total | Feminino | Masculino | OR | 95% IC | p‐valor | <6 0 anos | ≥ 60 anos | OR | IC 95% | p‐valor | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Topografia | ||||||||||||||||
| Tórax | 202 | 33% | 83 | 27% | 119 | 39% | 0,58 | 0,42‐0,82 | 0,002 | 107 | 43% | 95 | 26% | 2,10 | 1,50‐2,96 | <0,001 |
| Cabeça/pescoço | 193 | 31% | 85 | 28% | 108 | 35% | 0,70 | 0,50‐0,99 | 0,043 | 50 | 20% | 143 | 39% | 0,38 | 0,27‐0,56 | <0,001 |
| Membro superior | 80 | 13% | 53 | 17% | 27 | 9% | 2,16 | 1,33‐3,50 | 0,002 | 34 | 14% | 46 | 13% | 1,08 | 0,67‐1,74 | 0,742 |
| Acral | 72 | 12% | 38 | 12% | 34 | 11% | 1,13 | 0,69‐1,85 | 0,626 | 29 | 12% | 43 | 12% | 0,98 | 0,59‐1,61 | 0,922 |
| Membro inferior | 66 | 11% | 47 | 15% | 19 | 6% | 2,73 | 1,59‐4,69 | <0,001 | 31 | 12% | 35 | 10% | 1,32 | 0,79‐2,21 | 0,281 |
| Outro/não classificado | 2 | 0% | 2 | 1% | 0 | 0% | ‐ | ‐ | ‐ | 0 | 0% | 2 | 1% | ‐ | ‐ | ‐ |
| Tipo histológico | ||||||||||||||||
| Extensivo superficial | 256 | 42% | 147 | 48% | 109 | 36% | 1,66 | 1,20‐2,29 | 0,002 | 139 | 55% | 117 | 32% | 2,62 | 1,89‐3,64 | <0,001 |
| Lentigo | 174 | 28% | 78 | 25% | 96 | 31% | 0,75 | 0,52‐1,06 | 0,102 | 30 | 12% | 144 | 40% | 0,21 | 0,14‐0,31 | <0,001 |
| Lentiginoso acral | 64 | 10% | 34 | 11% | 30 | 10% | 1,15 | 0,68‐1,92 | 0,607 | 23 | 9% | 41 | 11% | 0,79 | 0,46‐1,36 | 0,402 |
| Nodular | 60 | 10% | 22 | 7% | 38 | 12% | 0,54 | 0,32‐0,94 | 0,029 | 26 | 10% | 34 | 9% | 1,12 | 0,66‐1,92 | 0,676 |
| Outro/não classificado | 61 | 10% | 27 | 9% | 34 | 11% | ‐ | ‐ | ‐ | 33 | 13% | 28 | 8% | ‐ | ‐ | ‐ |
| Espessura de Breslow | ||||||||||||||||
| In situ | 209 | 34% | 106 | 37% | 103 | 37% | 1,00 | ‐ | 0,644 | 71 | 28% | 138 | 38% | 1,00 | ‐ | 0,008 |
| ≤ 1 mm | 173 | 28% | 93 | 32% | 80 | 29% | 1,13 | 0,76‐1,69 | 83 | 33% | 90 | 25% | 1,79 | 1,19‐2,71 | ||
| 1‐3 mm | 81 | 13% | 46 | 16% | 35 | 13% | 1,28 | 0,76‐2,14 | 40 | 16% | 41 | 11% | 1,90 | 1,13‐3,19 | ||
| 3 mm | 102 | 17% | 43 | 14% | 59 | 21% | 0,71 | 0,44‐1,14 | 35 | 14% | 67 | 18% | 1,02 | 0,62‐1,67 | ||
| Não classificado | 50 | 8% | 20 | 7% | 30 | 10% | ‐ | ‐ | ‐ | 22 | 9% | 28 | 8% | ‐ | ‐ | ‐ |
| Nível de Clark | ||||||||||||||||
| I | 209 | 34% | 106 | 34% | 103 | 34% | 1,00 | ‐ | 0,734 | 71 | 28% | 138 | 38% | 1,00 | ‐ | 0,048 |
| II | 96 | 16% | 53 | 17% | 43 | 14% | 1,20 | 0,74‐1,95 | 46 | 18% | 50 | 14% | 1,79 | 1,09‐2,93 | ||
| III | 132 | 21% | 62 | 20% | 70 | 23% | 0,86 | 0,56‐1,33 | 63 | 25% | 69 | 19% | 1,78 | 1,14‐2,78 | ||
| IV | 100 | 16% | 49 | 16% | 51 | 17% | 0,93 | 0,58‐1,50 | 38 | 15% | 62 | 17% | 1,19 | 0,73‐1,95 | ||
| V | 19 | 3% | 12 | 4% | 7 | 2% | 1,67 | 0,63‐4,40 | 6 | 2% | 13 | 4% | 0,90 | 0,33‐2,46 | ||
| Não classificado | 59 | 10% | 26 | 8% | 33 | 11% | ‐ | ‐ | ‐ | 27 | 11% | 32 | 9% | ‐ | ‐ | ‐ |
OR, odds ratio (razão de chances).
Quando comparados, os melanomas agrupados em três períodos de sete anos (tabela 2), ajustados por sexo e idade por meio de uma regressão logística ordinal, os tumores acrais e torácicos aumentaram sua frequência, assim como os tipos extensivos superficiais e os lentiginosos acrais. Em contrapartida, tumores localizados na cabeça e pescoço, assim como os lentigos malignos, reduziram sua frequência, entre os períodos. Não houve modificação nas proporções dos tumores de acordo com os níveis de invasão histológica, e cerca de 35% dos melanomas são diagnosticados com> 1mm.
Comparação evolutiva das proporções relacionadas ao melanoma cutâneo diagnosticado em hospital universitário: 1999–2019 (n=615)
| 1999‐2005 (n=140) | 2006‐2012 (n=256) | 2013‐2019 (n=219) | ORa | 95% IC | p‐valora | ||||
|---|---|---|---|---|---|---|---|---|---|
| Topografia | |||||||||
| Tórax | 33 | 24% | 88 | 34% | 81 | 37% | 1,48 | 1,05‐2,08 | 0,027 |
| Cabeça e pescoço | 61 | 44% | 78 | 30% | 54 | 25% | 0,54 | 0,38‐0,76 | 0,001 |
| Membro superior | 24 | 17% | 31 | 12% | 25 | 11% | 0,73 | 0,45‐1,17 | 0,189 |
| Acral | 9 | 6% | 31 | 12% | 32 | 15% | 1,69 | 1,03‐2,75 | 0,037 |
| Membro inferior | 13 | 9% | 27 | 11% | 26 | 12% | 1,23 | 0,73‐2,06 | 0,436 |
| Outro/não classificado | 0 | 0% | 1 | 0% | 1 | 0% | ‐ | ‐ | ‐ |
| Tipo histológico | |||||||||
| Extensivo superficial | 49 | 35% | 103 | 40% | 104 | 47% | 1,49 | 1,07‐2,07 | 0,018 |
| Lentigo | 51 | 36% | 77 | 30% | 46 | 21% | 0,55 | 0,38‐0,79 | <0,001 |
| Lentiginoso acral | 8 | 6% | 27 | 11% | 29 | 13% | 1,73 | 1,04‐2,87 | 0,035 |
| Nodular | 11 | 8% | 26 | 10% | 23 | 11% | 1,19 | 0,71‐2,00 | 0,512 |
| Outro/não classificado | 21 | 15% | 23 | 9% | 17 | 8% | ‐ | ‐ | ‐ |
| Espessura de Breslow | |||||||||
| In situ | 38 | 27% | 107 | 42% | 64 | 29% | 1,00 | ‐ | 0,522 |
| ≤ 1 mm | 44 | 31% | 66 | 26% | 63 | 29% | 0,96 | 0,64‐1,44 | |
| 1‐3 mm | 16 | 11% | 28 | 11% | 37 | 17% | 1,42 | 0,84‐2,41 | |
| 3 mm | 25 | 18% | 38 | 15% | 39 | 18% | 1,06 | 0,66‐1,70 | |
| Não classificado | 17 | 12% | 17 | 7% | 16 | 7% | |||
| Nível de Clark | |||||||||
| I | 38 | 27% | 107 | 42% | 64 | 29% | 1,00 | ‐ | 0,960 |
| II | 24 | 17% | 35 | 14% | 37 | 17% | 1,02 | 0,62‐1,69 | |
| III | 31 | 22% | 48 | 19% | 53 | 24% | 1,11 | 0,71‐1,74 | |
| IV | 29 | 21% | 35 | 14% | 36 | 16% | 0,89 | 0,55‐1,45 | |
| V | 4 | 3% | 9 | 4% | 6 | 3% | 0,97 | 0,38‐2,47 | |
| Não classificado | 14 | 10% | 22 | 9% | 23 | 11% | ‐ | ‐ | ‐ |
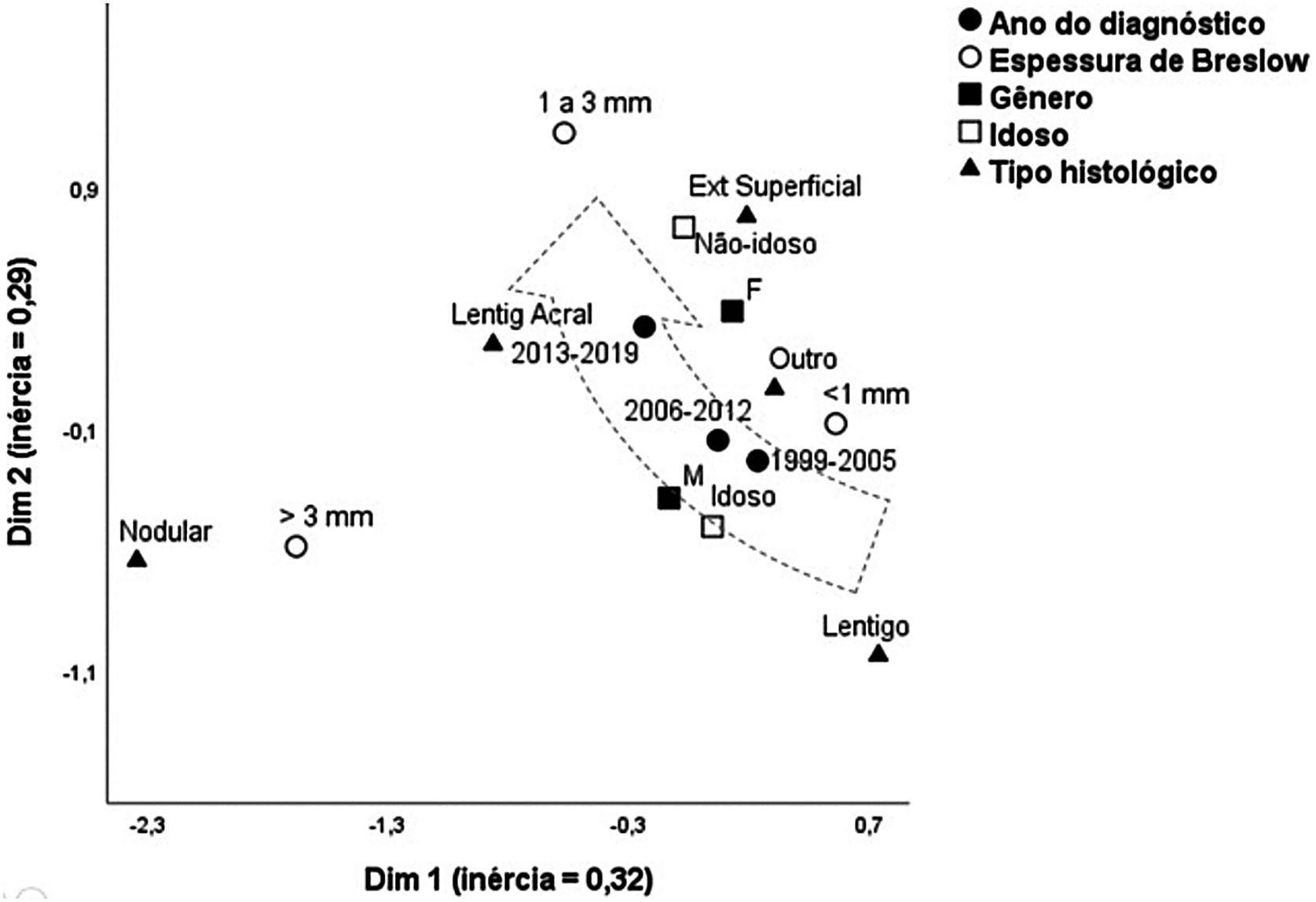
A figura 1 apresenta o mapa perceptual, estimado pela técnica multivariada de análise de correspondência múltipla, que ajusta simultaneamente o sexo, faixa etária, tipo histológico e espessura de Breslow. O modelo multivariado composto com duas dimensões explicou 62% da variação total (inércias 32% e 29%), possibilitando identificar relações de proximidade entre as variáveis e de continuidade entre as categorias. Melanomas de espessura intermediária (1–3mm), formas acrais, extensivas superficiais, e em menores que 60 anos, aproximaram‐se do polo mais recente (2013‐2019) do seguimento, Enquanto o período mais remoto (1999‐2005) aproximou‐se de idosos, lentigos malignos e tumores <1mm. Formas nodulares associaram‐se aos maiores níveis de invasão, sem aproximar‐se do tempo de seguimento, sexo ou faixa etária.
Nessa série, o aumento percentual dos melanomas diagnosticados na instituição foi maior que o crescimento populacional da região, sugerindo aumento de incidência. Entretanto, apesar das campanhas de conscientização, os melanomas invasivos ainda compreendem importante fração dos tumores diagnosticados na instituição, e os resultados não evidenciam reversão desse panorama. De fato, há evidências multifatoriais para a transição na epidemiologia dos melanomas em diferentes séries internacionais, cuja justificativa vai desde o sobrediagnóstico até perfis de fotoexposição, envelhecimento populacional, miscigenação racial e as campanhas de prevenção.3,4
Nessa população, apesar do envelhecimento populacional, a redução da proporção de melanomas em idosos e das formas lentiginosas prevalentes na cabeça/pescoço podem refletir melhor padrão de fotoproteção ocupacional, além do processo de urbanização que o Brasil vem apresentando desde a década de 1970.5 Esse perfil de melanoma é associado ao crescimento lento da fase horizontal, com comportamento menos agressivo.
Em contrapartida, o aumento das formas acrais e de tumores em adultos jovens pode refletir miscigenação da população, já que essas formas são mais comuns em adultos melanodérmicos e orientais. Esse perfil de melanoma tem comportamento mais agressivo, com fase vertical precoce.6
A fração de melanomas nodulares na instituição permaneceu estável durante o período, o que já fora identificado em outros países. Essas formas são precocemente invasivas, contribuem para a maior parte da mortalidade específica e não são sensíveis ao diagnóstico precoce a partir de campanhas que valorizem aspectos pigmentares, de simetria ou alterações em nevos preexistentes.7
Em Goiânia (Brasil), também se identificou aumento na incidência de melanomas entre 1988 e 2000, em ambos os sexos, apesar de maior mortalidade entre homens.8 Isso foi também evidenciado em pesquisa do registro de óbitos no estado de São Paulo (Brasil).9 Da mesma maneira, outro estudo nacional identificou diferenças regionais para as tendências de mortalidade específica do melanoma, sugerindo que fatores étnicos e ambientais – que variam grandemente através do país – interfiram na epidemiologia da doença.10
As campanhas de rastreamento populacional são uma importante ferramenta adotada mundialmente,11 e o Brasil a promove, anualmente, há duas décadas. Estratégias adicionais como conscientização de podólogos e mapeamento corporal, visto que múltiplos nevos aumentam a chance de surgimento de melanomas extensivos superficiais, são também importantes no diagnóstico precoce.
Este estudo apresenta limitações decorrentes da característica retrospectiva, da fidelidade dos registros médicos e da falta de dados longitudinais quanto ao desfecho clínico dos pacientes. Outrossim, o laboratório de patologia da instituição não congregou todos os casos de melanoma da região, não permitindo inferências quanto a sua incidência; apesar disso, o hospital centraliza todos os diagnósticos histopatológicos do sistema público de saúde (SUS), possibilitando uma amostra representativa dessa população regional.
Melanoma cutâneo primário apresentou mudanças no perfil epidemiológico, nos últimos 21 anos, nessa instituição. As campanhas de prevenção devem salientar formas acrais e localizadas no tórax, especialmente em indivíduos com menos de 60 anos de idade, visando o diagnóstico precoce diante das características que estão se tornando mais prevalentes.
Suporte financeiroNenhum.
Contribuição dos autoresCésar Augusto Zago Ferreira: Concepção e planejamento do estudo; obtenção, análise e interpretação de dados; redação do manuscrito; aprovação da versão final submetida.
Lais Soares Ker Marques: Obtenção de dados; aprovação da versão final submetida.
Hélio Amante Miot: Concepção e planejamento do estudo; análise e interpretação dos dados; revisão do manuscrito; aprovação da versão final submetida.
Juliano Vilaverde Schmitt: Concepção e planejamento do estudo; análise e interpretação dos dados; revisão do manuscrito; aprovação da versão final submetida.
Conflito de interessesNenhum.
Como citar este artigo: Ferreira CA, Marques LS, Miot HA, Schmitt JV. Epidemiological transition of primary cutaneous melanoma in a public hospital in Brazil (1999–2019). An Bras Dermatol. 2023;98:89–92.
Trabalho realizado no Departamento de Doenças Infecciosas, Dermatologia, Diagnóstico por Imagem e Radioterapia, Faculdade de Medicina, Universidade Estadual de São Paulo, Botucatu, SP, Brasil.