Os testes de contato são o padrão‐ouro no diagnóstico etiológico da dermatite alérgica de contato (DAC), relacionada à reação de hipersensibilidade tardia tipo 4 (de Gell & Coombs).1
O uso de substâncias que interferem na resposta imunológica dos pacientes, tais como corticosteroides, ciclosporina, metotrexato, azatioprina, micofenolato mofetil e os mais recentes inibidores de citocinas (infliximabe, adalimumabe), poderia ser considerado limitação para a realização dos testes de contato, uma vez que atuam inibindo as respostas celulares. Por outro lado, a utilização dessas medicações tem se tornado cada vez mais comum e, muitas vezes, sua retirada não é possível pela doença de base. Além disso, estudos mostram que muitos pacientes são capazes de desenvolver reações eczematosas mesmo em uso de tais substâncias.2–5
O presente trabalho objetivou investigar casos suspeitos de DAC submetidos a testes de contato em situação considerada não ideal (que estavam em uso de medicamentos imunossupressores e/ou inibidores de citocinas).
Foram analisados retrospectivamente os dados de 16 pacientes testados entre 2009 e 2021 e que estavam em uso de alguma das medicações anteriormente citadas no momento do teste. Utilizaram‐se diferentes séries de alérgenos, cujas indicações basearam‐se na anamnese e quadro clínico.
Os testes foram aplicados na porção superior do dorso e removidos após 48 horas. Os resultados foram obtidos em 48 e 96 horas. As possíveis reações foram: negativo, positivo fraco (1+) – eritema, infiltração ou pápulas; positivo forte (2+) – edema e/ou vesículas; e positivo muito forte (3+) – bolhas ou ulceração.
A média das idades dos pacientes foi de 49 anos, com 12 mulheres e quatro homens. O tempo médio de presença da dermatite foi de 37 meses (3‐180 meses). As medicações utilizadas pelos pacientes no momento dos testes foram: prednisona em nove casos, metotrexato em sete, azatioprina em quatro e infliximabe, ciclosporina, ciclofosfamida, tacrolimo e adalimumabe em um caso cada. Alguns pacientes faziam uso de mais de um fármaco ao mesmo tempo. As doses empregadas variaram de acordo com a indicação e as fases em que as doenças se encontravam. No caso da prednisona, elas variaram entre 5 e 40 mg/dia e o metotrexato, entre 10 e 15 mg/semana. Em relação à ciclofosfamida, a paciente havia sido submetida à pulsoterapia um mês antes do teste com a dose de 1g, e a azatioprina foi utilizada nas doses de 100 e 150 mg/dia.
Os motivos para uso dessas medicações foram eczemas de difícil controle (quatro casos), colagenoses (lúpus sistêmicos e discoide, doença de Behçet e síndrome antisintetase) em oito casos, doença de Crohn, síndrome de Cushing e psoríase em um caso cada.
Entre os pacientes testados, 10 (62,5%) apresentaram pelo menos um teste positivo e 6 (37,5%) tiveram todos os resultados negativos. Um dos casos com teste inicial negativo apresentou positividade em novo teste realizado após a retirada da medicação (metotrexato), resultado que apresentava relevância prévia. No novo teste, houve positividade para parafenilenodiamina (PPDA), cujo contato e DAC ocorreu após aplicação de tatuagem temporária (“de henna”) na adolescência.
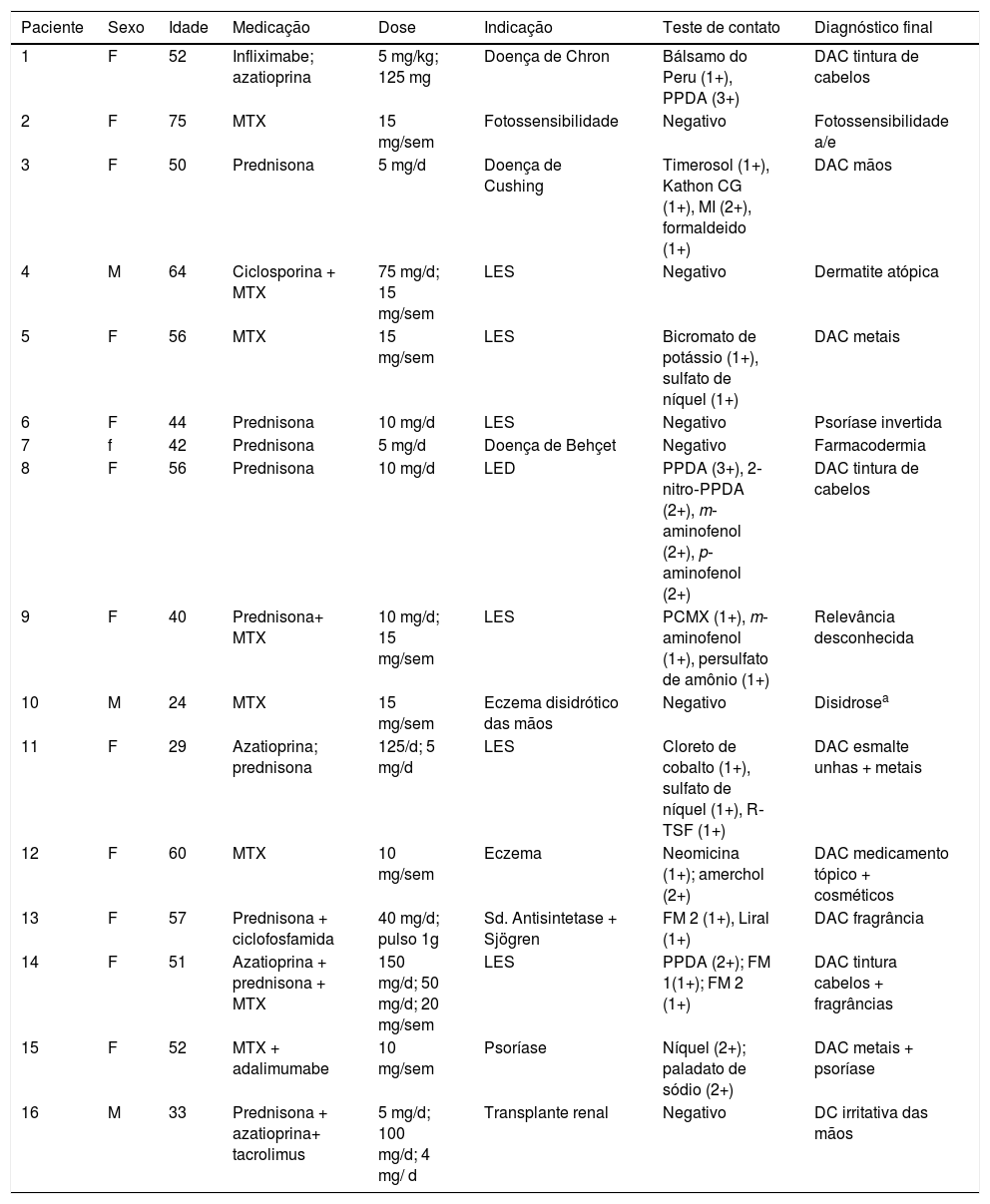
Após finalização dos testes, nove casos (56,3%) foram considerados com diagnóstico final de DAC. Outros diagnósticos foram psoríase, dermatite de contato irritativa, dermatite atópica, farmacodermia e disidrose, com um caso cada. Dois casos permaneceram sem diagnóstico definitivo, em seguimento ambulatorial. A tabela 1 mostra os resultados e as intensidades dos testes de contato e diagnósticos finais nos 16 pacientes em questão.
Distribuição dos resultados dos testes de contato e diagnósticos finais em relação as medicações em uso nos pacientes submetidos aos testes de contato
| Paciente | Sexo | Idade | Medicação | Dose | Indicação | Teste de contato | Diagnóstico final |
|---|---|---|---|---|---|---|---|
| 1 | F | 52 | Infliximabe; azatioprina | 5 mg/kg; 125 mg | Doença de Chron | Bálsamo do Peru (1+), PPDA (3+) | DAC tintura de cabelos |
| 2 | F | 75 | MTX | 15 mg/sem | Fotossensibilidade | Negativo | Fotossensibilidade a/e |
| 3 | F | 50 | Prednisona | 5 mg/d | Doença de Cushing | Timerosol (1+), Kathon CG (1+), MI (2+), formaldeido (1+) | DAC mãos |
| 4 | M | 64 | Ciclosporina + MTX | 75 mg/d; 15 mg/sem | LES | Negativo | Dermatite atópica |
| 5 | F | 56 | MTX | 15 mg/sem | LES | Bicromato de potássio (1+), sulfato de níquel (1+) | DAC metais |
| 6 | F | 44 | Prednisona | 10 mg/d | LES | Negativo | Psoríase invertida |
| 7 | f | 42 | Prednisona | 5 mg/d | Doença de Behçet | Negativo | Farmacodermia |
| 8 | F | 56 | Prednisona | 10 mg/d | LED | PPDA (3+), 2‐nitro‐PPDA (2+), m‐aminofenol (2+), p‐aminofenol (2+) | DAC tintura de cabelos |
| 9 | F | 40 | Prednisona+ MTX | 10 mg/d; 15 mg/sem | LES | PCMX (1+), m‐aminofenol (1+), persulfato de amônio (1+) | Relevância desconhecida |
| 10 | M | 24 | MTX | 15 mg/sem | Eczema disidrótico das mãos | Negativo | Disidrosea |
| 11 | F | 29 | Azatioprina; prednisona | 125/d; 5 mg/d | LES | Cloreto de cobalto (1+), sulfato de níquel (1+), R‐TSF (1+) | DAC esmalte unhas + metais |
| 12 | F | 60 | MTX | 10 mg/sem | Eczema | Neomicina (1+); amerchol (2+) | DAC medicamento tópico + cosméticos |
| 13 | F | 57 | Prednisona + ciclofosfamida | 40 mg/d; pulso 1g | Sd. Antisintetase + Sjögren | FM 2 (1+), Liral (1+) | DAC fragrância |
| 14 | F | 51 | Azatioprina + prednisona + MTX | 150 mg/d; 50 mg/d; 20 mg/sem | LES | PPDA (2+); FM 1(1+); FM 2 (1+) | DAC tintura cabelos + fragrâncias |
| 15 | F | 52 | MTX + adalimumabe | 10 mg/sem | Psoríase | Níquel (2+); paladato de sódio (2+) | DAC metais + psoríase |
| 16 | M | 33 | Prednisona + azatioprina+ tacrolimus | 5 mg/d; 100 mg/d; 4 mg/ d | Transplante renal | Negativo | DC irritativa das mãos |
MTX, metotrexato; LES, lúpus eritematoso sistêmico; LED, lúpus eritematoso discoide; DAC, dermatite alérgica de contato; Kathon CG, metilisotiazolinona + metilclortiazolinona; MI, metilisotiazolinona; PPDA, parafenilenodiamina; PCMX, cloroxilenol; R‐TSF, resina toluenossulfonamida formaldeído; FM 2, fragrância mix 2 (liral, citral, geranial, farnesol, citronelol, hexil aldeído cinamico, coumarin); FM 1, fragrância mix 1 (amilcinamal, cinamal, álcool cinâmico, eugenol, oak moss absolute, geraniol, hidroxicitronelal e isoeugenol).
Alguns estudos mostram que o uso de corticosteroides (principalmente acima de 30 mg/dia) causa supressão parcial a completa de resultados do teste em muitos casos; no entanto, alguns pacientes podem manter reações positivas, como observado em um dos casos, que apresentou testes positivos para fragrância mesmo em uso de prednisona 40 mg/dia.3
Trabalhos publicados na literatura mostram resultados positivos em pacientes testados e que estavam em uso de diferentes imunossupressores ou moduladores com resultados variáveis. Kim et al., em 2014, publicaram uma série de casos evidenciando que os biológicos não interfeririam nos resultados dos testes, embora muitas dessas medicações tenham ação em citocinas comuns à psoríase e à DAC (TNF‐a; IL‐23 e IL‐17). No mesmo ano, Wentworth e colegas publicaram uma pequena série de casos de pacientes recebendo metrotexato e/ou micofenolato mofetil com testes positivos e relevantes.2,3
Os imunossupressores afetam a primeira fase da resposta imune de diferentes formas: bloqueando IL‐1, IL‐2, TNF‐α e fator estimulador de colônias de granulócitos (corticosteroides); reduzindo a quantidade de células de Langerhans e debilitando a atividade das células T (azatioprina); afetando a síntese de DNA, diminuindo a atividade da IL‐1 e liberação de TNF‐α (metotrexato); reduzindo proliferação de células T, bloqueando a função das células dendríticas e limitando o estímulo na liberação de citocinas (micofenolato mofetil).3 Entretanto, estudos sugerem que as concentrações na área de aplicação do teste parecem ser elevadas o suficiente para superar a capacidade de supressão dessas medicações.4,5
As principais limitações do estudo foram o baixo número de pacientes analisados, e o uso substâncias de diferentes classes e em doses variadas. No entanto, a atual pequena série de casos demonstrou que pacientes em uso de imunossupressores obtiveram resultados positivos e relevantes, alertando para a possibilidade de realizá‐los, embora seja necessária uma interpretação cuidadosa dos resultados. Ao realizar o teste nessas condições, deve‐se usar a menor dose possível da medicação e considerar novos testes após a descontinuação da terapia. Estudos com populações maiores de seguimento cuidadoso dos pacientes são necessários para maiores esclarecimentos em relação ao tema.
Suporte financeiroNenhum.
Contribuição dos autoresRosana Lazzarini: Conceito do estudo, análise e interpretação dos dados; participação intelectual na propedêutica e terapêutica dos casos; revisão crítica do conteúdo; aprovação final do manuscrito.
Nathalia T. Kawakami: Coleta dos dados, interpretação e análise dos dados; revisão da literatura; aprovação final do manuscrito.
Nathalie Suzuki: Análise e interpretação dos dados; participação intelectual na propedêutica e terapêutica dos casos; revisão crítica do conteúdo; aprovação final do manuscrito.
Mariana de Figueiredo da Silva Hafner: Análise e interpretação dos dados; participação intelectual na propedêutica e terapêutica dos casos; revisão crítica do conteúdo; aprovação final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Lazzarini R, Kawakami NT, Suzuki N, Hafner MF. Patch tests in patients using immunosuppressants and/or cytokine inhibitors: descriptive analysis of 16 cases. An Bras Dermatol. 2023;98:99–101.
Trabalho realizado na Clínica de Dermatologia, Santa Casa de São Paulo, São Paulo, SP, Brasil.