Acne vulgar (AV) é uma dermatose imunoinflamatória de glândulas sebáceas (GS), epitélio interanexial (EI) e folículos pilosos (FP); nela, há síntese lipídicas e expressão citocínica por interação microrganismos‐células. Na AV, receptores Toll‐like tipo 2 (TLR2) e 4 (TLR4), nucleotide oligomerization domain‐like, tipo 1 (NOD1) e 2 (NOD2) e peroxisome proliferator‐activated receptor gamma (PPARG) regulam a expressão das GS, a diferenciação celular e o metabolismo de macronutrientes.1 Os ácidos graxos (AG) dietéticos parecem influenciar a AV pelo desequilíbrio dos AG ômega‐3 e ‐6.2 Nossa hipótese é de que a suplementação com ácidos gamalinolênico (AGL), linoleico (AL) e oleico (AO), com ou sem limeciclina (LM), interfere na expressão de TLR1, TLR2, NOD1, NOD2 e PPARG na AV.
Conduzimos estudo aberto, prospectivo, randomizado não placebo‐controlado, aprovado pelo Comitê de Ética em Pesquisa da Pontifícia Universidade Católica de Campinas (PUC‐Campinas) (protocolo 387/09) e Faculdade de Medicina da Universidade de São Paulo (FMUSP) (229/10), no Serviço de Dermatologia da PUC‐Campinas; Departamento de Dermatologia da FMUSP; Laboratório de Patologia Experimental da Universidade Federal do Rio Grande do Sul (UFRGS); e Programa de Pós‐graduação em Ciências da Saúde do Instituto de Assistência Médica ao Servidor Público Estadual (IAMSPE) de São Paulo, resultando nos Doutorados do primeiro e último autores. Houve apoio financeiro do Fundo de Apoio da Sociedade Brasileira de Dermatologia (Funaderm) e doação de LM (Tetralysal®, 300 mg) e AGL/AL/OL (Tiliv L, 1.000 mg; 480 mg/dia, 1.200 mg/dia e 510 mg/dia, respectivamente, de AGL/AL/OL) por Galderma Brasil Ltda., São Paulo, SP, Brasil, e Arese Pharma Ltda., Valinhos, SP, Brasil, respectivamente.
Quarenta e cinco pacientes do sexo masculino com acne papulopustulosa ou cística, entre 13 e 38 anos, leram, entenderam, assinaram Termo de Consentimento Livre e Esclarecido e foram randomizados em três grupos (1:1:1) terapêuticos por 90 dias: Grupo 1, LM 300mg/dia; Grupo 2, AGL/AL/OL 1.000mg/dia; ou Grupo 3, Grupo 1+Grupo 2. Pápulas, pústulas e cistos foram contados nas visitas 1, dia 0 (D0); 2, D30; 3, D60; e 4, D90. Fez‐se biópsia de lesão papulopustulosa em D0 e D90 para análise imuno‐histoquímica de TLR1, TLR2, NOD1, NOD2 e PPARG, avaliados por três patologistas pelo seguinte escore de intensidade: inexistente (0), fraco (1), médio (2) e forte (3).
As médias obtidas antes e depois do tratamento foram comparadas entre os grupos e lesões. As variáveis quantitativas foram descritas por média e desvio‐padrão, comparando‐se aquelas com distribuição simétrica por análise de variância (ANOVA), seguido de post‐hoc de Tukey; avaliação intergrupos, com teste de Kruskal‐Wallis para dados não paramétricos; e intragrupos, com Wilcoxon. Usou‐se estatística descritiva, com desvio‐padrão, valores mínimo e máximo e medianas com nível de significância de 5% (p<0,05) e pacote estatístico IBM SPSS versão 20.
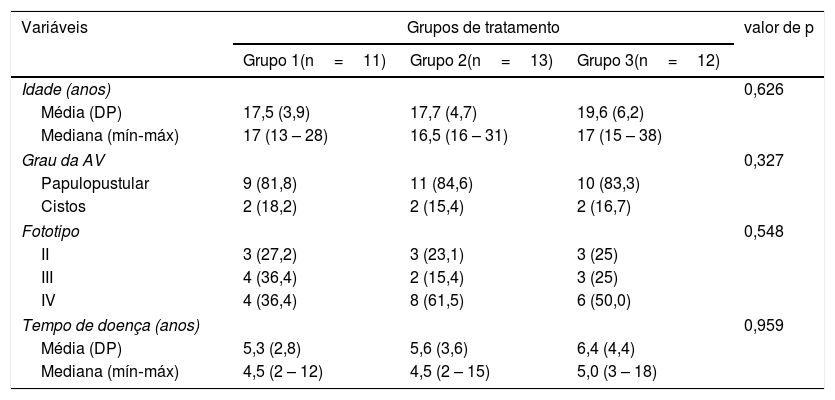
Dos 45 indivíduos, 36 (80%) terminaram o estudo: 11 do grupo 1; 13 do grupo 2; e 12 do grupo 3. Não houve diferença estatística entre os grupos (p=0,626). A relação de sujeitos com acne papulopustular e cística para os grupos 1, 2 e 3 foi similar, e não houve diferenças para fototipos (p=0,548) e tempo de evolução da doença (p=0,959) – tabela 1.
Características dos pacientes com AV incluídos no estudo
| Variáveis | Grupos de tratamento | valor de p | ||
|---|---|---|---|---|
| Grupo 1(n=11) | Grupo 2(n=13) | Grupo 3(n=12) | ||
| Idade (anos) | 0,626 | |||
| Média (DP) | 17,5 (3,9) | 17,7 (4,7) | 19,6 (6,2) | |
| Mediana (mín‐máx) | 17 (13 – 28) | 16,5 (16 – 31) | 17 (15 – 38) | |
| Grau da AV | 0,327 | |||
| Papulopustular | 9 (81,8) | 11 (84,6) | 10 (83,3) | |
| Cistos | 2 (18,2) | 2 (15,4) | 2 (16,7) | |
| Fototipo | 0,548 | |||
| II | 3 (27,2) | 3 (23,1) | 3 (25) | |
| III | 4 (36,4) | 2 (15,4) | 3 (25) | |
| IV | 4 (36,4) | 8 (61,5) | 6 (50,0) | |
| Tempo de doença (anos) | 0,959 | |||
| Média (DP) | 5,3 (2,8) | 5,6 (3,6) | 6,4 (4,4) | |
| Mediana (mín‐máx) | 4,5 (2 – 12) | 4,5 (2 – 15) | 5,0 (3 – 18) | |
DP, desvio‐padrão; Mín, mínimo; Máx, máximo; n, número; p, probabilidade de se observar um resultado tão ou mais extremo que o da amostra, supondo que a hipótese nula seja verdadeira; AV, acne vulgar.
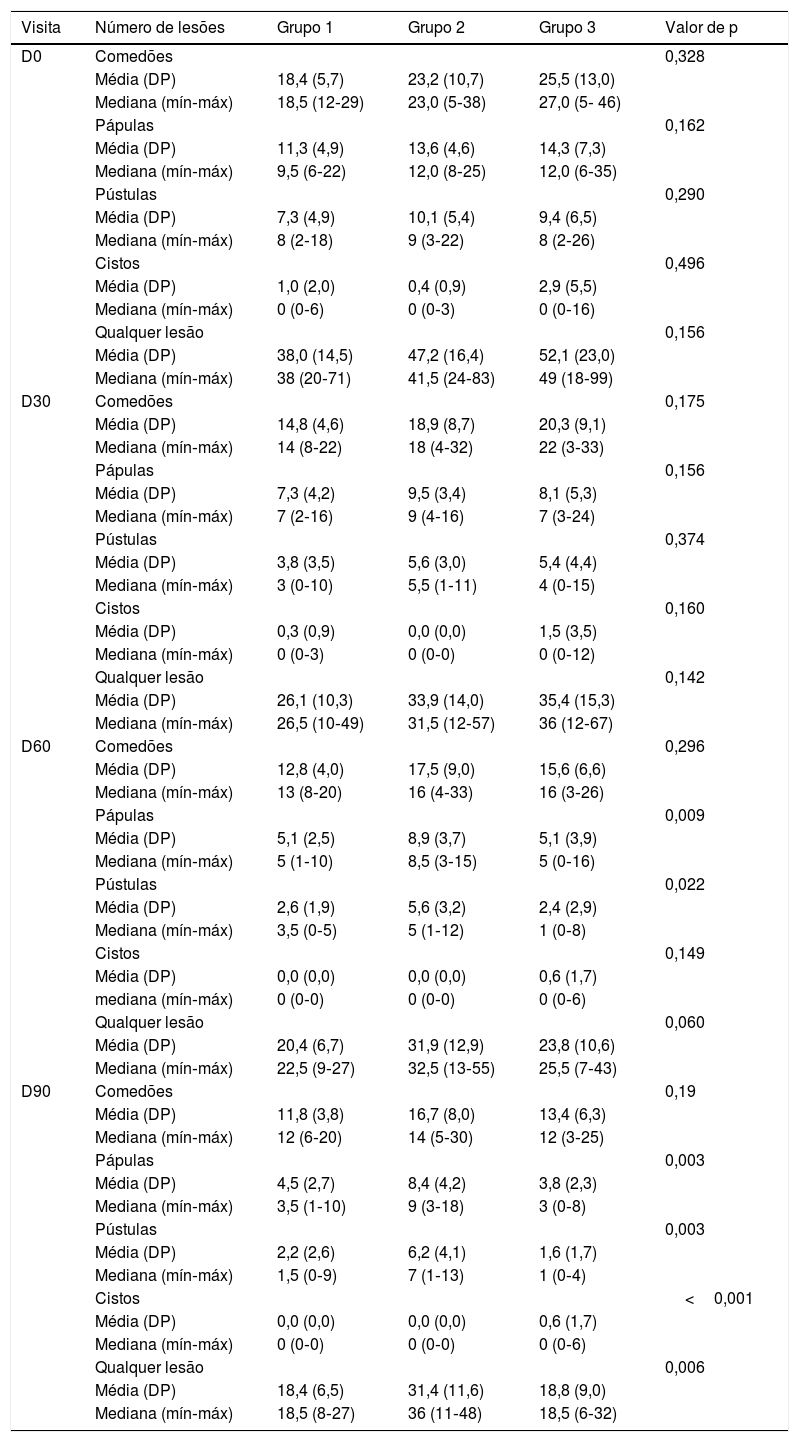
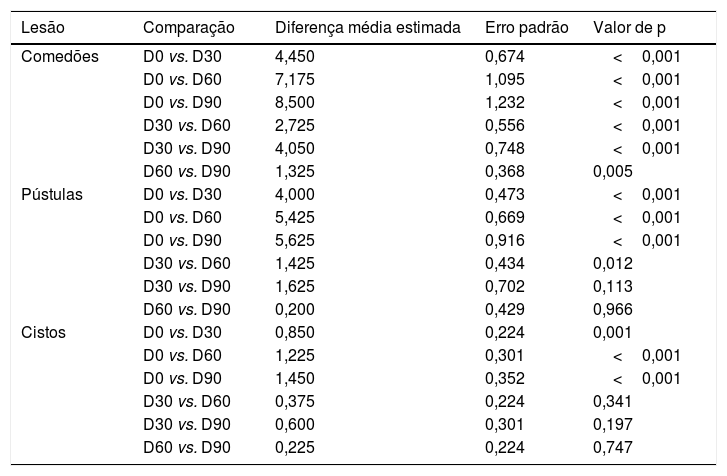
Notou‐se que houve diminuição significativa do número de comedões e cistos ao longo da pesquisa (p<0,001), sem diferença entre os grupos e sem alteração em comedões e cistos. As pústulas diminuíram significativamente (p<0,001), sem interferência do tempo, diferença entre os grupos (p=0,049) (tabela 2). Contudo, pápulas e o total de lesões de AV variaram entre os grupos no estudo (p=0,049 e p=0,011; interação grupo×visita) – tabela 2. Houve diminuição de comedões e pústulas em todos os grupos e visitas em relação à D0, exceto entre as D60 e as D90 (p=0,966). Para cistos, houve diminuição, exceto a partir da D30 (tabela 3).
Estatística descritiva das lesões segundo grupo e tempo de tratamento
| Visita | Número de lesões | Grupo 1 | Grupo 2 | Grupo 3 | Valor de p |
|---|---|---|---|---|---|
| D0 | Comedões | 0,328 | |||
| Média (DP) | 18,4 (5,7) | 23,2 (10,7) | 25,5 (13,0) | ||
| Mediana (mín‐máx) | 18,5 (12‐29) | 23,0 (5‐38) | 27,0 (5‐ 46) | ||
| Pápulas | 0,162 | ||||
| Média (DP) | 11,3 (4,9) | 13,6 (4,6) | 14,3 (7,3) | ||
| Mediana (mín‐máx) | 9,5 (6‐22) | 12,0 (8‐25) | 12,0 (6‐35) | ||
| Pústulas | 0,290 | ||||
| Média (DP) | 7,3 (4,9) | 10,1 (5,4) | 9,4 (6,5) | ||
| Mediana (mín‐máx) | 8 (2‐18) | 9 (3‐22) | 8 (2‐26) | ||
| Cistos | 0,496 | ||||
| Média (DP) | 1,0 (2,0) | 0,4 (0,9) | 2,9 (5,5) | ||
| Mediana (mín‐máx) | 0 (0‐6) | 0 (0‐3) | 0 (0‐16) | ||
| Qualquer lesão | 0,156 | ||||
| Média (DP) | 38,0 (14,5) | 47,2 (16,4) | 52,1 (23,0) | ||
| Mediana (mín‐máx) | 38 (20‐71) | 41,5 (24‐83) | 49 (18‐99) | ||
| D30 | Comedões | 0,175 | |||
| Média (DP) | 14,8 (4,6) | 18,9 (8,7) | 20,3 (9,1) | ||
| Mediana (mín‐máx) | 14 (8‐22) | 18 (4‐32) | 22 (3‐33) | ||
| Pápulas | 0,156 | ||||
| Média (DP) | 7,3 (4,2) | 9,5 (3,4) | 8,1 (5,3) | ||
| Mediana (mín‐máx) | 7 (2‐16) | 9 (4‐16) | 7 (3‐24) | ||
| Pústulas | 0,374 | ||||
| Média (DP) | 3,8 (3,5) | 5,6 (3,0) | 5,4 (4,4) | ||
| Mediana (mín‐máx) | 3 (0‐10) | 5,5 (1‐11) | 4 (0‐15) | ||
| Cistos | 0,160 | ||||
| Média (DP) | 0,3 (0,9) | 0,0 (0,0) | 1,5 (3,5) | ||
| Mediana (mín‐máx) | 0 (0‐3) | 0 (0‐0) | 0 (0‐12) | ||
| Qualquer lesão | 0,142 | ||||
| Média (DP) | 26,1 (10,3) | 33,9 (14,0) | 35,4 (15,3) | ||
| Mediana (mín‐máx) | 26,5 (10‐49) | 31,5 (12‐57) | 36 (12‐67) | ||
| D60 | Comedões | 0,296 | |||
| Média (DP) | 12,8 (4,0) | 17,5 (9,0) | 15,6 (6,6) | ||
| Mediana (mín‐máx) | 13 (8‐20) | 16 (4‐33) | 16 (3‐26) | ||
| Pápulas | 0,009 | ||||
| Média (DP) | 5,1 (2,5) | 8,9 (3,7) | 5,1 (3,9) | ||
| Mediana (mín‐máx) | 5 (1‐10) | 8,5 (3‐15) | 5 (0‐16) | ||
| Pústulas | 0,022 | ||||
| Média (DP) | 2,6 (1,9) | 5,6 (3,2) | 2,4 (2,9) | ||
| Mediana (mín‐máx) | 3,5 (0‐5) | 5 (1‐12) | 1 (0‐8) | ||
| Cistos | 0,149 | ||||
| Média (DP) | 0,0 (0,0) | 0,0 (0,0) | 0,6 (1,7) | ||
| mediana (mín‐máx) | 0 (0‐0) | 0 (0‐0) | 0 (0‐6) | ||
| Qualquer lesão | 0,060 | ||||
| Média (DP) | 20,4 (6,7) | 31,9 (12,9) | 23,8 (10,6) | ||
| Mediana (mín‐máx) | 22,5 (9‐27) | 32,5 (13‐55) | 25,5 (7‐43) | ||
| D90 | Comedões | 0,19 | |||
| Média (DP) | 11,8 (3,8) | 16,7 (8,0) | 13,4 (6,3) | ||
| Mediana (mín‐máx) | 12 (6‐20) | 14 (5‐30) | 12 (3‐25) | ||
| Pápulas | 0,003 | ||||
| Média (DP) | 4,5 (2,7) | 8,4 (4,2) | 3,8 (2,3) | ||
| Mediana (mín‐máx) | 3,5 (1‐10) | 9 (3‐18) | 3 (0‐8) | ||
| Pústulas | 0,003 | ||||
| Média (DP) | 2,2 (2,6) | 6,2 (4,1) | 1,6 (1,7) | ||
| Mediana (mín‐máx) | 1,5 (0‐9) | 7 (1‐13) | 1 (0‐4) | ||
| Cistos | <0,001 | ||||
| Média (DP) | 0,0 (0,0) | 0,0 (0,0) | 0,6 (1,7) | ||
| Mediana (mín‐máx) | 0 (0‐0) | 0 (0‐0) | 0 (0‐6) | ||
| Qualquer lesão | 0,006 | ||||
| Média (DP) | 18,4 (6,5) | 31,4 (11,6) | 18,8 (9,0) | ||
| Mediana (mín‐máx) | 18,5 (8‐27) | 36 (11‐48) | 18,5 (6‐32) |
DP, desvio‐padrão; Mín, mínimo; Máx, máximo; n, número; p, probabilidade de se observar um resultado tão ou mais extremo que o da amostra, supondo que a hipótese nula seja verdadeira.
Comparações múltiplas dos números de lesões nas visitas para os grupos de tratamento
| Lesão | Comparação | Diferença média estimada | Erro padrão | Valor de p |
|---|---|---|---|---|
| Comedões | D0 vs. D30 | 4,450 | 0,674 | <0,001 |
| D0 vs. D60 | 7,175 | 1,095 | <0,001 | |
| D0 vs. D90 | 8,500 | 1,232 | <0,001 | |
| D30 vs. D60 | 2,725 | 0,556 | <0,001 | |
| D30 vs. D90 | 4,050 | 0,748 | <0,001 | |
| D60 vs. D90 | 1,325 | 0,368 | 0,005 | |
| Pústulas | D0 vs. D30 | 4,000 | 0,473 | <0,001 |
| D0 vs. D60 | 5,425 | 0,669 | <0,001 | |
| D0 vs. D90 | 5,625 | 0,916 | <0,001 | |
| D30 vs. D60 | 1,425 | 0,434 | 0,012 | |
| D30 vs. D90 | 1,625 | 0,702 | 0,113 | |
| D60 vs. D90 | 0,200 | 0,429 | 0,966 | |
| Cistos | D0 vs. D30 | 0,850 | 0,224 | 0,001 |
| D0 vs. D60 | 1,225 | 0,301 | <0,001 | |
| D0 vs. D90 | 1,450 | 0,352 | <0,001 | |
| D30 vs. D60 | 0,375 | 0,224 | 0,341 | |
| D30 vs. D90 | 0,600 | 0,301 | 0,197 | |
| D60 vs. D90 | 0,225 | 0,224 | 0,747 |
D30, 30 dias de estudo; D60, 60 dias de estudo; D90, 90 dias de estudo; p, probabilidade de se observar um resultado tão ou mais extremo que o da amostra, supondo que a hipótese nula seja verdadeira.
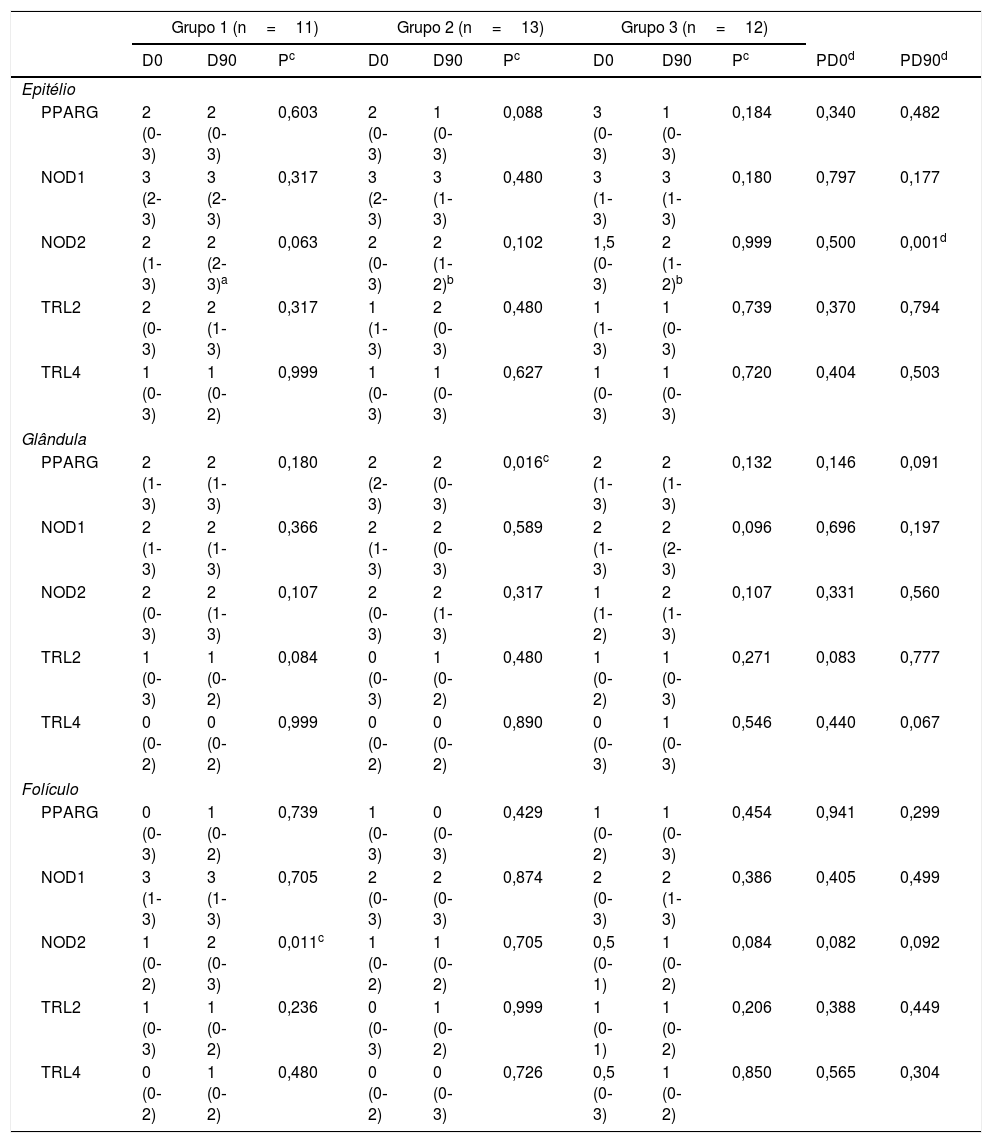
Pela imuno‐histoquímica, em D0 inexistiu diferença entre os grupos e sítios histológicos analisados. No D90, houve diferença NOD2 no IE entre os grupos (grupo 1 com valores maiores que 2 e 3). A mediana de NOD2 no IE foi 2 nos três grupos, com valor máximo no grupo 1 superando os demais, indicando distribuição de valores algo mais alto no grupo 1. Nas comparações intragrupos, houve diminuição do PPARG na GS no grupo 2 (p=0,016) e aumento significativo do NOD2 no FP no 1 (p=0,011) – tabela 4.
Tabela comparativa entre e dentro dos grupos para a avaliação pelo escore
| Grupo 1 (n=11) | Grupo 2 (n=13) | Grupo 3 (n=12) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| D0 | D90 | Pc | D0 | D90 | Pc | D0 | D90 | Pc | PD0d | PD90d | |
| Epitélio | |||||||||||
| PPARG | 2 (0‐3) | 2 (0‐3) | 0,603 | 2 (0‐3) | 1 (0‐3) | 0,088 | 3 (0‐3) | 1 (0‐3) | 0,184 | 0,340 | 0,482 |
| NOD1 | 3 (2‐3) | 3 (2‐3) | 0,317 | 3 (2‐3) | 3 (1‐3) | 0,480 | 3 (1‐3) | 3 (1‐3) | 0,180 | 0,797 | 0,177 |
| NOD2 | 2 (1‐3) | 2 (2‐3)a | 0,063 | 2 (0‐3) | 2 (1‐2)b | 0,102 | 1,5 (0‐3) | 2 (1‐2)b | 0,999 | 0,500 | 0,001d |
| TRL2 | 2 (0‐3) | 2 (1‐3) | 0,317 | 1 (1‐3) | 2 (0‐3) | 0,480 | 1 (1‐3) | 1 (0‐3) | 0,739 | 0,370 | 0,794 |
| TRL4 | 1 (0‐3) | 1 (0‐2) | 0,999 | 1 (0‐3) | 1 (0‐3) | 0,627 | 1 (0‐3) | 1 (0‐3) | 0,720 | 0,404 | 0,503 |
| Glândula | |||||||||||
| PPARG | 2 (1‐3) | 2 (1‐3) | 0,180 | 2 (2‐3) | 2 (0‐3) | 0,016c | 2 (1‐3) | 2 (1‐3) | 0,132 | 0,146 | 0,091 |
| NOD1 | 2 (1‐3) | 2 (1‐3) | 0,366 | 2 (1‐3) | 2 (0‐3) | 0,589 | 2 (1‐3) | 2 (2‐3) | 0,096 | 0,696 | 0,197 |
| NOD2 | 2 (0‐3) | 2 (1‐3) | 0,107 | 2 (0‐3) | 2 (1‐3) | 0,317 | 1 (1‐2) | 2 (1‐3) | 0,107 | 0,331 | 0,560 |
| TRL2 | 1 (0‐3) | 1 (0‐2) | 0,084 | 0 (0‐3) | 1 (0‐2) | 0,480 | 1 (0‐2) | 1 (0‐3) | 0,271 | 0,083 | 0,777 |
| TRL4 | 0 (0‐2) | 0 (0‐2) | 0,999 | 0 (0‐2) | 0 (0‐2) | 0,890 | 0 (0‐3) | 1 (0‐3) | 0,546 | 0,440 | 0,067 |
| Folículo | |||||||||||
| PPARG | 0 (0‐3) | 1 (0‐2) | 0,739 | 1 (0‐3) | 0 (0‐3) | 0,429 | 1 (0‐2) | 1 (0‐3) | 0,454 | 0,941 | 0,299 |
| NOD1 | 3 (1‐3) | 3 (1‐3) | 0,705 | 2 (0‐3) | 2 (0‐3) | 0,874 | 2 (0‐3) | 2 (1‐3) | 0,386 | 0,405 | 0,499 |
| NOD2 | 1 (0‐2) | 2 (0‐3) | 0,011c | 1 (0‐2) | 1 (0‐2) | 0,705 | 0,5 (0‐1) | 1 (0‐2) | 0,084 | 0,082 | 0,092 |
| TRL2 | 1 (0‐3) | 1 (0‐2) | 0,236 | 0 (0‐3) | 1 (0‐2) | 0,999 | 1 (0‐1) | 1 (0‐2) | 0,206 | 0,388 | 0,449 |
| TRL4 | 0 (0‐2) | 1 (0‐2) | 0,480 | 0 (0‐2) | 0 (0‐3) | 0,726 | 0,5 (0‐3) | 1 (0‐2) | 0,850 | 0,565 | 0,304 |
Dados apresentados pela mediana (mínimo‐máximo).
A redução de lesões inflamatórias nos grupos com LM no tratamento (grupos 1 e 3) era prevista, pois é uma das tetraciclinas escolhidas na abordagem da AV inflamatória, com grande penetração cutânea.3,4
Costa et al., em 2007, apontaram uma não resposta clínica no uso da suplementação de AGL/AL/AO, comparada a placebo, na AV, mas possível melhora no tamanho da GS, vista em biópsias pré e pós‐tratamento.5 Nosso estudo, contudo, indicada uma possível utilidade do AGL/AL/AO para comedões e cistos, confirmando as suposições remotas de Rustin.6
Os NODs são ativados por peptideoglicanos muramílicos bacterianos, combinados ou não aos TLR. Assim, o resultado observado em NOD2 pode vir do controle da inflamação microrganismo‐mediada, já que a superexpressão de NOD2 reduz a proliferação clonal.7,8
O PPARG age na modulação sebocítica. Sua redução na GS, induzida por AGL/AL/AO, pode ser a causa do aumento dos ácidos láurico, mirístico e palmítico sob igual terapêutica, sugerindo o mesmo papel sobre os efeitos de redução de NOD2 no EI.9
Nos grupos 2 e 3, usou‐se AGL/AL/AO. Logo, sugerimos que sua administração cause redução de PPARG nos sebócitos no grupo 2 e do NOD2 no EI de ambos os grupos 2 e 3, reforçando a hipótese de suplementação benéfica com AGL/AL/AO para AV comedoniana e cística.5–7 Logo, os AG com grande potencial bactericida poderiam reduzir as concentrações de Cutibacterium acnes e, assim, a expressão dos receptores bactéria‐ativados. Curiosamente, a LM isolada aumentou a marcação de NOD2 nos FP, necessitando de mais estudos elucidativos. Sobre PPARG e NOD2, como estão inversamente relacionados às pápulas no grupo 3, talvez eles possam ser recrutados nas fases iniciais da dermatose.
Podemos então concluir que a administração diária de LM e/ou AGL/AL/AO interfere em marcadores pró‐inflamatórios na AV e a suplementação com AGL/AL/AO poderia ser adjuvante no tratamento da AV.
Suporte financeiroEsta publicação foi possível graças ao Fundo de Apoio da Sociedade Brasileira de Dermatologia (Funaderm), à Galderma Brasil Ltda., São Paulo, SP, Brasil, e Arese Pharma Ltda., Valinhos, SP, Brasil.
Contribuição dos autoresClarissa Prati: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Emily Ferreira Salles Pilar: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Andre Cartel: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados.
João Bayma Galvão Pitoni: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados.
Cidia Vasconcellos: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Adilson da Costa: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Prati C, Pilar EF, Cartel A, Pitoni JB, Vasconcellos C, Costa A. Dietary supplementation with gamma‐linolenic, linoleic and oleic acids decreases PPAR‐gamma expression and helps the tetracycline derivative to reduce NOD2 expression in patients with acne vulgaris. An Bras Dermatol. 2022;97:253–7.
Trabalho realizado no Instituto de Assistência Médica ao Servidor Público Estadual, São Paulo, SP, Brasil; Pontifícia Universidade Católica de Campinas, Capinas, SP, Brasil; e Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.