Dermatite de contato é dermatose comum em Dermatologia. O teste de contato é o padrão ouro para diagnóstico, usando painel de alérgenos e irritantes comuns. No Brasil, uma bateria padronizada de 30 substâncias é usada. Entretanto, dados epidemiológicos abrangentes sobre dermatite de contato são limitados, e nenhum estudo compilou e comparou resultados nacionais.
ObjetivosEste estudo teve como objetivo avaliar a taxa de positividade dos testes de contato usando a Bateria Padrão Brasileira em casos suspeitos de dermatite de contato de 2000 a 2022. Também foram avaliadas associações entre substâncias reativas e variáveis clínicas e demográficas e a variação na frequência de reatividade a substâncias alergênicas ao longo do período do estudo.
MétodosFoi conduzida revisão sistemática da literatura usando PubMed, Scielo e LILACS. Foram avaliados a prevalência de testes positivos para cada substância, associações entre variáveis como sexo, região e idade e variações na positividade do teste de contato ao longo do tempo.
ResultadosInicialmente, 55 artigos foram identificados e dez foram incluídos na revisão. Sulfato de níquel foi o alérgeno mais frequentemente positivo, enquanto triclosan, butilfenol p‐terciário e antraquinona foram os menos prevalentes. A positividade do teste aumentou a cada cinco anos para Kathon CG, neomicina e sulfato de níquel, enquanto diminuiu para Quaternium 15 e Timerosal.
Limitações do estudoOs resultados foram limitados pelo pequeno número de artigos incluídos na revisão.
ConclusõesEste estudo pioneiro no Brasil fornece informações valiosas para profissionais de alergia dermatológica sobre a prevalência de positividade do teste de contato para cada substância na Bateria Padrão Brasileira, auxiliando na tomada de decisão informada e no manejo do paciente.
Dermatite de contato (DC) é condição inflamatória prevalente da pele frequentemente encontrada na prática dermatológica. Sua apresentação clínica é caracterizada por vesículas, pápulas ou placas eritematosas, descamativas e pruriginosas, frequentemente acompanhadas de liquenificação, levando a impacto significante na qualidade de vida dos pacientes.1 A DC compreende proporção significante de dermatoses ocupacionais e carrega implicações socioeconômicas substanciais, particularmente em nações industrializadas.2
A DC pode ser classificada em dois tipos principais: dermatite de contato irritativa (DCI) e dermatite de contato alérgica (DCA). A DCI surge de efeitos tóxicos e pró‐inflamatórios diretos de certas substâncias, enquanto a DCA é reação de hipersensibilidade do tipo retardada mediada por células T hapteno‐específicas.1
Embora o diagnóstico de DC dependa principalmente da avaliação clínica, o teste de contato (TC) serve como ferramenta diagnóstica complementar padrão ouro para confirmar essa condição. O TC visa reproduzir a fase de elicitação da DCA por exposição controlada a agentes suspeitos, confirmando assim o diagnóstico e determinando a etiologia da DCA. A série do TC normalmente consiste em uma bateria padrão de alérgenos e irritantes comuns, incluindo fragrâncias, conservantes, metais, borracha e outros produtos químicos aos quais os pacientes são comumente expostos e podem estar associados à sua apresentação clínica.2,3
No Brasil, o Grupo Brasileiro de Estudos em Dermatite de Contato (GBEDC) desenvolveu uma bateria padronizada em 2000, aprovada pela Sociedade Brasileira de Dermatologia (SBD), compreendendo 30 substâncias. Entretanto, há escassez de dados etiológicos e epidemiológicos brasileiros sobre DCA em diferentes regiões que poderiam fornecer representatividade populacional. Embora diversos estudos tenham sido publicados por importantes centros dermatológicos brasileiros, eles foram conduzidos isoladamente, e nenhuma análise abrangente ou comparação de resultados foi publicada em nível nacional.2,3
É bem estabelecido que o perfil populacional e a exposição a várias substâncias podem influenciar os resultados do TC, que também são conhecidos por evoluírem ao longo do tempo. Portanto, para abordar essas lacunas no conhecimento, foi realizada revisão sistemática com o objetivo de reunir e sintetizar informações sobre os resultados do TC obtidos utilizando a Bateria Padrão Brasileira nos últimos 22 anos.
MétodosDesenho do estudoEste estudo apresenta revisão sistemática (RS) conduzida entre 2000 e 2022, com o objetivo de identificar artigos relevantes publicados em inglês, português ou espanhol. Foi conduzido de acordo com a declaração Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (PRISMA).4
Foi realizada busca abrangente por dois pesquisadores que pesquisaram de maneira independente em bases de dados científicas conhecidas por abrigar estudos brasileiros, a saber: PubMed, LILACS e SciELO. O objetivo principal era reunir um corpo abrangente de literatura para fornecer informações valiosas no campo médico. O plano de estabelecer dados sobre o assunto entre 2000 e 2022 está relacionado à nova pesquisa realizada pelo Estudo de Dermatite de Contato e pela SBD, que começou em 2023. Artigos publicados após 2022 serão comentados e não incluídos na análise.
Extração de dados e avaliação de qualidadeNa etapa inicial, foi conduzida avaliação abrangente por dois pesquisadores para identificar e remover artigos duplicados obtidos no processo de busca. Posteriormente, o exame meticuloso dos títulos e resumos dos registros recuperados foi realizado, resultando na exclusão de estudos que não atendiam aos critérios de elegibilidade predeterminados.
Na etapa subsequente, os textos completos dos estudos restantes foram cuidadosamente avaliados pelos autores, empregando critérios rigorosos de inclusão e exclusão. Essa avaliação crítica possibilitou a identificação de estudos que atendiam aos critérios predefinidos e foram considerados elegíveis para análise posterior.
Critérios de seleção
Para garantir a inclusão de artigos relevantes, os seguintes critérios de seleção foram aplicados:
- •
Artigos originais;
- •
Artigos com textos completos disponíveis;
- •
Estudos que realizaram testes de contato com a Bateria Brasileira Padrão (Grupo Brasileiro de Estudos em Dermatite de Contato – GBEDC);
- •
Estudos com resultados completos de todas as substâncias testadas em TC;
- •
Estudos conduzidos no Brasil;
- •
Estudos que avaliaram a população de pacientes diagnosticados ou suspeitos de DC;
- •
Estudos publicados entre 2000 e 2022.
Critérios de exclusão
Os seguintes critérios foram empregados para excluir artigos da consideração:
- •
Ensaios clínicos em andamento sem resultados e relatos de caso publicados;
- •
Artigos com subpopulações específicas;
- •
Estudos que realizaram testes de contato com baterias diferentes da Bateria Padrão Brasileira (GBEDC);
- •
Estudos não conduzidos no Brasil.
A avaliação da qualidade foi realizada utilizando a ferramenta Joanna Briggs Institute Critical Appraisal Tool.
A lista de verificação para estudos transversais e a lista de verificação para estudos de coorte foram selecionadas e aplicadas, de acordo com o desenho do estudo:5
- •
Lista de verificação para estudos transversais, na qual os estudos foram pontuados em oito itens. Cada item foi avaliado usando as opções: sim, não, pouco claro, não aplicável. Os artigos foram considerados de boa qualidade se receberam resposta “sim” para todos os itens avaliados; de qualidade média se receberam resposta “sim” para cinco ou mais itens; e de baixa qualidade se receberam resposta “sim” para quatro ou menos itens.
- •
A lista de verificação para estudos de coorte, em que os estudos foram pontuados em 11 itens. Cada item foi avaliado usando as opções: sim, não, pouco claro, não aplicável. Os artigos foram considerados de boa qualidade se receberam uma resposta “sim” para todos os itens avaliados; de qualidade média se receberam uma resposta “sim” para seis ou mais itens; e de baixa qualidade se receberam uma resposta “sim” para cinco ou menos itens.
A busca abrangente foi realizada por dois pesquisadores que pesquisaram de maneira independente em bases de dados científicas conhecidas por abrigar estudos brasileiros, a saber, PubMed, LILACS e SciELO. O objetivo principal era reunir um corpo abrangente de literatura para fornecer informações valiosas no campo médico.
A seleção dos termos de busca foi orientada por sua relevância para a condição médica específica sob investigação, abrangendo palavras‐chave gerais e específicas. A busca foi conduzida em 10 de outubro de 2022, e a estratégia de busca utilizada em cada plataforma será detalhada abaixo:
- •
PubMed: (“patch tests”[MeSH Terms] OR (“patch”[All Fields] AND “tests”[All Fields]) OR “patch tests”[All Fields] OR (“patch”[All Fields] AND “test”[All Fields]) OR “patch test”[All Fields]) AND (“Brazil”[MeSH Terms] OR “Brazil”[All Fields] OR “Brazil s”[All Fields] OR “Brazils”[All Fields]);
- •
LiLACS: (“teste de contato” or “patch test”) (Brasil or Brazil);
- •
SciELO: (patch test) OR (teste de contato) AND (Brazil).
Para aumentar a abrangência da estratégia de busca e produzir um conjunto de dados robusto para análise, as listas de referência dos estudos incluídos foram revisadas para identificar estudos adicionais que podem ter sido perdidos no processo de busca inicial. Essa abordagem abrangente garantiu a inclusão de estudos relevantes no contexto brasileiro.
VariáveisO estudo examinou as seguintes variáveis:
- •
Reatividade das 30 substâncias que compõem a Bateria Padrão Brasileira;
- •
Gênero (sexo);
- •
Idade;
- •
Região geográfica do Brasil.
Para determinar a prevalência de testes positivos de substâncias, foi utilizada média ponderada de metanálise resumida, considerando o tamanho da amostra de cada estudo como fator de ponderação.
Para os testes de associação, oito regressões lineares compostas e simples de metanálise foram testadas para selecionar o melhor modelo. A medida de desfecho usada foi a porcentagem de TC positivos, com combinações da porcentagem de participantes do sexo feminino do estudo, região do estudo categorizada (com a região Sudeste como referência e a região Sul como comparação), média de idade dos participantes do estudo (com e sem uma constante). Para avaliar as mudanças nas taxas de positividade do TC ao longo do tempo, o valor médio de cada substância dentro de cada intervalo de tempo e seus coeficientes correspondentes foram calculados usando regressão linear simples, considerando o tempo uma variável contínua.
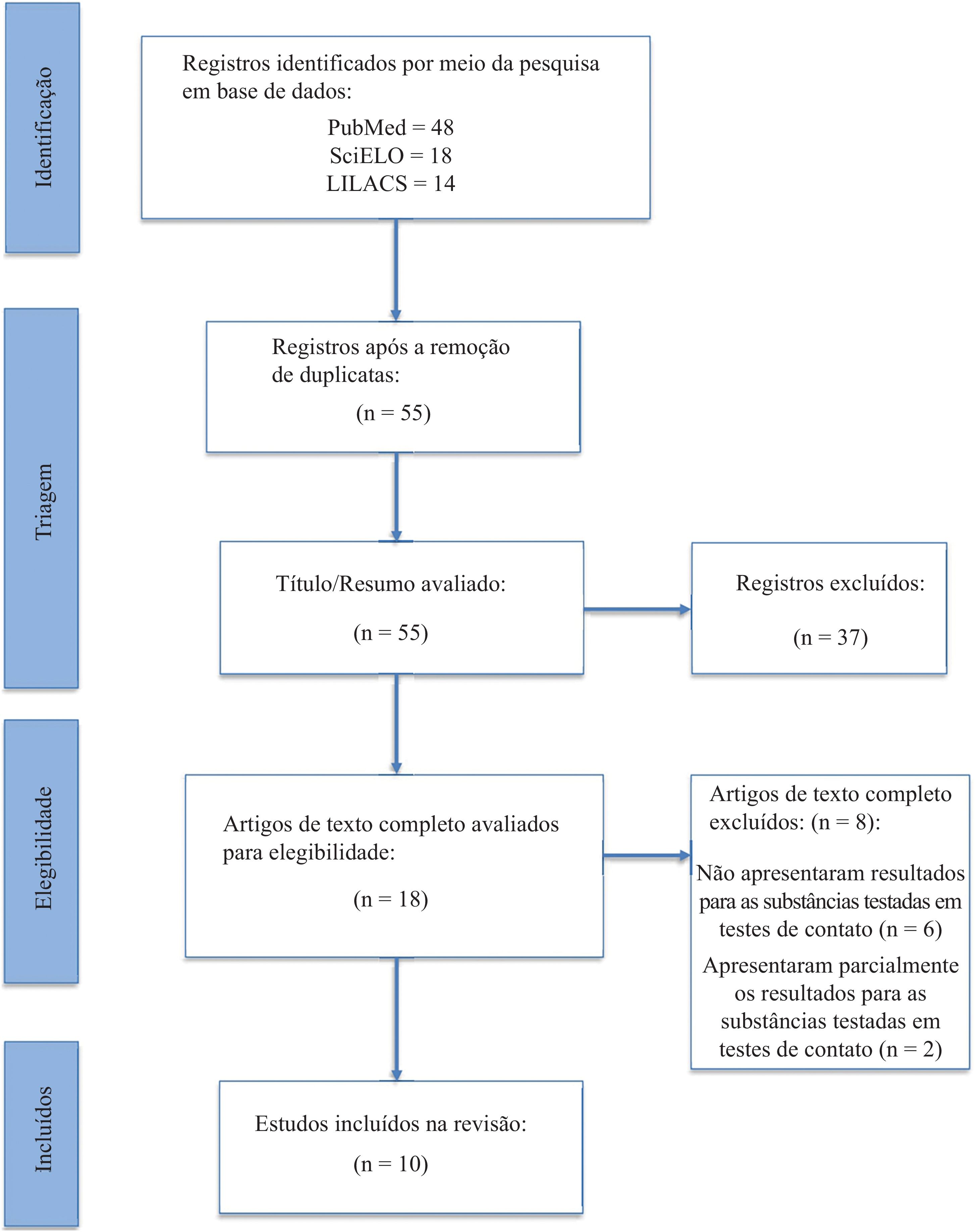
ResultadosPor meio da busca inicial, foram identificados 81 artigos considerados potencialmente relevantes. Após a remoção de duplicatas, 55 artigos permaneceram para avaliação. Posteriormente, 37 artigos foram excluídos com base na triagem por título e resumo. Os textos completos dos 18 artigos restantes foram cuidadosamente avaliados para elegibilidade. Por fim, dez estudos atenderam aos critérios de inclusão predefinidos e foram incluídos nesta revisão sistemática, como ilustrado na figura 1. A tabela 1 fornece um resumo dos estudos selecionados e suas respectivas características.
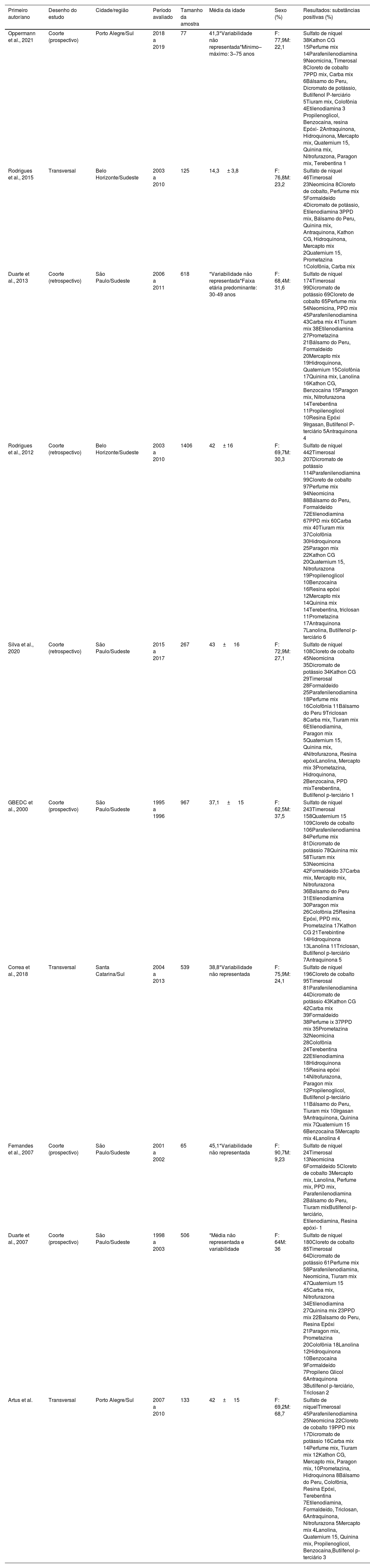
Resumo dos estudos selecionados e suas respectivas características
| Primeiro autor/ano | Desenho do estudo | Cidade/região | Período avaliado | Tamanho da amostra | Média da idade | Sexo (%) | Resultados: substâncias positivas (%) |
|---|---|---|---|---|---|---|---|
| Oppermann et al., 2021 | Coorte (prospectivo) | Porto Alegre/Sul | 2018 a 2019 | 77 | 41,3*Variabilidade não representada*Mínimo–máximo: 3–75 anos | F: 77,9M: 22,1 | Sulfato de níquel 38Kathon CG 15Perfume mix 14Parafenilenodiamina 9Neomicina, Timerosal 8Cloreto de cobalto 7PPD mix, Carba mix 6Bálsamo do Peru, Dicromato de potássio, Butilfenol P‐terciário 5Tiuram mix, Colofônia 4Etilenodiamina 3 Propilenoglicol, Benzocaína, resina Epóxi‐ 2Antraquinona, Hidroquinona, Mercapto mix, Quaternium 15, Quinina mix, Nitrofurazona, Paragon mix, Terebentina 1 |
| Rodrigues et al., 2015 | Transversal | Belo Horizonte/Sudeste | 2003 a 2010 | 125 | 14,3 ± 3,8 | F: 76,8M: 23,2 | Sulfato de níquel 46Timerosal 23Neomicina 8Cloreto de cobalto, Perfume mix 5Formaldeído 4Dicromato de potássio, Etilenodiamina 3PPD mix, Bálsamo do Peru, Quinina mix, Antraquinona, Kathon CG, Hidroquinona, Mercapto mix 2Quaternium 15, Prometazina 1Colofônia, Carba mix |
| Duarte et al., 2013 | Coorte (retrospectivo) | São Paulo/Sudeste | 2006 a 2011 | 618 | *Variabilidade não representada*Faixa etária predominante: 30‐49 anos | F: 68,4M: 31,6 | Sulfato de níquel 174Timerosal 99Dicromato de potássio 69Cloreto de cobalto 65Perfume mix 54Neomicina, PPD mix 45Parafenilenodiamina 43Carba mix 41Tiuram mix 38Etilenodiamina 27Prometazina 21Bálsamo do Peru, Formaldeído 20Mercapto mix 19Hidroquinona, Quaternium 15Colofônia 17Quinina mix, Lanolina 16Kathon CG, Benzocaína 15Paragon mix, Nitrofurazona 14Terebentina 11Propilenoglicol 10Resina Epóxi 9Irgasan, Butilfenol P‐terciário 5Antraquinona 4 |
| Rodrigues et al., 2012 | Coorte (retrospectivo) | Belo Horizonte/Sudeste | 2003 a 2010 | 1406 | 42 ± 16 | F: 69,7M: 30,3 | Sulfato de níquel 442Timerosal 207Dicromato de potássio 114Parafenilenodiamina 99Cloreto de cobalto 97Perfume mix 94Neomicina 88Bálsamo do Peru, Formaldeído 72Etilenodiamina 67PPD mix 60Carba mix 40Tiuram mix 37Colofônia 30Hidroquinona 25Paragon mix 22Kathon CG 20Quaternium 15, Nitrofurazona 19Propilenoglicol 10Benzocaína 16Resina epóxi 12Mercapto mix 14Quinina mix 14Terebentina, triclosan 11Prometazina 17Antraquinona 7Lanolina, Butilfenol p‐terciário 6 |
| Silva et al., 2020 | Coorte (retrospectivo) | São Paulo/Sudeste | 2015 a 2017 | 267 | 43 ± 16 | F: 72,9M: 27,1 | Sulfato de níquel 108Cloreto de cobalto 45Neomicina 35Dicromato de potássio 34Kathon CG 29Timerosal 28Formaldeído 25Parafenilenodiamina 18Perfume mix 16Colofônia 11Bálsamo do Peru 9Triclosan 8Carba mix, Tiuram mix 6Etilenodiamina, Paragon mix 5Quaternium 15, Quinina mix, 4Nitrofurazona, Resina epóxiLanolina, Mercapto mix 3Prometazina, Hidroquinona, 2Benzocaína, PPD mixTerebentina, Butilfenol p‐terciário 1 |
| GBEDC et al., 2000 | Coorte (prospectivo) | São Paulo/Sudeste | 1995 a 1996 | 967 | 37,1 ± 15 | F: 62,5M: 37,5 | Sulfato de níquel 243Timerosal 158Quaternium 15 109Cloreto de cobalto 106Parafenilenodiamina 84Perfume mix 81Dicromato de potássio 78Quinina mix 58Tiuram mix 53Neomicina 42Formaldeído 37Carba mix, Mercapto mix, Nitrofurazona 36Balsamo do Peru 31Etilenodiamina 30Paragon mix 26Colofônia 25Resina Epóxi, PPD mix, Prometazina 17Kathon CG 21Terebintine 14Hidroquinona 13Lanolina 11Triclosan, Butilfenol p‐terciário 7Antraquinona 5 |
| Correa et al., 2018 | Transversal | Santa Catarina/Sul | 2004 a 2013 | 539 | 38,8*Variabilidade não representada | F: 75,9M: 24,1 | Sulfato de níquel 196Cloreto de cobalto 95Timerosal 81Parafenilenodiamina 44Dicromato de potássio 43Kathon CG 42Carba mix 39Formaldeído 38Perfume ix 37PPD mix 35Prometazina 32Neomicina 28Colofônia 24Terebentina 22Etilenodiamina 18Hidroquinona 15Resina epóxi 14Nitrofurazona, Paragon mix 12Propilenoglicol, Butilfenol p‐terciário 11Bálsamo do Peru, Tiuram mix 10Irgasan 9Antraquinona, Quinina mix 7Quaternium 15 6Benzocaína 5Mercapto mix 4Lanolina 4 |
| Fernandes et al., 2007 | Coorte (prospectivo) | São Paulo/Sudeste | 2001 a 2002 | 65 | 45,1*Variabilidade não representada | F: 90,7M: 9,23 | Sulfato de níquel 24Timerosal 13Neomicina 6Formaldeído 5Cloreto de cobalto 3Mercapto mix, Lanolina, Perfume mix, PPD mix, Parafenilenodiamina 2Bálsamo do Peru, Tiuram mixButilfenol p‐terciário, Etilenodiamina, Resina epóxi‐ 1 |
| Duarte et al., 2007 | Coorte (prospectivo) | São Paulo/Sudeste | 1998 a 2003 | 506 | *Média não representada e variabilidade | F: 64M: 36 | Sulfato de níquel 180Cloreto de cobalto 85Timerosal 64Dicromato de potássio 61Perfume mix 58Parafenilenodiamina, Neomicina, Tiuram mix 47Quaternium 15 45Carba mix, Nitrofurazona 34Etilenodiamina 27Quinina mix 23PPD mix 22Balsamo do Peru, Resina Epóxi 21Paragon mix, Prometazina 20Colofônia 18Lanolina 12Hidroquinona 10Benzocaína 9Formaldeído 7Propileno Glicol 6Antraquinona 3Butilfenol p‐terciário, Triclosan 2 |
| Artus et al. | Transversal | Porto Alegre/Sul | 2007 a 2010 | 133 | 42 ± 15 | F: 69,2M: 68,7 | Sulfato de níquelTimerosal 45Parafenilenodiamina 25Neomicina 22Cloreto de cobalto 19PPD mix 17Dicromato de potássio 16Carba mix 14Perfume mix, Tiuram mix 12Kathon CG, Mercapto mix, Paragon mix, 10Prometazina, Hidroquinona 8Bálsamo do Peru, Colofônia, Resina Epóxi, Terebentina 7Etilenodiamina, Formaldeído, Triclosan, 6Antraquinona, Nitrofurazona 5Mercapto mix 4Lanolina, Quaternium 15, Quinina mix, Propilenoglicol, Benzocaína,Butilfenol p‐terciário 3 |
Considerando os critérios da ferramenta usada para avaliação de qualidade, a Joanna Briggs Institute Critical Appraisal Tool, foram encontrados sete artigos de qualidade média,2,3,6–8,11,13 três considerados de boa qualidade,9,10,12 e nenhum dos dez artigos pré‐selecionados com base nos critérios de inclusão e exclusão foi considerado de baixa qualidade, sem indicação de exclusão da revisão sistemática.
O número total de pacientes submetidos ao TC, considerando todos os estudos selecionados, foi de 4.703. Em todos os dez estudos, os testes foram realizados em pacientes com suspeita de DC. Os estudos foram conduzidos em quatro estados diferentes do Brasil, mas apenas em duas regiões, no Sul e Sudeste. Na região Sul, houve um estudo no estado de Santa Catarina e dois no estado do Rio Grande do Sul.2,6,7 Na região Sudeste, houve cinco estudos no estado de São Paulo 8–12 e dois no estado de Minas Gerais.3,13 Em relação ao sexo, a maioria da população incluída nos estudos era do sexo feminino em todos os dez estudos, como mostrado em detalhes na tabela 1.
Quanto aos locais de dermatite, o segmento cefálico (face, cabeça e pescoço) foi o mais acometido em todos os estudos, exceto no de Rodrigues et al.,13 no qual foi classificado como o segundo local mais comum depois das mãos. No estudo de Fernandes et al.,9 os locais mais comuns foram pálpebras (12,30%) e face (9,2%); em Silva et al.,12 o segmento cefálico incluindo cabeça, face e pescoço foi responsável por 44,79% dos casos; em Duarte et al.,11 o segmento cefálico foi responsável por 45,3% dos casos; em Rodrigues et al.,3 a face foi afetada em 24,8% dos casos; em Artus et al.,6 a cabeça e o pescoço foram afetados em 48,9% dos casos; e em Duarte et al.,8 o segmento cefálico (cabeça e pescoço) foi o mais frequentemente afetado (81 casos, 29%). No estudo de Rodrigues et al.,13 as mãos foram o local mais afetado (44,7%), e os estudos de Opperman et al.,7 GBEDC,10 e Correa et al.2 não forneceram essa informação.
TécnicaTodos os estudos utilizaram a Bateria Padrão Brasileira, composta por 30 substâncias recomendadas pelo GBEDC, originalmente produzida pelo FDA‐Allergenic/Immunothec (RJ, Brasil).
Todos os estudos seguiram os critérios do International Contact Dermatitis Research Group (ICDRG) para técnicas de aplicação e interpretação. As leituras foram realizadas em 48 e 96 horas, de acordo com os critérios estabelecidos. Testes positivos em 96 horas relacionados ao histórico atual e passado de DC foram considerados relevantes.10
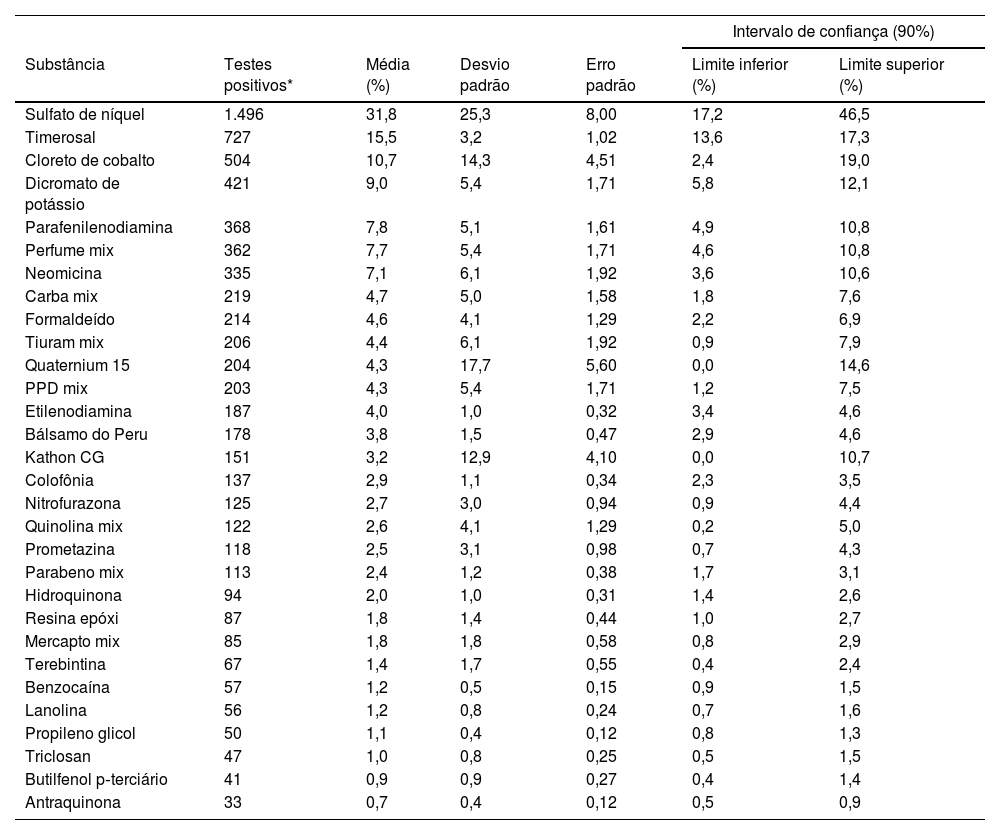
Frequência dos alérgenos mais comunsEntre adultos com suspeita de DCA, o alérgeno mais frequentemente positivo em TC foi o sulfato de níquel, com prevalência média de 31,8%, como mostrado na tabela 2. Individualmente, também foi o teste com maior positividade nos dez estudos que examinaram essa população, com porcentagens variando de 28,1%11 a 56,2%12 dos pacientes testados em cada estudo.
Prevalência de reações positivas em testes de contato no Brasil, por substância, entre 2000 e 2022 (n=4.703)
| Intervalo de confiança (90%) | ||||||
|---|---|---|---|---|---|---|
| Substância | Testes positivos* | Média (%) | Desvio padrão | Erro padrão | Limite inferior (%) | Limite superior (%) |
| Sulfato de níquel | 1.496 | 31,8 | 25,3 | 8,00 | 17,2 | 46,5 |
| Timerosal | 727 | 15,5 | 3,2 | 1,02 | 13,6 | 17,3 |
| Cloreto de cobalto | 504 | 10,7 | 14,3 | 4,51 | 2,4 | 19,0 |
| Dicromato de potássio | 421 | 9,0 | 5,4 | 1,71 | 5,8 | 12,1 |
| Parafenilenodiamina | 368 | 7,8 | 5,1 | 1,61 | 4,9 | 10,8 |
| Perfume mix | 362 | 7,7 | 5,4 | 1,71 | 4,6 | 10,8 |
| Neomicina | 335 | 7,1 | 6,1 | 1,92 | 3,6 | 10,6 |
| Carba mix | 219 | 4,7 | 5,0 | 1,58 | 1,8 | 7,6 |
| Formaldeído | 214 | 4,6 | 4,1 | 1,29 | 2,2 | 6,9 |
| Tiuram mix | 206 | 4,4 | 6,1 | 1,92 | 0,9 | 7,9 |
| Quaternium 15 | 204 | 4,3 | 17,7 | 5,60 | 0,0 | 14,6 |
| PPD mix | 203 | 4,3 | 5,4 | 1,71 | 1,2 | 7,5 |
| Etilenodiamina | 187 | 4,0 | 1,0 | 0,32 | 3,4 | 4,6 |
| Bálsamo do Peru | 178 | 3,8 | 1,5 | 0,47 | 2,9 | 4,6 |
| Kathon CG | 151 | 3,2 | 12,9 | 4,10 | 0,0 | 10,7 |
| Colofônia | 137 | 2,9 | 1,1 | 0,34 | 2,3 | 3,5 |
| Nitrofurazona | 125 | 2,7 | 3,0 | 0,94 | 0,9 | 4,4 |
| Quinolina mix | 122 | 2,6 | 4,1 | 1,29 | 0,2 | 5,0 |
| Prometazina | 118 | 2,5 | 3,1 | 0,98 | 0,7 | 4,3 |
| Parabeno mix | 113 | 2,4 | 1,2 | 0,38 | 1,7 | 3,1 |
| Hidroquinona | 94 | 2,0 | 1,0 | 0,31 | 1,4 | 2,6 |
| Resina epóxi | 87 | 1,8 | 1,4 | 0,44 | 1,0 | 2,7 |
| Mercapto mix | 85 | 1,8 | 1,8 | 0,58 | 0,8 | 2,9 |
| Terebintina | 67 | 1,4 | 1,7 | 0,55 | 0,4 | 2,4 |
| Benzocaína | 57 | 1,2 | 0,5 | 0,15 | 0,9 | 1,5 |
| Lanolina | 56 | 1,2 | 0,8 | 0,24 | 0,7 | 1,6 |
| Propileno glicol | 50 | 1,1 | 0,4 | 0,12 | 0,8 | 1,3 |
| Triclosan | 47 | 1,0 | 0,8 | 0,25 | 0,5 | 1,5 |
| Butilfenol p‐terciário | 41 | 0,9 | 0,9 | 0,27 | 0,4 | 1,4 |
| Antraquinona | 33 | 0,7 | 0,4 | 0,12 | 0,5 | 0,9 |
O segundo alérgeno mais frequentemente positivo foi o Timerosal e o cloreto de cobalto, com prevalência média de 15,5% e 10,7%, respectivamente. Ambas as substâncias estavam entre os cinco alérgenos mais frequentemente positivos em todos os artigos.
Considerando a série de metais, além da alta prevalência de sulfato de níquel e cloreto de cobalto, o dicromato de potássio apresentou prevalência média de 9%.
Dentre as sete substâncias mais frequentes nos estudos incluídos, também deve‐se citar o mix de fragrâncias (7,7%), a parafenilenodiamina (7,8%) e a neomicina (7,1%). A neomicina apresentou a maior prevalência entre os artigos incluídos quando comparada às substâncias presentes em medicamentos tópicos da série. Prometazina foi o segundo ingrediente ativo mais positivo, mas mostrou variação significante entre os estudos, com prevalência variando de 0,8%3 a 5,9%,2 resultando em prevalência média menor de testes positivos por substância do que a neomicina, em 2,5%. Nitrofurazona e quinolina também tiveram baixas porcentagens médias de prevalência nos testes dos estudos incluídos (2,7% e 2,6%, respectivamente).
As três substâncias menos prevalentes em todos os estudos foram triclosan (1%), butilfenol p‐terciário (0,9%) e antraquinona (0,7%).
Em relação à análise por faixa etária, os alérgenos mais comuns em crianças e adolescentes, de 1 a 19 anos, considerando um único estudo com n=1.253, foram sulfato de níquel (36,8%), Timerosal (18,4%), neomicina (6,4%), cloreto de cobalto e mix de fragrâncias (4,0% cada), formaldeído (3,2%), dicromato de potássio e etilenodiamina (2,4% cada). As crianças apresentaram reações positivas apenas para o mix de níquel e o mix de fragrâncias.3
A revisão sistemática também incluiu um artigo apresentando resultados na subpopulação idosa (> 65 anos):8 Os principais sensibilizadores nessa faixa etária foram Timerosal (11%), neomicina (10,5%), sulfato de níquel (10%), mix de fragrâncias (10%), nitrofurazona (7%), dicromato de potássio (6%) e parafenilenodiamina (5,5%).
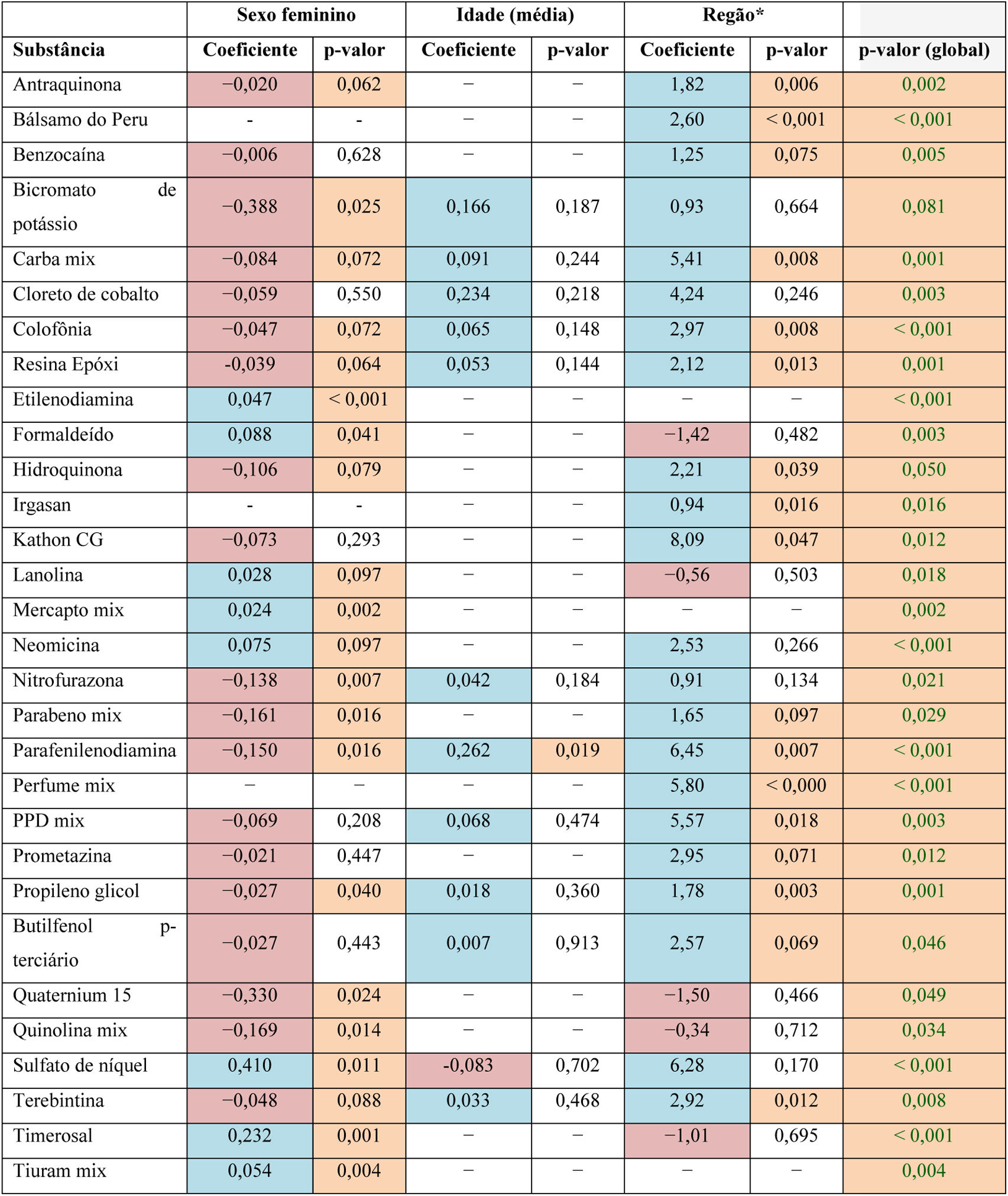
Associações entre variáveisEm relação às associações testadas entre a porcentagem de testes positivos e as variáveis sexo, idade e região no Brasil, os resultados estão descritos na tabela 3. Valores com p <0,1 foram considerados estatisticamente significantes.
Associações identificadas com sexo, idade e região no período de 2000 a 2023
a Região Sudeste considerada como referência.
Azul: Conforme a proporção da variável aumenta, a proporção de testes positivos diminui. Rosa: Conforme a proporção da variável aumenta, a proporção de testes positivos aumenta. Amarelo: Associações estatisticamente significantes.
Maior proporção de mulheres na amostra foi associada a menor proporção de testes positivos para as seguintes substâncias: antraquinona, dicromato de potássio, carbamix, colofônia, resina epóxi, hidroquinona, nitrofurazona, parabeno mix, parafenilenodiamina, propilenoglicol, Quaternium 15, quinolina mix e terebintina (p <0,1).
Para as substâncias etilenodiamina, formaldeído, lanolina, Mercapto mix, neomicina, sulfato de níquel, Timerosal e Tiuram mix, maior proporção de mulheres na amostra foi associada a maior proporção de testes positivos (p <0,1).
IdadeMaior média de idade no estudo foi associada a menor proporção de testes positivos para as substâncias dicromato de potássio, carbamix, cloreto de cobalto, colofônia, nitrofurazona, parafenilenodiamina, PPD mix, propilenoglicol, butilfenol p‐terciário e terebintina (p <0,1).
Por outro lado, apenas para sulfato de níquel, maior média de idade no estudo foi associada a maior proporção de testes positivos (p <0,1).
Regiões brasileiras dos estudos: As substâncias formaldeído, lanolina, quatérnio 15, quinolina mix e Timerosal apareceram em menor proporção de testes positivos na região Sul, mas sem associação direta estatisticamente significante (p> 0,1).
Em contrapartida, as substâncias antraquinona, bálsamo do Peru, benzocaína, carbamix, colofônia, resina epóxi, hidroquinona, triclosan, Kathon CG, parabeno mix, perfume mix, parafenilenodiamina, PPD mix, propilenoglicol, Prometazina, Quaternium 15, quinolina mix, p‐butilfenol terciário e terebintina apresentaram maior proporção de testes positivos nos estudos realizados na região Sudeste (p <0,1). A mesma sugestão é feita para dicromato de potássio, cloreto de cobalto, neomicina, nitrofurazona, sulfato de níquel, embora não tenha sido observada significância estatística (p> 0,1).
Nenhuma tendência ou associação foi observada para as substâncias restantes.
Variação na positividade do teste ao longo do tempoO estudo observou tendência crescente na positividade do teste a cada cinco anos para várias substâncias, incluindo Kathon CG; neomicina e sulfato de níquel também exibiram positividade crescente do teste (p <0,1). Além disso, antraquinona, benzocaína, dicromato de potássio, bálsamo do Peru, cloreto de cobalto, colofônia, formaldeído, triclosan, butilfenol p‐terciário, PPD mix, parafenilenodiamina, perfume mix, propilenoglicol e terebintina (p> 0,1).
Por outro lado, houve tendência decrescente de positividade do teste, a cada cinco anos, para Quaternium 15 e Timerosal (p <0,1), resina epóxi, etilenodiamina, hidroquinona, lanolina, Mercapto mix, nitrofurazona, parabeno mix, Prometazina, Tiuram mix e quinolina mix (p> 0,1). Os resultados são descritos na tabela 4.
Variação da positividade dos resultados dos testes de contato ao longo do tempo, utilizando a Bateria Padrão Brasileira, entre 2000 e 2022 (n=4.703)
| Substância | −| 1999a | 2000 – 2005 | 2005 – 2010 | 2011 |− | ß (pp)b |
|---|---|---|---|---|---|
| Antraquinona | 0,5 | 0,3 | 1,4 | 0,6 | 0,07 |
| Benzocaína | 0,5 | 0,9 | 1,3 | 1,7 | 0,28 |
| Dicromato de potássio | 8,1 | 6,0 | 8,0 | 9,6 | 0,73 |
| Bálsamo do Peru | 3,2 | 2,8 | 3,4 | 4,9 | 0,54 |
| Carba mix | 3,7 | 3,4 | 5,4 | 5,0 | 0,42 |
| Cloreto de cobalto | 11,0 | 8,6 | 10,4 | 13,0 | 0,91 |
| Colofônia | 2,6 | 1,8 | 3,1 | 4,7 | 0,71 |
| Resina Epóxi | 1,8 | 2,8 | 2,0 | 2,0 | −0,07 |
| Etilenodiamina | 3,1 | 3,4 | 3,9 | 2,9 | −0,11 |
| Formaldeído | 3,8 | 4,5 | 4,6 | 4,7 | 0,14 |
| Hidroquinona | 1,3 | 1,0 | 2,9 | 1,0 | −0,04 |
| Triclosan | 0,7 | 0,1 | 1,6 | 1,5 | 0,31 |
| Kathon CG | 2,2 | 0,0 | 3,7 | 15,2 | 4,02 |
| Lanolina | 1,1 | 2,7 | 1,2 | 0,6 | −0,39 |
| Mercapto mix | 3,7 | 1,5 | 1,8 | 1,2 | −0,41 |
| Neomicina | 4,3 | 9,3 | 8,2 | 11,7 | 1,41 |
| Nitrofurazona | 3,7 | 3,4 | 1,9 | 1,4 | −0,61 |
| Butilfenol p‐terciário | 0,7 | 1,0 | 1,1 | 3,4 | 0,74 |
| PPD mix | 1,8 | 3,7 | 6,2 | 4,3 | 0,44 |
| Parabeno mix | 2,7 | 2,0 | 2,6 | 1,6 | −0,21 |
| Parafenilenodiamina | 8,7 | 6,2 | 7,7 | 9,2 | 0,51 |
| Perfume mix | 8,4 | 7,3 | 6,4 | 12,1 | 1,22 |
| Prometazina | 1,8 | 2,0 | 3,5 | 0,4 | −0,43 |
| Propileno Glicol | 0,8 | 0,6 | 1,3 | 1,3 | 0,17 |
| Quaternium 15 | 11,3 | 4,4 | 1,6 | 1,4 | −1,85 |
| Quinolina mix | 6,0 | 2,3 | 1,6 | 1,4 | −0,78 |
| Sulfato de Níquel | 25,1 | 36,2 | 33,3 | 44,9 | 4,06 |
| Terebintina | 1,4 | 0,0 | 2,4 | 0,8 | 0,03 |
| Timerosal | 16,3 | 18,4 | 16,6 | 10,4 | −1,98 |
| Tiuram mix | 5,5 | 5,4 | 3,6 | 3,7 | −0,49 |
O objetivo principal deste estudo foi compilar e comparar os resultados de TC conduzidos na população brasileira, com foco específico em pacientes com suspeita de DC, de 2000 a 2022.
Consistente com a literatura global, o níquel foi identificado como o principal agente sensibilizador em todos os estudos. As taxas de positividade encontradas na população brasileira neste estudo (31,8%) foram maiores em comparação a relatos mais recentes na população europeia, em que a sensibilização ao níquel foi encontrada em aproximadamente 13% a 17% dos adultos, cerca de 10% dos adolescentes e 7% a 9% das crianças.14
Os metais apareceram como sensibilizadores significantes na maioria dos estudos e estão entre os principais alérgenos causadores de DC. Além do níquel, o cobalto e o cromo foram sensibilizadores notáveis, provavelmente pela alta prevalência de produtos contendo metais aos quais a população brasileira é exposta, como joias, piercings, produtos de limpeza, óculos, relógios, botões em roupas e itens folheados a ouro, juntamente com a presença de metais em dermatoses ocupacionais.15
De acordo com Spiewak et al.,14 os sensibilizadores mais comuns na população europeia, além do sulfato de níquel, são o Timerosal e as fragrâncias. Da mesma maneira, nessa revisão sistemática, o Timerosal foi classificado entre os dez sensibilizadores mais frequentes em todos os artigos. Ressalta‐se sua presença em medicamentos, conservantes de vacinas, soluções para lentes de contato e tintas para tatuagem, o que pode contribuir para a alta prevalência de sensibilização a essa substância.2
Em relação às substâncias com menor prevalência de reações positivas em TC, este estudo identificou triclosan, p‐terc‐butilfenol e antraquinona, com percentuais médios de prevalência de até 1%. Considerando a frequência muito baixa de testes positivos para essas substâncias, pode‐se questionar sua real importância na etiologia da DAC na população brasileira nas últimas duas décadas e a necessidade de incluí‐las no painel padrão de TC brasileiro.
Esses resultados estão alinhados com dados publicados relatando sensibilização de contato pouco frequente ao triclosan. O Swiss Contact Dermatitis Research Group relatou prevalência de sensibilização ao triclosan de 0,8% em um grande estudo envolvendo 2.295 pacientes.16 Schena et al.17 confirmaram baixa incidência de sensibilização ao triclosan, principalmente associada ao uso de desodorantes contendo essa substância em seu estudo.
Em virtude dos riscos potenciais relatados que variam de alergias a disrupção endócrina, o triclosan foi banido pelo FDA em setembro de 2016 em sabonetes (líquidos, em gel, espuma, em barra), enquanto a União Europeia proibiu seu uso em todos os produtos biocidas para higiene humana a partir de janeiro de 2017, o que pode explicar a redução de testes positivos para triclosan.18
Um estudo de Fransway et al.19 do North American Contact Dermatitis Group em 2013 também relatou diminuição na prevalência de reações positivas ao p‐terc‐butilfenol, substância comumente usada em adesivos, incluindo a produção de calçados, entre outras substâncias, quando comparado às taxas observadas nos dez anos anteriores.
Em relação às antraquinonas, elas têm aplicações industriais na produção de peróxido de hidrogênio, tintas e medicamentos como laxantes e catárticos. Também estão presentes em plantas como Senna, Cascara sagrada, Ruibarbo e Aloe.20,21 A antraquinona não está incluída nos painéis de TC padrão americanos e europeus, com dados publicados limitados sobre sua prevalência de reações positivas em testes de contato.
Foi encontrada tendência a maior proporção de testes positivos em mulheres para várias substâncias, possivelmente relacionada à maior frequência de exposição que ocorre neste grupo. Entre elas estão a etilenodiamina, usada principalmente em medicamentos tópicos, como antifúngicos, antibacterianos e corticosteroides; formaldeído, utilizado na formulação de cosméticos, produtos de higiene pessoal e esmaltes; lanolina, emoliente cutâneo usado na indústria de cosméticos; Mercapto mix, empregada na indústria da borracha e encontrada em luvas, preservativos, brinquedos, sapatos, entre outros itens; Timerosal, utilizado como conservante em vacinas; Tiuram mix, usada na indústria da borracha para fungicidas e pesticidas, bem como repelentes; neomicina, medicamento antibacteriano de venda livre no Brasil; e sulfato de níquel, encontrado em joias, brincos, relógios, pulseiras, botões de jeans, agulhas, zíperes, moedas, chaves, fivelas, armações de óculos, aparelhos ortodônticos e ortopédicos, alimentos, entre outros.
Além disso, foi encontrada tendência maior de proporções de testes positivos para várias substâncias na região Sudeste em comparação à região Sul (antraquinona, bálsamo do Peru, benzocaína, carbamix, colofônia, resina epóxi, hidroquinona, triclosan, Kathon CG, parabeno mix, perfume mix, parafenilenodiamina, PPD mix, propilenoglicol, prometazina, Quaternium 15, quinolina mix, butilfenol p‐terciário e terebintina). Esse achado pode ser justificado pelo maior número de estudos conduzidos na região Sudeste (sete de dez estudos) incluídos na análise.
Além disso, a maior média de idade na população estudada, abrangendo crianças, adultos e idosos, foi associada a menor proporção de testes positivos para substâncias como dicromato de potássio, carbamix, cloreto de cobalto, colofônia, nitrofurazona, parafenilenodiamina, PPD mix, propilenoglicol, butilfenol p‐terciário e terebintina. A possível explicação está na associação dessas substâncias com atividades ocupacionais, como construção civil e indústrias como borracha, couro e metais, que tendem a ser menos comuns em faixas etárias mais avançadas.
O artigo de Duarte et al.11 avaliou a variação nas taxas de positividade para substâncias incluídas no painel de TC brasileiro padrão recomendado pelo GBEDC entre 2006 e 2011. Três substâncias apresentaram diminuição estatisticamente significante nas taxas de sensibilização ao longo dos anos estudados: lanolina (p=0,01), neomicina (p=0,01) e antraquinona (p=0,04). A presente revisão sistemática, com força mais robusta, também encontrou porcentagem decrescente, a cada cinco anos em média, para lanolina; entretanto, observou‐se porcentagem crescente para neomicina e antraquinona. Historicamente, a exposição a certos alérgenos mostra variação de acordo com áreas geográficas, como a neomicina, que continua sendo mais comum na América do Norte do que na Europa.22 A prevalência geral de sensibilização à neomicina diminuiu em vários países nos últimos anos, possivelmente por sua disponibilidade restrita em alguns locais.23 No Brasil, a neomicina ainda está presente em medicamentos tópicos de venda livre com alto consumo pela população brasileira, o que pode explicar o aumento percentual observado no presente estudo.
Os achados desta revisão sobre a frequência de alérgenos comuns na população pediátrica e adolescente são consistentes com a literatura global.10 Entretanto, o presente estudo foi limitado pelo pequeno número de artigos incluindo essa faixa etária. O sulfato de níquel foi o alérgeno mais frequentemente positivo em TC conduzidos na população pediátrica no Brasil, o que está alinhado com uma revisão sistemática anterior.24 Na mesma revisão, a lanolina foi considerada uma das dez substâncias mais frequentemente positivas, diferente dos resultados do presente estudo, no qual não foi observada nenhuma reação positiva a esse alérgeno na população pediátrica e adolescente.
Apesar da metodologia rigorosa empregada nesta revisão sistemática, várias limitações devem ser reconhecidas. Uma limitação significante é o pequeno número de estudos incluídos na análise. Oito artigos tiveram que ser excluídos após a elegibilidade inicial, de acordo com os critérios de exclusão descritos na metodologia: seis por não apresentarem resultados de TC25–30 e dois por apresentarem resultados de TC parcialmente.31,32 O número limitado de artigos elegíveis restringe a generalização dos achados. Essa escassez de estudos provavelmente reflete o estágio inicial da pesquisa neste domínio no Brasil, apontando para oportunidades de investigação e expansão adicionais.
Na revisão mais recente da literatura relevante, foi encontrado apenas um artigo após 2022 que seria possível integrar a esta revisão sistemática, que foi realizada retrospectivamente para investigar DC nas mãos. Esse estudo encontrou, em um total de 173 pacientes, 61,8% de dermatite irritativa e apenas 23,1% de dermatite alérgica e 5,2% de dermatite atópica. Os alérgenos mais frequentes foram Kathon CG (42%), sulfato de níquel (33%) e Tiuram mix 18%.33 O perfil é compatível com os dados observados na série histórica de 2000 a 2022 atual nesta revisão sistemática.
Outra limitação crítica diz respeito à qualidade geral dos estudos incluídos. Embora a maioria dos artigos selecionados fosse de qualidade metodológica média, o que pode aumentar o risco de viés, é digno de nota que estudos de alta qualidade também foram incluídos, e nenhum estudo de baixa qualidade foi admitido na revisão.
ConclusãoOs alérgenos mais frequentemente identificados em TC nesta RS foram sulfato de níquel, Timerosal e cobalto. Triclosan, P‐butilfenol terciário e antraquinona foram as três substâncias menos prevalentes. Foi demonstrada tendência de aumento da positividade do teste a cada cinco anos, em média, para Kathon CG, neomicina e sulfato de níquel.
Esta revisão sistemática oferece informações valiosas, apesar de algumas limitações. Embora o número de estudos incluídos seja pequeno, isso destaca o potencial para exploração adicional nesta área de pesquisa. A compilação desses dados permitirá que os profissionais de saúde que trabalham com alergias dermatológicas obtenham compreensão mais concreta da prevalência de reações positivas em TC para cada substância presente na bateria padrão brasileira. Esses achados, além de sua relevância clínica, podem servir como base para recomendar séries úteis e apropriadas de TC, permitindo a avaliação mais abrangente e precisa de pacientes com suspeita de DAC no Brasil no futuro.
Suporte financeiroNenhum.
Contribuição dos autoresAna Laura Andrade Bueno: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Nathalia Hoffmann Guarda Aguzzoli: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Renan Rangel Bonamigo: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Bueno AL, Aguzzoli NHG, Bonamigo RR. Prevalence of reactive allergens in contact patch testing studies using the Brazilian standard battery: a systematic review. An Bras Dermatol. 2025;100:501126.
Trabalho realizado na Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, RS, Brasil.