A alopecia areata (AA) é uma forma autoimune adquirida de queda de cabelos não cicatricial. A adiponectina e seu polimorfismo genético foram relacionados a muitas doenças autoimunes.
ObjetivoAvaliar o nível sérico de adiponectina e o polimorfismo de nucleotídio único (SNP) rs2241766 do gene da adiponectina (ADIPOQ) em pacientes com AA e correlacionar os resultados com a gravidade da doença nesses pacientes.
MétodosEste estudo incluiu 75 pacientes com AA e 75 indivíduos saudáveis pareados por idade e sexo (controles). Foi realizada avaliação do escore Severity of Alopecia Tool (SALT) para determinar a gravidade da AA. Os níveis séricos de adiponectina foram avaliados por ELISA e SNP do gene ADIPOQ (rs2241766) por PCR.
ResultadosOs níveis séricos de adiponectina resultaram significantemente menor nos pacientes com AA do que nos controles (p=0,001). O genótipo TG do gene ADIPOQ (rs2241766) e o alelo G predominaram nos pacientes com AA, aumentando seu risco em cinco e quatro vezes (OR=5,17, p=0,001; OR=3,82, p=0,001), respectivamente. Os níveis séricos de adiponectina correlaconaram‐se negativamente com o escore SALT (r=−0,435, p=0,001) e associado à alopecia total (p=0,016). O genótipo TG do gene ADIPOQ (rs2241766) foi significantemente associado aos menores níveis séricos de adiponectina e maior escore SALT (p=0,001).
Limitações do estudoO pequeno tamanho da amostra.
ConclusõesO polimorfismo (rs2241766) do gene ADIPOQ (genótipo TG e alelo G) pode modular o risco de AA e contribuir para o desenvolvimento de AA em populações egípcias. A diminuição dos níveis circulantes de adiponectina pode ter papel dinâmico na etiopatogenia da AA. A concentração sérica de adiponectina pode ser considerada marcador de gravidade da queda de cabelos na AA.
A alopecia areata (AA) representa um tipo de queda de cabelo, em que o sistema imunológico ataca erroneamente os folículos pilosos.1 A prevalência estimada de AA é de aproximadamente 1 em 1.000 pessoas, com risco ao longo da vida de cerca de 2%.2 Tanto adultos quanto crianças são afetados pela AA, com taxa semelhante em mulheres e homens.3
A etiologia exata da AA é indefinida. AA é considerada doença autoimune – o sistema imunológico em sua totalidade é influenciado por muitos fatores genéticos e múltiplos fatores ambientais.4 A AA está associada a risco aumentado de comorbidades metabólicas, sugerindo que as adipocinas podem desempenhar papel na patogênese da AA.5
O tecido adiposo não é um tecido inerte e produz adipocinas ativamente. Essas adipocinas, além da regulação do gasto energético e da sensibilidade à insulina, desempenham papel importante como reguladores de muitos processos fisiológicos e patológicos, incluindo inflamação e imunidade.6
A adiponectina é uma adipocina circulante que aumenta a sensibilidade à insulina.7 É uma proteína com 224 aminoácidos. A estrutura da adiponectina é composta por trímeros de cadeia única; um domínio N‐terminal variável, um domínio globular C‐terminal e um domínio de colágeno. Esse trímero é envolvido por uma estrutura em forma de sino.8
A adiponectina exerce muitas ações pleiotrópicas; promove a sensibilidade à insulina, promove a apoptose em células carcinogênicas e tem efeitos antioxidantes e anti‐inflamatórios.9
Foi encontrado nível diminuído de adiponectina no sangue na psoríase,10,11 acne vulgar12–14 e dermatite atópica.15 No entanto, apenas dois estudos recentes investigaram o nível sérico de adiponectina em pacientes com AA. Além disso, os dois estudos apresentaram resultados controversos.16,17
O ADIPOQ está localizado no braço longo do cromossomo 3, locus 3q27.18 Esse gene tem 17kb de comprimento e consiste em três éxons e dois íntrons.19 Os SNPs do ADIPOQ estão associados ao risco aumentado de muitas doenças, incluindo aterosclerose,20 artrite reumatoide (AR),21 acne vulgar19 e dermatite atópica,22 mas não foram avaliados em AA até o momento.
O objetivo deste estudo foi elucidar o possível papel da adiponectina na AA por meio da avaliação do polimorfismo do gene ADIPOQ (rs2241766) em relação a seu nível sérico em amostra de pacientes egípcios portadores de AA, bem como correlacionar os resultados avaliados com aspectos clínicos da AA, incluindo o local, curso e gravidade da doença nesses pacientes.
MétodosO atual estudo caso‐controle foi conduzido em um número total de 150 indivíduos. Foram incluídos 75 pacientes com AA (36 homens e 39 mulheres) e 75 voluntários aparentemente saudáveis pareados por idade e sexo (43 homens e 32 mulheres) como grupo de controle. Eles foram avaliados no Ambulatório de Dermatologia do Menoufia University Hospital durante o período de março de 2022 a fevereiro de 2023. A parte laboratorial do estudo foi realizada no Departamento de Bioquímica Médica e Biologia Molecular da Faculdade de Medicina, Menoufia University.
Design administrativo e ético- •
O consentimento por escrito foi obtido de todos os participantes após serem informados sobre o objetivo e o processo do estudo, bem como os objetivos aplicáveis.
- •
O estudo foi aprovado pelo Comitê de Ética local em pesquisa envolvendo seres humanos da Faculdade de Medicina de Menoufia. O número de aprovação ética é 3/2022 DERMA 19.
- •
Os procedimentos do estudo foram isentos de quaisquer efeitos nocivos para os participantes, bem como o serviço prestado.
- •
O investigador principal manteve os dados individuais como informações privadas de maneira segura. Não houve nenhuma taxa extra a ser paga pelos participantes, e o investigador cobriu todos os custos nesse sentido.
Os critérios de inclusão foram: pacientes com grau variável de gravidade de AA, de ambos os sexos e com idade igual ou superior a 18 anos.
Qualquer indivíduo que apresentasse uma ou mais das seguintes características foi excluído do estudo: a) pacientes com histórico de uso de qualquer tratamento que pudesse impactar o estado metabólico nos três meses anteriores ao exame (p. ex., terapia hormonal e tratamento sistêmico, como terapia oral com prednisolona); b) pacientes com outras doenças autoimunes (p. ex., tireoidite de Hashimoto e vitiligo); e c) mulheres grávidas e lactantes.
MétodosCada um dos casos selecionados foi submetido a anamnese e exame geral completo. O índice de massa corporal (IMC) foi calculado [IMC=peso (kg)/altura (m)2].23
O diagnóstico de AA foi feito clinicamente por dois dermatologistas especializados. A distribuição das lesões de AA foi avaliada quanto a sua localização (couro cabeludo, barba, sobrancelha e/ou qualquer área pilosa do corpo). As variantes clínicas de AA (irregular, total, universal, ofiásica, ofiásica inversa) foram registradas. A avaliação clínica da gravidade e extensão da doença foi feita com base no escore SALT,24 no qual o couro cabeludo é dividido em quatro regiões: direita (18%), esquerda (18%), posterior (24%) e superior (40%). Para cada região, foi estimada a porcentagem da área de cabelos afetada e depois transformada em uma nota de S0 a S5. O escore SALT foi calculado multiplicando‐se a porcentagem da perda de cabelo em cada um dos quatro quadrantes do couro cabeludo pela área da superfície do quadrante. Então, os quatro valores foram somados para obter‐se o escore total. O escore SALT variou de 0% a 100%.
Após jejum de 12 horas, foram coletados 6mL de sangue venoso de cada participante, sob completa assepsia. Cada amostra foi dividida em duas partes: uma parte (3mL) para extração de DNA, que foi mantida em tubo de EDTA, e a outra parte (3mL) colocada em um tubo simples, deixada coagular por 30 minutos em temperatura ambiente, depois submetida a centrifugação por 10 minutos a 4.000rpm; o soro obtido foi armazenado a −80°C. até o momento da análise da glicemia de jejum (GJ), perfil lipídico e adiponectina sérica.
A glicemia foi determinada por teste colorimétrico enzimático. A glicose é oxidada pela glicose oxidase em ácido glucurônico e peróxido de hidrogênio. Em seguida, o peróxido de hidrogênio formado é detectado por um aceptor de oxigênio cromogênico, fenol aminofenazona na presença de peroxidase, produzindo quinonimina, que é um composto colorido cuja intensidade da cor é diretamente proporcional à quantidade de glicose na amostra. A absorbância da amostra e do teste padrão foi medida por espectrofotometria e a concentração de glicose na amostra foi determinada.25
A estimativa quantitativa de colesterol total (CT), lipoproteína de alta densidade (HDL) e triglicerídeos (TG) foi feita utilizando método enzimático colorimétrico, utilizando kits colorimétricos enzimáticos padrão (kit de diagnóstico Spinreact, Espanha) e a lipoproteína de baixa densidade foi medida pela equação modificada de Friedewald et al.26
A detecção do nível sérico de adiponectina foi feita por ensaio imunoenzimático (ELISA). O kit (fabricado na China, Sun Red Company) usa um teste Sandwich ELISA com duplo anticorpo.
A avaliação das variantes genéticas do gene ADIPOQ (rs2241766) foi realizada por PCR em tempo real. A extração de DNA do sangue total foi realizada com o kit Quick‐genomic DNATM MiniPrep, Zymo Research. A genotipagem do gene ADIPOQ (rs2241766) foi completada por ensaio de discriminação alélica utilizando sondas TaqMan (Applied Biosystems, EUA). Uma mistura geral de 25μL foi utilizada aplicando 5μL de amostra de DNA a uma mistura de 12,5μL de master mix de genotipagem, 1,25μL de ensaio SNP e 6,25μL de água livre de nuclease. As sondas TaqMan foram marcadas com corantes fluorescentes VIC e FAM. A sequência da sonda para ADIPOQ (rs2241766) foi TTCTACTGCTATTAGCTCTGCCCGG [T/G] CATGACCAGGAAACCACGACTCAAG; a ciclagem foi realizada com: 95°C inicialmente por 10 minutos como etapa de desnaturação primária seguida por 45 ciclos de 15 segundos a 95°C e 60 segundos a 60°C (ciclagem), e uma etapa de extensão final por 60 segundos a 60°C. O sistema de detecção de sequência implementa a fluorescência emitida durante a leitura da placa e os valores de fluorescência (Rn) foram plotados dependendo dos sinais de cada poço. Cada poço da placa de reação de 96 poços é um ponto individual no gráfico. A detecção de fluorescência e a análise de dados foram realizadas pelo instrumento 7500 Real‐Time PCR (Applied Biosystems) versão 2.0.1.
Análise estatísticaOs dados foram coletados, tabulados e analisados estatisticamente usando um computador pessoal com o software SPSS, versão 22 (SPSS, Inc, Chicago, Illinois, EUA). Foram aplicadas as seguintes estatísticas: a) estatística descritiva: na qual os dados quantitativos foram apresentados na forma de média, desvio padrão (DP), variação e os dados qualitativos foram apresentados na forma de números e porcentagens; b) estatística analítica: utilizada para descobrir a possível associação entre os fatores estudados e a doença alvo. Os testes de significância utilizados incluíram: teste Qui‐quadrado (χ2),27 teste t de Student (t),28 teste de Mann‐Whitney (U),29 teste de Kruskal‐Wallis30; o valor de p foi considerado significante se ≤ 0,05.
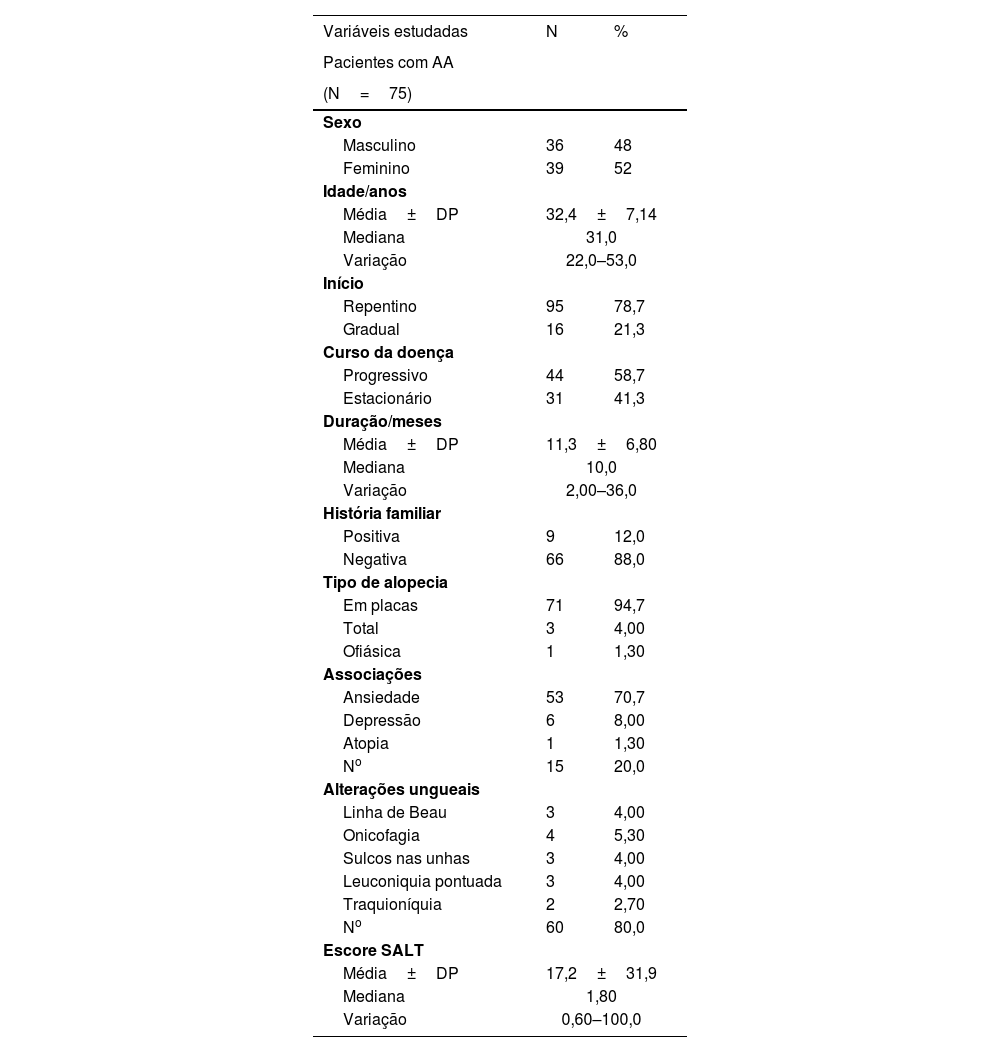
ResultadosDados pessoais e clínicos dos indivíduos investigadosOs pacientes com AA eram 36 (48%) homens e 39 (52%) mulheres, com proporção homem:mulher de 1:1,08. A idade variou de 22 a 53 anos, com 32,4±7,14 anos como valor médio±DP. Os indivíduos controle eram 43 (57,3%) homens e 32 (42,7%) mulheres, com proporção homem:mulher de 1,34:1. A idade variou de 18 a 54 anos, com 32,7±9,11 anos como valor médio±DP. Houve diferenças não estatisticamente significantes entre casos e controles em relação a idade (p=0,956) e sexo (p=0,252). A tabela 1 mostra os dados clínicos de pacientes com AA (n=75).
Dados demográficos e clínicos dos pacientes com AA (n=75)
| Variáveis estudadas | N | % |
|---|---|---|
| Pacientes com AA | ||
| (N=75) | ||
| Sexo | ||
| Masculino | 36 | 48 |
| Feminino | 39 | 52 |
| Idade/anos | ||
| Média±DP | 32,4±7,14 | |
| Mediana | 31,0 | |
| Variação | 22,0–53,0 | |
| Início | ||
| Repentino | 95 | 78,7 |
| Gradual | 16 | 21,3 |
| Curso da doença | ||
| Progressivo | 44 | 58,7 |
| Estacionário | 31 | 41,3 |
| Duração/meses | ||
| Média±DP | 11,3±6,80 | |
| Mediana | 10,0 | |
| Variação | 2,00–36,0 | |
| História familiar | ||
| Positiva | 9 | 12,0 |
| Negativa | 66 | 88,0 |
| Tipo de alopecia | ||
| Em placas | 71 | 94,7 |
| Total | 3 | 4,00 |
| Ofiásica | 1 | 1,30 |
| Associações | ||
| Ansiedade | 53 | 70,7 |
| Depressão | 6 | 8,00 |
| Atopia | 1 | 1,30 |
| No | 15 | 20,0 |
| Alterações ungueais | ||
| Linha de Beau | 3 | 4,00 |
| Onicofagia | 4 | 5,30 |
| Sulcos nas unhas | 3 | 4,00 |
| Leuconiquia pontuada | 3 | 4,00 |
| Traquioníquia | 2 | 2,70 |
| No | 60 | 80,0 |
| Escore SALT | ||
| Média±DP | 17,2±31,9 | |
| Mediana | 1,80 | |
| Variação | 0,60–100,0 | |
No, número; %, porcentagem; DP, desvio padrão; AA, alopecia areata; SALT, Severity of Alopecia Areata Tool.
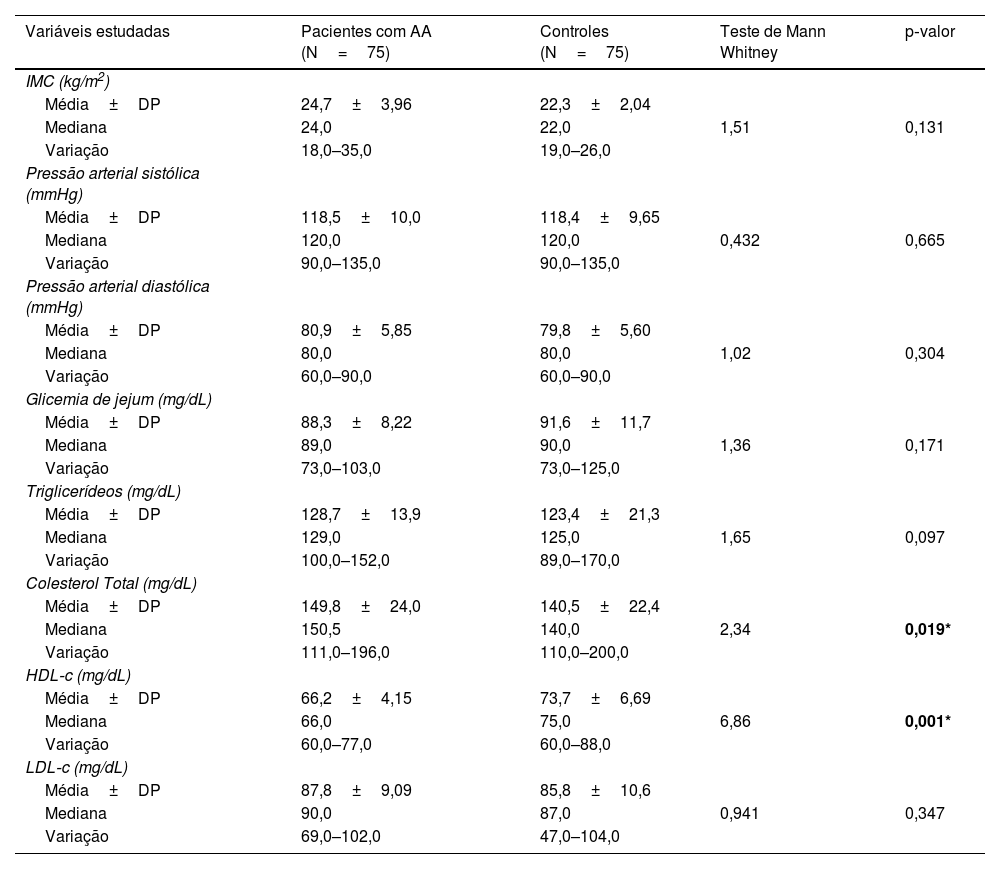
Houve diferenças não significantes entre os pacientes com AA e controles em relação ao IMC (p=0,131), pressão arterial sistólica (p=0,665), pressão arterial diastólica (p=0,304), glicemia de jejum (p=0,171), triglicérides (p=0,097) e lipoproteína de baixa densidade (p=0,347). Houve elevação significante do colesterol total (p=0,019) e diminuição significante da lipoproteína de alta densidade (p=0,001; tabela 2).
Comparação entre pacientes com AA e controles em relação ao IMC, pressão arterial e exames laboratoriais (n=150)
| Variáveis estudadas | Pacientes com AA (N=75) | Controles (N=75) | Teste de Mann Whitney | p‐valor |
|---|---|---|---|---|
| IMC (kg/m2) | ||||
| Média±DP | 24,7±3,96 | 22,3±2,04 | ||
| Mediana | 24,0 | 22,0 | 1,51 | 0,131 |
| Variação | 18,0–35,0 | 19,0–26,0 | ||
| Pressão arterial sistólica (mmHg) | ||||
| Média±DP | 118,5±10,0 | 118,4±9,65 | ||
| Mediana | 120,0 | 120,0 | 0,432 | 0,665 |
| Variação | 90,0–135,0 | 90,0–135,0 | ||
| Pressão arterial diastólica (mmHg) | ||||
| Média±DP | 80,9±5,85 | 79,8±5,60 | ||
| Mediana | 80,0 | 80,0 | 1,02 | 0,304 |
| Variação | 60,0–90,0 | 60,0–90,0 | ||
| Glicemia de jejum (mg/dL) | ||||
| Média±DP | 88,3±8,22 | 91,6±11,7 | ||
| Mediana | 89,0 | 90,0 | 1,36 | 0,171 |
| Variação | 73,0–103,0 | 73,0–125,0 | ||
| Triglicerídeos (mg/dL) | ||||
| Média±DP | 128,7±13,9 | 123,4±21,3 | ||
| Mediana | 129,0 | 125,0 | 1,65 | 0,097 |
| Variação | 100,0–152,0 | 89,0–170,0 | ||
| Colesterol Total (mg/dL) | ||||
| Média±DP | 149,8±24,0 | 140,5±22,4 | ||
| Mediana | 150,5 | 140,0 | 2,34 | 0,019* |
| Variação | 111,0–196,0 | 110,0–200,0 | ||
| HDL‐c (mg/dL) | ||||
| Média±DP | 66,2±4,15 | 73,7±6,69 | ||
| Mediana | 66,0 | 75,0 | 6,86 | 0,001* |
| Variação | 60,0–77,0 | 60,0–88,0 | ||
| LDL‐c (mg/dL) | ||||
| Média±DP | 87,8±9,09 | 85,8±10,6 | ||
| Mediana | 90,0 | 87,0 | 0,941 | 0,347 |
| Variação | 69,0–102,0 | 47,0–104,0 |
DP, desvio padrão; U, teste de Mann‐Whitney; IMC, índice de massa corporal; GJ, glicemia de jejum; TG, Triglicerídeo; HDL, lipoproteína de alta densidade; LDL, lipoproteína de baixa densidade; AA, alopecia areata.
O nível sérico de adiponectina foi significantemente menor nos pacientes com AA do que nos controles (9,45±4,12 vs. 13,8±5,62 ng/mL; p=0,001; tabela 3).
Comparação entre pacientes com AA e controles em relação ao nível sérico de adiponectina e ao SNP rs1077398 do gene da adiponectina (n=150)
| Variáveis estudadas | Pacientes com AA (N=75) | Controles (N=75) | Teste | p‐valor | OR (IC95%) |
|---|---|---|---|---|---|
| Nível sérico de adiponectina (ng/mL) | Mann‐Whitney | ||||
| Média±DP | 9,45±4,12 | 13,8±5,62 | 4,38 | 0,001a | – |
| Mediana | 9,60 | 12,6 | |||
| Variação | 2,80–15,3 | 6,89–29,5 |
| SNP rs2241766 do gene da adiponectina | No | % | No | % | χ2 | ||
|---|---|---|---|---|---|---|---|
| TT | 44 | 58,7 | 66 | 88,0 | Referência 5,17 (2,24–11,9) | ||
| TG | 31 | 41,3 | 9 | 12,0 | 16,5 | 0,001 |
| Alelos | N=150 | % | N=150 | % | χ2 | ||
|---|---|---|---|---|---|---|---|
| T | 119 | 79,3 | 141 | 94,0 | 13,9 | 0,001 | Referência 3,82 (1,75–8,35) |
| G | 31 | 20.7 | 9 | 6,00 |
AA, alopecia areata; N, número; %, porcentagem; χ2, teste de qui‐quadrado; OR, odds ratio; IC, intervalo de confiança.
O estudo do polimorfismo do gene ADIPOQ (rs2241766) mostrou que houve diferença significante entre pacientes com AA e controles. O genótipo TG estava presente em 31 (41,3%) pacientes com AA versus nove (12,0%) controles. A presença do genótipo TG aumentou significantemente o risco de AA em cerca de cinco vezes (OR=5,17, p=0,001). Além disso, o alelo G aumenta significantemente o risco de AA em cerca de quatro vezes (OR=3,82, p=0,001; tabela 3).
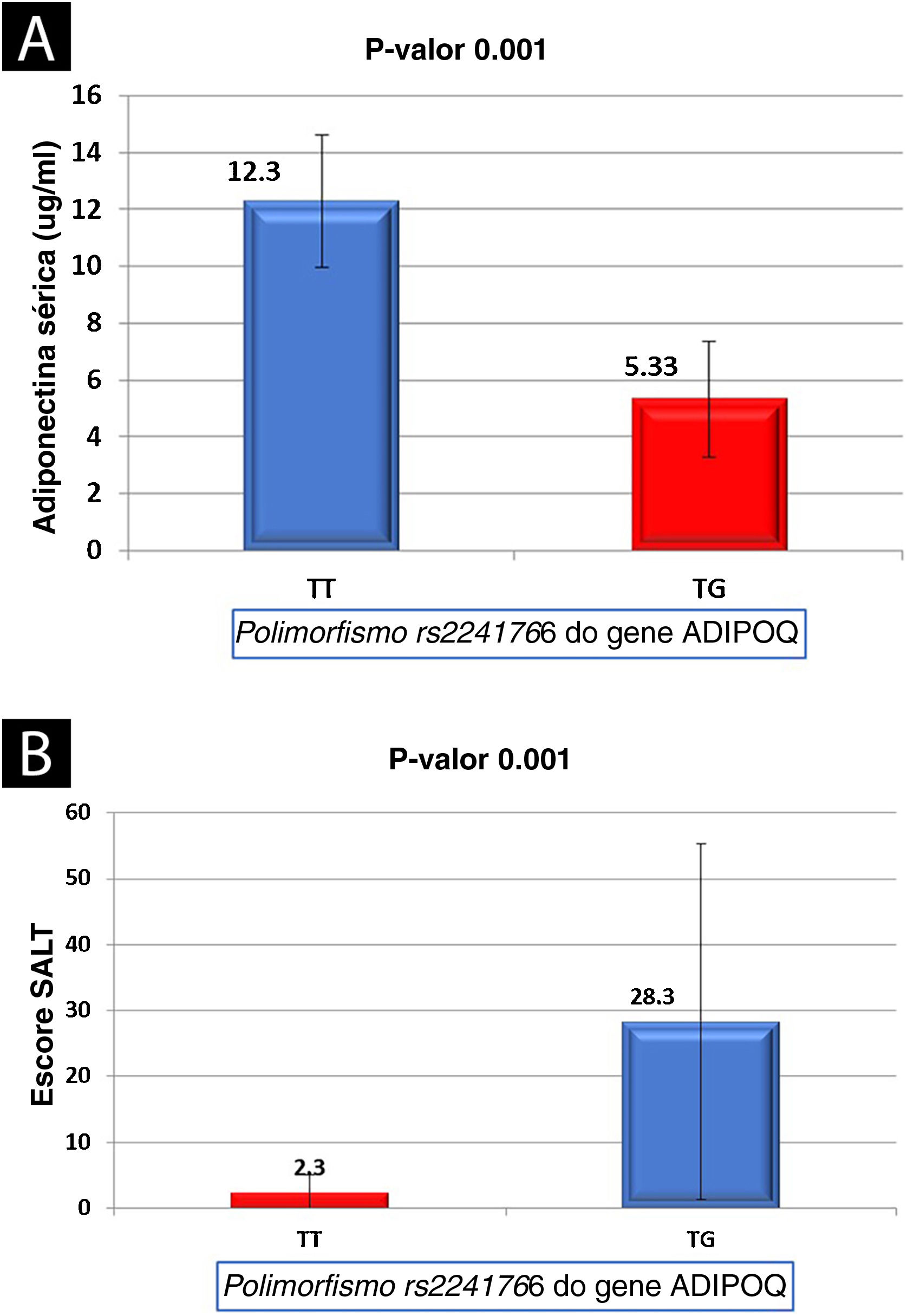
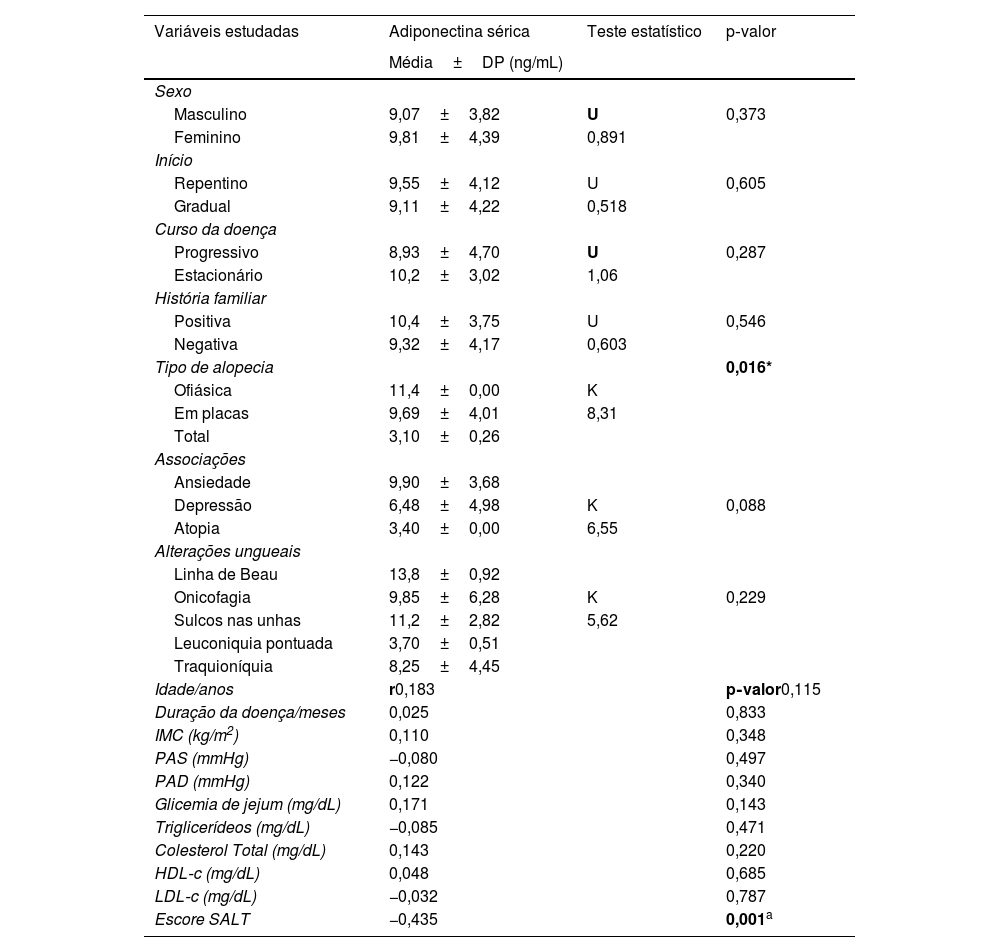
Nível sérico de adiponectina em relação aos dados estudados de pacientes com AAHouve relações não significantes entre o nível sérico de adiponectina e os dados investigados de pacientes com AA, exceto para o tipo de alopecia (significantemente menor na alopecia total [p=0,016]) e o escore SALT [correlação negativa significante (r=−0,435, p=0,001; tabela 4). O nível sérico de adiponectina foi significantemente menor em pacientes com AA com genótipo TG do que nos casos com genótipo TT (5,33±2,02 vs. 12,3±2,34; p=0,001; fig. 1A).
Relação entre nível sérico de adiponectina e dados estudados de pacientes com AA (n=75)
| Variáveis estudadas | Adiponectina sérica | Teste estatístico | p‐valor |
|---|---|---|---|
| Média±DP (ng/mL) | |||
| Sexo | |||
| Masculino | 9,07±3,82 | U | 0,373 |
| Feminino | 9,81±4,39 | 0,891 | |
| Início | |||
| Repentino | 9,55±4,12 | U | 0,605 |
| Gradual | 9,11±4,22 | 0,518 | |
| Curso da doença | |||
| Progressivo | 8,93±4,70 | U | 0,287 |
| Estacionário | 10,2±3,02 | 1,06 | |
| História familiar | |||
| Positiva | 10,4±3,75 | U | 0,546 |
| Negativa | 9,32±4,17 | 0,603 | |
| Tipo de alopecia | 0,016* | ||
| Ofiásica | 11,4±0,00 | K | |
| Em placas | 9,69±4,01 | 8,31 | |
| Total | 3,10±0,26 | ||
| Associações | |||
| Ansiedade | 9,90±3,68 | ||
| Depressão | 6,48±4,98 | K | 0,088 |
| Atopia | 3,40±0,00 | 6,55 | |
| Alterações ungueais | |||
| Linha de Beau | 13,8±0,92 | ||
| Onicofagia | 9,85±6,28 | K | 0,229 |
| Sulcos nas unhas | 11,2±2,82 | 5,62 | |
| Leuconiquia pontuada | 3,70±0,51 | ||
| Traquioníquia | 8,25±4,45 | ||
| Idade/anos | r0,183 | p‐valor0,115 | |
| Duração da doença/meses | 0,025 | 0,833 | |
| IMC (kg/m2) | 0,110 | 0,348 | |
| PAS (mmHg) | −0,080 | 0,497 | |
| PAD (mmHg) | 0,122 | 0,340 | |
| Glicemia de jejum (mg/dL) | 0,171 | 0,143 | |
| Triglicerídeos (mg/dL) | −0,085 | 0,471 | |
| Colesterol Total (mg/dL) | 0,143 | 0,220 | |
| HDL‐c (mg/dL) | 0,048 | 0,685 | |
| LDL‐c (mg/dL) | −0,032 | 0,787 | |
| Escore SALT | −0,435 | 0,001a |
DP, desvio padrão; K, teste de Kruskal‐Wallis; U, teste de Mann‐Whitney; *r, correlação de Spearman; IMC, índice de massa corporal; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; HDL, lipoproteína de alta densidade; LDL, lipoproteína de baixa densidade; SALT, Severity of Alopecia Areata Tool.
Houve relações não significantes entre os genótipos do polimorfismo (rs2241766) do gene ADIPOQ e os dados clínicos dos pacientes com AA estudados, exceto o escore SALT, que foi significantemente maior nos portadores do genótipo TG do que nos portadores de TT (p=0,001; fig. 1B).
DiscussãoNo presente estudo, o SNP do gene ADIPOQ (rs2241766) foi fortemente relacionado às concentrações séricas de adiponectina em pacientes com AA e associado à gravidade da doença. O presente estudo acrescenta dados a literatura crescente que sugere que o SNP (rs2241766) do gene ADIPOQ poderia modular o risco de AA e contribuir para o desenvolvimento de AA em populações egípcias que não haviam sido identificadas anteriormente, e confirma que a diminuição dos níveis circulantes de adiponectina pode ter papel ativo na etiopatogenia da AA. Estudos confirmatórios como o atual são necessários para garantir que as associações observadas sejam verdadeiras e não espúrias.
O metabolismo e o sistema imunológico estão conectados por meio de uma rede de numerosos mediadores solúveis conhecidos como adipocinas. Essas adipocinas podem ser boas e ruins. As adipocinas ruins são pró‐inflamatórias e produzem resistência à insulina, disfunção vascular e reações inflamatórias locais que induzem inflamação cutânea. Por outro lado, as adipocinas boas têm propriedades opostas.31
Aqui, os autores consideraram a adiponectina uma boa adipocina, já que foi encontrada diminuição significante em seu nível circulante nos pacientes com AA em relação aos controles, e essa baixa concentração foi observada mais frequentemente em casos mais graves e na alopecia total.
Confirmando essas observações, Stochmal et al.17 demonstraram diminuição significante no nível sérico de adiponectina em pacientes com AA em relação a seus pares. Eles também relataram que o nível sérico de adiponectina foi negativamente correlacionado com o escore SALT e tinha concentração mais baixa em pacientes com alopecia universal. Níveis diminuídos de adiponectina sérica também foram descritos em pacientes com síndrome de Sjögren, artrite psoriásica e esclerose múltipla.32
A adiponectina, uma proteína sérica, é produzida principalmente pelos adipócitos. Porém, outras células como os fibroblastos, células endoteliais, macrófagos e leucócitos também podem sintetizar a adiponectina.33 A adiponectina tem efeito anti‐inflamatório, reduz a linfopoiese das células B e a capacidade de resposta das células T, bem como a síntese de TNF‐α. Também estimula a produção de IL‐10.32
A patogênese da AA não é completamente entendida. Parece que a ativação do sistema imunológico é considerada um dos principais processos biológicos ligados à patogênese da AA.34 Na AA, foram confirmados níveis incomuns de muitas citocinas pró‐inflamatórias, como IL‐6 e TNF‐α, e anti‐inflamatórias, como IL‐10.35,36 Parece que o desequilíbrio na produção de citocinas, com um excesso relativo de citocinas pró‐inflamatórias versus baixas citocinas anti‐inflamatórias, poderia ter papel ativo no desenvolvimento de AA.37
O TNF‐α é um inibidor normal in vitro do crescimento do folículo piloso. O TNF‐α, juntamente com IL‐1α e β, induz a vacuolização das células da matriz dentro do bulbo do folículo piloso e a diminuição do tamanho da matriz. Também desorganiza os melanócitos foliculares e induz a diferenciação anormal na bainha radicular interna e nas células pré‐corticais.38 Foi relatado que os níveis séricos39 e teciduais38 de TNF‐α em pacientes com AA foram significantemente maiores que nos controles.
Assim, foi levantada a hipótese de que na AA, a adiponectina poderia atuar como molécula anti‐inflamatória, e os baixos níveis séricos de adiponectina demonstrados em pacientes com AA no presente estudo podem ser traduzidos em uma atividade anti‐inflamatória reprimida. Níveis prejudicados de adiponectina podem influenciar vários processos no ambiente do folículo piloso, levando a uma resposta autoimune local, resultando em perda exacerbada de cabelos.
Entretanto, Serarslan et al.16 não mostraram diferenças significantes na concentração de adiponectina em pacientes com AA em comparação com controles saudáveis. Além disso, os autores demonstraram níveis séricos mais elevados de adiponectina em pacientes com queda de cabelo no couro cabeludo em comparação com aqueles com AA isolada em barba e sobrancelha. Esses autores afirmaram que o resultado foi uma descoberta inesperada. Eles acrescentaram que, assim como na AR, onde os níveis séricos e sinoviais de adiponectina estavam aumentados, sugere‐se que a adiponectina aumente a produção de mediadores inflamatórios.40 Esses resultados controversos precisam de mais estudos semelhantes em grande escala para serem verificados.
No presente trabalho, analisamos, pela primeira vez, o SNP (rs2241766) do gene ADIPOQ em pacientes com AA e correlacionamos os genótipos com a gravidade, local, progressão e duração da AA, bem como com o nível sérico de adiponectina. Os resultados mostraram que o genótipo TG estava significantemente presente em pacientes com AA, aumentando seu risco em cerca de cinco vezes, enquanto o alelo G aumenta significantemente o risco em cerca de quatro vezes. Além disso, os portadores do genótipo TG do polimorfismo (rs2241766) do gene ADIPOQ demonstraram níveis séricos de adiponectina significantemente baixos e forma grave de AA. Portanto, sugere‐se que o polimorfismo (rs2241766) do gene ADIPOQ contribui não apenas para o desenvolvimento da AA, mas também para sua gravidade. Isso é mediado pela desregulação da transcrição da adiponectina.
Apoiando esses resultados, Saleh et al.41 revelaram que os alelos mutantes do polimorfismo (rs2241766) do gene ADIPOQ estavam ligados à diminuição dos níveis circulatórios de adiponectina em casos de infarto do miocárdio. Além disso, Al‐Shaheri et al.22 descobriram que os SNPs rs2241766 e rs3774261 do gene ADIPOQ aumentam o risco de dermatite atópica. Anteriormente, Wassel et al.42 relataram que os SNPs da adiponectina rs17300539, rs182052, rs822393, rs9882205 e rs3774261 estavam fortemente associados às concentrações séricas de adiponectina em indivíduos brancos.
As limitações do estudo foram: a) o pequeno tamanho da amostra; b) estudo ser estruturalmente um estudo de caso‐controle; e c) ter sido avaliada apenas uma única adipocina em vez de múltiplas.
ConclusãoParece que o polimorfismo (rs2241766) do gene ADIPOQ (genótipo TG e alelo G) pode modular o risco de AA e contribuir para o desenvolvimento de AA em populações egípcias. A diminuição dos níveis circulantes de adiponectina pode ter papel dinâmico na etiopatogenia da AA, que poderia ser mediada por seus efeitos anti‐inflamatórios. A concentração sérica de adiponectina pode ser considerada um marcador de gravidade da queda de cabelos na AA.
Suporte financeiroNenhum.
Contribuição dos autoresAzza Gaber Antar Farag: Revisão crítica da literatura; concepção e planejamento do estudo.
Eman Abd‐Elfatah Badr labeeb: Análise e interpretação dos dados.
Banan Mohamed Gamal Abd‐Elaty: Obtenção dos dados
Nada Farag Elnaidany: Análise estatística.
Mai Medhat Mohamed Ghanem: Análise e interpretação dos dados.
Conflito de interessesNenhum.
Agradecemos às equipes técnicas e administrativas do Departamento de Dermatologia e Bioquímica da Faculdade de Medicina, Menoufia University, que gentilmente ajudaram ao longo deste trabalho.
Como citar este artigo: Farag AGA, Badr EA, Abd‐Elaty BMG, Elnaidany NF, Ghanem MMM. Adiponectin serum level and ADIPOQ polymorphism in alopecia areata Egyptian patients. An Bras Dermatol. 2024;99:181–8.
Trabalho realizado no Departamento de Dermatologia, Andrologia e ISTs, e Departamento de Bioquímica Médica e Biologia Molecular, Faculdade de Medicina, Menoufia University, Menoufia, Egito.