O nevo acneiforme de Munro, também conhecido como nevo comedônico (MIM 617025), é anomalia rara do desenvolvimento da unidade pilossebácea, classificada como um subtipo de nevo epidérmico. Estudos recentes implicaram vários genes em sua patogênese, incluindo FGFR2, FGFR3 e NEK9. Aqui, relata‐se um caso de nevo acneiforme de Munro associado a mutação heterozigótica de linhagem germinativa FGF22 (c.104A>G) e mutação somática de mosaico FGFR2 (c.755G>C).
A paciente do sexo feminino de 22 anos apresentava placa congênita assintomática no dorso que havia aumentado progressivamente (fig. 1A). O exame físico revelou mancha eritematosa de formato irregular com bordas bem demarcadas na região lombossacral direita. A lesão era cravejada de pápulas foliculares vermelho‐escuras a pretas com pontas acuminadas (fig. 1B). Comedões e pelos terminais hipopigmentados eram evidentes na área afetada. A avaliação clínica abrangente não revelou anormalidades sistêmicas.
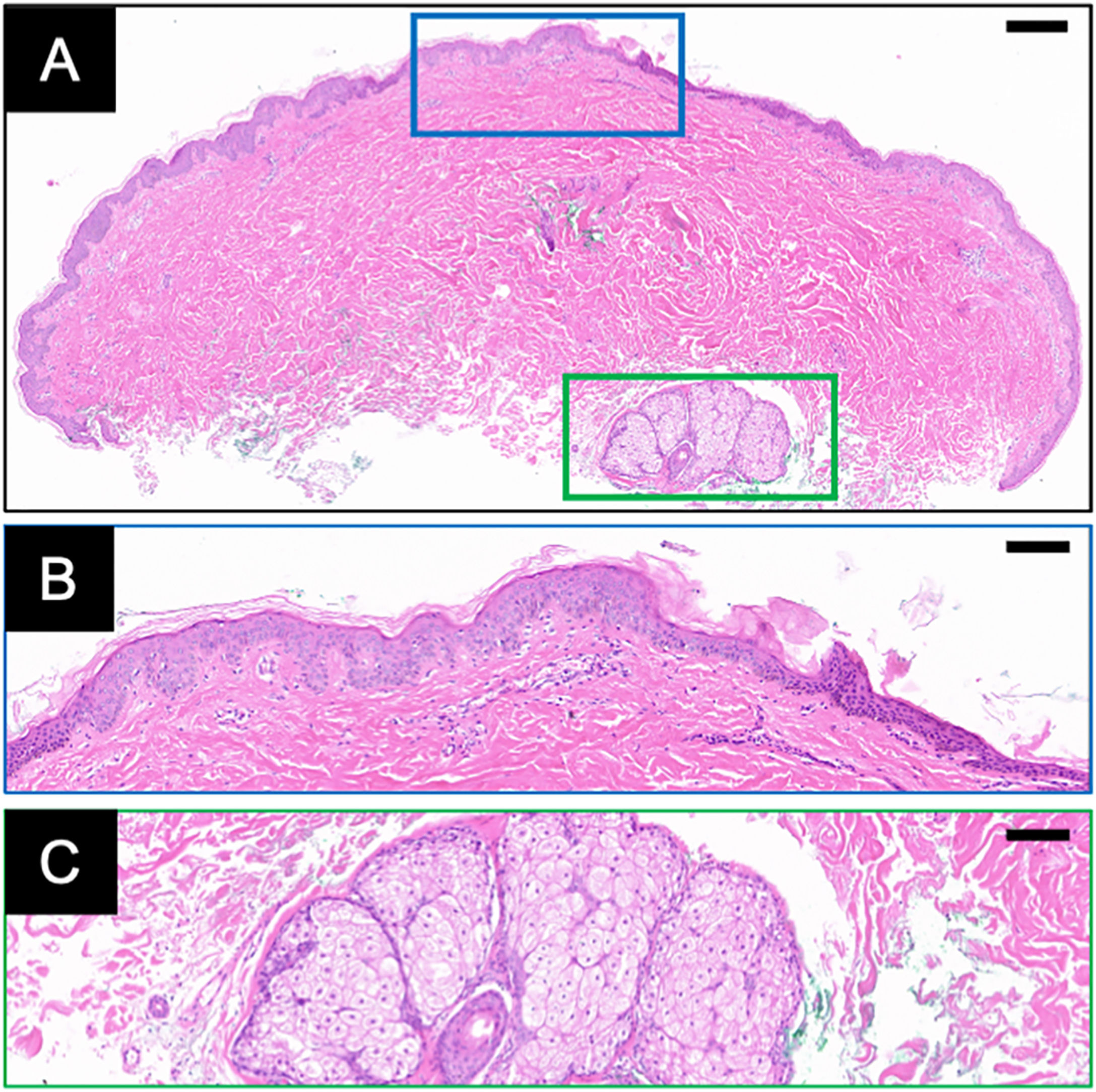
A histopatologia (fig. 2A) demonstrou acantose leve e hiperceratose da epiderme (fig. 2B), hiperpigmentação focal da camada basal e hiperplasia do colágeno dérmico. Folículo piloso degenerativo com hiperplasia sebácea proeminente foi observado (fig. 2C), acompanhado por fibrose perifolicular leve e infiltrado linfocítico. A derme superficial exibia infiltração linfocítica perivascular esparsa.
A análise genética identificou mutação heterozigótica de linhagem germinativa em FGF22 (rs574406266, c.104A>G, p.His35Arg) na pele lesional e no sangue periférico, com base no sequenciamento completo do exoma (WES, do inglês whole exome sequencing) do DNA extraído com o kit TIANamp Genomic DNA (DP304, TIANGEN, China). Além disso, mutação de mosaico somático em FGFR2 (rs79184941, c.755G>C, p.Ser252Trp) foi detectada exclusivamente na pele afetada, com frequência de alelo variante de 17%, confirmada pelo sequenciamento de Sanger (fig. 3).
A análise de imunofluorescência (fig. 4) revelou distribuição desigual de células Ki‐67‐positivas na epiderme e glândulas sebáceas, com maior abundância em comparação com a pele de controle normal. A regulação positiva aberrante de CK6 e a regulação negativa de CK5 foram observadas na epiderme e nas células basais periféricas ao redor das glândulas sebáceas. Notavelmente, os queratinócitos basais e suprabasais demonstraram expressão aumentada e colocalizada de FGF22 e FGFR2, como evidenciado por sinais intensos de fluorescência amarela. Em contraste, as glândulas sebáceas exibiram expressão de FGFR2, com expressão mínima de FGF22.
Coloração de imunofluorescência da biópsia lesional (A) e controle saudável (B). Na pele lesional (A), a distribuição desigual de células Ki‐67‐positivas foi observada na epiderme, os queratinócitos basais e suprabasais demonstraram expressão aumentada e colocalizada de FGF22 e FGFR2, como evidenciado por sinais intensos de fluorescência amarela.Barra de escala: 200 m para visão geral; 50 m para epiderme e glândulas sebáceas.
Mutações FGFR2 ativadoras de mosaico cutâneo foram identificadas em vários casos de nevo comedônico, incluindo c.755G>C (p.Ser252Trp),1,2 c.758C>G (p.Pro253Arg),3 e c.1144T>C (p.Cys382Arg).4 A síndrome de Apert também envolve mutações nesses locais do FGFR2, mas é tipicamente associada a acne extensa, juntamente com craniossinostose e sindactilia grave das mãos e pés.5 As mutações p.Ser252Trp e p.Pro253Arg do FGFR2 estão localizadas no domínio topológico extracelular, especificamente na região de ligação entre os domínios semelhantes à imunoglobulina II e III. Essas mutações de ganho de função criam contatos FGF‐FGFR adicionais não específicos, permitindo a ligação patológica de FGFs ao FGFR2. O presente caso relata pela primeira vez uma paciente chinesa com nevo acneiforme de Munro portadora da mutação FGFR2 c.755G>C (p.Ser252Trp). Curiosamente, essa mutação específica foi associada a diversos fenótipos: Larsabal et al.1 descreveram acantose nigricans nevoide com espessamento localizado da pele e hiperpigmentação, enquanto Melnik et al.2 relataram pápulas e pústulas inflamatórias com hipopigmentação. Em comparação, o presente caso exibiu lesões cutâneas relativamente mais brandas em comparação a esses dois casos.
O FGF22 é potente ativador do FGFR2 na pele, ligando‐se ao FGFR2 IgIIIc. A mutação p.His35Arg (c.104A>G) do FGF22 é nova no nevo epidérmico e permanece amplamente não caracterizada (escore SIFT=0,001; escore HVAR do Polyphen2=0,998). O His35 é proximal à região do peptídeo sinal N‐terminal, sugerindo que a mutação p.His35Arg possa afetar a secreção do FGF22 e a localização extracelular. No presente caso, FGFR2 e FGF22 estavam claramente colocalizados na epiderme, sugerindo potencial interação ligante‐receptor in situ. Juntamente com o aumento da expressão de CK6 e Ki‐67 nessa área, isso indica que a estratificação epidérmica interrompida e a proliferação anormal de queratinócitos podem estar associadas à sinalização FGF22/FGFR2. Propõe‐se um modelo em que o FGF22 mutante atue como ligante hiperativo para ativação constitutiva do FGFR2, resultando em ativação sustentada dessas vias e glândulas sebáceas, com maior abundância em comparação à pele de controle normal. O CK6 estava regulado positivamente e o CK5 regulado negativamente na epiderme e nas células basais periféricas das glândulas sebáceas. Os queratinócitos basais e suprabasais mostraram expressão aumentada e colocalizada de FGF22 e FGFR2. Em contraste, as glândulas sebáceas exibiram expressão de FGFR2, mas FGF22 mínimo. Na pele controle saudável, havia presença mínima de células Ki‐67‐positivas ou CK6 na epiderme e glândulas sebáceas. CK5 foi expresso na epiderme e células basais periféricas das glândulas sebáceas. Queratinócitos basais e suprabasais não exibiram expressão de FGF22 ou FGFR2. Nas células basais periféricas das glândulas sebáceas, a expressão de FGFR2 foi observada, com FGF22 ausente.
Suporte financeiroNenhum
Contribuição dos autoresJiachen Sun: Realizou os experimentos e análise de dados, elaboração e redação do manuscrito e revisou criticamente o manuscrito.
Yimeng Wang: Realizou os experimentos e análise de dados, elaboração e redação do manuscrito e revisou criticamente o manuscrito.
Lihua Zhang: Realizou os experimentos e análise de dados, elaboração e redação do manuscrito, forneceu a análise patológica e revisou criticamente o manuscrito.
Chunlei Zhang: Concepção do estudo e projetou os experimentos; revisou criticamente o manuscrito.
Chuan Ma: Concepção do estudo e projetou os experimentos; revisou criticamente o manuscrito.
Conflito de interessesNenhum.
Os autores expressam sua sincera gratidão à paciente por sua participação e consentimento neste estudo.