Linfoma de células do manto é linfoma não Hodgkin, de células B, com origem linfonodal ou extranodal, agressivo, com sobrevida média de três a cinco anos. O comprometimento cutâneo é raro, secundário e sinaliza disseminação da neoplasia. Relatamos o caso de paciente do sexo feminino de 69 anos de idade, diagnosticada havia um ano com linfoma cutâneo de células do manto por biópsia de linfonodo e de medula óssea. Estava em vigência do segundo esquema quimioterápico quando apresentou lesões tipo placa infiltrada, nódulos e tumorações no tronco e na raiz da coxa, com histopatológico e imuno‐histoquímica demonstrando a infiltração cutânea da variedade blastoide do linfoma.
O linfoma de células do manto (LCM) é linfoma não Hodgkin, de células B, derivado de células internas da zona do manto de folículos linfoides. É tumor agressivo, com sobrevida média de três a cinco anos.1 Corresponde a 4% dos linfomas diagnosticados nos Estados Unidos e entre 7% a 9% na Europa, com maior incidência em pacientes com mais de 60 anos e no sexo masculino (2:1).1,2 Apresenta quatro variantes histológicas: de pequenas células, da zona do manto, difusa e variante blástica, ou blastoide – esta última corresponde entre 10% a 30% dos casos de LCM.2,3 Ocorre primordialmente em linfonodos e órgãos extranodais, como medula óssea e baço. O comprometimento cutâneo é raro, secundário, com ocorrência em cerca de 2% dos casos, e pode ser entendido como sentinela de disseminação do linfoma e mais frequentemente associado às características citológicas de origem blastoide, também apontada como a de pior prognóstico.4 Nos poucos casos de acometimento cutâneo descritos na literatura, as lesões mais prevalentes consistiam principalmente de infiltrações subcutâneas, nódulos e tumorações.4
Relato do casoRelatamos o caso de paciente do sexo feminino de 69 anos de idade, diagnosticada havia um ano com linfoma cutâneo de células do manto por biópsia de linfonodo e medula óssea, após queixa de linfonodomegalia dolorosa generalizada associada à perda ponderal, astenia e dores gastrintestinais.
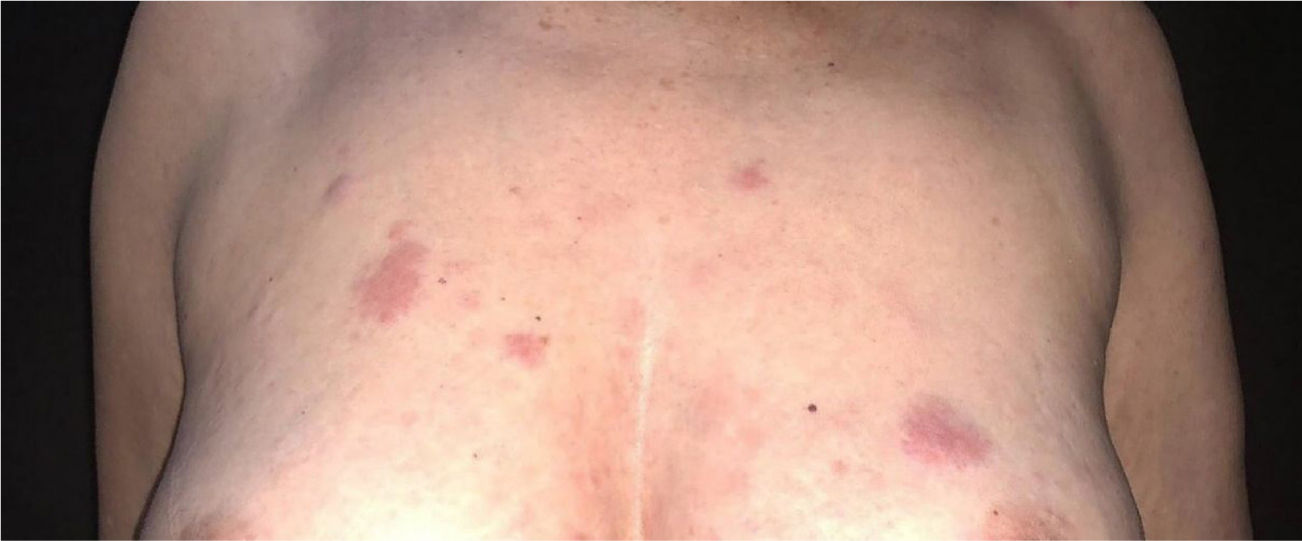
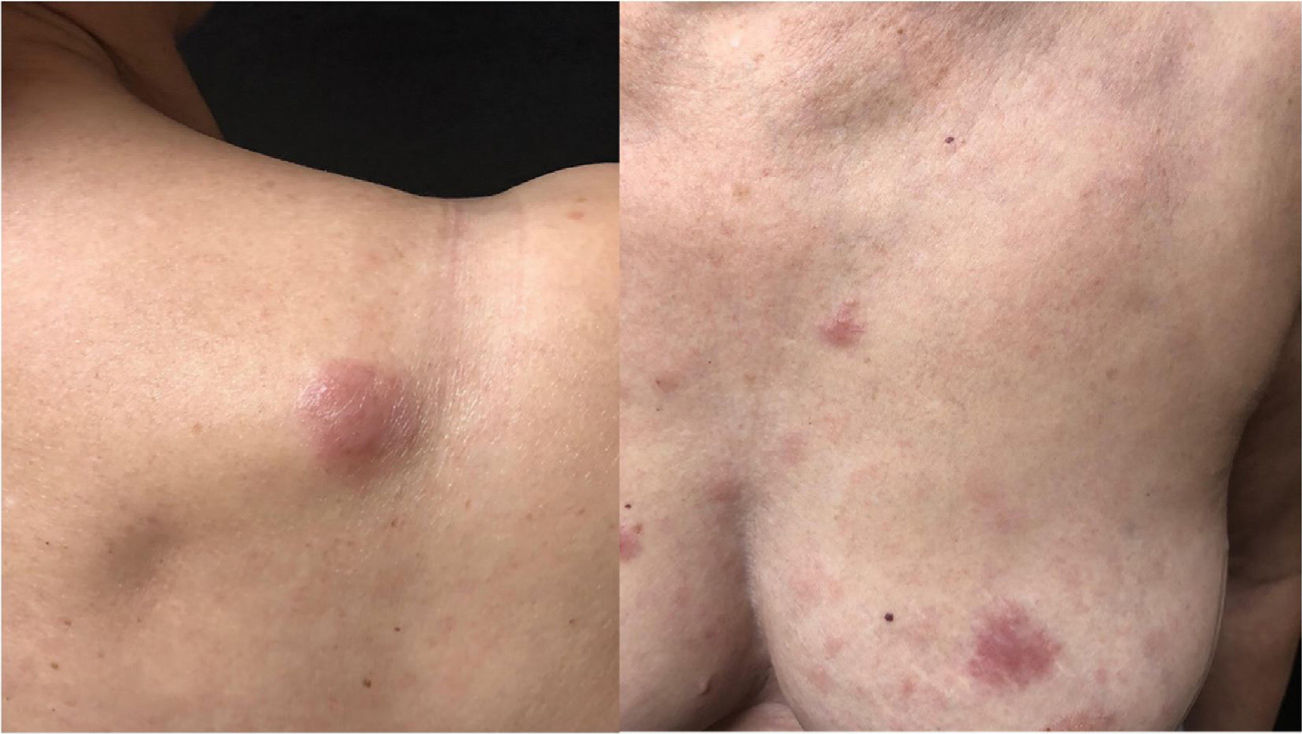
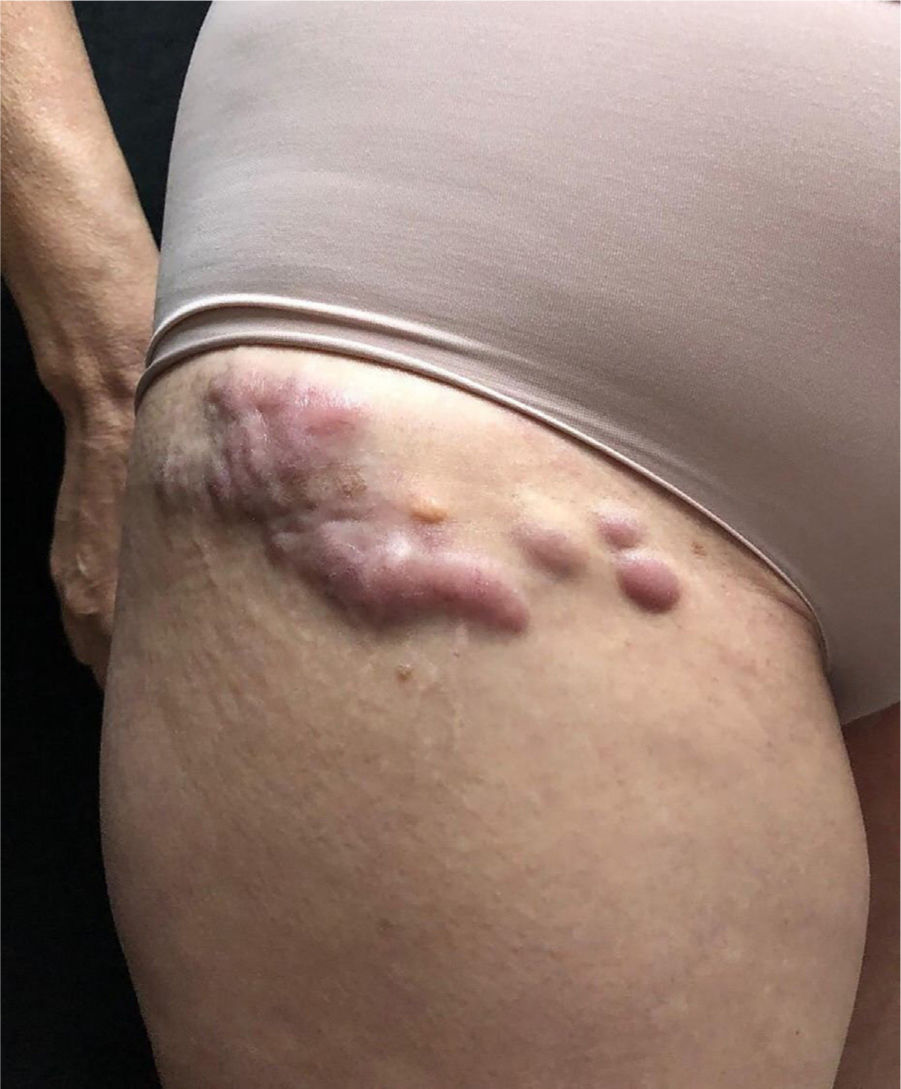
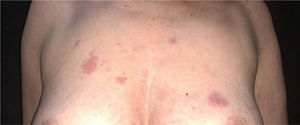
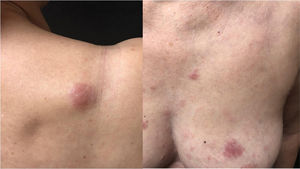
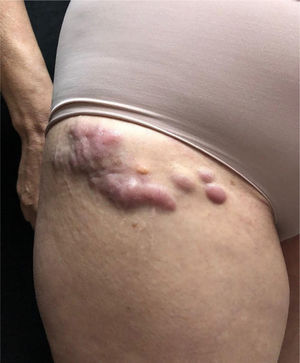
A paciente foi submetida inicialmente ao esquema CHOP alternado com AraC HD, com resposta completa após o sétimo ciclo. Porém, após recidiva diagnosticada no sétimo mês pós‐diagnóstico, houve transição para esquema GEMOX‐FT (gemcitabina e oxaliplatina). No entanto, poucos meses depois, na vigência deste esquema, a paciente apresentou, em sequência, lesões eritematosas, pápulas, nódulos e lesões em placas infiltradas localizadas no tronco e abdome (figs. 1 e 2). Posteriormente, surgiram lesões nódulo‐tumorais na região inguinal (fig. 3), associadas à recorrência com aumento linfonodal difuso, momento em que a Dermatologia foi consultada.
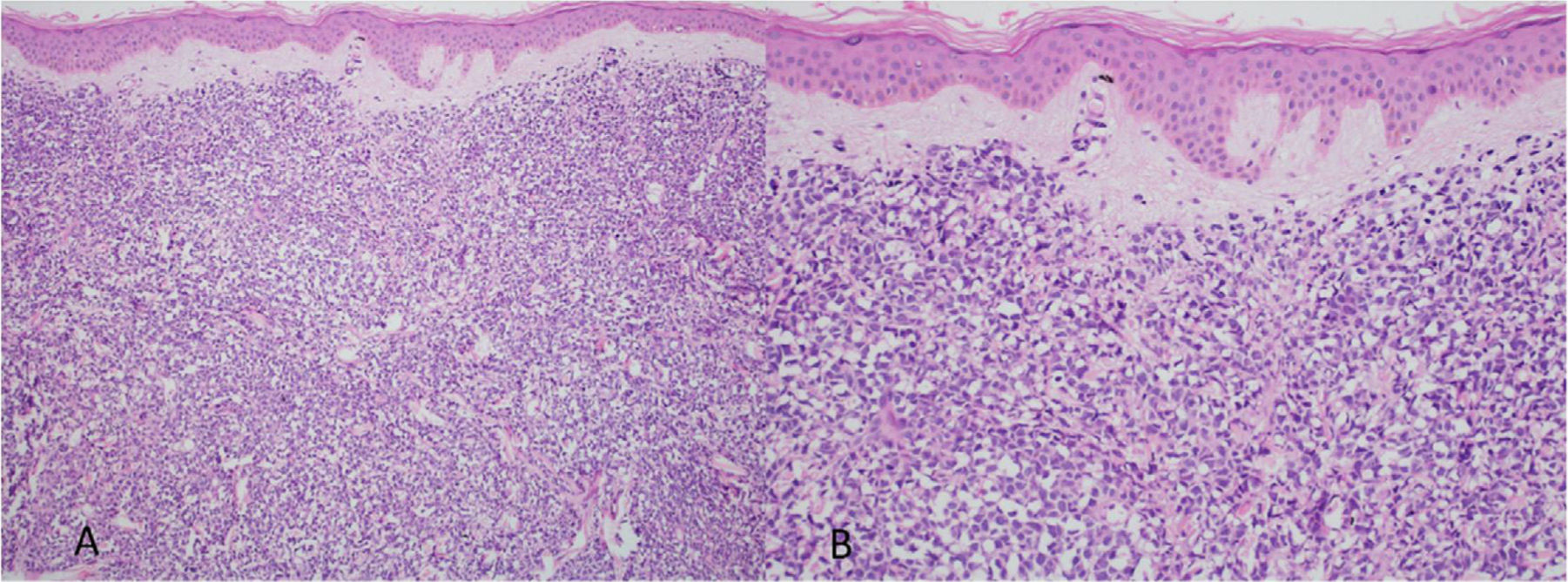
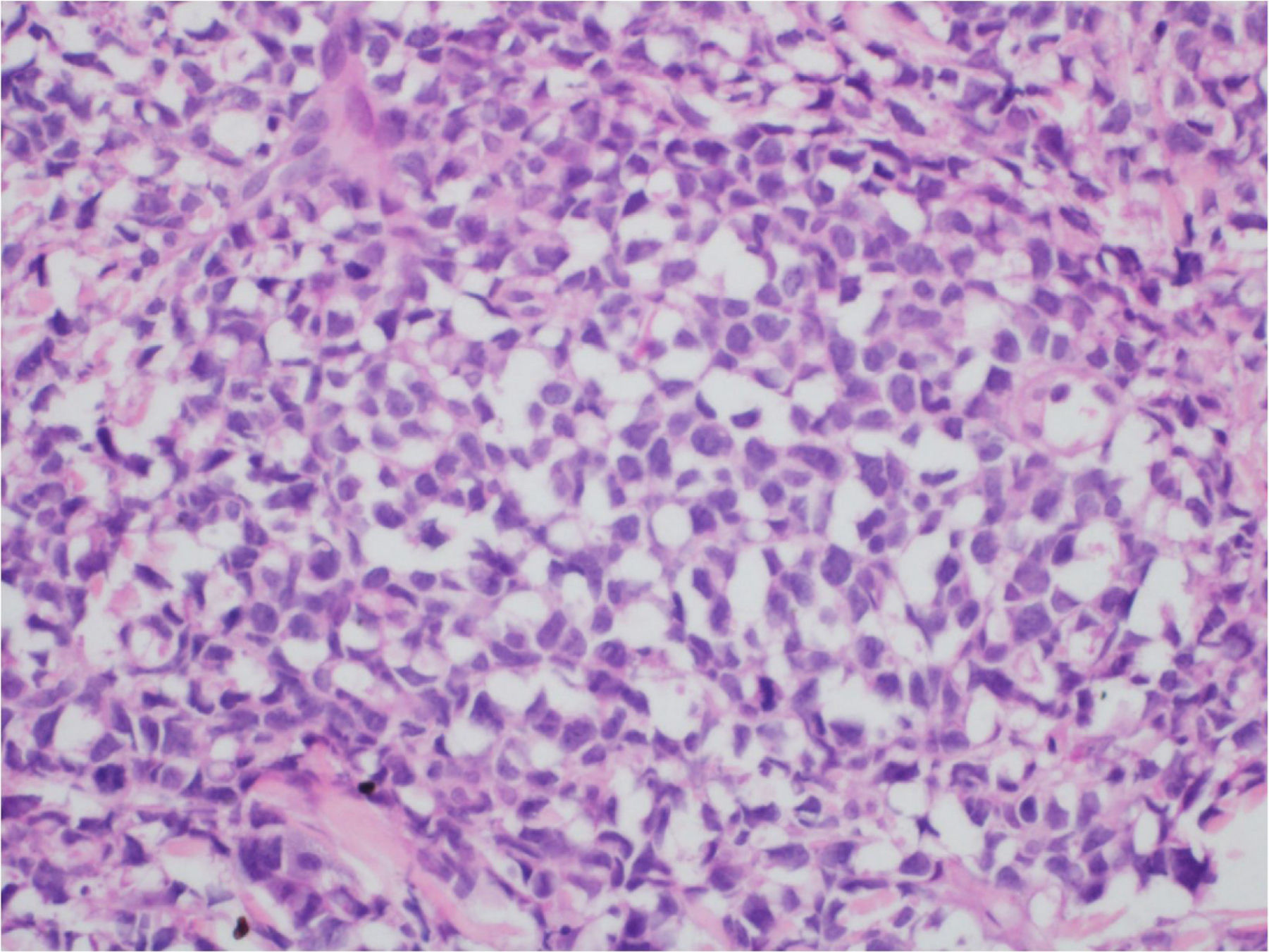
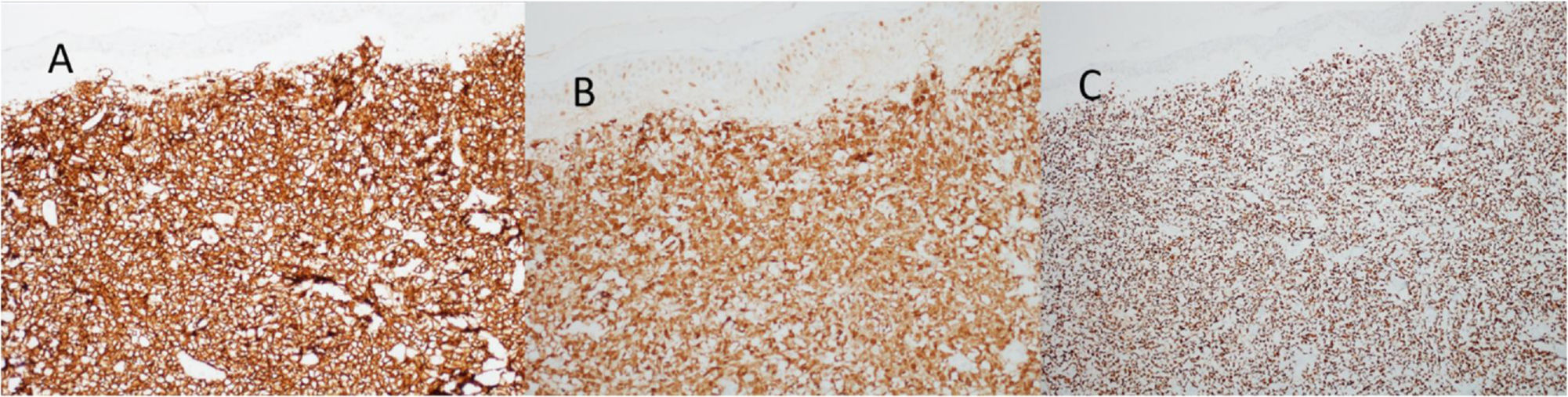
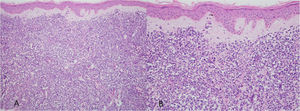
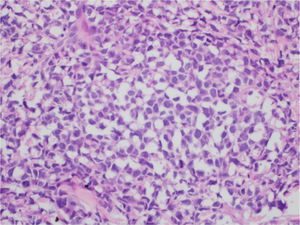
Ao exame, as lesões em placas infiltradas eram eritematosas, consistentes, e as lesões nódulo‐tumorais eritemato‐acastanhadas, de consistência firme e indolores. A hipótese clínica foi de infiltração cutânea específica pela enfermidade de base, confirmada pós‐biópsia de lesão em placa infiltrada. O exame anatomopatológico correspondente mostrou densa infiltração cutânea da derme e tecido celular subcutâneo por linfócitos de pequeno e médio diâmetro, com núcleos irregulares e acúmulos de células blásticas. O infiltrado poupava a epiderme e mantinha visível zona de Grenz ocupando a derme superficial e papilar (figs. 4 e 5). Na imuno‐histoquímica observaram‐se marcação positiva para CD20, CD5, PAX5 e Ciclina D1, e negativo para CD23, CD30, achados diagnósticos do LCM blastoide com infiltração cutânea (fig. 6). Com a confirmação histológica, o esquema quimioterápico foi novamente modificado para ciclos de ifosfamida, etoposídeo e dexametasona, com remissão inicial do quadro. Porém, aproximadamente dois anos após o diagnóstico, a paciente veio a falecer em consequência da disseminação sistêmica do linfoma.
O LCM está associado à mutação caracterizada por translocação cromossômica t(11:14) (q13 32) do gene CCND1, a qual leva à expressão aberrante da Ciclina D1, que não é tipicamente expressa em linfócitos normais.2,3 Essa expressão aumentada da proteína Ciclina D1 leva à desregulação do ciclo celular normal, uma vez que a mesma atua como um sinal positivo para a transição da fase G1 para a fase S da divisão celular e um estímulo às células para a proliferação sem controle.
Imunofenotipicamente, o LCM consiste em células tumorais com marcação para CD20+, CD5+, Ciclina D1+, geralmente negativas para CD3, CD10, CD23, CD30 e bcl‐6.2,3 No estudo anatomopatológico, a morfologia típica é a de células linfoides monomórficas de tamanho pequeno a médio, com contornos nucleares irregulares; na variante blastoide, observa‐se acúmulo de grandes células, de núcleos grandes e citoplasma escasso.4,5
Clinicamente, o LCM se expressa inicialmente com sintomas B, linfonodomegalia generalizada, infiltração de medula óssea e esplenomegalia – esta última podendo ser de grande repercussão.1,2 Outros órgãos acometidos são o trato gastrintestinal e, mais raramente, infiltração ocular, do tegumento cutâneo e sistema nervoso central. Laboratorialmente, caracteriza‐se pela presença de pancitopenia ou apresentação leucêmica com extensa leucocitose.1,2 A variedade blastoide do LCM ocorre em 10% a 30% e está associada a pior prognóstico.2
Em decorrência da baixa frequência de LCM com envolvimento cutâneo, poucos são os casos descritos na literatura. Até o ano de 2015, apenas 25 casos encontravam‐se descritos em relatos na língua inglesa. Baseando‐se nesses dados, as lesões mais prevalentes são tipo nódulo; porém, máculas, placas infiltradas, tumorações e infiltrações subcutâneas também podem estar presentes.4–6 As localizações mais acometidas são o tronco e a face, seguido dos membros e do couro cabeludo. Deve‐se ressaltar que a presença de lesões cutâneas sinaliza pior prognóstico e pode ser a manifestação de alerta da presença do LCM sistêmico.7 LCM primário da pele é de ocorrência extremamente rara e exige ampla e detalhada investigação sistêmica que exclua comprometimento extracutâneo para ser considerado como tal.8
Em relação à terapêutica, pela raridade do LCM, não há ensaio clínicos randomizados que informem qual o tratamento mais adequado; na prática clínica, esquemas CHOP ou suas variações são empregadas como tratamento inicial.9,10 Com essas iniciativas de tratamento são observadas remissões em curto prazo, porém, como no presente caso, seguidas por recidivas e evolução fatal. O rituximabe tem sido proposto como alternativa em monoterapia ou associado a diferentes esquemas. O transplante de medula óssea também deve ser considerado.9,10
O presente relato ilustra manifestações dermatológicas e histopatológicas de linfoma B, das células do manto, variedade blastoide, raro, agressivo e com lesões cutâneas múltiplas indicativas de disseminação e mal prognóstico.
Suporte financeiroNenhum.
Contribuição dos autoresMariana Righetto de Ré: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura.
Flávia de Oliveira Valentim: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Mariangela Esther Alencar Marques: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Silvio Alencar Marques: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ré MR, Valentim FO, Marques MEA, Marques SA. Blastoid mantle cell lymphoma: cutaneous infiltration. An Bras Dermatol. 2021;96:442–6.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.