É crescente a frequência do uso de medicamentos que atuam no receptor do fator de crescimento epidérmico (EGFR), com consequente aparecimento de toxicidade cutânea, especificamente a erupção acneiforme. Os autores revisam amplamente o tema, preocupados em descrever as formas como esses medicamentos podem afetar a pele e os anexos cutâneos, ou seja, a fisiopatologia que abrange a toxicidade cutânea relacionada ao uso dos inibidores do EGFR (EGFRis). Além disso, foi possível listar os fatores de risco que podem estar associados a esse efeito adverso desses medicamentos. Com base nesses recentes conhecimentos, espera‐se auxiliar no manejo dos pacientes mais vulneráveis à toxicidade, diminuindo morbidades e melhorando a qualidade de vida dos doentes em tratamento com EGFRis. Outras questões relacionadas à toxicidade dos EGFRis, como os aspectos clínicos sistematizados por graduações da erupção acneiforme, e outras diferentes formas de reações cutaneomucosas, também estão inseridas no artigo.
A pele é um alvo relativamente comum de reações adversas a medicamentos, mas é difícil estimar a incidência exata de farmacodermias. Em pacientes hospitalizados, dados da literatura relatam que as reações cutâneas são responsáveis por aproximadamente 3% das complicações incapacitantes em pacientes internados, representam 2% das consultas médicas e 5% das internações em serviços de dermatologia.1,2
Especificamente na terapia oncológica, a quantidade de novos medicamentos disponíveis cresce rapidamente. Portanto, há uma gestão em constante transformação dos possíveis efeitos adversos. Vários novos medicamentos foram estudados, e a imunoterapia e as terapias direcionadas tornaram‐se os tratamentos escolhidos em vários tipos de câncer.3 Simultaneamente ao aumento do uso desses novos tratamentos, notou‐se a descrição de reações cutâneas até então desconhecidas ou inusitadas e diferentes daquelas vivenciadas com a quimioterapia convencional.3
Dentre esses fármacos modernos, peculiarmente as terapias‐alvo, destacam‐se as medicações direcionadas ao receptor do fator de crescimento epidérmico (EGFR). Esse receptor é expresso em diversos tumores sólidos e também é identificado nos queratinócitos presentes na epiderme cutânea, nas glândulas apêndices e no endotélio dos capilares da derme.3 Desse modo, a terapia de inibição de EGFR interfere nas vias de sinalização da epiderme e apêndices cutâneos. Como consequência, torna‐se lógico que uma das principais toxicidades desses inibidores esteja concentrada no tegumento cutâneo.
Atualmente, os inibidores do receptor do fator de crescimento epidérmico (EGFRis) são usados no tratamento de muitas neoplasias malignas, como cabeça e pescoço, pulmão, colorretal, próstata, mama, ovário, estômago e pâncreas.4 Os EGFRis podem ser anticorpos monoclonais para EGFR (cetuximabe e panitumumabe), inibidores de tirosina quinase de moléculas pequenas específicas de EGFR (erlotinibe e gefitinibe), inibidores duplos de quinase de EGFR e HER2 (lapatinibe, neratanibe e afatinibe), inibidores do receptor erbB (canertinibe) e outros inibidores de multiquinase menos específicos (vandetanibe).
Uma vez que esses agentes terapêuticos são amplamente utilizados e cada vez mais prescritos, é importante adquirir conhecimento sobre os mecanismos fisiopatológicos das toxicidades de pele, cabelo, unhas e mucosas, bem como seus fatores de risco para o desenvolvimento de reações. Ao reconhecer as suscetibilidades clínicas individuais, espera‐se ser possível antecipar a otimização do manejo terapêutico.
Em pacientes sob tratamento com EGFRis, a reação cutânea mais incidente é a erupção acneiforme. O presente artigo apresenta e discute os aspectos clínicos, os principais fatores de risco para essa toxicidade e aborda sinteticamente outros contextos cutâneos relacionados.5
EGFRi e erupção acneiformeO EGFR é expresso em uma variedade de tecidos normais da pele, incluindo células basais da epiderme, glândulas sebáceas, células da bainha radicular externa, glândulas écrinas e células do músculo liso vascular.6 A maioria dos agentes direcionados ao EGFR produz um espectro semelhante de toxicidades dermatológicas.4,7
A estimulação de EGFR regula o crescimento epidérmico e inibe a apoptose de queratinócitos. Os EGFRs também afetam a formação de glândulas sudoríparas e sebáceas, bem como inibem o crescimento do cabelo e participam da angiogênese.4 A inibição da atividade do EGFR tem comprometimento notável na homeostase epidérmica, resultando em afinamento pronunciado da epiderme, incluindo o estrato córneo. Ademais, leva à redução da função protetora da pele em decorrência do aumento da permeabilidade, aumentando o risco de infecções bacterianas. A liberação de citocinas e a ativação de células envolvidas no processo inflamatório são responsáveis pela suscetibilidade à toxicidade cutânea quando se utiliza um bloqueador de EGFR.4,8 O mecanismo exato que leva à toxicidade cutânea durante o tratamento com EGFRi não é bem conhecido, mas sem dúvida é resultado de modificações genéticas dos sinais associados à sua ativação. Sabe‐se que há interferência na via RAS/RAF/MEK/ERK, que afeta a regulação do ciclo celular, incluindo proliferação e diferenciação de células epidérmicas.4
A erupção papulopustulosa é a toxicidade cutânea mais frequentemente relatada após o uso de um EGFRi. A incidência geral varia de 60% a 80%,9 chegando a 90% dos pacientes tratados com cetuximabe e panitumumabe.10
A erupção pode ser monomórfica ou multiforme e afeta principalmente áreas seborreicas, como a face, o couro cabeludo e a parte superior do tórax. Na literatura, geralmente é descrita como erupção acneiforme, mas, diferentemente da acne vulgar, não são encontrados comedões ou cistos purulentos. Assim, o tratamento específico para acne vulgar não é adequado.4,8,11,12
Em mais de 75% dos pacientes, as lesões cutâneas anteriores surgem nas primeiras duas semanas de tratamento. Eritema e edema geralmente aparecem primeiro, acompanhados de distúrbios sensoriais. Logo após, entre a segunda e a quarta semana, ocorrem foliculite e/ou lesões pustulosas com prurido. O desaparecimento completo é observado aproximadamente de um a dois meses após a suspensão do fármaco,4,8,11,12 e pode causar hiperpigmentação pós‐inflamatória.4,8,11 Dor e prurido13 são sintomas comuns, e as crises podem ser induzidas pela medicação em cada administração.14,15
Classificação com graduações das erupções acneiformesAs reações adversas cutâneas podem ser classificadas de acordo com algumas escalas. Entre elas, o sistema NCI CTCAE v5.0 (Common Terminology Criteria for Adverse Events versão 5.0. [http://www.cancer.gov].) classifica a gravidade da erupção de acordo com algumas variantes: manifestação física, impacto psicossocial, efeito nas atividades de vida diária (AVD) e necessidade de antibioticoterapia intravenosa. O cálculo da área de superfície corporal (ASC) atingida, que utiliza a “regra dos 9”, pode levar à confusão, pois reações graves que afetam uma pequena área do corpo podem ser classificadas em grau mais baixo.4,5,16,17
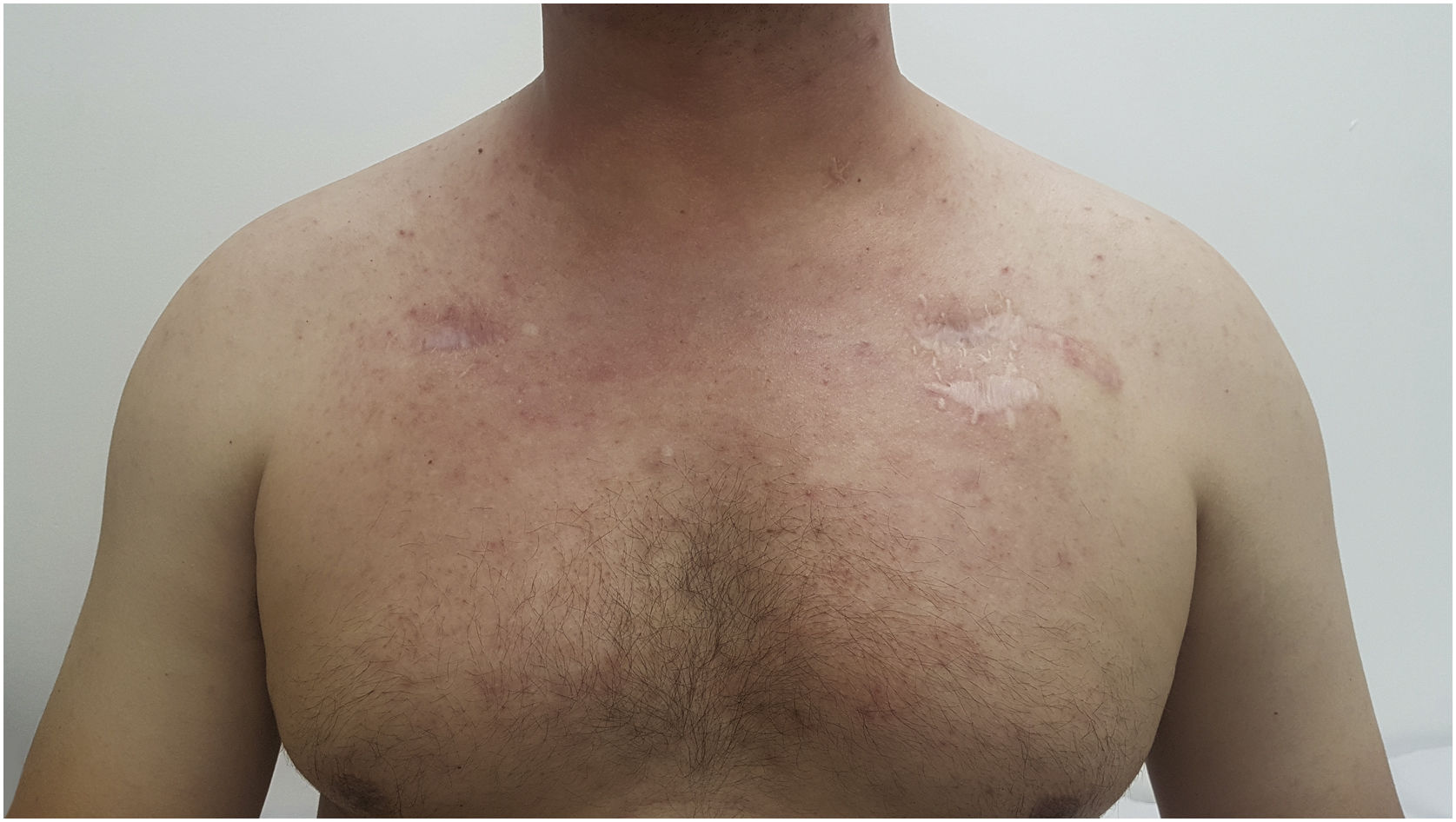
Grau 1 – Pápulas e/ou pústulas cobrindo<10% da ASC, que podem ou não estar associadas a sintomas de prurido ou sensibilidade (fig. 1).
Grau 2 – Pápulas e/ou pústulas cobrindo 10%‐30% de ASC, que podem ou não estar associadas a sintomas de prurido ou sensibilidade; associados ao impacto psicossocial; limitação das AVD; pápulas e/ou pústulas cobrindo> 30% ASC com ou sem sintomas leves.
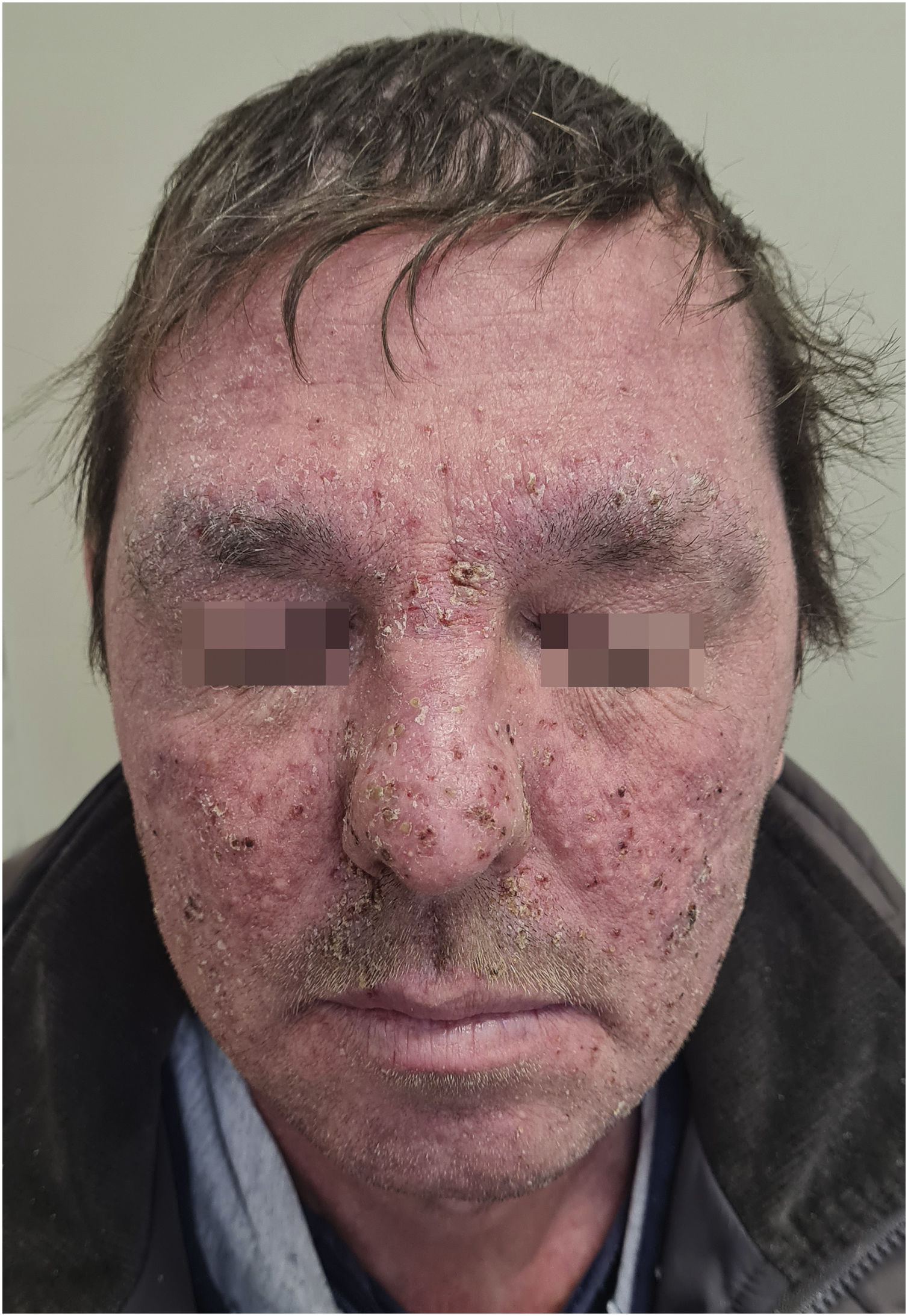
Grau 3 – Pápulas e/ou pústulas cobrindo> 30% da ASC com sintomas moderados ou graves; limitar o autocuidado AVD; associada à superinfecção local com antibióticos orais indicados (fig. 2).
Grau 4 – Consequências com risco de vida; pápulas e/ou pústulas cobrindo qualquer % de ASC, que podem ou não estar associadas a sintomas de prurido ou sensibilidade e estão associadas a superinfecção extensa com antibióticos intravenosos indicados.
Grau 5 – Morte.
Uma segunda graduação é o MESTT (the Multinational Association of Supportive Care in Cancer – MASCC; EGFR Inhibitor Skin Toxicity Tool), um sistema complexo que leva em consideração os dados relatados pelo paciente, como alteração na qualidade de vida, alterações no tempo e na dose do tratamento em função do efeito adverso.16
Há também o sistema de três partes proposto por Wollenberg et al. O Induced Rash Severity Score (IRSS, ou WoMoScore) é um sistema de pontuação específico introduzido, em 2008,18 que combina a gravidade de cinco características de erupção cutânea EGFRi (cor do eritema, distribuição do eritema, papulação, pustulação e descamação/crostas), associando a pontuação com base na extensão da área facial afetada e na área corporal total envolvida. A pontuação final varia de 0 (nenhuma doença de pele), 1 a 20 (leve), entre 20 e 40 (moderado), até pontuar acima de 40 pontos em casos graves.16
A gravidade se baseia no envolvimento da ASC e no grau de limitação nas AVD.7 Erupção cutânea grave ocorre em 10% dos pacientes. Quando graves, as toxicidades dermatológicas podem levar à modificação ou descontinuação da dose em 36% e 72% pelos profissionais de saúde, respectivamente. Embora o perfil de efeitos colaterais possa ser principalmente dermatológico, as toxicidades resultam em desconforto físico e emocional significante; portanto, é fundamental maximizar as medidas de suporte.19
Histopatologicamente, as análises realizadas em pacientes com erupção acneiforme demonstraram infiltrado de células inflamatórias superficiais ao redor do infundíbulo folicular hiperceratótico ou ectásico ou uma foliculite neutrofílica supurativa com ruptura do revestimento epitelial.15,19 Os queratinócitos basais e os folículos pilosos exibem níveis superiores de p53.15 As pústulas são estéreis, apresentam culturas negativas para bactérias, fungos, leveduras e ausência de Demodex folliculorum.14
Fatores de risco para erupção acneiformeOs relevantes fatores de risco para erupções acneiformes estão mencionados na tabela 1 e serão discutidos separadamente, a seguir.
Fatores de risco para erupção acneiforme relacionada ao uso de EGFRi
| Relacionados ao tratamento |
| Tipo de medicação, dose e duração |
| Radiação ionizante |
| Relacionados ao tumor |
| Relacionados ao paciente |
| Fototipo |
| Idade |
| Sexo |
| Raça |
| Secreção sebácea |
| Presença de Demodex |
| Sistema imune |
| Infecção bacteriana |
| Fatores ambientais |
| Radiação UV |
| Sensibilizantes |
| Níveis de CPK |
| Biomarcadores e polimorfismos genéticos |
A existência de uma erupção cutânea depende principalmente do tipo e da dose do medicamento utilizado. A literatura sugere que a frequência19 e a gravidade da erupção dependem do tipo de medicamento utilizado.10 Anticorpos monoclonais causam reações com mais frequência4,19 do que inibidores de tirosina quinase, por exemplo.4
Owczarek et al. relataram a ocorrência de erupção cutânea em 88%‐90% dos pacientes usando cetuximabe, 100% dos pacientes usando panitumumabe, 43%‐54% dos usuários de gefitinibe, 75% dos usuários de erlotinibe e 13%‐47% dos usuários de lapatinibe.4
Algumas evidências apontam que a incidência e gravidade/intensidade da reação é dose‐dependente, bem como a duração do quadro cutâneo.9,20 Segundo Macdonald, o aumento da dose e o reinício da medicação podem acentuar as crises.7
Radiação ionizanteFoi documentada a sensibilidade das células tratadas com EGFRi à radiação ionizante. O tratamento com EGFRi antes da radioterapia aumenta a sensibilidade das células tumorais à radiação. Curiosamente, áreas de pele previamente irradiadas podem não desenvolver erupção cutânea durante o uso de EGFRi. Alterações crônicas induzidas pela radiação, como ausência de folículos e glândulas sebáceas, decorrentes da indução de apoptose e fibrose pela radioterapia, explicam esse achado.21
Bossi et al. avaliaram seis pacientes com erupção cutânea acneiforme induzida por cetuximabe e observaram que as áreas previamente irradiadas estavam livres de lesões cutâneas.22
Outros pesquisadores também argumentam que os locais tratados com radiação prévia são normalmente poupados durante uma erupção acneiforme.7,14 Yalçin relatou o caso de um paciente com câncer de pulmão de células não pequenas (CPCNP) em uso de erlotinibe que desenvolveu erupção acneiforme típica poupando a área da radioterapia anterior. Foi realizada biópsia da área afetada e da área poupada (anteriormente irradiada). No primeiro, o exame histológico revelou foliculite supurativa destruindo o epitélio folicular e estruturas anexiais. No segundo, não havia estrutura folicular. A dose estimada para o envolvimento do folículo piloso na radioterapia é de cerca de 40Gy (o paciente recebeu 45Gy no total na neoplasia, enquanto a pele normal recebeu 18,5Gy).23 Conclui‐se que o paciente não apresentou erupção acneiforme em área de irradiação anterior decorrente da perda de folículo, o que é bastante semelhante à patogênese da erupção acneiforme em pacientes em uso de EGFRi.
Em contraste, Tejwani realizou uma metanálise para avaliar a erupção acneiforme em 1.238 pacientes tratados com EGFRi com ou sem radioterapia.24 Os resultados revelam maior incidência de reações cutâneas em pacientes que receberam terapia combinada (EGFRi e radiação). Com relação aos medicamentos, a maior incidência foi observada em pacientes que receberam terapia com erlotinibe mais cisplatina, e a menor incidência em pacientes que estavam recebendo cetuximabe com docetaxel/cisplatina.
Wu propôs que uma “toxicidade de campo” significante pode ocorrer quando os EGFris são usados concomitantemente com a radioterapia, pois a radiação causa regulação positiva do EGFR na pele normal.17 Um estudo randomizado de fase 3, que comparou radioterapia com ou sem cetuximabe em pacientes com câncer escamoso de cabeça e pescoço avançado locorregionalmente, mostrou uma extensão da duração da radiodermatite na parte ou grupo do estudo que utilizou cetuximabe.15
Tipo de câncerSu publicou uma revisão sistemática e metanálise que quantificou a incidência geral e o risco de erupção cutânea grave em pacientes com diferentes tipos de tumores sólidos tratados com cetuximabe. Foram analisados 2.037 pacientes; a incidência global de erupção acneiforme foi de 81,6%, dos quais 6,5% de alto grau. Embora não estatisticamente significante, uma incidência elevada de erupção acneiforme foi observada em pacientes com câncer colorretal (CCR) em comparação com não CCR (6,8% vs. 5,6%; RR=1,2; p=0,402). Em outras palavras, o estudo indicou que o risco de desenvolver erupção cutânea de alto grau varia de acordo com o tipo de tumor. Isso é possível pela diversidade da neoplasia e suas diferenças biológicas (como a secreção de fatores de crescimento), que podem afetar a suscetibilidade à toxicidade da pele.25 Portanto, o grau de erupção pode refletir interações não apenas entre o tecido da pele e o medicamento, mas também entre o tecido da pele e o tumor.26
FototipoVários autores relataram que pacientes com fototipo baixo (pele clara) são mais propensos ao desenvolvimento de erupção por EGFRi, além de apresentarem reações mais intensas.10,14,27 Esse dado é descrito por Lacouture (2011) apenas com o uso de erlotinibe em fototipo baixo,19 contrastando com outras evidências que não encontraram relação entre o fototipo do paciente e a gravidade da reação.20,26
Idade e sexoOs dados sugerem que pacientes mais jovens e do sexo masculino correm maior risco de erupção cutânea.27,28 Sabe‐se também que, com a idade avançada, os fibroblastos cultivados expressam menos receptores do fator de crescimento epidérmico e, assim, os EGFRis podem ter menos alvos cutâneos em pacientes mais velhos e, portanto, menor toxicidade cutânea.28
Jatoi investigou preditores clínicos de erupção cutânea grave em 933 pacientes tratados com cetuximabe como quimioterapia adjuvante para câncer de cólon. Cinquenta pacientes (5%) desenvolveram erupção cutânea grave; mais homens do que mulheres desenvolveram essa erupção: 34 (7%) vs. 16 (3%). Maior número de pacientes jovens (< 70 anos de idade) também desenvolveu erupção cutânea: 48 (6%) vs. 2 (1%) – 70 anos e do sexo masculino.19,28 Conforme sustentado por Le‐Rademacher et al., o sexo masculino é duas vezes mais propenso a desenvolver erupção cutânea de grau 3 ou superior induzida por EGFRi do que as mulheres.29
Além disso, os hormônios são outro fator que pode estar envolvido no desenvolvimento da erupção relacionada ao gênero. Andrógenos e estrógenos parecem interagir com o EGFR.28,29 Um artigo descreveu a importância dos andrógenos e mostrou que os genes dos receptores androgênicos relacionados são superexpressos na pele de pacientes com reação EGFRi.29
A diversidade racial não teve relação com o risco de erupção cutânea.9,28 Outros manuscritos não encontraram resultados suficientes para correlacionar idade, sexo ou outra característica individual com suscetibilidade à reação cutânea.9
Deve‐se mencionar que a pele seca, comum em pacientes mais velhos, pode levar ao desenvolvimento da erupção cutânea. Dentro dessa hipótese, pacientes mais velhos com histórico de dermatite atópica e pessoas que fizeram terapia prévia com agentes citotóxicos teriam maior risco de desenvolver essa erupção.30
Secreção sebáceaOs achados da literatura são conflitantes sobre esse tema. Para alguns autores, o aumento da produção de sebo não está associado a risco aumentado de toxicidade cutânea. No entanto, atenção é necessária, pois a predisposição prévia para foliculite e acne pode estar associada a eventos adversos cutâneos durante o uso de EGFRis.7
Nakahara realizou um estudo para determinar a relação entre os níveis de sebo da pele e a erupção acneiforme medindo os níveis de sebo antes e após o tratamento com EGFRi. Oito pacientes com CPCNP que usaram gefitinibe ou erlotinibe foram avaliados quanto aos níveis de sebo na face, tórax e costas antes e após a terapia. Os pacientes que já apresentavam níveis elevados de sebo ou que tiveram alteração maior em relação à linha de base pré‐tratamento desenvolveram erupção cutânea acneiforme. Esse resultado pode revelar que a atividade da glândula sebácea pode estar envolvida no mecanismo subjacente às origens da erupção acneiforme em pacientes tratados com esses medicamentos.6
Kikuchi et al. procuraram elucidar parâmetros úteis e altamente sensíveis para detecção precoce de alterações cutâneas por EGFRi. Perda de água transepidérmica, hidratação da superfície da pele, níveis lipídicos da superfície da pele e índice de eritema/melanina foram medidos em série por duas semanas em 19 pacientes tratados com afatinibe/erlotinibe (EGFR‐TKI) e por oito semanas em 20 pacientes tratados com cetuximabe. Os níveis de perda hídrica transepidérmica na região bucinadora em pacientes que desenvolveram erupção acneiforme grau 2 ou mais foram elevados dentro de sete dias após o início da terapia com afatinibe/erlotinibe (AfE) em comparação com aqueles antes da terapia, bem como em pacientes com grau 1 ou menos. Em pacientes tratados com cetuximabe, a hidratação da superfície da pele na região bucinadora em pacientes de toxicidade grau 2 ou mais foi significantemente diminuída em comparação a pacientes com reações de grau 1 em duas e seis semanas. Os níveis basais de lipídios da superfície da pele e o índice de eritema da região bucinadora de pacientes com AfE ≥ Gr2 foram significantemente maiores do que aqueles com AfE ≤ Gr1. Em conclusão, a avaliação instrumental verificou rápidas alterações inflamatórias da pele pelo EGFRi e apontou pele oleosa como risco para AfE grave.31
Outros estudos foram feitos e, em um no qual 10 pacientes com carcinoma de células renais foram tratados com cetuximabe, nenhuma conexão aparente foi encontrada entre a gravidade da reação e o tipo de pele ou história de acne.32
Segundo Sipples, ao utilizar TKI, a reação é mais intensa em pacientes com pele oleosa e com tendência a acne.12 Outros autores não correlacionaram tipo de pele, história de acne ou rosácea com o aparecimento e gravidade da reação ao uso de EGFRi.20
Demodex folliculorumSobre o Demodex, as evidências encontradas são contraditórias. Gerber analisou a densidade de Demodex folliculorum, por biópsia, em lesões de 19 pacientes apresentando erupções cutâneas induzidas por EGFRi. Os dados coletados mostraram que os pacientes com terapia com EGFRi tiveram maior suscetibilidade à colonização ou infecção pelo ácaro.33 No entanto, outros estudos não detectaram o ácaro na biópsia de pele de 10 pacientes com erupção acneiforme por cetuximabe, e concluíram que a erupção não está relacionada com a presença de Demodex.34
Sistema imune do pacienteUm artigo observou que pacientes com melhor desempenho e melhor sistema imunológico têm reações mais intensas.10
Infecção bacterianaAlguns autores argumentaram que o EGFRi não apenas induz inflamação, mas também suprime a síntese de peptídios antimicrobianos e proteínas de barreira da pele em queratinócitos – predispondo a infecções bacterianas.35 Artigos interessantes encontraram infecções bacterianas em locais de toxicidade cutânea em aproximadamente um terço dos pacientes com câncer tratados com inibidores de EGFR, e a maioria desses pacientes também teve hemocultura positiva para Staphylococcus aureus.8
Tohyama et al. avaliaram a incidência de infecção bacteriana e os resultados do tratamento de pacientes com erupção papulopustular em estágio avançado. A cultura bacteriana foi realizada em 51 casos, 50 dos quais produziram resultados positivos. Após antibioticoterapia tópica e/ou oral sem uso de corticoide tópico, a erupção papulopustulosa apresentou melhora rápida. No entanto, o uso de combinação de antibióticos tópicos e corticosteroides prolongou o período de recuperação. Em conclusão, a foliculite que se desenvolve mais de quatro semanas após o início do tratamento com um inibidor de EGFR é tipicamente causada por infecção estafilocócica. A cultura bacteriana é necessária pela resistência a antibióticos em níveis elevados. É importante diferenciar as pústulas estéreis (mais comuns na fase inicial da erupção) das pústulas infecciosas (mais comuns na fase tardia), pois o tratamento dessas condições é divergente, e o uso incorreto de corticosteroides tópicos pode prolongar ou transformar erupções pustulosas recorrentes infecciosas.35
Já se sabe que a erupção acneiforme ocorre pela inibição do EGFR nos queratinócitos, mas a sobreposição de uma infecção bacteriana pode desempenhar papel importante.36 Lacouture relatou infecção bacteriana em lesões cutâneas em um de três pacientes tratados com EGFRi.8,21Staphylococcus aureus apareceu na maioria, algo encontrado nos dados de prevalência desses microrganismos nas erupções de EGFRi. Alguns autores indicam a profilaxia antibiótica como fator protetor contra a geração de erupções acneiformes em pacientes tratados com EGFRi.17,37
Radiação ultravioletaA inibição de EGFR fortalece a apoptose de queratinócitos induzida por radiação ultravioleta (UV). Em condições fisiológicas, a radiação UV danifica o DNA dos queratinócitos, afetando a formação de radicais livres. Consequentemente, ocorre aumento da expressão de EGFR e dos sinais proliferativos. Os distúrbios desse processo podem causar lesões ou exacerbações pela exposição à radiação UV. Nos folículos capilares, esse processo resulta em maior expressão de genes que estimulam processos inflamatórios, apoptose e bloqueio de ductos, levando à ruptura.4,21 Assim, a radiação UV, combinada com a inibição do EGFR, pode causar estresse oxidativo aditivo e resposta inflamatória nos queratinócitos, contribuindo para a erupção da patogênese.
Foi realizado um estudo de prevenção no qual 54 pacientes foram submetidos a EGFR‐TKIs ou anticorpos monoclonais anti‐EGFR foram testados para uso de protetor solar. A incidência de erupção cutânea em oito semanas foi de 78% e 80% com protetor solar e placebo, respectivamente (p=1,00). Assim, o protetor solar pode ser eficaz se combinado com outros métodos.3
Embora a radiação UV possa exacerbar as reações cutâneas, estudos não mostraram que a fotoproteção impeça seu desenvolvimento.4 O uso de protetor solar em um estudo controlado por placebo não preveniu ou atenuou a erupção cutânea induzida pelo EGFRi.7 Outros quatro autores também apontaram a exposição solar como desencadeante e/ou agravante da erupção.7,10,14
SensibilizantesA pele desses pacientes é anormalmente sensível a irritantes e alérgenos. A inibição do EGFR pode resultar em proliferação, migração e diferenciação errôneas de células‐alvo e leva à ruptura da integridade cutânea com o recrutamento de células inflamatórias.38
Vários cuidados com a pele são recomendados, como limpeza com óleo de banho em água fria ou morna, uso de emoliente sem álcool para reter a umidade e fotoproteção. Em caso de exposição ao sol, recomenda‐se o uso de produtos com alto fator de proteção solar. O tratamento com corticosteroides não é recomendado, pois essas medicações podem induzir a rosácea. Embora eficaz para erupções acneiformes, o peróxido de benzoíla é frequentemente muito irritante. Os retinoides tópicos também não são recomendados, pois o mecanismo do anti‐EGFR e da erupção da acne vulgar são diferentes e também podem agravar a irritação da pele.11
Waris et al. relataram o caso de um homem afro‐americano de 61 anos com câncer de orofaringe localmente avançado que foi tratado com cetuximabe e radiação. Ele desenvolveu erupção cutânea repentina após o quinto ciclo de cetuximabe, depois de usar medicamentos para cuidados com a pele de venda livre. Agentes tópicos devem ser usados com extrema cautela em pacientes em tratamento com anti‐EGFR. Medicamentos tópicos de venda livre para acne e pele seca podem mudar repentinamente a forma de acne leve para erupção cutânea em toxicidade cutânea grave associada a descamação e esfoliação graves.38
Níveis de creatina quinaseO nível sérico elevado de creatina quinase foi associado à gravidade da erupção cutânea e pode ter o potencial de prever quais pacientes desenvolverão lesões cutâneas.38 A creatina (Cr) e a creatina quinase (CK) desempenham papel importante no tecido mole humano. No nível celular, a CK catalisa a fosforilação reversível entre ATP e Cr para produzir fosfocreatina (PCr) e ADP, atuando como tampão de energia citosólica. Durante a cicatrização de feridas, os queratinócitos super expressam CK‐BB para lidar com o aumento do metabolismo causado pela biossíntese de nucleotídios. A hipótese de que a toxicidade cutânea causada por novos agentes anticancerígenos está associada ao estresse de queratinócitos, levando ao aumento dos níveis de CK na pele e possivelmente nos níveis de CK no plasma circulante, foi levantada. Garcia et al. investigaram a associação entre erupção cutânea e níveis plasmáticos de CK e concluíram que a elevação da CK plasmática está associada ao desenvolvimento de erupção cutânea causada por EGFRi.39
Biomarcadores e polimorfismos genéticosAlguns biomarcadores e polimorfismos genéticos estudados como possíveis marcadores de risco para o desenvolvimento de erupção acneiforme ao usar EGFRi estão citados na tabela 2 e discutidos a seguir.
Biomarcadores e mutações preditivas de gravidade de toxicidade relacionada aos anti‐EGFR
| Referência | Biomarcador / polimorfismo genético | Fator de risco para toxicidade |
|---|---|---|
| Vallböhmer et al. (2005) | Ciclo‐oxigenase‐2 | Baixa expressão |
| Tan et al. (2008) | pAkt | Baixa expressão |
| Graziano et al. (2008) | Repetição EGFR intron 1 (CA) | Baixa expressão |
| Parmar et al. (2013) | PIK3CA | Mutação |
| Jaka et al. (2014) | SNP‐216 | Mutação |
| Paul et al. (2014) | CXCL8 (IL‐8) | Baixos níveis séricos |
| Takahashi et al. (2014, 2015) | Epiregulin (EREG) Amphiregulin (AREG) | Baixos níveis séricos |
| HGF | ||
| Hichert et al. (2017) | HGF | Altos níveis séricos |
| Froelich et al. (2018) | SNP‐ rs849142 | Mutação |
| Labadie et al. (2021) | RARA | Mutação |
Kubo revisou estudos anteriores e encontrou várias associações, descritas na tabela 2, juntamente com outras descobertas sobre biomarcadores preditivos da gravidade da toxicidade do anti‐EGFR no câncer colorretal.37
Hichert et al. também são citados. Seu artigo mostrou que pacientes com níveis séricos elevados de fator de crescimento de hepatócitos (HGF) desenvolveram erupção acneiforme menos grave.40
No estudo de Froelich et al., o polimorfismo de nucleotídio único (SNP) rs849142 foi significantemente associado à erupção acneiforme em pacientes tratados com EGFR.41
Tan relatou que pacientes com baixa atividade de RAC‐α serina/treonina‐proteína quinase (pAkt) fosforilada são mais propensos a desenvolver toxicidade acneiforme da pele ao usar EGFRi. A adição de um inibidor de MAPK à terapia desses pacientes pode ajudar a controlar as erupções cutâneas.42
Paul et al. mostraram que o baixo nível sérico do ligante 8 do motivo C‐X‐C (CXCL8) – um potente fator angiogênico – foi associado a maior gravidade da erupção acneiforme.43
Além disso, Jaka et al. sugeriram que o polimorfismo SNP‐216 do gene EGFR pode ser útil para antecipar a resposta ao tratamento e o início de erupção acneiforme grave.44 Duas variantes genéticas no gene do receptor de ácido alfa retinoico (RARA) foram significantemente associadas à toxicidade crítica da pele (incluindo pacientes com descamação e erupção cutânea acneiforme). Esse achado pode representar um potencial alvo terapêutico para tratamento profilático ou reativo em pacientes submetidos a essa terapia.45
Parmar et al. descreveram mais de um polimorfismo genético correlacionado com toxicidades cutâneas, mas não especificaram a relação com erupção acneiforme, apenas sobre toxicidade geral.46
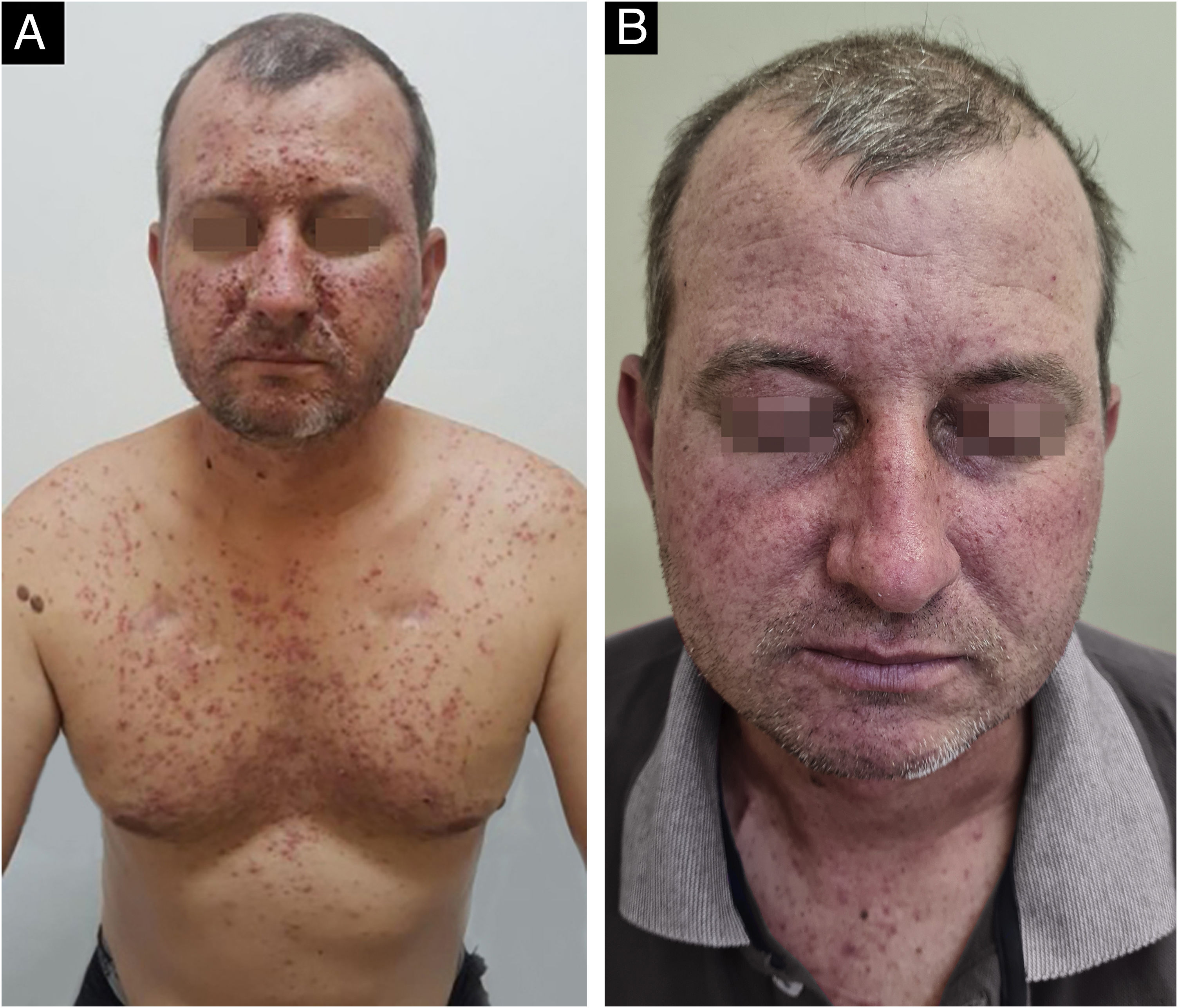
Tratamento e profilaxiaUm grupo multinacional e interdisciplinar de especialistas em cuidados oncológicos de suporte revisou estudos pertinentes usando critérios estabelecidos para desenvolver recomendações para toxicidades dermatológicas associadas a inibidores de EGFR. Com base na maior frequência de erupções cutâneas em pacientes tratados com inibidores de EGFR e apresentação consistente nas primeiras duas a quatro semanas de terapia, o manejo profilático é recomendado, a menos que haja contraindicações baseadas em fatores do paciente e/ou do profissional de saúde. Hidrocortisona 1% combinada com hidratante, protetor solar e doxiciclina 100 mg, duas vezes/dia é recomendada nas primeiras seis semanas, com base em dados randomizados. Outro estudo descobriu que a minociclina profilática 100 mg/dia é agente eficaz na redução do número de lesões durante as primeiras oito semanas. A doxiciclina parece ter perfil de segurança mais favorável, especialmente em pacientes com disfunção renal (fig. 3). Enquanto isso, a minociclina é menos fotossensibilizante e, portanto, preferível em locais geográficos ou sazonais com alto índice de UV.19
O uso de corticosteroides tópicos de média a alta potência é recomendado com base em estudos que mostram a liberação in vitro de quimiocinas inflamatórias após terapia com EGFRis. A vitamina K3 (menadiona) está sendo investigada, mas os relatos publicados sobre a vitamina K1 são baseados em estudos sem grupos controle. Da mesma maneira, estudos que investigaram a isotretinoína para o tratamento de erupções cutâneas induzidas por EGFRis não incluíram grupos controles, mas relatos consistentes de isotretinoína em doses inferiores às usadas para acne suportam a recomendação de seu uso quando outras medidas falharam.19
Outras reaçõesAlém da erupção acneiforme, outras toxicidades cutâneas podem ocorrer com o uso de EGFRi; a seguir elas são discutidas, sinteticamente.
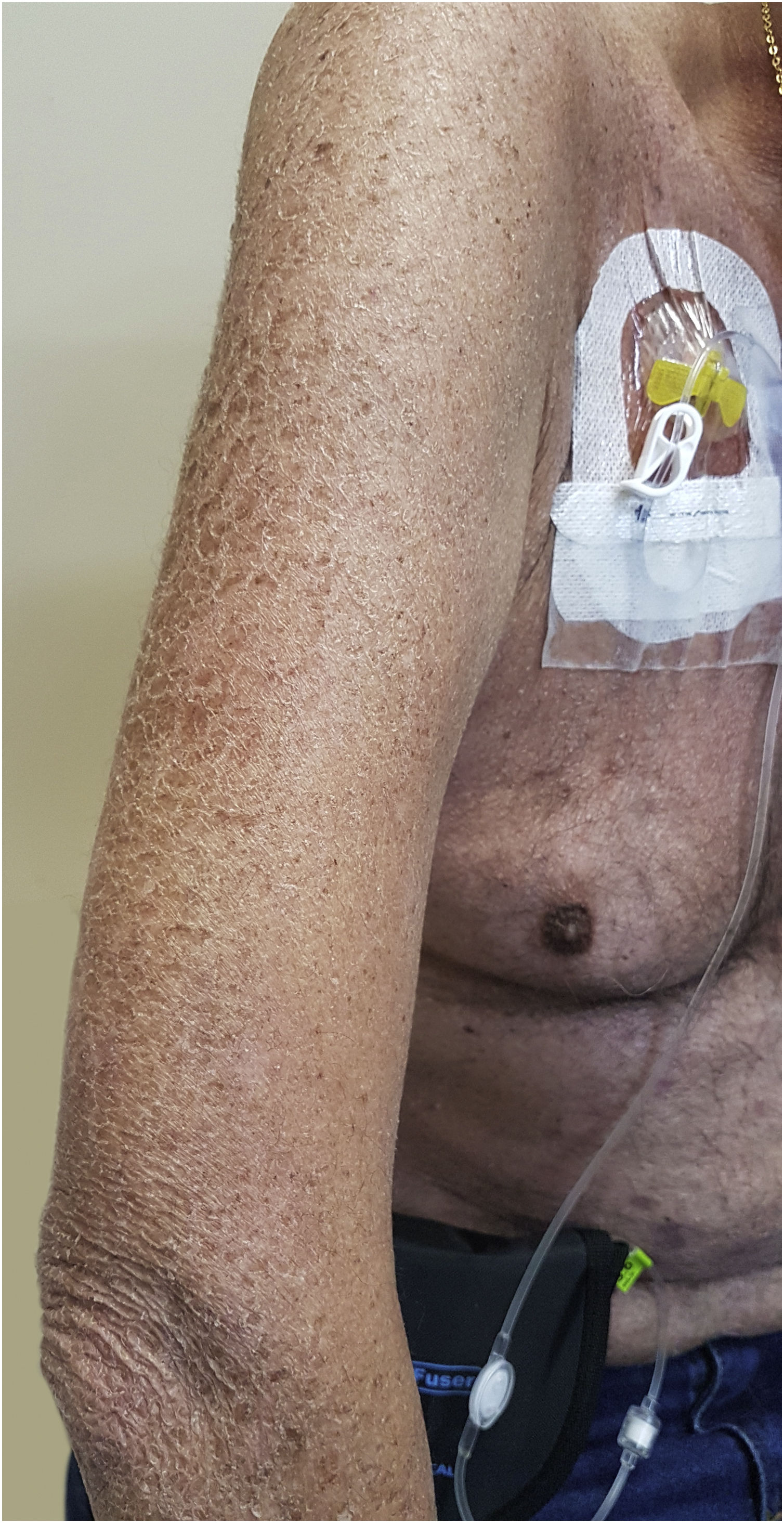
Xerose e pruridoA fisiopatogenia da xerose associada às terapias‐alvo, em especial os EGFRis, parece estar relacionada ao processo de diferenciação da epiderme e da homeostase. Esses medicamentos levam a aumento da inflamação, apoptose de queratinócitos, sensibilidade à radiação UV e diferenciação alterada, o que facilitaria o ressecamento cutâneo47 (fig. 4), que parece ter comportamento progressivo em direção às extremidades, piorando com o tempo do tratamento, com pico em torno de um a três meses depois do início da medicação. Pelo aumento da fragilidade cutânea, pode ocorrer prurido, formação de fissuras e dor no local, o que pode facilitar as infecções secundárias.7 Estudos concluíram que a incidência da xerose foi maior em algumas classes de fármacos, dentre as quais os EGFRis.47 Outros autores relatam que xerose cutânea está presente em até 35% dos pacientes que recebem terapia com EGFRi.7 Já Valentine et al. concordam que os EGFRis tiveram as maiores taxas de xerose, mas citam em especial o panitumumabe, com incidência total de 47% de xerose de todos os graus.47
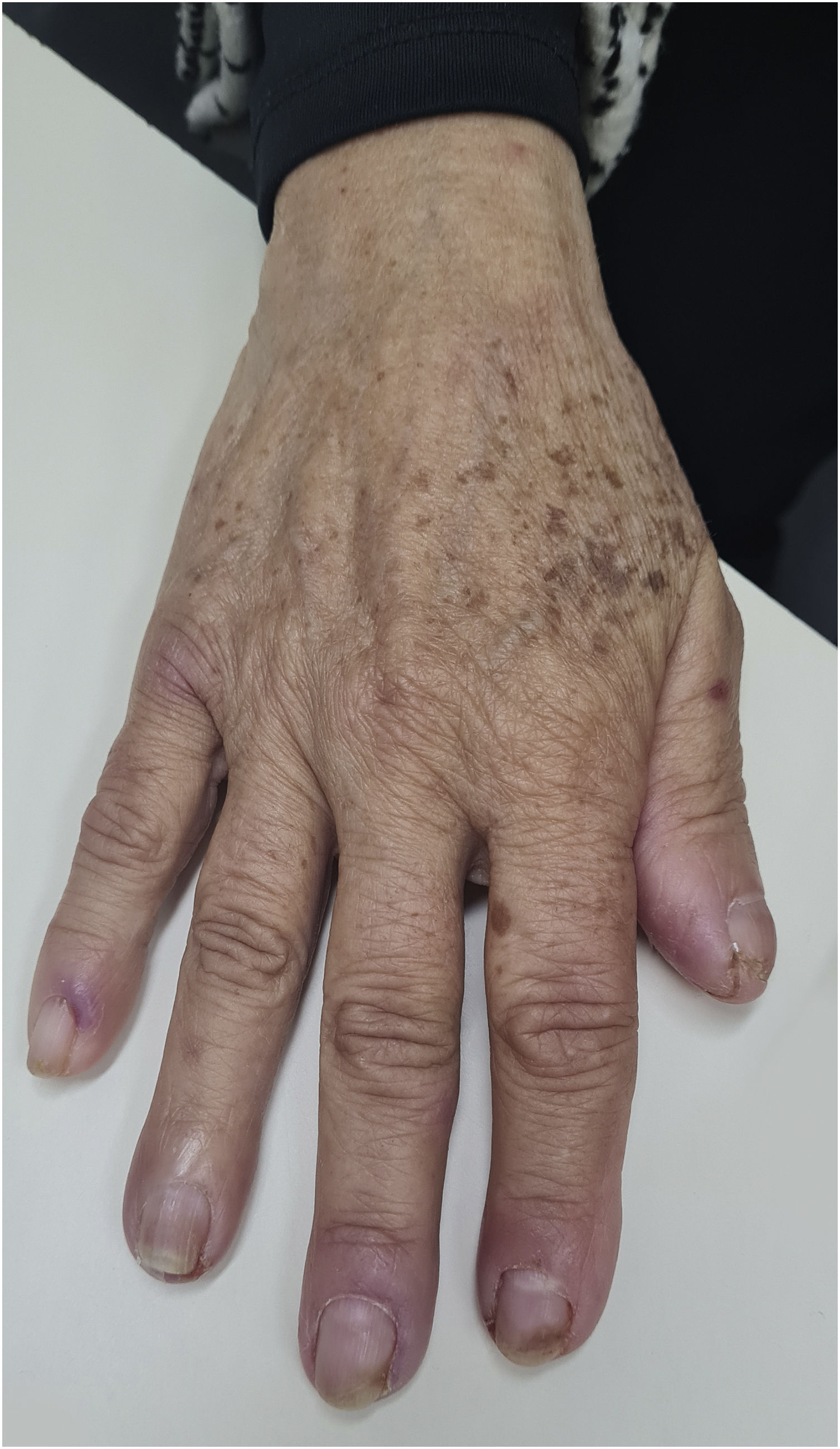
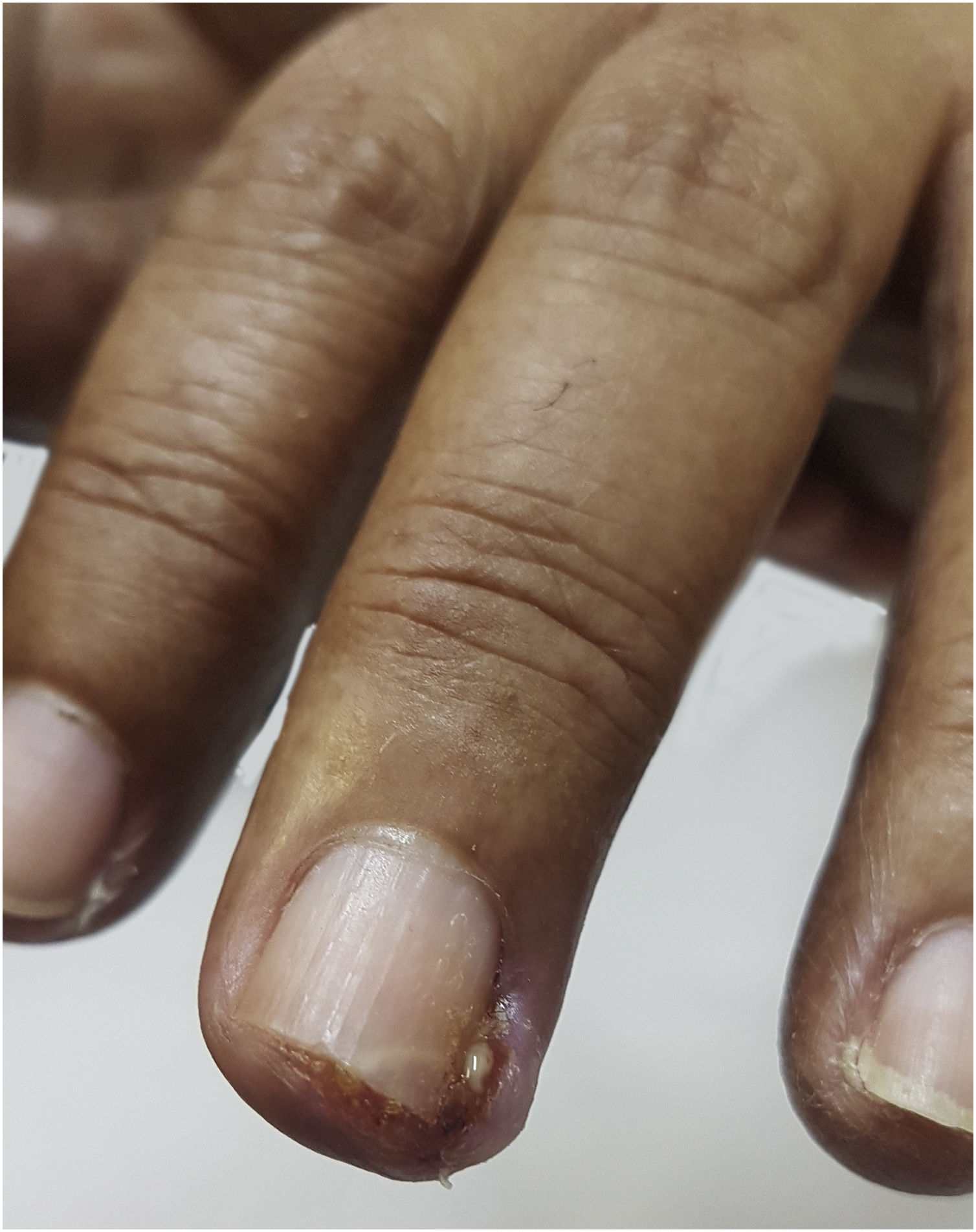
ParoníquiaO mecanismo fisiopatológico que leva ao desenvolvimento dessas lesões periungueais ainda é desconhecido. Acredita‐se que as lesões resultem da inibição do EGFR e vias reguladoras da proliferação dos queratinócitos suprabasais, o que levaria a alterações na diferenciação e migração de células epidérmicas associada à inibição da proliferação de queratinócitos e diminuição da sobrevivência celular por meio da indução de apoptose. Em função disso, a epiderme periungueal se tornaria mais afinada, podendo estar mais suscetível ao trauma e assim a ocasionar reação semelhante de inflamação secundária à presença de corpo estranho. Estuda‐se também a possibilidade da participação do metabolismo do retinoide intracelular, já que o uso de isotretinoína e acitretina oral levam ao desenvolvimento de lesões semelhantes.48 Ocorre em aproximadamente quatro a oito semanas após o início do tratamento, mas pode aparecer até seis meses após (fig. 5). Há na literatura a descrição do início dos sintomas entre a 4ª e a 8ª semanas após o início do tratamento com as terapias‐alvo. Portanto, podemos considerar o início dos efeitos tóxicos tardio quando comparados aos outros já citados.5 Em geral, envolve vários dedos e pode ocorrer formação de granulomas e abscessos periungueais. Os primeiros sinais são inflamação eritematosa dolorosa com edema e sensibilidade aumentada nas dobras ungueais laterais. Sangramento e saída de secreção do local também podem ocorrer. Com a evolução, pode haver formação de tecido de granulação friável nas dobras laterais da unha, como granulomas periungueais. Pode afetar qualquer dígito, mas os polegares e, especialmente, os hálux são os mais afetados, provavelmente por estarem mais suscetíveis a microtraumas repetidos.5 O granuloma piogênico é tumor vascular benigno e é considerado consequência da paroníquia. Sua elevada frequência nos pacientes em uso dessas medicações pode ser explicada por traumas repetidos e/ou inflamação dos tecidos periungueais e alta vascularização da unidade ungueal (fig. 6). Estudos sugerem a existência de grande quantidade de receptores do VEGF nessa localização, o que possibilitaria mais dessas reações nesses locais.49 Paroníquia e granulomas periungueais são relatados principalmente em resposta a EGFRis, com incidência próxima dos 17%, incluindo todos os graus de toxicidade.5,48,49
Em camundongos, a desregulação da via EGFR‐Ras‐Raf pode resultar em morfogênese anormal do folículo piloso. No entanto, não se sabe por que, paradoxalmente, os EGFRis resultam em alopecia do couro cabeludo, mas resultam em hirsutismo e tricomegalia de sobrancelhas e cílios.50 As alterações capilares geralmente se manifestam após dois meses de tratamento. A alopecia no couro cabeludo é tipicamente inflamatória, podendo ser cicatricial ou não cicatricial. No entanto, a melhora espontânea do crescimento do cabelo é observada após vários meses de terapia contínua com EGFRi. Alopecia difusa leve é relativamente frequente com EGFRis (p. ex., erlotinibe, afatinibe, cetuximabe, panitumumabe). Já alopecia cicatricial foi relatada em 5% dos pacientes tratados com cetuximabe, o que é citado na literatura como possível consequência de infecção bacteriana secundária do couro cabeludo.50 Paradoxalmente à alopecia no couro cabeludo e extremidades, pode ocorrer hirsutismo facial;17 a tricomegalia é um achado recente e está associada a até 30% dos pacientes em uso dessas medicações.5 Costumam acontecer nos cílios e ter início após 10 semanas do início do tratamento.50,51 Em recente artigo, Sartori DS et al. demonstraram por microscopia eletrônica de varredura alterações capilares (pili canaliculi) induzidas pelo panitumumabe.52
Alterações em mucosasAs complicações orais relatadas em pacientes tratados com EGFRi são infrequentes. A complicação oral mais comumente relatada é a mucosite.19 Além disso, conjuntivite foi relatada em 6%‐20% dos pacientes.5 A genitália está ocasionalmente envolvida com vulvovaginite seca (especialmente em mulheres pós‐menopausa) ou balanite.14 De maneira mais ampla, segundo Lacouture, cerca de 15% daqueles em uso de inibidores de TKI EGFR desenvolvem estomatite.5
ConclusãoOs EGFRis são uma importante modalidade terapêutica no tratamento de pacientes oncológicos. No entanto, apresentam toxicidade cutânea como uma de suas limitações – a erupção acneiforme é a mais prevalente delas. A revisão da literatura sobre os mecanismos que podem estar relacionados ao desenvolvimento da erupção acneiforme em pacientes em uso de EGFRi, mesmo com necessidade de mais estudos em relação ao tema, sugere algumas ligações. É importante que o dermatologista esteja atento a alguns fatores de risco para o desenvolvimento da lesão e, assim, proporcione tratamento precoce para o paciente e evite o abandono do tratamento oncológico com consequente piora do prognóstico.
Suporte financeiroNenhum.
Contribuição dos autoresJulia Kanaan Recuero: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Joana Roberta Fitz: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Andrea Abe Pereira: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Renan Rangel Bonamigo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Recuero JK, Fitz JR, Pereira AA, Bonamigo RR. EGFR inhibitors: clinical aspects, risk factors and biomarkers for acneiform eruptions and others mucosal and cutaneous effects. An Bras Dermatol. 2023;98:429–39.
Trabalho realizado no Departamento de Dermatologia, Irmandade Santa Casa de Misericórdia de Porto Alegre e Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, RS, Brasil.