A biopsia do linfonodo sentinela (LNS) em pacientes com melanoma tem papel importante no estadiamento, avaliação do prognóstico e definição do tratamento. Poucos estudos avaliaram seu papel no subtipo melanoma acral.
ObjetivoAvaliar os resultados da biopsia do LNS em 79 pacientes com melanoma acral tratados em um único centro oncológico e compará‐los com os dados descritos na literatura.
MétodosEntre janeiro de 2016 e dezembro de 2022, foram analisados todos os pacientes com melanoma acral submetidos à biopsia do LNS em um único instituto. Foram analisados os dados epidemiológicos, clínicos e histopatológicos. As curvas de sobrevida global (SG) e sobrevida livre de doença (SLD) foram estimadas utilizando o método de Kaplan‐Meier. As análises multivariadas foram conduzidas usando o modelo de regressão de Cox.
ResultadosDurante o período, foram analisados 79 casos. A média de idade foi de 60 anos, a mediana da espessura foi de 4,5mm e 67,1% apresentaram ulceração. O LNS foi positivo em 27 pacientes (34,2%). A SG e SLD estimadas foram de 67,7% e 45,2%. A SG foi melhor no grupo LNS negativo em comparação ao grupo LNS positivo (70,9% vs. 53,2%), mas sem significância estatística (p=0,08). A SLD estimada para LNS positivo foi associada a prognóstico significantemente pior (33,8 × 46,7%; p=0,001).
Limitações do estudoA natureza retrospectiva do estudo e o número limitado de pacientes.
ConclusõesO presente estudo tem implicações significantes para determinar o prognóstico. Pacientes com melanoma acral e LNS positivo tiveram pior prognóstico em comparação àqueles com LNS negativo.
O melanoma lentiginoso acral é subtipo raro que representa de 1% a 3% dos casos de melanoma, afetando principalmente a pele acral da palma, unhas e, especialmente, a sola do pé. Não está diretamente relacionado à exposição solar e é o subtipo mais comum entre indivíduos de ascendência africana e asiática.1–3 No Brasil, tem incidência maior do que a média global, atribuída à diversidade racial da população. Alguns estudos sugerem que o melanoma acral está associado a prognóstico desfavorável quando comparado a outros subtipos.3–5 Isso pode ser parcialmente explicado por diagnósticos em estágios mais avançados. Entretanto, alguns estudos asiáticos não confirmam esses achados e sugerem melhor prognóstico.6–8
Apesar de sua raridade e características específicas, o tratamento do melanoma acral segue os mesmos princípios dos outros subtipos. A biopsia do linfonodo sentinela (LNS) é atualmente recomendada para pacientes com melanomas de espessura intermediária e tem sido amplamente utilizada com baixa morbidade.9–11 Desde a publicação do The Second Multicenter Selective Lymphadenectomy Trial (MSLTII) e do Dermatologic Cooperative Oncology Group Trial (DECOG), pacientes com LNS positivo foram poupados da dissecção completa dos linfonodos e, com a introdução de novos tratamentos eficazes, o papel da biopsia do LNS tem sido questionado.12,13 Entretanto, seu papel tem se mostrado importante na avaliação do prognóstico, com estadiamento mais preciso do melanoma e definição de estratégias de tratamento complementares. Seu papel terapêutico ainda está em debate, mas dados do MSLTII sugerem melhora no prognóstico em pacientes com melanoma espesso e melhor controle local com redução na recorrência nodal em pacientes submetidos à biopsia do LNS.14,15
Ao analisar os principais estudos prospectivos, a maioria dos pacientes apresentava o subtipo de disseminação superficial, localizado no tronco e extremidades, enquanto um número menor apresentava o subtipo acral.12–15 A maioria dos estudos sobre melanoma acral é retrospectiva, envolvendo número limitado de pacientes, e foi conduzida na Ásia.7,8,16–22
Por falta de dados sobre o uso da biopsia do LNS neste subgrupo de pacientes e pela alta proporção de pacientes com este subtipo no Brasil, é essencial obter mais informações sobre o uso da biopsia do LNS neste grupo. Portanto, o objetivo deste estudo é avaliar os resultados da biopsia do LNS em 79 pacientes com melanoma acral tratados em um único centro oncológico e compará‐los com os dados descritos na literatura.
MétodosSeleção de pacientesEntre janeiro de 2016 e dezembro de 2022, foi analisada uma coorte retrospectiva de 79 pacientes com melanoma acral submetidos consecutivamente à biopsia do LNS e mapeamento linfático em uma única instituição. Os critérios de inclusão foram pacientes com diagnóstico histológico confirmado de melanoma cutâneo acral, ausência de aumento dos linfonodos e Índice de Breslow >1mm ou presença de ulceração, nível de Clark IV ou V. Não houve limites quanto a sexo, idade ou cor da pele.
Biopsia do LNS e mapeamento linfáticoA biopsia do LNS e o mapeamento linfático foram realizados pela mesma equipe de cirurgiões. A linfocintilografia dinâmica foi realizada na manhã anterior à cirurgia com injeção intradérmica de 1 mCi 99mTc‐fitato. O corante azul vital foi injetado subdermicamente ao redor do melanoma primário ou local da biopsia no momento da cirurgia. Os LNSs foram localizados com sonda gama portátil intraoperatoriamente e por inspeção visual para corante azul. Contagens in vivo e ex vivo dos linfonodos radiomarcados foram obtidas e comparadas com contagens do leito nodal antes e depois da remoção. Todos os linfonodos “quentes” e “corados” foram considerados LNSs e excisados.
Avaliação patológica e opções de tratamentoOs LNSs não foram avaliados durante o período perioperatório. Os mesmos foram processados no laboratório de patologia, corados com Hematoxilina & eosina (H&E) e com os marcadores imuno‐histoquímicos HMB 45, Melan‐A e S100. A dissecção completa dos linfonodos foi inicialmente programada em todos os casos positivos. Após a publicação do MSLTII e DECOG, abordagem conservadora foi oferecida aos pacientes com LNSs positivos.
A classificação micromorfométrica adotada foi baseada no diâmetro máximo. A profundidade de invasão da cápsula também foi avaliada. Os depósitos metastáticos identificados nos LNSs tiveram seu maior diâmetro medido utilizando microscópio óptico com micrômetro ocular. O maior valor definiu a carga tumoral do LNS. Se vários LNSs positivos estivessem presentes, o maior diâmetro máximo em qualquer um dos LNSs era considerado. O número de depósitos metastáticos em cada LNS também foi avaliado.
Coleta de dadosOs dados foram coletados retrospectivamente dos prontuários médicos e bancos de dados eletrônicos do hospital. O seguimento pós‐operatório foi realizado no ambulatório de melanoma e consistiu em exame clínico a cada três meses e radiografia de tórax a cada seis meses. Outros exames foram realizados de acordo com a necessidade do paciente. O status atual do paciente foi classificado como “vivo sem evidência de doença”, “vivo com doença”, “óbito devido à doença” ou “óbito por outra causa”.
Desfechos e análise estatísticaAs análises estatísticas foram realizadas usando o software Statistical Package for Social Sciences (versão 18.0; SPSS Inc., Chicago, IL, EUA). O teste de Qui‐quadrado foi usado para avaliar as relações entre variáveis categóricas. A sobrevida livre de doença (SLD) e a sobrevida global (SG) foram calculadas a partir da data da biopsia do LNS até a data da primeira recorrência ou morte, respectivamente, censuradas na data do último contato se não houvesse eventos.
As estimativas univariadas de sobrevida foram realizadas pelo método de Kaplan‐Meier e comparadas usando o teste de log‐rank. A análise multivariada foi realizada com o modelo de regressão de riscos proporcionais de Cox, incluindo variáveis com significância estatística na análise univariada; o valor de p <0,05 foi considerado estatisticamente significante. O estudo foi aprovado pelo Comitê de Publicações e Ética em Pesquisa Humana do Hospital Santa Izabel.
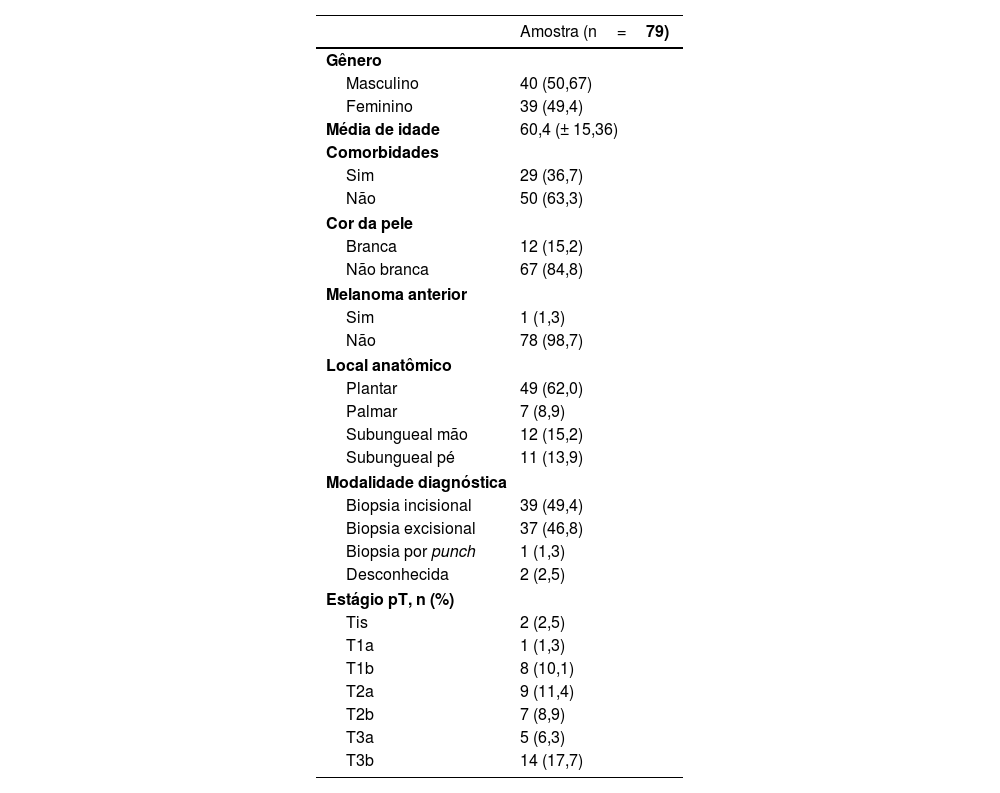
ResultadosCaracterísticas demográficas e pré‐operatóriasNeste estudo, 79 pacientes diagnosticados com melanoma acral foram submetidos à biopsia do LNS de 2016 a 2022. A mediana da idade foi de 60 anos, variando de 20 a 92 anos, com leve predominância masculina (51%); 83,5% foram classificados como negros ou pardos; 63,3% tinham comorbidades e 17,7% dos pacientes tinham histórico familiar de câncer, com 5,1% tendo histórico familiar de melanoma, e apenas um paciente (1,3%) tinha diagnóstico prévio de melanoma (tabela 1).
Características clínicas e histopatológicas
| Amostra (n=79) | |
|---|---|
| Gênero | |
| Masculino | 40 (50,67) |
| Feminino | 39 (49,4) |
| Média de idade | 60,4 (± 15,36) |
| Comorbidades | |
| Sim | 29 (36,7) |
| Não | 50 (63,3) |
| Cor da pele | |
| Branca | 12 (15,2) |
| Não branca | 67 (84,8) |
| Melanoma anterior | |
| Sim | 1 (1,3) |
| Não | 78 (98,7) |
| Local anatômico | |
| Plantar | 49 (62,0) |
| Palmar | 7 (8,9) |
| Subungueal mão | 12 (15,2) |
| Subungueal pé | 11 (13,9) |
| Modalidade diagnóstica | |
| Biopsia incisional | 39 (49,4) |
| Biopsia excisional | 37 (46,8) |
| Biopsia por punch | 1 (1,3) |
| Desconhecida | 2 (2,5) |
| Estágio pT, n (%) | |
| Tis | 2 (2,5) |
| T1a | 1 (1,3) |
| T1b | 8 (10,1) |
| T2a | 9 (11,4) |
| T2b | 7 (8,9) |
| T3a | 5 (6,3) |
| T3b | 14 (17,7) |
O diagnóstico foi realizado principalmente por biopsia incisional (49,4%) ou biopsia excisional (46,8%), seguida por método desconhecido (2,5) e biopsia por punch (1,3). A localização preferencial foi a planta do pé (62%), seguida da região subungueal da mão (15,2%), subungueal do pé (13,9%) e palmar (8,9%).
Resultados operatóriosTodos os pacientes foram submetidos à ressecção cirúrgica com intenção curativa, e amputação foi necessária em 19% dos pacientes. A margem cirúrgica intraoperatória foi> 1cm em 72,1%. Todos os pacientes apresentaram cadeia linfonodal clinicamente negativa e foram submetidos à biopsia do LNS. Em 100% dos casos foi utilizado corante azul patente, e apenas dois casos (2,5%) não foram submetidos à linfocintilografia pré‐operatória.
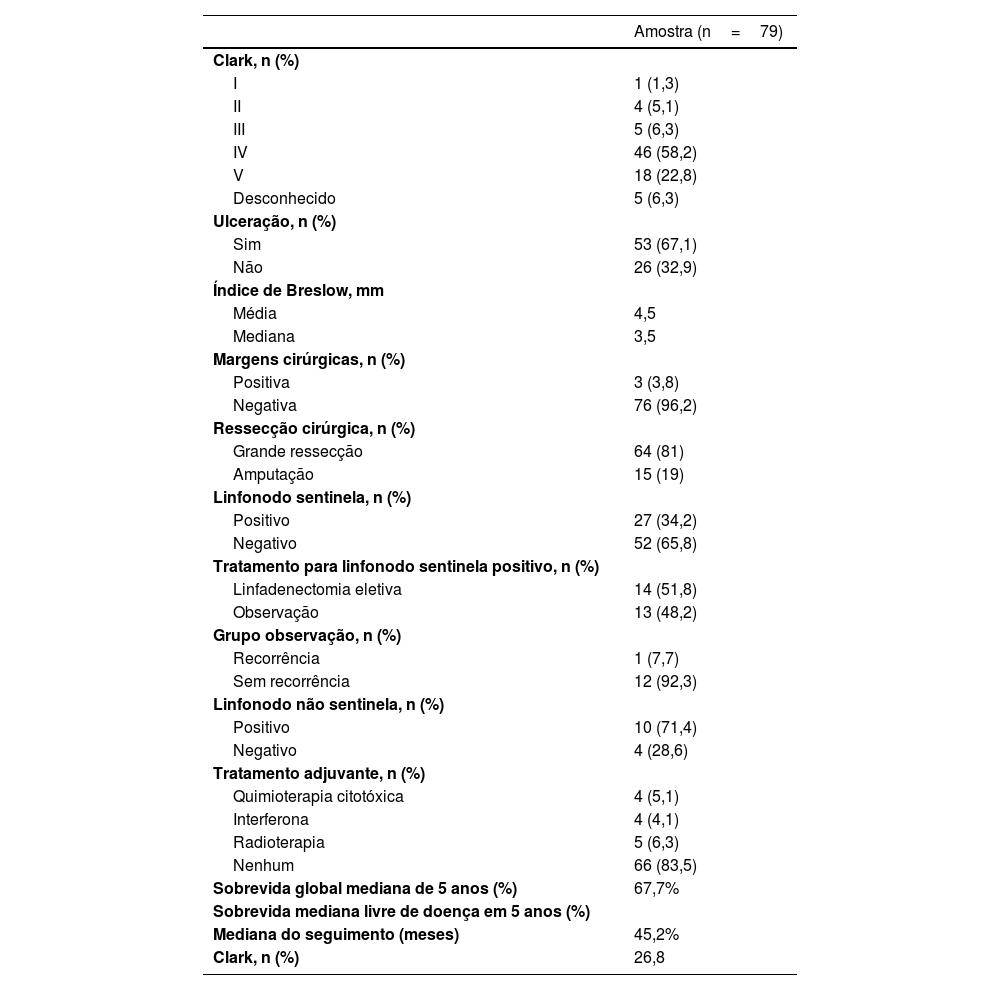
A mediana do número de LNS identificados foi de 1,75, variando de um a seis, com 82,2% apresentando um ou dois LNS. A cadeia de drenagem preferencial foi a inguinal em 72,2% dos casos. No estudo anatomopatológico da peça cirúrgica, o nível de Clark estava acima de III em 87,3%, ulceração estava presente em 67,1%, regressão em 7,6% e satelitose em 15,2%. A mediana do Índice de Breslow foi de 4,5mm, variando de 0 a 25mm (tabela 2).
Resultados operatórios e pós‐operatórios
| Amostra (n=79) | |
|---|---|
| Clark, n (%) | |
| I | 1 (1,3) |
| II | 4 (5,1) |
| III | 5 (6,3) |
| IV | 46 (58,2) |
| V | 18 (22,8) |
| Desconhecido | 5 (6,3) |
| Ulceração, n (%) | |
| Sim | 53 (67,1) |
| Não | 26 (32,9) |
| Índice de Breslow, mm | |
| Média | 4,5 |
| Mediana | 3,5 |
| Margens cirúrgicas, n (%) | |
| Positiva | 3 (3,8) |
| Negativa | 76 (96,2) |
| Ressecção cirúrgica, n (%) | |
| Grande ressecção | 64 (81) |
| Amputação | 15 (19) |
| Linfonodo sentinela, n (%) | |
| Positivo | 27 (34,2) |
| Negativo | 52 (65,8) |
| Tratamento para linfonodo sentinela positivo, n (%) | |
| Linfadenectomia eletiva | 14 (51,8) |
| Observação | 13 (48,2) |
| Grupo observação, n (%) | |
| Recorrência | 1 (7,7) |
| Sem recorrência | 12 (92,3) |
| Linfonodo não sentinela, n (%) | |
| Positivo | 10 (71,4) |
| Negativo | 4 (28,6) |
| Tratamento adjuvante, n (%) | |
| Quimioterapia citotóxica | 4 (5,1) |
| Interferona | 4 (4,1) |
| Radioterapia | 5 (6,3) |
| Nenhum | 66 (83,5) |
| Sobrevida global mediana de 5 anos (%) | 67,7% |
| Sobrevida mediana livre de doença em 5 anos (%) | |
| Mediana do seguimento (meses) | 45,2% |
| Clark, n (%) | 26,8 |
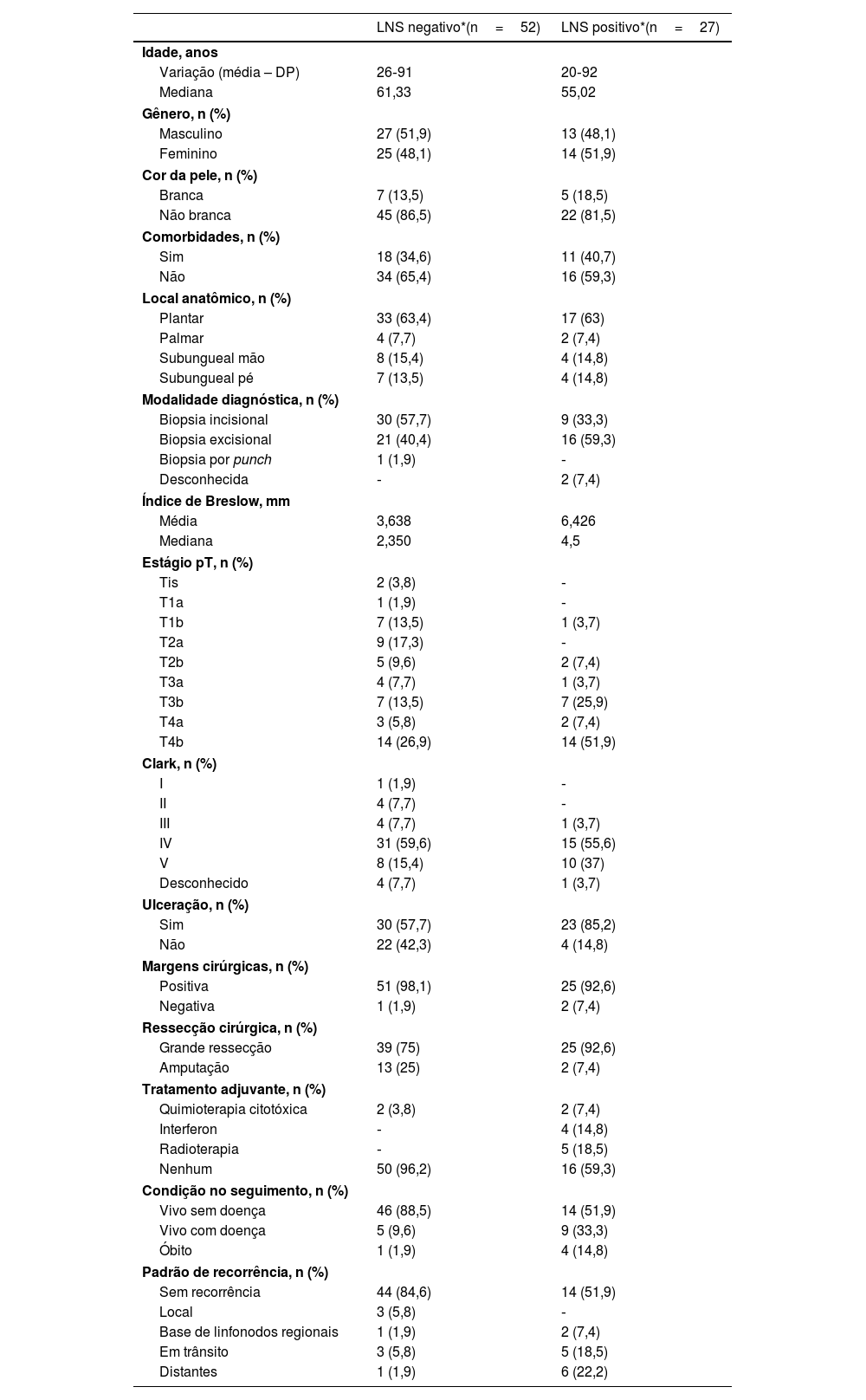
Os LNS foram positivos em 27 pacientes (34,2%). Além disso, 17 pacientes (21,5%) foram submetidos à linfadenectomia completa da cadeia de drenagem. Entre esses pacientes, 14 (82,3%) foram submetidos à linfadenectomia em virtude da presença de LNS positivo, dois (11,8%) foram submetidos à linfadenectomia por recorrência nodal após biopsia negativa do LNS e um (5,9%) foi submetido à linfadenectomia por recorrência nodal após tratamento conservador com um LNS positivo. O número mediano de linfonodos dissecados foi de 7,7 (variando de quatro a 12), e o número mediano de linfonodos positivos foi de 1,5 (variando de 0 a seis).
Analisando os 27 pacientes com LNS positivos, 14 (51,8%) foram submetidos à linfadenectomia eletiva. Entre esses pacientes, apenas quatro (28,6%) não apresentaram outros linfonodos positivos além do LNS. Em 13 pacientes com LNS positivo (48,2%), a abordagem conservadora foi escolhida, e apenas um teve recorrência nodal e foi submetido a linfadenectomia terapêutica. O tamanho do depósito tumoral foi descrito em apenas oito pacientes, e a mediana do maior diâmetro foi de 2,4mm, variando de 1 a 5mm. Infiltração capsular foi encontrada em nove pacientes (33,3%).
Nenhum paciente recebeu tratamento neoadjuvante, e apenas 16,5% deles receberam tratamento adjuvante. Quimioterapia citotóxica foi realizada em 5,1%, interferona (INF) em 5,1% e radioterapia em 6,3%. Nenhum dos pacientes teve acesso a tratamentos como imunoterapia ou inibidores de BRAF.
Mortalidade e sobrevidaO seguimento mediano foi de 26,8 meses. A taxa de mortalidade foi de 6,3% (cinco casos) e a taxa de recorrência foi de 26,6% (21 casos). O local mais frequente de recorrência foi “em trânsito” (oito casos ‐ 40%), seguido de recorrência a distância em 35% (sete casos), dentre os quais o pulmão foi o local mais frequente (15%). Recorrência local ocorreu em três casos (15%) e recorrência nodal também ocorreu em três casos (15%; tabela 3). tabela 4, tabela 5
Comparação do status do linfonodo sentinela (LNS)* com características clínicas e histopatológicas de 79 pacientes com melanoma acral
| LNS negativo*(n=52) | LNS positivo*(n=27) | |
|---|---|---|
| Idade, anos | ||
| Variação (média – DP) | 26‐91 | 20‐92 |
| Mediana | 61,33 | 55,02 |
| Gênero, n (%) | ||
| Masculino | 27 (51,9) | 13 (48,1) |
| Feminino | 25 (48,1) | 14 (51,9) |
| Cor da pele, n (%) | ||
| Branca | 7 (13,5) | 5 (18,5) |
| Não branca | 45 (86,5) | 22 (81,5) |
| Comorbidades, n (%) | ||
| Sim | 18 (34,6) | 11 (40,7) |
| Não | 34 (65,4) | 16 (59,3) |
| Local anatômico, n (%) | ||
| Plantar | 33 (63,4) | 17 (63) |
| Palmar | 4 (7,7) | 2 (7,4) |
| Subungueal mão | 8 (15,4) | 4 (14,8) |
| Subungueal pé | 7 (13,5) | 4 (14,8) |
| Modalidade diagnóstica, n (%) | ||
| Biopsia incisional | 30 (57,7) | 9 (33,3) |
| Biopsia excisional | 21 (40,4) | 16 (59,3) |
| Biopsia por punch | 1 (1,9) | ‐ |
| Desconhecida | ‐ | 2 (7,4) |
| Índice de Breslow, mm | ||
| Média | 3,638 | 6,426 |
| Mediana | 2,350 | 4,5 |
| Estágio pT, n (%) | ||
| Tis | 2 (3,8) | ‐ |
| T1a | 1 (1,9) | ‐ |
| T1b | 7 (13,5) | 1 (3,7) |
| T2a | 9 (17,3) | ‐ |
| T2b | 5 (9,6) | 2 (7,4) |
| T3a | 4 (7,7) | 1 (3,7) |
| T3b | 7 (13,5) | 7 (25,9) |
| T4a | 3 (5,8) | 2 (7,4) |
| T4b | 14 (26,9) | 14 (51,9) |
| Clark, n (%) | ||
| I | 1 (1,9) | ‐ |
| II | 4 (7,7) | ‐ |
| III | 4 (7,7) | 1 (3,7) |
| IV | 31 (59,6) | 15 (55,6) |
| V | 8 (15,4) | 10 (37) |
| Desconhecido | 4 (7,7) | 1 (3,7) |
| Ulceração, n (%) | ||
| Sim | 30 (57,7) | 23 (85,2) |
| Não | 22 (42,3) | 4 (14,8) |
| Margens cirúrgicas, n (%) | ||
| Positiva | 51 (98,1) | 25 (92,6) |
| Negativa | 1 (1,9) | 2 (7,4) |
| Ressecção cirúrgica, n (%) | ||
| Grande ressecção | 39 (75) | 25 (92,6) |
| Amputação | 13 (25) | 2 (7,4) |
| Tratamento adjuvante, n (%) | ||
| Quimioterapia citotóxica | 2 (3,8) | 2 (7,4) |
| Interferon | ‐ | 4 (14,8) |
| Radioterapia | ‐ | 5 (18,5) |
| Nenhum | 50 (96,2) | 16 (59,3) |
| Condição no seguimento, n (%) | ||
| Vivo sem doença | 46 (88,5) | 14 (51,9) |
| Vivo com doença | 5 (9,6) | 9 (33,3) |
| Óbito | 1 (1,9) | 4 (14,8) |
| Padrão de recorrência, n (%) | ||
| Sem recorrência | 44 (84,6) | 14 (51,9) |
| Local | 3 (5,8) | ‐ |
| Base de linfonodos regionais | 1 (1,9) | 2 (7,4) |
| Em trânsito | 3 (5,8) | 5 (18,5) |
| Distantes | 1 (1,9) | 6 (22,2) |
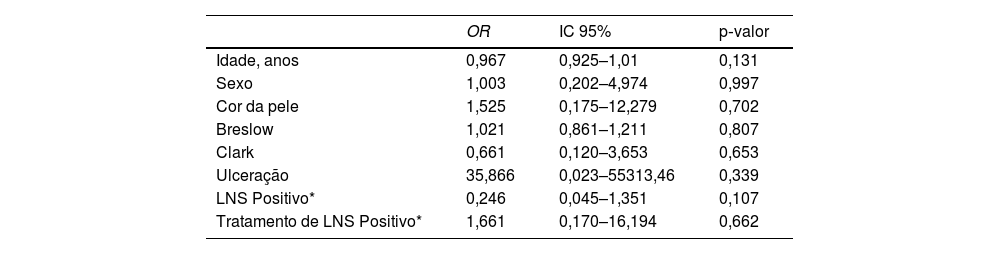
Fatores associados à sobrevida global em cinco anos
| OR | IC 95% | p‐valor | |
|---|---|---|---|
| Idade, anos | 0,967 | 0,925–1,01 | 0,131 |
| Sexo | 1,003 | 0,202–4,974 | 0,997 |
| Cor da pele | 1,525 | 0,175–12,279 | 0,702 |
| Breslow | 1,021 | 0,861–1,211 | 0,807 |
| Clark | 0,661 | 0,120–3,653 | 0,653 |
| Ulceração | 35,866 | 0,023–55313,46 | 0,339 |
| LNS Positivo* | 0,246 | 0,045–1,351 | 0,107 |
| Tratamento de LNS Positivo* | 1,661 | 0,170–16,194 | 0,662 |
OR, odds ratio; IC, intervalo de confiança; LNS*, linfonodo sentinela.
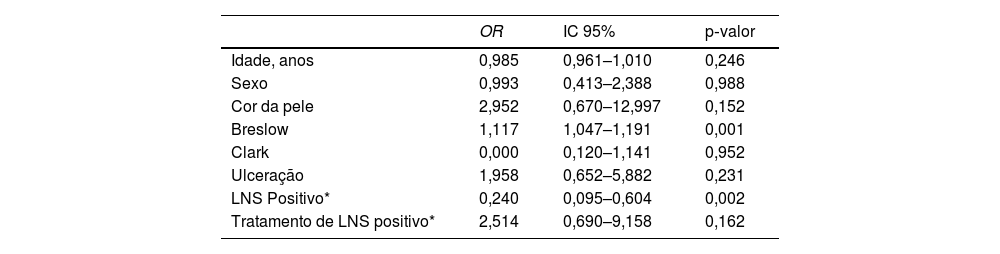
Fatores associados à sobrevida livre de doença em cinco anos
| OR | IC 95% | p‐valor | |
|---|---|---|---|
| Idade, anos | 0,985 | 0,961–1,010 | 0,246 |
| Sexo | 0,993 | 0,413–2,388 | 0,988 |
| Cor da pele | 2,952 | 0,670–12,997 | 0,152 |
| Breslow | 1,117 | 1,047–1,191 | 0,001 |
| Clark | 0,000 | 0,120–1,141 | 0,952 |
| Ulceração | 1,958 | 0,652–5,882 | 0,231 |
| LNS Positivo* | 0,240 | 0,095–0,604 | 0,002 |
| Tratamento de LNS positivo* | 2,514 | 0,690–9,158 | 0,162 |
OR, odds ratio; IC, intervalo de confiança; LNS*, linfonodo sentinela.
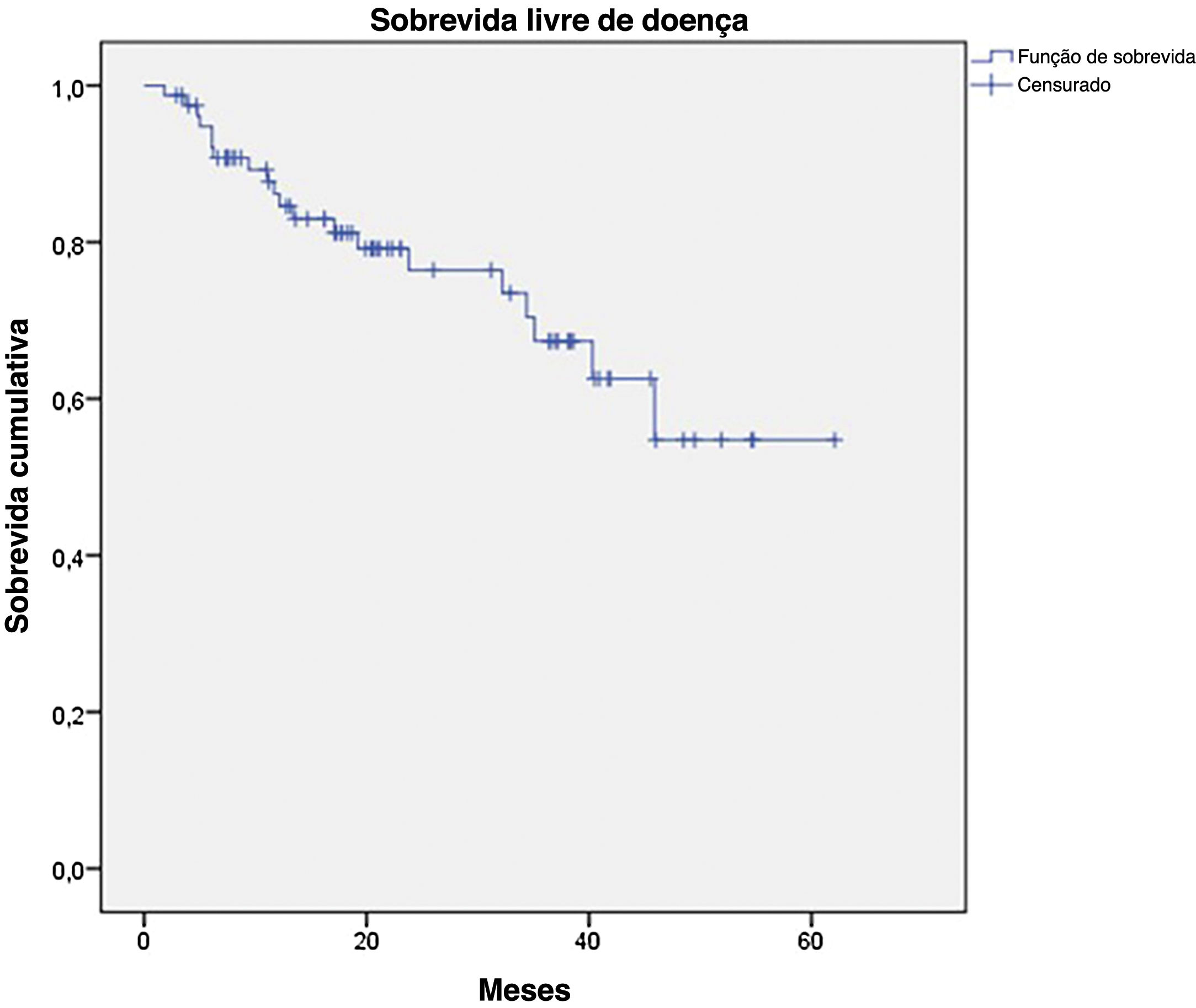
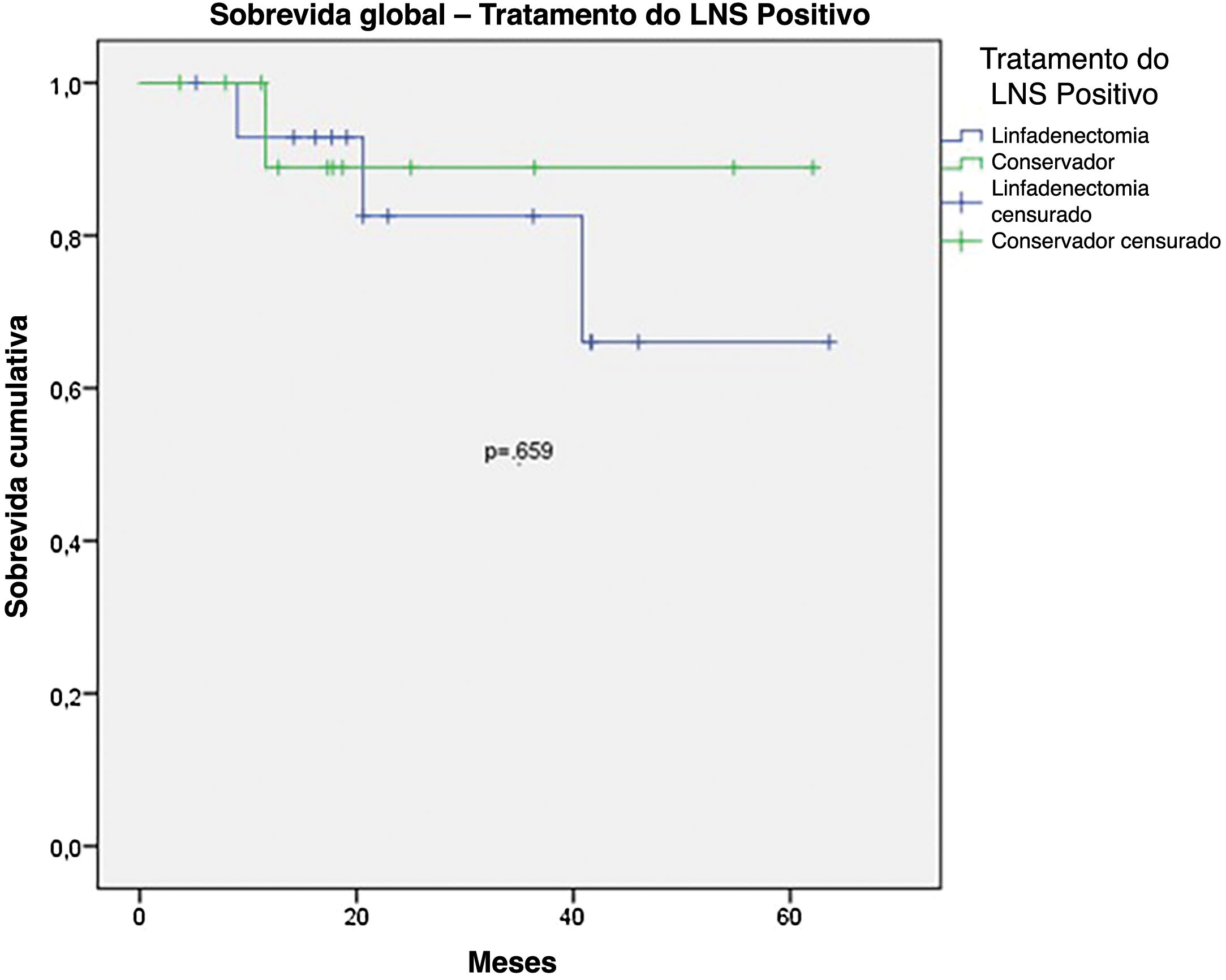
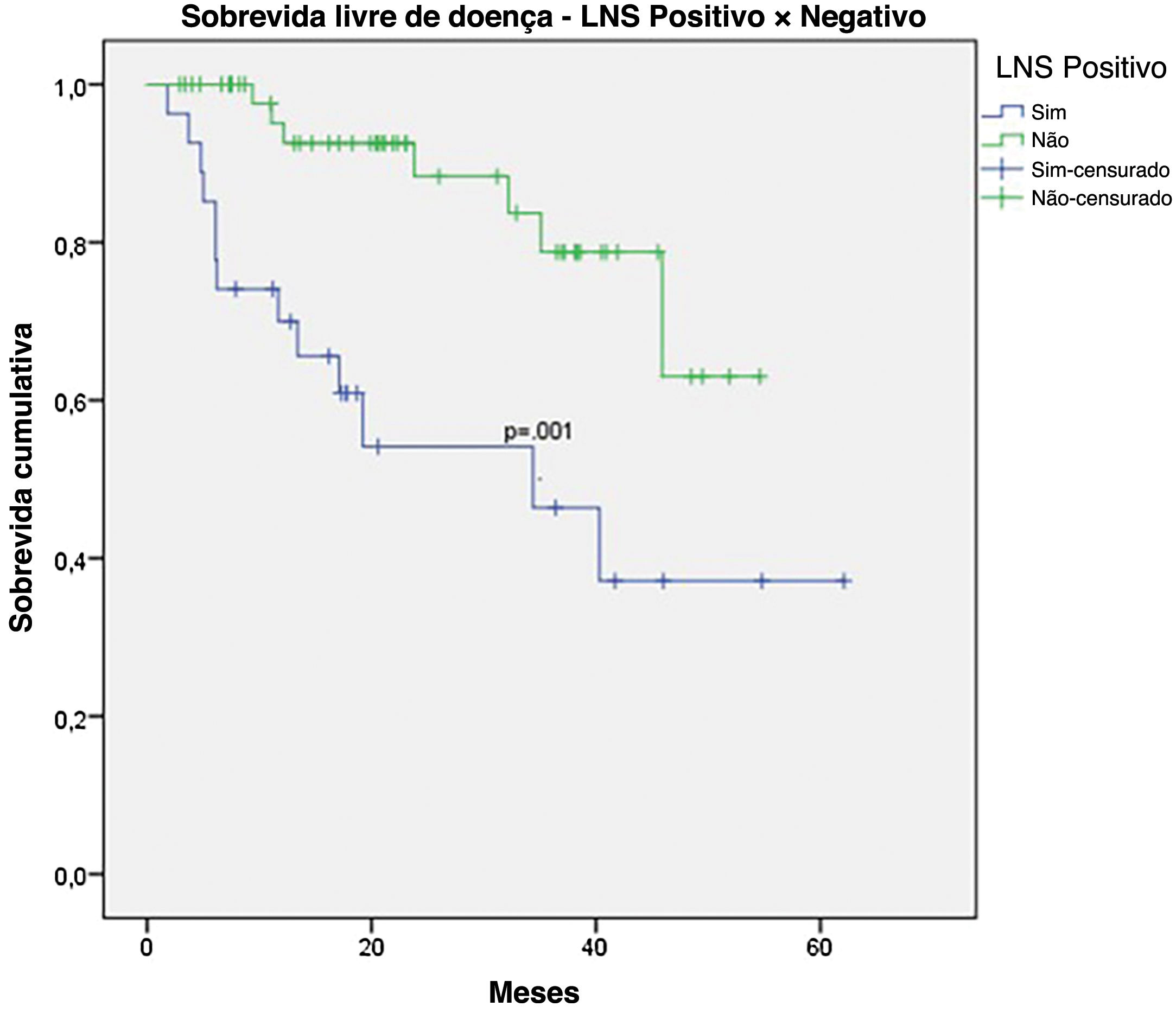
A SG para todo o grupo foi de 67,7%, e a SLD foi de 45,2% (figs. 1 e 2). Na análise univariada, a SG foi melhor no grupo LNS negativo em comparação ao grupo LNS positivo (70,9% vs. 53,2%; fig. 3), mas sem significância estatística (p=0,081), como foi o caso na análise estratificada pelo Índice de Breslow (fig. 4; p=0,572) e ulceração (fig. 5; p=0,106). A SG dos pacientes com LNS positivo que foram tratados de maneira conservadora foi de 56,4%, em comparação com 51,5% no grupo de pacientes com LNS positivo tratados com linfadenectomia eletiva (fig. 6; p=0,659).
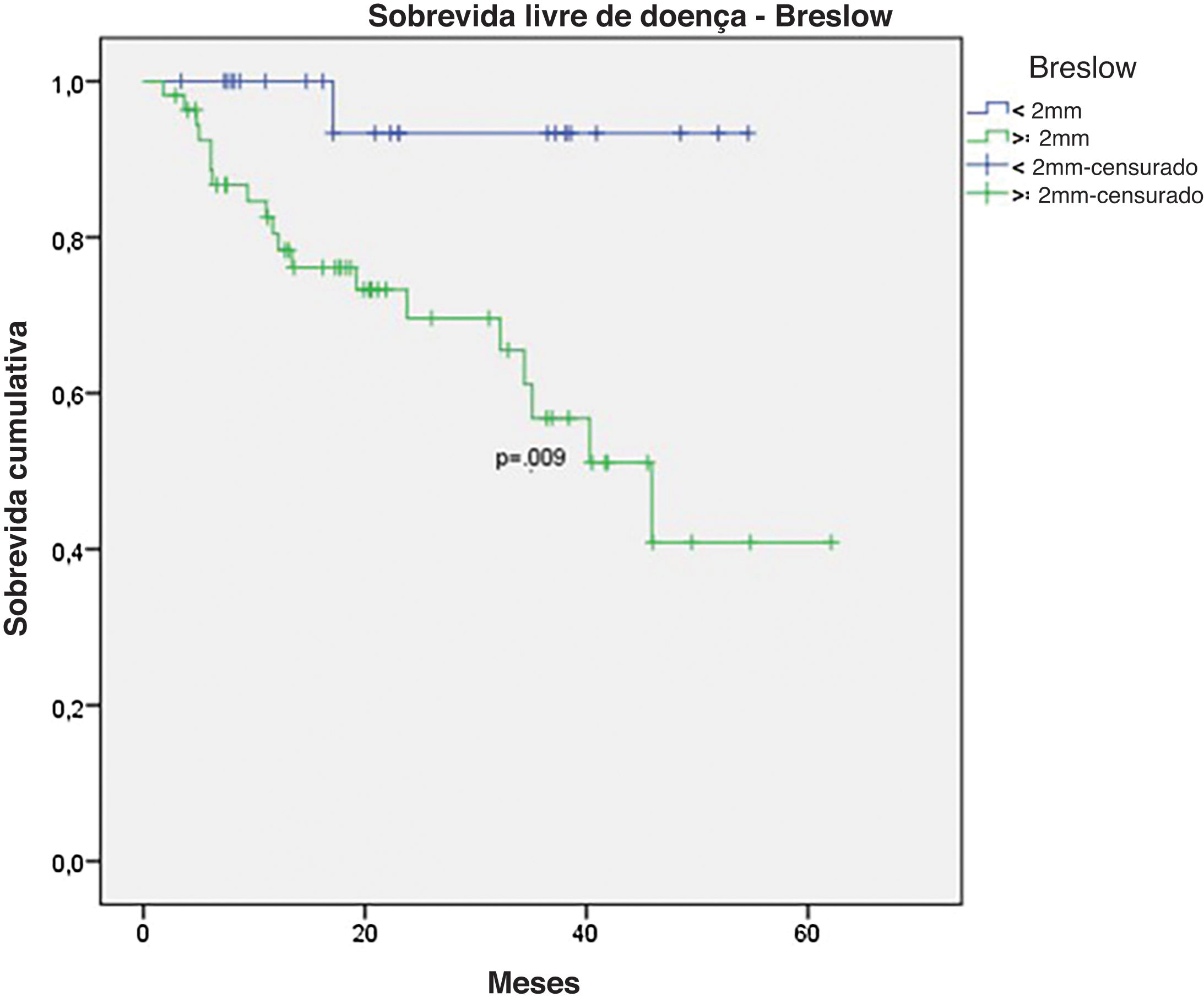
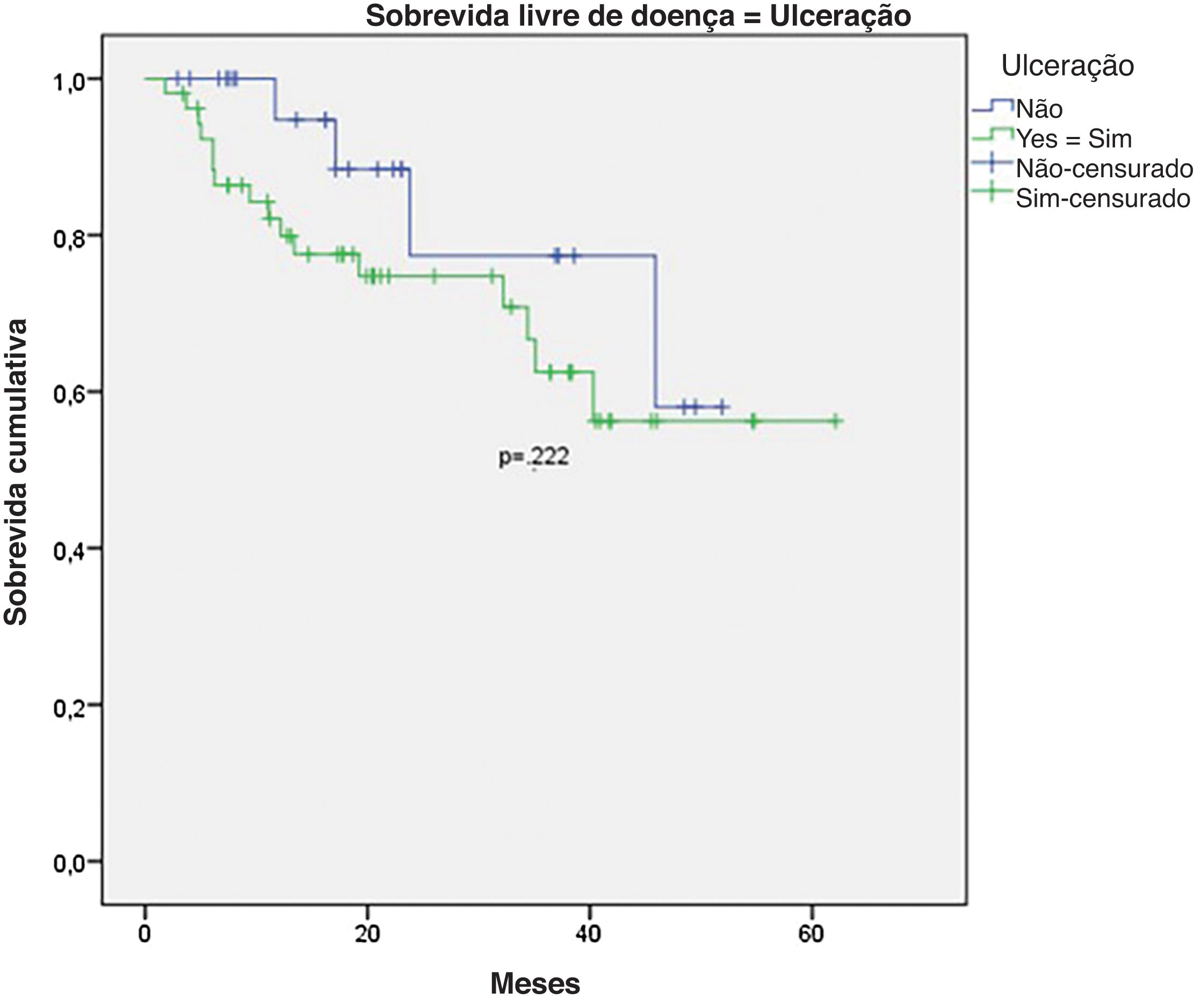
Na análise univariada da SLD, LNS positivo (fig. 7) e espessura de Breslow> 2mm (fig. 8) foram associados a prognóstico significantemente pior (33,8% × 46,7%, p=0,001 e 40 × 52,1, p=0,009). As outras variáveis, ulceração (fig. 9) e o tratamento realizado em pacientes com LNS positivo (fig. 10) não atingiram significância estatística (p=0,222, p=0,147).
Na análise multivariada, nenhuma das variáveis apresentou significância estatística (Índice de Breslow, presença de ulceração, regressão, idade, raça, status nodal, localização do tumor ou nível de Clark).
DiscussãoNeste estudo, foi analisado retrospectivamente o resultado de 79 pacientes com melanoma acral submetidos à biopsia do LNS ao longo de seis anos em um centro de referência. Os dados do presente estudo revelam perfil de paciente com melanomas mais espessos (4,5mm) e maior taxa de ulceração (67,1%), o que está acima das médias relatadas em estudos como MSLTI, MSLTII e DECOG.12–15 Também excede o estudo do SEER envolvendo pacientes com melanoma acral submetidos à biopsia regional do LNS (espessura mediana de Breslow de 2mm e 34% apresentaram ulceração) e tem resultados semelhantes aos do estudo brasileiro com 66,7% de ulceração e mediana de Breslow de 5mm.16–23
Esses dados podem explicar a taxa elevada de LNS positivos no presente estudo (34,2%). A maioria dos estudos sobre melanoma relata taxas de LNS positivo em torno de 20%.24–26 Estudos envolvendo especificamente melanoma acral frequentemente mostram resultados divergentes, em geral pelo número limitado de pacientes e sua natureza retrospectiva, com taxas variando de 11,9% a 42,2%.7,8,16–22 Um estudo coreano com apenas 34 pacientes mostrou taxa de LNS positivo de 41,2%,17 enquanto outro estudo coreano, com número maior de pacientes (107) tratados ao longo de 12 anos, relatou taxa de LNS positivo de 20,6.18 Um estudo retrospectivo utilizando banco de dados dos EUA com 753 pacientes, a maioria de ascendência caucasiana, mostrou taxa de LNS positivo de 25,7%,16 e um estudo brasileiro com 201 pacientes com melanoma acral mostrou taxa de LNS positivo de 29,9%.23
Os LNSs foram identificados corretamente em todos os pacientes. Isso é consistente com os achados de estudos asiáticos envolvendo melanoma acral, que podem ser atribuídos à localização de lesões acrais em extremidades com cadeia de drenagem mais previsível. Isso também explica a alta taxa de identificação de LNS usando a técnica combinada de corante azul e linfocintilografia.7,8,17–22 Alguns dados sugerem que a taxa de falso‐negativos para LNS em pacientes com melanoma acral pode ser maior. Entretanto, esses dados não são consistentes com outros estudos27–29 e não foram observados no presente estudo, onde a taxa de recorrência no local de drenagem após LNS negativo foi de apenas 3,8% (dois casos de 52), o que é menor do que o relatado no MSLTI (5,5%) e em estudo coreano (11,8%).14,18
A biopsia do LNS provou ser importante na avaliação do prognóstico dos pacientes. Entretanto, o número de pacientes com melanoma acral sempre foi limitado em estudos ocidentais prospectivos.12–15 Estudos específicos sobre melanoma acral são retrospectivos e originários da Ásia. Apesar dessas limitações, sete estudos mostraram que a presença de metástase de LNS é fator de risco significante correlacionado com as taxas de sobrevida, especialmente em termos de SLD.8,17–21,23
Neste estudo, foi observada SG de 67,7% no grupo total, que é menor do que aquela tipicamente vista em estudos de melanoma, variando em torno de 91,7%, e menor do que outros estudos retrospectivos envolvendo melanoma acral, que tipicamente relatam taxas de sobrevida em torno de 80%.3,4 As razões para esse prognóstico desfavorável podem ser explicadas pelo diagnóstico mais avançado nos pacientes do presente estudo, como pode ser observado no estudo brasileiro que tem características semelhantes e prognóstico ainda pior (SG de 44,6% e 38,6% SLD).23
Ao analisar os resultados de LNS, observa‐se clara tendência de melhor sobrevida em pacientes com LNSs negativos (SG 70,9% vs. 53,2%; p=0,081). Entretanto, a significância estatística só foi alcançada em termos de SLD (46,7% vs. 33,9%; p=0,001). Acredita‐se que, pela natureza retrospectiva do estudo e pelo número limitado de pacientes, a significância estatística não foi alcançada. Outros estudos com foco exclusivo no melanoma acral também mostraram resultados semelhantes. Em estudo envolvendo pacientes com melanoma acral nos Estados Unidos, a sobrevida específica do melanoma foi de 88,5% no grupo LNS negativo, em comparação com 58,9% no grupo LNS positivo.16 Em seis estudos asiáticos, incluindo três japoneses, um chinês e dois coreanos, o LNS positivo correlacionou‐se com pior sobrevida, especialmente em termos de SLD.8,17–21
O tratamento conservador após LNS positivo tem sido recomendado desde a publicação do DECOG e do MSLTII.12,13 No presente estudo, apenas metade dos pacientes (48%) seguiu essa recomendação, em grande parte porque os dados que apoiam essa abordagem surgiram durante o curso do estudo. Além disso, está sendo tratada uma população com lesões mais avançadas, com depósitos tumorais substanciais no LNS, muito além do que foi descrito em pacientes nos estudos DECOG e MSLTII. Isso também justifica por que apenas quatro de 14 pacientes submetidos à linfadenectomia eletiva após LNS positivo não apresentaram outros linfonodos positivos além do LNS.
No entanto, apesar de todos esses dados, na análise de subgrupos com LNS positivos, a SG e a SLD foram piores no grupo submetido à linfadenectomia eletiva após LNS positivo. Entretanto, essa diferença não atingiu significância estatística (SG 51,5% vs. 56,5%, com p=0,659; SLD 23,8% vs. 46,9%, com p=0,147). Nesse grupo, em que a abordagem conservadora foi adotada, apenas um paciente foi submetido à linfadenectomia por recorrência local. A taxa de mortalidade foi de 9,3% no grupo submetido ao tratamento conservador e de 20% no grupo submetido à linfadenectomia após LNS positivo. Esses dados podem sugerir que a linfadenectomia foi indicada em pacientes com maior volume tumoral, mas também sugerem que o tratamento conservador após LNS positivo pode ser oferecido em pacientes com melanoma acral.
ConclusãoNeste estudo, a biopsia do LNS em pacientes com melanoma acral demonstrou alta precisão na identificação de LNS e teve implicações significantes para determinar o prognóstico. Pacientes com melanoma acral e LNS positivos tiveram pior prognóstico em comparação com aqueles com LNS negativos. Pacientes com biopsia positiva de LNS que foram submetidos a linfadenectomia mostraram prognóstico semelhante ao daqueles tratados com observação, sugerindo que essa abordagem também poderia ser recomendada para esse subgrupo de pacientes. Entretanto, em virtude da natureza retrospectiva do estudo e do número limitado de pacientes, cada paciente deve ser avaliado individualmente.
Suporte financeiroNenhum.
Contribuição dos autoresThiago Francischetto: Concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Ana Clara Falcão: Obtenção dos dados; análise estatística.
Adson Santos Neves: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Ana Beatriz Lira: Obtenção dos dados; análise estatística.
Robson Freitas de Moura: Obtenção, análise e interpretação dos dados.
Thiago Souza Oliveira Freitas de Moura: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Juvandy Antonio Inacio Santos: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
André Bacellar Costa Lima: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Marco Antonio Oliveira Lessa: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Jussamara Britos Santos: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Alexandre Farias de Albuquerque: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Vaner Paulo da Silva Fonseca Pinheiro: Análise estatística; obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Francischetto T, Falcão AC, Neves AS, Lira AB, Moura RF, Moura TSOF, et al. Influence of sentinel lymph node biopsy on prognosis of acral melanoma patients. An Bras Dermatol. 2025;100:501129.
Trabalho realizado na Santa Casa de Misericórdia da Bahia, Hospital Santa Izabel, Salvador, BA, Brasil.