Talaromyces marneffei (TM) é um patógeno oportunista raro que infecta principalmente pacientes com baixa imunidade em comparação com aqueles que têm imunidade normal. Pode estar relacionado à deficiência imunológica ou a fatores genéticos.
ObjetivoAvaliar a mutação genética de um paciente infectado por TM em área endêmica com autoanticorpos anti‐interferon‐γ negativos e vírus da imunodeficiência humana (HIV) negativo.
MétodosExtrair amostras de ácido desoxirribonucleico (DNA) do sangue periférico do paciente, detectar a mutação do gene por sequenciamento do exoma completo (WES) e realizar a verificação do sequenciamento de Sanger para o gene da mutação detectado.
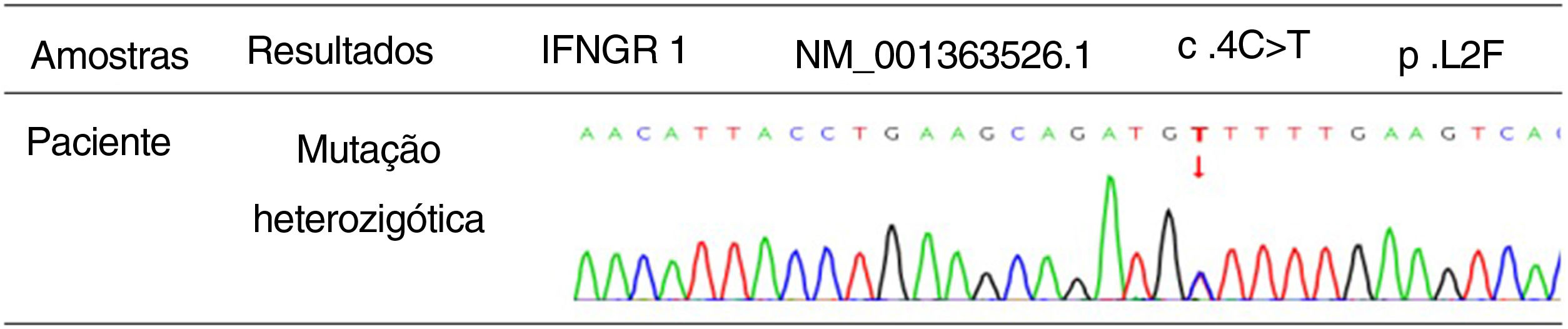
ResultadosFoi detectada mutação no gene IFNGR1 (NM_001363526.1), validada utilizando o sequenciamento de Sanger. Os resultados mostraram mutação heterozigótica, c.4C>T (p.L2F), localizada no gene IFNGR1 (NM_001363526.1).
Limitações do estudoO mecanismo do gene IFNGR1 não foi investigado no presente estudo.
ConclusõesA mutação do gene IFNGR1 pode ser fator de risco potencial para infecção por TM, e a presença de autoanticorpos anti‐interferon‐γ pode agravar os sintomas da doença.
Talaromyces marneffei (TM) é um fungo patogênico bifásico oportunista, dependente da temperatura, que geralmente infecta pacientes imunocomprometidos, predominantemente pelo vírus da imunodeficiência humana (HIV).1 Nos pacientes com síndrome de imunodeficiência adquirida (AIDS), a taxa de infecção chega a 16,2% e é a principal causa de morte.2 Entretanto, a infecção por TM também pode ocorrer em indivíduos HIV negativos sem imunossupressão significante. A suscetibilidade do hospedeiro a essa infecção pode ser decorrente de deficiência imunológica ou de fatores genéticos. O IFNGR1 é um gene localizado no cromossomo 6, e o produto de expressão do gene é um receptor de interferon‐γ (IFN‐γ) que se combina com IFN‐γ e participa da ativação de macrófagos e de processos anti‐infecciosos. Os autoanticorpos anti‐IFN‐γ bloqueiam o IFN‐γ, resultando em imunidade comprometida ou deficiência imunológica. Isso, por sua vez, torna o paciente suscetível a patógenos.
No presente estudo, os autores relatam um caso raro de infecção endêmica, não HIV, não imunossupressora, com autoanticorpos anti‐IFN‐γ negativos, e mutação no gene IFNGR1. As características dos casos de infecção por TM com mutações genéticas ou autoanticorpos anti‐IFN‐γ na literatura foram revisadas e resumidas.
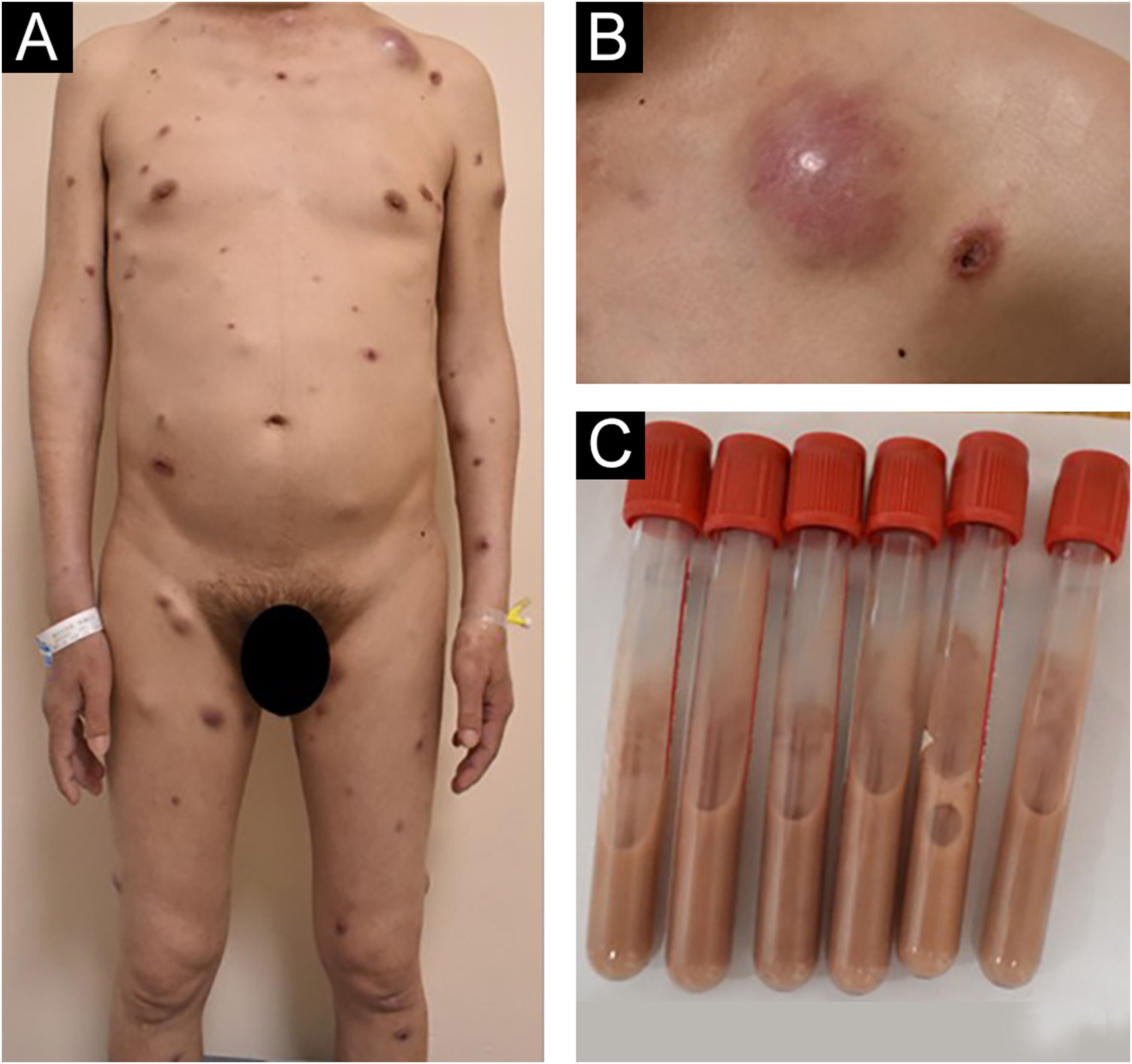
Relato do casoPaciente do sexo masculino, de 44 anos, da província de Jiangxi, China, foi internado no hospital em virtude de pápulas e nódulos generalizados que persistiam por dois meses. Havia dois meses, várias pápulas e nódulos vermelhos do tamanho de um grão de soja apareceram no tronco sem gatilhos conhecidos, sem dor ou prurido significantes. Após o ato de coçar, as lesões progrediram para erosão e apresentaram cicatrização deficiente. As lesões cutâneas aumentaram em número e tamanho, gradativamente, com ulceração no centro das lesões. O paciente alegou que costumava caminhar por florestas infestadas de ratos do bambu chinês (Rhizomys sinensis) antes de adoecer. Apresentava histórico de sífilis havia 17 anos, herpes genital havia cinco anos e solicitação de serviços sexuais. O paciente negou qualquer histórico de uso de drogas, atividade homossexual ou transfusões de sangue. Os sinais vitais na hospitalização eram estáveis. O exame físico revelou aspecto emaciado, hepatoesplenomegalia, linfadenopatias bilaterais nas regiões cervical, axilar e inguinal com exame neurológico normal. O exame dermatológico revelou pápulas, nódulos e abscessos eritematosos e acastanhados espalhados pelo corpo com tamanhos variados. Algumas lesões apresentavam ulcerações necróticas centrais umbilicadas; os abscessos eram flutuantes e apresentavam secreção purulenta branco‐amarelada (fig. 1).
(A e B) O exame dermatológico revelou pápulas, nódulos e abscessos eritematosos e acastanhados espalhados pelo corpo com tamanhos variados. Algumas lesões exibiam ulcerações necróticas centrais umbilicadas, e os abscessos eram flutuantes e apresentavam secreção purulenta branco‐amarelada. (C) O conteúdo do tubo de ensaio foi retirado de um abscesso.
Os resultados dos exames laboratoriais foram os seguintes: contagem de leucócitos (leucócitos): 24,34×109/L; nível de hemoglobina (Hb): 62g/dL; contagem de plaquetas: 366×109/L; contagem absoluta de neutrófilos (ANC): 20,93×109/L; nível de albumina: 18,4g/L; nível de proteína C‐reativa: 187,41mg/L; velocidade de hemossedimentação (VHS): >140mm/h; nível de ferroproteína: 763 ug/L. A detecção de marcadores imunológicos séricos do vírus da hepatite B (cinco itens) indicou que o antígeno de superfície da hepatite B, o anticorpo de superfície e os anticorpos centrais eram positivos. A sorologia para HIV foi negativa, com autoanticorpos anti‐IFN‐γ negativos. Não foram encontradas doenças do tecido conjuntivo ou outras doenças de imunodeficiência. Tomografia computadorizada de alta resolução (TCAR) de abdome total e cervicotorácica sugeriu múltiplos linfonodos aumentados na região cervical, mediastino, região axilar bilateral, região hilar, retroperitônio e região inguinal bilateral com liquefação parcial e necrose.
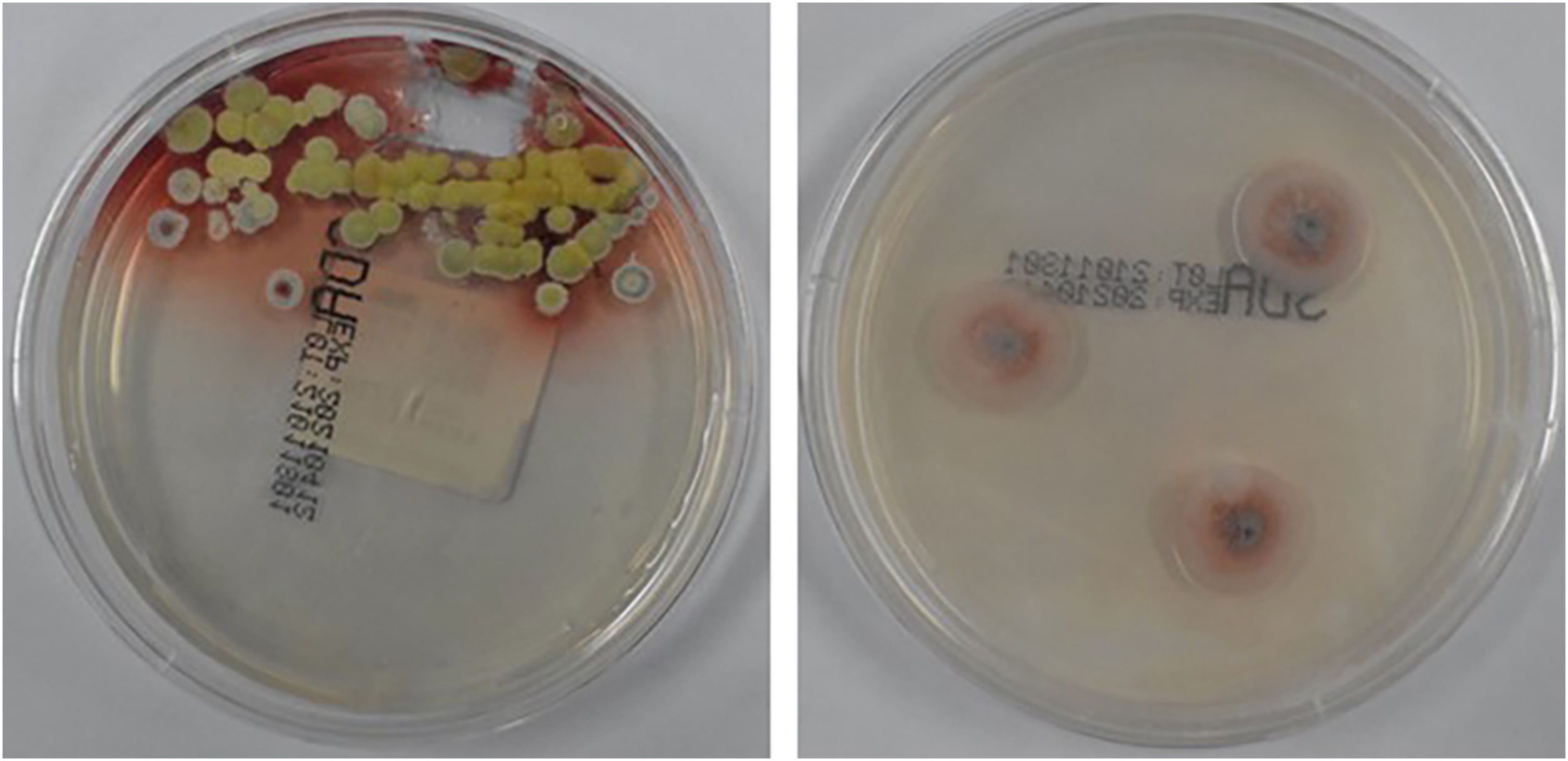
Evidenciou‐se sombra de densidade anormal subpleural no lobo inferior de ambos os pulmões, com efeito hipostático inicial. Culturas de secreções purulentas da erupção cutânea revelaram infecção por TM (fig. 2). O teste de galactomanana, cultura de punção de medula óssea, hemocultura, cultura de fezes e urina e cultura de lavado broncoalveolar não mostraram anormalidades óbvias. Além disso, a histopatologia de um linfonodo mostrou hiperplasia reativa sem evidência de elemento fúngico. Com o consentimento do paciente, amostras de ácido desoxirribonucleico (DNA) foram extraídas de seu sangue periférico. A mutação do gene IFNGR1 (NM_001363526.1) foi detectada utilizando sequenciamento do exoma completo (WES, do inglês whole exome sequencing). O resultado foi validado usando sequenciamento de Sanger para a mutação detectada, e a mutação heterozigótica c.4C>T (p.L2F) foi identificada no gene IFNGR1 (NM_001363526.1; fig. 3).
O paciente recebeu terapia antifúngica intravenosa com voriconazol de acordo com a cultura de TM e os resultados dos testes de sensibilidade aos medicamentos. No terceiro dia de administração, a temperatura corporal e a frequência cardíaca do paciente voltaram ao normal, as lesões cicatrizaram gradualmente e a linfadenopatia e a hepatoesplenomegalia melhoraram. Após sete dias de tratamento com voriconazol, o sequenciamento completo do exoma (WES), a proteína C‐reativa e a contagem de plaquetas do paciente estavam dentro dos limites normais. Após um mês de tratamento, a lesão cutânea foi significantemente reduzida e o paciente continua em acompanhamento.
DiscussãoEm 1956, pela primeira vez, no Instituto Pasteur, TM foi isolado do fígado de um rato do bambu chinês que morreu de histoplasmose.3 TM é um fungo bifásico dependente de temperatura, distribuído no Sudeste Asiático, norte da Índia e sul da China.4 A forma de levedura é sua principal forma patogênica. O principal modo de infecção do TM é por inalação dos esporos. No trato respiratório, o agente é convertido em leveduras, espalhando‐se pelo corpo através do sistema sanguíneo.3 Em geral, a infecção pelo HIV é a condição subjacente mais importante que leva à infecção. Entretanto, nos últimos anos, o número de pacientes imunocompetentes e HIV negativos com infecções por TM também aumentou. Neste estudo, o paciente era HIV negativo, vivia no sul da China durante todo o ano e perambulava pela floresta infestada de ratos do bambu, o que apresentava alto risco de infecção.
A patogênese da infecção por TM não é totalmente compreendida e envolve principalmente o sistema fagocitário mononuclear. Uma vez estabelecida a infecção, os fungos se espalham colonizando os tecidos do hospedeiro, propagando‐se, escapando dos sistemas de defesa do hospedeiro ou destruindo‐os e danificando os tecidos do mesmo. As manifestações clínicas comuns da infecção por TM incluem febre, perda ponderal, tosse, anemia, pápulas umbilicadas generalizadas, linfadenopatia e pneumonia cavitaria.5 Pacientes com diagnóstico tardio e tratamento antifúngico apresentam alta taxa de mortalidade, de cerca de 75%, independentemente da infecção pelo HIV.6 Chen Donghe et al.7 relataram casos de morte causados por atraso no diagnóstico e tratamento.
Foi documentado que autoanticorpos anti‐IFN‐γ são o fator causal mais importante na infecção grave por TM em pacientes HIV negativos com imunodeficiência adquirida do tipo adulto.8 Entretanto, neste relato, o resultado do teste para autoanticorpos anti‐IFN‐γ do paciente foi negativo. Assim, especulou‐se que as principais causas da infecção fossem dois fatores: o fator ambiental mencionado acima, e um outro, que poderia estar relacionado à mutação do gene IFNGR. IFNGR1 é um importante gene que codifica o receptor 1 do IFN‐γ (IFN‐γR1), o qual está envolvido na composição de uma cadeia de ligação ao ligante do receptor de IFN‐γ. A mutação IFNGR1 pode alterar a estrutura do receptor de IFN‐γ, afetando assim a ligação e a transdução de sinal do receptor de IFN‐γ e do IFN‐γ, deixando de exercer eficazmente seus efeitos biológicos. O IFN‐γ é uma importante citocina imunomoduladora produzida por células‐T ativadas e células natural killer (NK; células T Th1 e CD8+). É um mediador‐chave da resposta imune do hospedeiro. Após a ligação ao receptor do IFN‐γ, o sinal transduzido através da via Janus Kinase‐Signal Transducer and Activator of Transcription (JAK‐STAT) pode ativar ou, de outro modo, regular a atividade funcional de macrófagos mononucleares de outras maneiras e induzir a capacidade de matar vários patógenos microbianos intracelulares e extracelulares e células tumorais.9 Isso pode promover a proliferação de linfócitos T e melhorar a função imunológica celular. Supõe‐se que a mutação do gene IFNGR1 afete a ligação e produção de IFN‐γ, causando deficiência imunológica ou imunidade prejudicada, aumentando assim o risco de infecção por TM. Além disso, a gravidade da doença depende do estado imunológico do hospedeiro, incluindo autoanticorpos neutralizantes anti‐IFN‐γ.8,10 Seis pacientes da revisão de literatura realizada pelos autores e o relatado aqui apresentavam mutação genética ou autoanticorpos anti‐IFN‐γ positivos. Após terapia antifúngica padronizada, o prognóstico foi bom, com baixa taxa de mortalidade. Apenas um paciente com mutação e autoanticorpos anti‐IFN‐γ positivos evoluiu a óbito.11‐16 Portanto, especula‐se que a mutação genética seja fator de risco potencial para infecção por TM e que a presença de autoanticorpos anti‐IFN‐γ podem agravar os sintomas da doença. A coexistência de ambos pode levar a mau prognóstico e até aumentar o risco de morte.
A anfotericina B continua sendo o medicamento de preferência no tratamento da infecção por TM. Um estudo recente revelou que o voriconazol tem eficácia comparável à anfotericina.6 De acordo com os resultados do teste de sensibilidade aos medicamentos na cultura de TM e considerando que os efeitos adversos da anfotericina B, como reação à infusão, comprometimento da função hepática e renal, distúrbio eletrolítico, anemia e tolerância do paciente;17 podem agravar a condição do paciente, voriconazol foi selecionado para o paciente do presente estudo. O voriconazol, administrado nesse paciente, é o agente antifúngico triazol sintético de segunda geração, com amplo espectro antifúngico e forte atividade antifúngica. É um medicamento eficaz e bem tolerado no tratamento da peniciliose,18,19 com relativamente poucos eventos adversos.
Não há nenhum caso relatado de infecção por TM com mutação do gene IFNGR1 não relacionada à AIDS, não imunossupressora, com anticorpos anti‐IFN‐γ negativos, até agora. Acredita‐se que as mutações genéticas sejam fator de risco potencial para infecção por TM, e a presença de autoanticorpos anti‐IFN‐γ pode agravar os sintomas da doença.
Suporte financeiroEste trabalho recebeu suporte financeiro do Science and Technology Research Project of Education Department of Jiangxi Province (n° GJJ200230) e Health Commission Jiangxi Provincial of China (n° 202130178).
Contribuição dos autoresShiyang Li: Obtenção dos dados; elaboração e redação do manuscrito.
Xianwei Cao: Obtenção de dados; elaboração e redação do manuscrito.
Zhuxiu Guo: Análise dos dados; revisão do manuscrito.
Jian Wang: Análise dos dados; revisão do manuscrito.
Jianbo Tong: Concepção do estudo, elaboração e redação do manuscrito; revisão crítica de conteúdo intelectual relevante; aprovação da versão final do manuscrito.
Zhibin Zhang: Concepção do estudo, elaboração e redação do manuscrito; revisão crítica de conteúdo intelectual relevante; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Li S, Cao X, Guo Z, Wang J, Tong J, Zhang Z. Talaromyces marneffei infection with IFNGR1 gene mutation in a patient with negative Anti‐Interferon‐γ autoantibodies. An Bras Dermatol. 2024;99:233–7.
Trabalho realizado no Departamento de Dermatologia, The First Affiliated Hospital of Nanchang University, Nanchang, Jiangxi, China.