O uso cada vez mais frequente da dermatoscopia pode constituir‐se em risco para a transferência de microrganismos, através do dermatoscópio, entre médico e pacientes.
ObjetivosIdentificar os cocos gram‐positivos mais frequentes em dermatoscópios e adaptadores para smartphones, bem como o perfil de resistência, e avaliar os fatores associados com um maior risco de contaminação bacteriana dos dermatoscópios.
MétodosEstudo transversal com 118 dermatologistas de Porto Alegre/ Brasil entre setembro de 2017 e julho de 2018. Os cocos gram‐positivos foram identificados por MALDI‐TOF MS e os hábitos de uso do dermatoscópio foram avaliados através de um questionário anônimo.
ResultadosDos dermatoscópios analisados, 46,6% tiveram crescimento de cocos gram‐positivos na lente e 37,3% no botão liga/desliga. Os microrganismos mais frequentemente identificados foram S. epidermidis, S. hominis e S. warneri. Atender em hospital, pacientes internados e pacientes em unidade de terapia intensiva foram significantemente associados com a presença de cocos gram‐positivos nos dermatoscópios (p<0,05). As maiores taxas de resistência foram observadas frente à penicilina, eritromicina e sulfametoxazol‐trimetoprim.
Limitações do estudoA não inclusão de bacilos gram‐negativos, fungos e vírus. Além disso, o pequeno número de adaptadores não permitiu avaliar diferenças estatísticas.
ConclusãoEstafilococos coagulase negativos foram frequentemente identificados. S. aureus foi detectado apenas na lente.
A dermatoscopia é uma excelente ferramenta diagnóstica na prática diária do dermatologista. E, nos últimos anos, os adaptadores para smartphones têm sido usados para fotografar lesões cutâneas, como nevos melanocíticos, e permitir o seu acompanhamento, bem como possibilitar a discussão de casos entre grupos de dermatologistas.
Toda essa inovação tecnológica trouxe aos profissionais da saúde uma maior agilidade no acesso às informações: smartphones e tablets permitem buscar artigos, fazer consultas rápidas em livros ou aplicativos, discutir casos em grupos com experts, além de ter um papel no ensino de futuros profissionais da saúde, como um dos possíveis facilitadores de aprendizagem.1,2 O uso indiscriminado desses objetos trouxe um novo desafio: a possibilidade de transferência de microrganismos, com ou sem potencial patogênico, desses aparelhos para as mãos dos profissionais, ou vice‐versa, ou ainda, transferir de pessoa a pessoa. Para exemplificar, pacientes com colonização nasal por Staphylococcus aureus têm entre 2 a 9 vezes mais risco de ter uma infecção por S. aureus.3 Os patógenos associados com infecções associadas à assistência médica mais frequentemente identificados foram Staphylococcus coagulase negativo (SCoN) (15%), S. aureus (15%), Enterococcus sp. (12%), Candida sp. (11%), seguidos por diversos bacilos gram‐negativos.4 Essas infecções relacionadas à assistência médica representam um importante desafio para o sistema de saúde e estão associadas com significativo custo, morbidade e mortalidade. Estima‐se que a cada 100 pacientes hospitalizados a qualquer momento, sete em países desenvolvidos e dez em países em desenvolvimento adquirirão pelo menos uma infecção relacionada a esses cuidados.5
Poucos estudos avaliaram a contaminação de microrganismos em dermatoscópios e não há estudos em adaptadores para smartphones. Um estudo feito na Suíça analisou a presença bacteriana em lentes dos dermatoscópios de 10 dermatologistas (n=10) envolvidos com o atendimento de pacientes do Ambulatório de Dermatologia em dois hospitais suíços. Dos 112 swabs feitos, 65% dos aparelhos mostraram o crescimento de bactérias não patogênicas (inclusive todos os SCoN, Streptococcus α e γ‐hemolíticos, Corynebacterium, Bacillus e Lactobacillus). S. aureus sensível à meticilina (MSSA) foi encontrado em três ocasiões (nos três swabs foi usado óleo de imersão no aparelho e não álcool isopropílico para a dermatoscopia).6 Na Áustria estudaram o espectro de microrganismos em 4 dermatoscópios (lente e corpo) do Departamento de Dermatologia em um hospital de Viena após a dermatoscopia de 39 pacientes e encontraram S. epidermidis em 74% dos aparelhos e S. aureus em 7%. Na Inglaterra, Chattopadhyay et al. avaliaram 9 lentes de dermatoscópios em 60 ocasiões (30 antes do exame e 30 após a dermatoscopia) para monitoramento de crescimento bacteriano. Um álcool‐gel com etanol 70% foi usado como líquido de imersão. Os autores encontraram S. aureus resistente à meticilina (MRSA) em 10% dos experimentos (todos de swabs feitos depois da dermatoscopia).7
Os investigadores quiseram identificar os cocos gram‐positivos mais frequentemente encontrados nos dermatoscópios e adaptadores para smartphones e avaliar os fatores associados com um maior risco de contaminação bacteriana na lente e no botão liga/desliga dos dermatoscópios.
MétodosEstudo de delineamento transversal, feito entre setembro de 2017 e julho de 2018. Foram convidados para participar do estudo dermatologistas e residentes em dermatologia que atendiam em ambulatório hospitalar, em ambulatório não hospitalar e em consultórios privados. Os médicos responderam a um questionário anônimo com informações demográficas e sobre os hábitos de uso do dermatoscópio e forneceram os seus aparelhos para análise bacteriológica através da técnica de swab. Foram excluídos os médicos que não desejaram participar do preenchimento do questionário ou da coleta de swab dos dermatoscópios e dos adaptadores de celulares.
Para coleta, foram usados swabs em dois ou três locais previamente definidos dos dermatoscópios: na lente, no botão liga/desliga e no adaptador (para os profissionais que usavam esse equipamento). Os swabs foram selados, etiquetados e encaminhados para análise. No laboratório, os swabs foram colocados em tubos com o meio enriquecido BHI (Infusão Cérebro‐Coração) (Sigma Aldrich, Merck, Alemanha) e deixados na estufa a 35°±2°C por 24 horas. Na presença de turvação (nesse caso o teste é considerado positivo, ou seja, houve crescimento bacteriano), os caldos foram semeados em placas de ágar sangue de carneiro a 5% (biomeriéux, Marcy L’Etoile, França) com o auxílio de uma alça estéril. Na sequência, as placas foram deixadas na estufa a 35°±2°C por 24 horas. As placas em que foram observadas crescimento bacteriano foram colocadas em skim milk e congeladas para posterior identificação. As amostras que turvaram no caldo BHI foram, posteriormente, descongeladas e, novamente, semeadas em placas de ágar sangue para identificação por MALDI‐TOF MS. No estudo foi usada a plataforma da Bruker Daltonics (microflex LT; Bruker Daltonik GmbH, Bremen, Germany).
Para os testes de suscetibilidade, as colônias com 24 horas de cultivo em ágar sangue de carneiro eram incubadas a 35°±2°C por 18–24 horas e foram testadas para os seguintes antibióticos: penicilina (10U), cefoxitina (30 μg), eritromicina (15 μg), clindamicina (2 μg), levofloxacina (5 μg), sulfametoxazol‐trimetropim (1,25/23,75 μg), linezolida (30 μg), tetraciclina (30 μg), gentamicina (10 μg) e rifampicina (5 μg). As placas foram analisadas conforme as recomendações do Clinical and Laboratory Standards Institute (CLSI, 2018).8 Conforme o diâmetro do halo de inibição, as amostras foram classificadas como sensível, resistência intermediária ou resistente. S.aureus ATCC 25923 foi usado para o controle de qualidade dos discos de antibióticos, de acordo com os procedimentos padronizados no teste de disco difusão.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Irmandade da Santa Casa de Porto Alegre (protocolo n° 69396017.5.0000.5335), Universidade Federal de Ciências da Saúde de Porto Alegre (protocolo n° 69396017.5.0001.5345) e Secretaria Estadual de Saúde do Rio Grande do Sul (protocolo n° 69396017.5.3002.5312). Todos os participantes incluídos no estudo assinaram Termo de Consentimento Informado.
Os dados foram digitados no programa Excel e posteriormente exportados para o programa SPSS v. 20.0 para análise estatística. Foram descritas as variáveis qualitativas por frequências e percentuais. As variáveis quantitativas com distribuição simétrica foram descritas pela média e o desvio padrão e as com distribuição assimétrica pela mediana e o intervalo interquartil. As variáveis categóricas foram comparadas pelo teste de qui‐quadrado ou exato de Fisher. O teste de Mann‐Whitney foi usado para as variáveis numéricas, com exceção da variável “idade”, para a qual foi usado o teste t de Student. Foi considerado um nível de significância de 5% para as comparações estabelecidas.
Para o cálculo do tamanho da amostra, com aproximadamente 59 dermatologistas para cada um dos dois grupos (um com dermatologistas que atendiam em ambiente hospitalar e o outro com dermatologistas que atendiam em consultório), conseguiríamos detectar uma diferença de 20 pontos percentuais na frequência de colonização por bactérias. Consideramos um valor basal de colonização de 5% (no referencial teórico foi citado um valor que oscila entre 2,7% a 10%), um poder de 80% e uma significância de 5%.
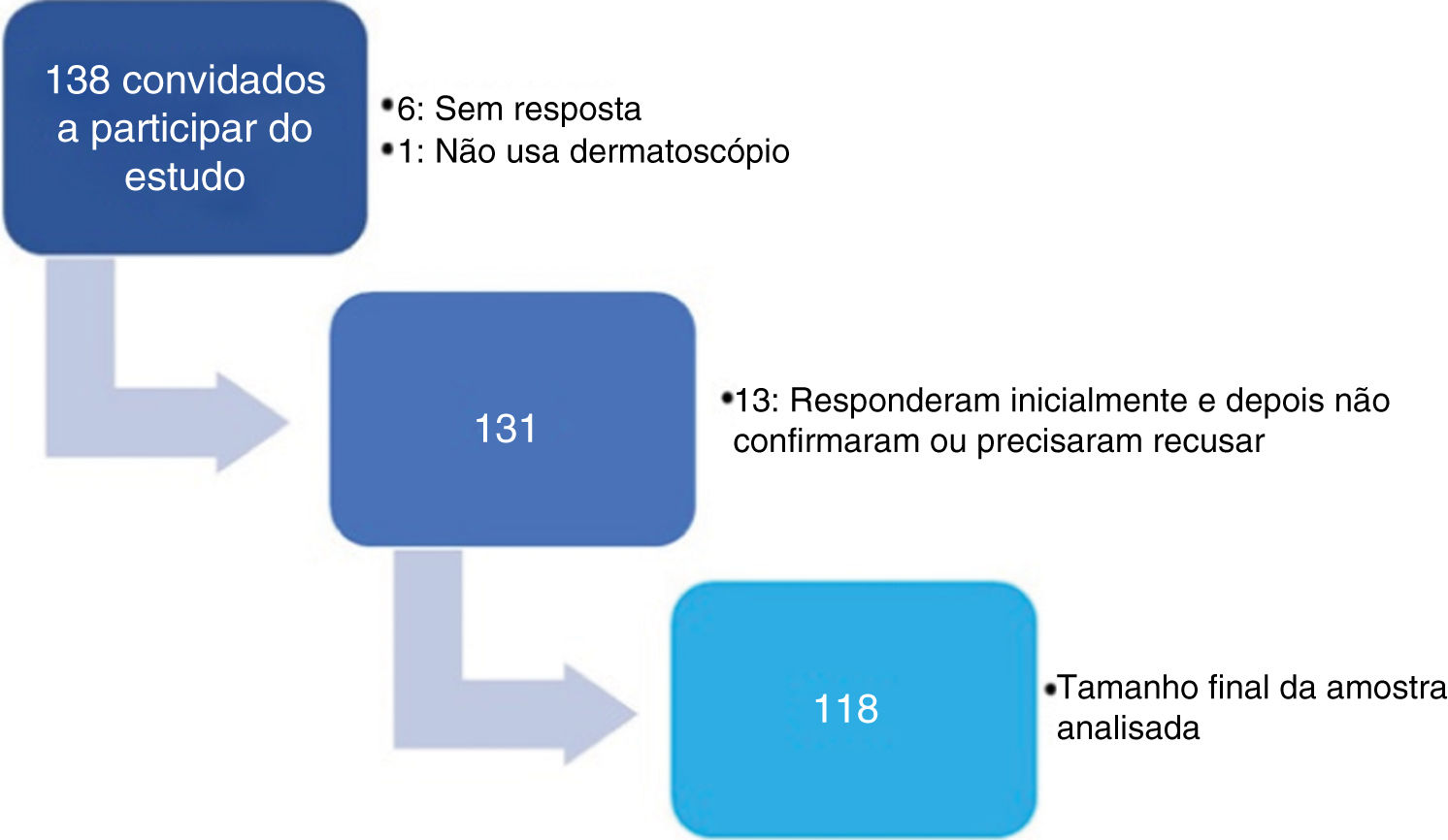
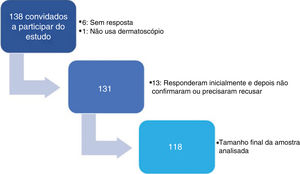
ResultadosForam convidados a participar da pesquisa 138 dermatologistas (fig. 1). As características dos 118 dermatologistas que tiveram seus aparelhos analisados estão descritas na tabela 1.
Características dos dermatologistas da amostra e do uso do dermatoscópio
| Variável | Medidas descritivas |
|---|---|
| Idade em anos – média±DP | 36,4±8,4 |
| Sexo, n (%) | |
| Masculino | 16 (13,5) |
| Feminino | 102 (86,5) |
| Tempo que atua como dermatologista, em anos–mediana (intervalo interquartil) | 6,5 (2–15) |
| Onde atende pacientes? – n (%) | |
| Em consultório | 47 (39,8) |
| Em hospital | 25 (21,2) |
| Em consultório e hospital | 46 (39,0) |
| Número de vezes de uso do dermatoscópio por dia–mediana (intervalo interquartil) | 15 (10–20) |
| Tempo de uso do dermatoscópio por consulta, em minutos–mediana (intervalo interquartil) | 5 (3–7) |
| Modelo do dermatoscópio, n (%) | |
| DL100 | 6 (5,1) |
| DL200 | 2 (1,7) |
| DL3 | 24 (20,3) |
| DL4 | 34 (28,8) |
| Hybrid | 42 (35,6) |
| MiniHeine ou Heine | 8 (6,8) |
| Wellch Allyn | 1 (0,8) |
| Veos Canfield | 1 (0,8) |
| O aparelho toca a pele do paciente durante o exame? – n (%) | |
| Sim | 92 (78) |
| Não | 26 (22) |
| Onde guarda o dermatoscópio? – n (%) | |
| Jaleco | 68 (57,6) |
| Mesa de trabalho | 76 (64,4) |
| Armário | 21 (17,8) |
| Estojo | 15 (12,7) |
| Usa o dermatoscópio no consultório? – n (%) | |
| Sim | 102 (86,4) |
| Não | 16 (13,6) |
| Usa o dermatoscópio no hospital? – n (%) | |
| Sim | 64 (54,2) |
| Não | 54 (45,8) |
| Usa o dermatoscópio em pacientes internados? – n (%) | |
| Sim | 39 (33) |
| Não | 79 (67) |
| Usa o dermatoscópio em UTI? – n (%) | |
| Sim | 20 (17) |
| Não | 98 (83) |
| Atendeu paciente internado em isolamento por bactéria multirresistente nos últimos 30 dias? – n (%) | |
| Sim | 15 (12,7) |
| Não | 103 (87,3) |
| Usou o dermatoscópio em paciente internado em isolamento por bactéria multirresistente nos últimos 30 dias? – n (%) | |
| Sim | 2 (1,7) |
| Não | 116 (98,3) |
| Usa algum produto de limpeza para o dermatoscópio? – n (%) | |
| Sim | 92 (78) |
| Não | 26 (22) |
| Usa adaptador para smartphone? – n (%) | |
| Sim | 27 (22,9) |
| Não | 91 (77,1) |
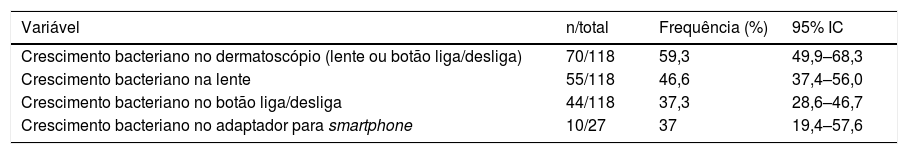
Dos dermatoscópios analisados, 46,6% tiveram crescimento de cocos gram‐positivos na lente e 37,3% no botão liga/desliga (tabela 2).
Frequência de colonização bacteriana por cocos gram‐positivos em dermatoscópios e adaptadores para smartphones
| Variável | n/total | Frequência (%) | 95% IC |
|---|---|---|---|
| Crescimento bacteriano no dermatoscópio (lente ou botão liga/desliga) | 70/118 | 59,3 | 49,9–68,3 |
| Crescimento bacteriano na lente | 55/118 | 46,6 | 37,4–56,0 |
| Crescimento bacteriano no botão liga/desliga | 44/118 | 37,3 | 28,6–46,7 |
| Crescimento bacteriano no adaptador para smartphone | 10/27 | 37 | 19,4–57,6 |
IC, intervalo de confiança.
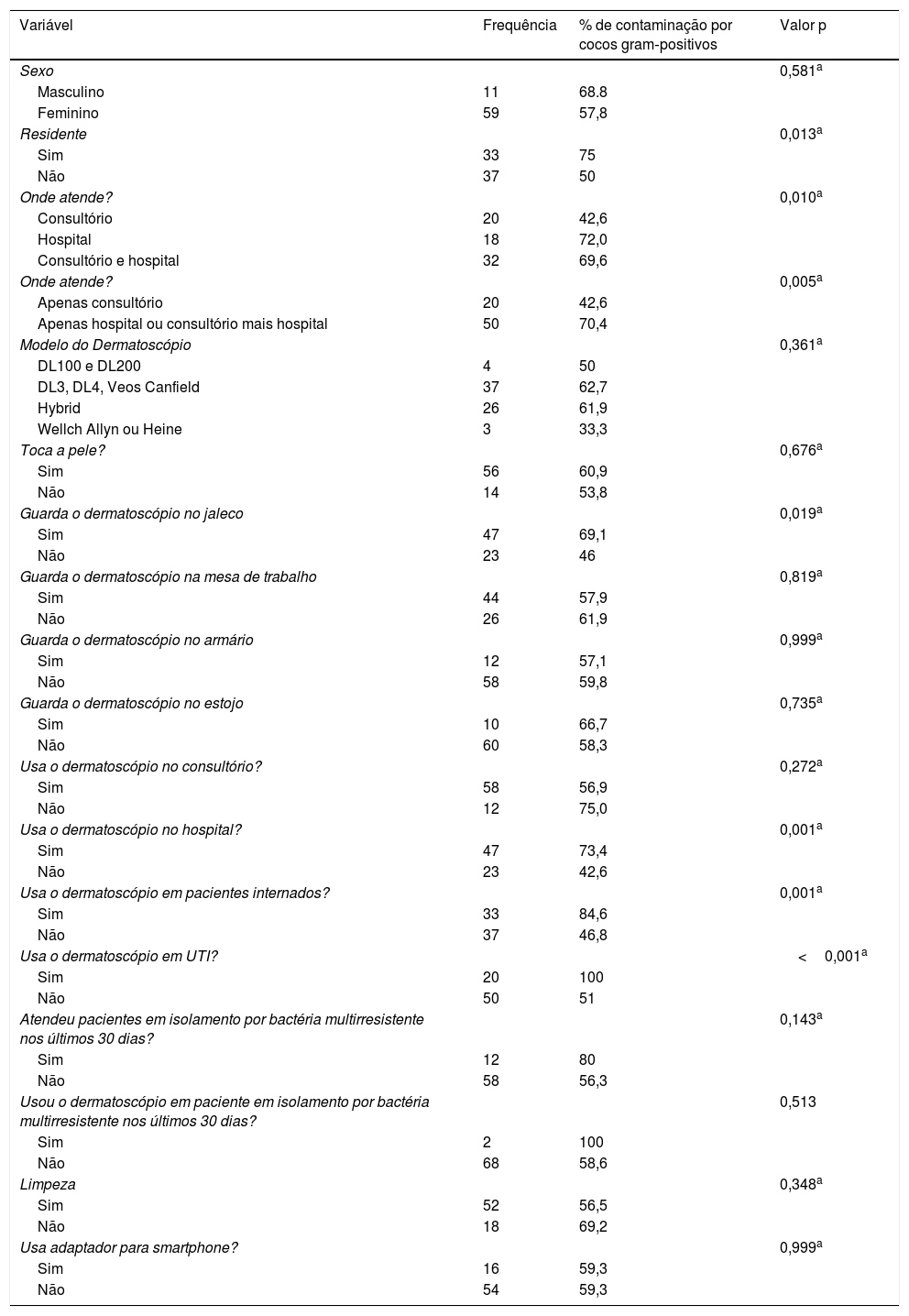
Houve uma maior frequência de crescimento de cocos gram‐positivos no sexo masculino, mas essa diferença não teve significância estatística (tabela 3). Ser residente, atender em hospital ou não exclusivamente em consultório, guardar o dermatoscópio no jaleco, usar o dermatoscópio no hospital, em pacientes internados e na Unidade de Terapia Intensiva foram significantemente associados com a presença de cocos gram‐positivos (p<0,05). Usar adaptador para smartphone não foi associado com contaminação dos dermatoscópios.
Variáveis categóricas e sua relação com a presença de contaminação bacteriana na lente ou no botão liga/desliga
| Variável | Frequência | % de contaminação por cocos gram‐positivos | Valor p |
|---|---|---|---|
| Sexo | 0,581a | ||
| Masculino | 11 | 68.8 | |
| Feminino | 59 | 57,8 | |
| Residente | 0,013a | ||
| Sim | 33 | 75 | |
| Não | 37 | 50 | |
| Onde atende? | 0,010a | ||
| Consultório | 20 | 42,6 | |
| Hospital | 18 | 72,0 | |
| Consultório e hospital | 32 | 69,6 | |
| Onde atende? | 0,005a | ||
| Apenas consultório | 20 | 42,6 | |
| Apenas hospital ou consultório mais hospital | 50 | 70,4 | |
| Modelo do Dermatoscópio | 0,361a | ||
| DL100 e DL200 | 4 | 50 | |
| DL3, DL4, Veos Canfield | 37 | 62,7 | |
| Hybrid | 26 | 61,9 | |
| Wellch Allyn ou Heine | 3 | 33,3 | |
| Toca a pele? | 0,676a | ||
| Sim | 56 | 60,9 | |
| Não | 14 | 53,8 | |
| Guarda o dermatoscópio no jaleco | 0,019a | ||
| Sim | 47 | 69,1 | |
| Não | 23 | 46 | |
| Guarda o dermatoscópio na mesa de trabalho | 0,819a | ||
| Sim | 44 | 57,9 | |
| Não | 26 | 61,9 | |
| Guarda o dermatoscópio no armário | 0,999a | ||
| Sim | 12 | 57,1 | |
| Não | 58 | 59,8 | |
| Guarda o dermatoscópio no estojo | 0,735a | ||
| Sim | 10 | 66,7 | |
| Não | 60 | 58,3 | |
| Usa o dermatoscópio no consultório? | 0,272a | ||
| Sim | 58 | 56,9 | |
| Não | 12 | 75,0 | |
| Usa o dermatoscópio no hospital? | 0,001a | ||
| Sim | 47 | 73,4 | |
| Não | 23 | 42,6 | |
| Usa o dermatoscópio em pacientes internados? | 0,001a | ||
| Sim | 33 | 84,6 | |
| Não | 37 | 46,8 | |
| Usa o dermatoscópio em UTI? | <0,001a | ||
| Sim | 20 | 100 | |
| Não | 50 | 51 | |
| Atendeu pacientes em isolamento por bactéria multirresistente nos últimos 30 dias? | 0,143a | ||
| Sim | 12 | 80 | |
| Não | 58 | 56,3 | |
| Usou o dermatoscópio em paciente em isolamento por bactéria multirresistente nos últimos 30 dias? | 0,513 | ||
| Sim | 2 | 100 | |
| Não | 68 | 58,6 | |
| Limpeza | 0,348a | ||
| Sim | 52 | 56,5 | |
| Não | 18 | 69,2 | |
| Usa adaptador para smartphone? | 0,999a | ||
| Sim | 16 | 59,3 | |
| Não | 54 | 59,3 |
UTI, Unidade de Terapia Intensiva.
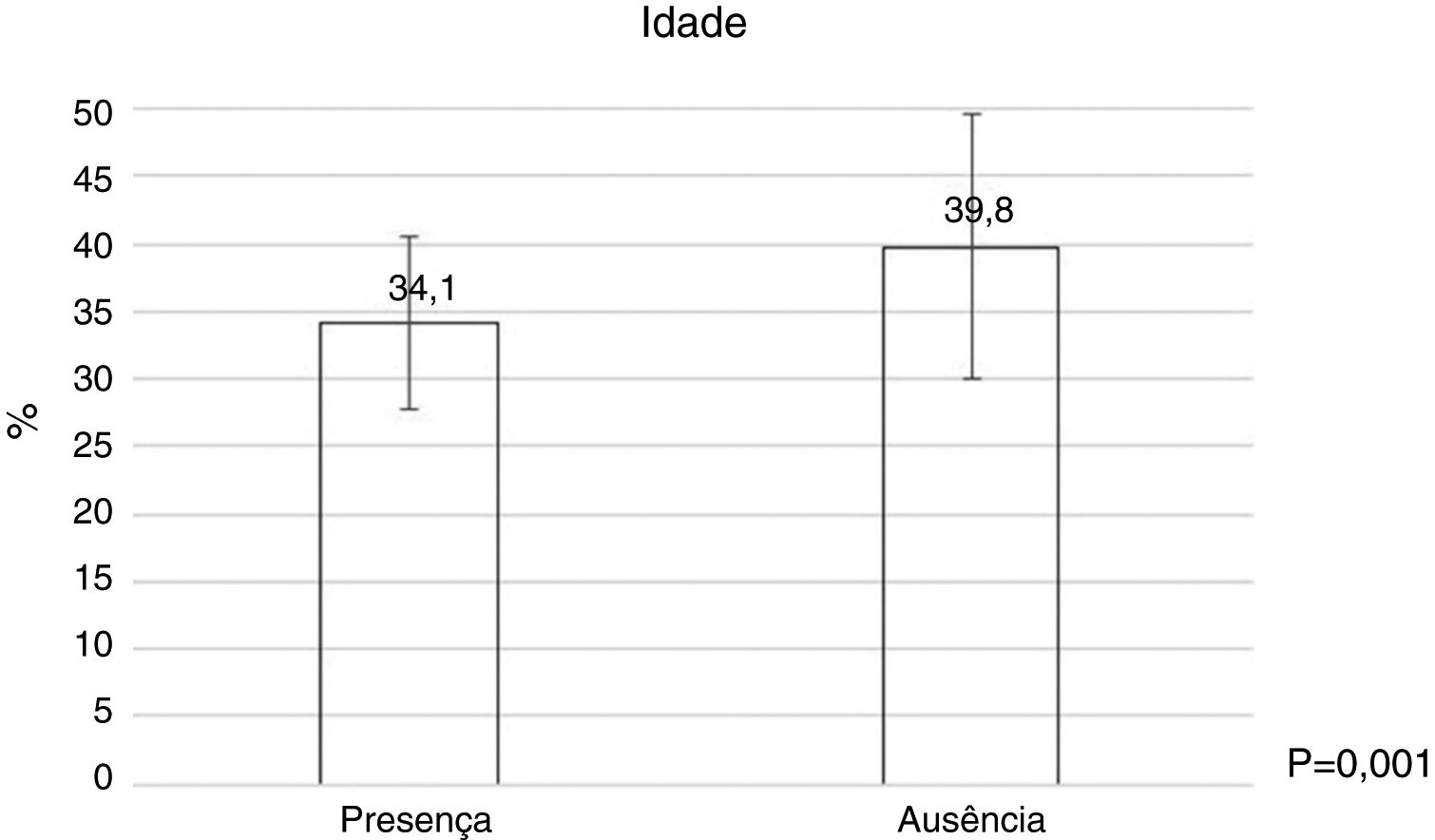
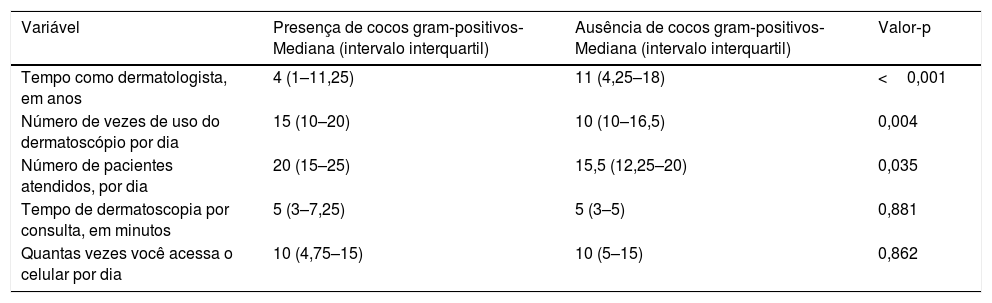
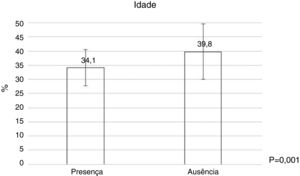
Dermatologistas mais jovens (fig. 2) e com menos tempo de profissão (tabela 4) tinham maior presença bacteriana, assim como foi observado uma relação estatisticamente significativa entre o número de pacientes atendidos por dia e o número de vezes que usava o dermatoscópio ao dia (tabela 4).
Variáveis numéricas e sua relação com a presença ou ausência de contaminação bacteriana na lente ou no botão liga/desliga
| Variável | Presença de cocos gram‐positivos‐ Mediana (intervalo interquartil) | Ausência de cocos gram‐positivos‐ Mediana (intervalo interquartil) | Valor‐p |
|---|---|---|---|
| Tempo como dermatologista, em anos | 4 (1–11,25) | 11 (4,25–18) | <0,001 |
| Número de vezes de uso do dermatoscópio por dia | 15 (10–20) | 10 (10–16,5) | 0,004 |
| Número de pacientes atendidos, por dia | 20 (15–25) | 15,5 (12,25–20) | 0,035 |
| Tempo de dermatoscopia por consulta, em minutos | 5 (3–7,25) | 5 (3–5) | 0,881 |
| Quantas vezes você acessa o celular por dia | 10 (4,75–15) | 10 (5–15) | 0,862 |
Teste estatístico usado: Mann‐Whitney.
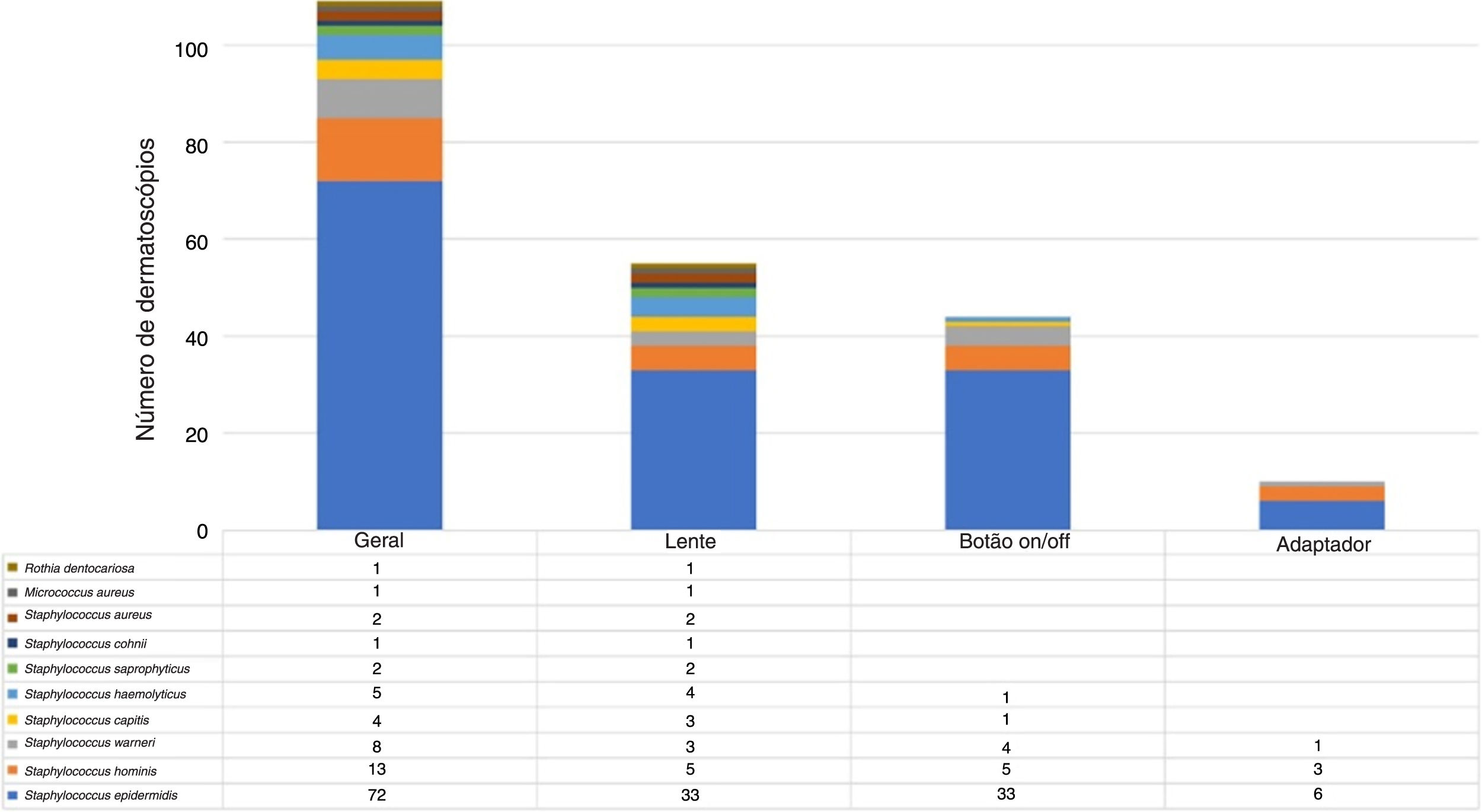
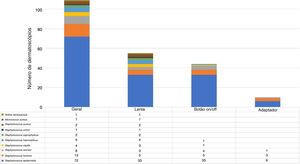
Os microrganismos mais frequentemente encontrados foram S. epidermidis, S. hominis e S. warneri. S. aureus foi detectado apenas na lente (fig. 3).
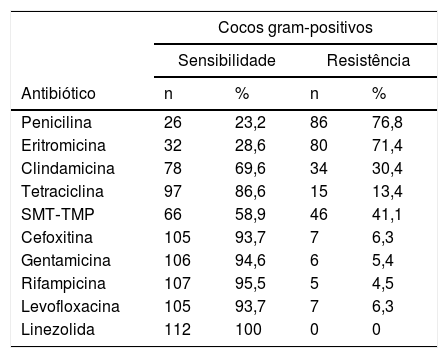
As maiores taxas de resistência dos cocos gram‐positivos foram observadas frente à penicilina, eritromicina, sulfametoxazol‐trimetoprima (SMT‐TMP) e clindamicina (tabela 5). A resistência dos cocos gram‐positivos à cefoxitina foi de 6,6% e nenhum microrganismo apresentava resistência à linezolida.
Perfil de resistência antimicrobiana dos isolados de cocos gram‐positivos obtidos de dermatoscópios e adaptadores para smartphones
| Cocos gram‐positivos | ||||
|---|---|---|---|---|
| Sensibilidade | Resistência | |||
| Antibiótico | n | % | n | % |
| Penicilina | 26 | 23,2 | 86 | 76,8 |
| Eritromicina | 32 | 28,6 | 80 | 71,4 |
| Clindamicina | 78 | 69,6 | 34 | 30,4 |
| Tetraciclina | 97 | 86,6 | 15 | 13,4 |
| SMT‐TMP | 66 | 58,9 | 46 | 41,1 |
| Cefoxitina | 105 | 93,7 | 7 | 6,3 |
| Gentamicina | 106 | 94,6 | 6 | 5,4 |
| Rifampicina | 107 | 95,5 | 5 | 4,5 |
| Levofloxacina | 105 | 93,7 | 7 | 6,3 |
| Linezolida | 112 | 100 | 0 | 0 |
SMT‐TMP, sulfametoxazol‐trimetoprima.
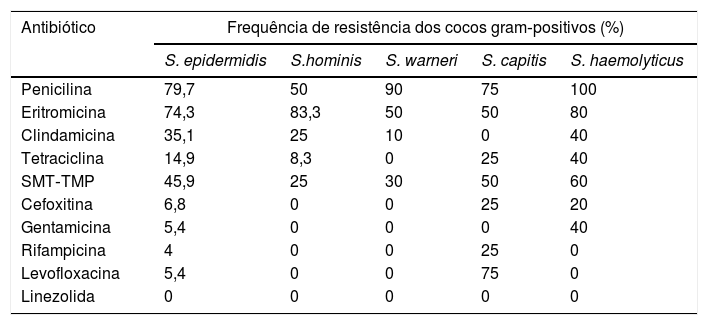
S. epidermidis apresentou alta taxa de resistência à penicilina, eritromicina e SMP‐TMP, enquanto S. hominis apresentou maior resistência à eritromicina em relação à penicilina. S. capitis apresentou altas taxas de resistência a diversos antibióticos, mas nenhum caso de resistência à clindamicina e gentamicina. As maiores taxas de resistência à penicilina foram verificadas com S. warneri e S. haemolyticus. Todos os isolados de S. haemolyticus eram resistentes à penicilina, além de apresentar as maiores frequências relativas de resistência à clindamicina, tetraciclina, SMT‐TMP e gentamicina (tabela 6).
Perfil de resistência antimicrobiana dos isolados dos cocos gram‐positivos mais frequentes obtidos de dermatoscópios e adaptadores para smartphones
| Antibiótico | Frequência de resistência dos cocos gram‐positivos (%) | ||||
|---|---|---|---|---|---|
| S. epidermidis | S.hominis | S. warneri | S. capitis | S. haemolyticus | |
| Penicilina | 79,7 | 50 | 90 | 75 | 100 |
| Eritromicina | 74,3 | 83,3 | 50 | 50 | 80 |
| Clindamicina | 35,1 | 25 | 10 | 0 | 40 |
| Tetraciclina | 14,9 | 8,3 | 0 | 25 | 40 |
| SMT‐TMP | 45,9 | 25 | 30 | 50 | 60 |
| Cefoxitina | 6,8 | 0 | 0 | 25 | 20 |
| Gentamicina | 5,4 | 0 | 0 | 0 | 40 |
| Rifampicina | 4 | 0 | 0 | 25 | 0 |
| Levofloxacina | 5,4 | 0 | 0 | 75 | 0 |
| Linezolida | 0 | 0 | 0 | 0 | 0 |
SMT‐TMP, sulfametoxazol‐trimetoprima.
Os dermatoscópios foram colonizados principalmente por bactérias da microbiota cutânea (SCoN), S. epidermidis foi o mais frequentemente encontrado, o que está de acordo com a literatura.9,10 Esse microrganismo tornou‐se a causa mais comum de bacteremia primária e infecção de dispositivos médicos, como cateteres, particularmente em indivíduos imunocomprometidos e neonatos. Em contraste com S. aureus, que é muito mais virulento e sintetiza uma matriz de toxinas e outros fatores de virulência, o principal fator de virulência definido associado a S. epidermidis é sua capacidade de formar biofilme e colonizar biomateriais. Em contraste com o S. aureus, cujo principal sítio são as narinas, o S. epidermidis pode ser facilmente transferido para a pele de outros indivíduos através do simples contato.11
Tanto S. hominis – o segundo microrganismo mais encontrado em nosso estudo e que na literatura é citado como um dos três SCoN mais encontrados em hemoculturas de neonatos e em pacientes imunossuprimidos12 – quanto S. warneri – o terceiro mais frequente nos dermatoscópios do nosso estudo e citado em alguns artigos como o segundo mais frequente dos SCoN13,14 – têm capacidade de formar biofilme15,16 e têm sido associados com bacteremia, septicemia e endocardite.16,17
S. capitis raramente causa infecção em adultos, mas tem sido relatada uma suscetibilidade decrescente à vancomicina e uma população clonal de S. capitis resistente à meticilina com heterorresistência à vancomicina se espalhou entre várias UTIs neonatais na França e em outros países.18 Ehlersson et al. avaliaram isolados de S. capitis de hemoculturas de neonatos na Suécia e acharam uma taxa de resistência à cefoxitina e gentamicina de 75%, apenas 3% de resistência à eritromicina e nenhum caso de resistência à norfloxacina e SMT‐TMP.19
Verificamos que o dermatoscópio pode carrear S. aureus. Essa bactéria coloniza a camada superficial da pele, sobrevive por curto período e é frequentemente adquirida por profissionais de saúde durante contato direto com o paciente (colonizado ou infectado), ambiente, superfícies próximas ao paciente, produtos e equipamentos contaminados,20,21 tanto que foi detectado em nosso estudo justamente na lente e não no adaptador ou no botão liga/desliga, locais esses que poderiam estar mais relacionados ao contato direto com a pele do profissional de saúde.
As mãos dos profissionais de saúde podem ser persistentemente colonizadas por microrganismos patogênicos (como S. aureus, bacilos gram‐negativos ou leveduras) que, em áreas críticas como unidades de terapia intensiva e unidades com pacientes imunocomprometidos ou cirúrgicos, podem ter um importante papel adicional como causa de infecção relacionada à assistência à saúde.22
No nosso estudo, a resistência à cefoxitina foi considerada baixa. Resistência à eritromicina foi destacadamente alta nos isolados de S. hominis do nosso estudo (83,3%), fato já citado em outros trabalhos.23 Szczuka et al. encontraram uma taxa de resistência à eritromicina de 75% em isolados oriundos de sangue e ferida cirúrgica de pacientes hospitalizados.24 As maiores taxas de resistência a diversos antibióticos foram observadas no S. haemolyticus, o que já foi observado em outras publicações.23 Alguns estudos recentes têm citado S. haemolyticus como o segundo SCoN, depois do S. epidermidis, mais frequentemente isolado de casos clínicos, inclusive de pacientes em sepse.25–27
Este é o primeiro estudo na literatura que avalia resistência antimicrobiana de SCoN em dermatoscópios e em adaptadores para smarphones. Conhecer o padrão de resistência dos SCoN dos dermatoscópios, e da nossa própria pele, passa a ser importante quando consideramos que esse grupo bacteriano pode agir como reservatório de genes de resistência antimicrobiana por transferência horizontal entre espécies estafilocócicas, até serem adquiridos por S. aureus26,28,29 e, posteriormente, serem transferidos entre o dermatologista e seus pacientes, especialmente médicos que atendem em ambiente hospitalar, em que as taxas de resistência antimicrobiana são maiores.26 Segundo uma coorte com 2.518 pacientes, feita em Israel, os padrões de resistência de SCoN obtidos por hemoculturas, mesmo quando contaminantes, poderiam ajudar a prever a mortalidade e corrigir a antibioticoterapia empírica.30
Uma das limitações do nosso estudo inclui a não pesquisa de bactérias gram‐negativas, fungos e vírus. Além disso, o pequeno número de adaptadores não permitiu definir melhor se as diferenças de frequências tivessem significância estatística.
ConclusãoNós identificamos uma alta frequência de cocos gram‐positivos nos equipamentos testados. Staphylococcus epidermidis foi o mais observado, tanto na lente, no botão liga/desliga quanto no adaptador. S. aureus foi detectado apenas na lente.
Este estudo reflete a associação entre o examinador dermatologista e a contaminação dos dermatoscópios. Os profissionais devem adotar medidas para prevenir a contaminação de seus aparelhos e a colonização cruzada com seus pacientes.
Suporte financeiroCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Conselho Nacional de Pesquisa e Desenvolvimento Tecnológico (CNPq) e Fundação de Amparo à Pesquisa do Rio Grande do Sul (Fapergs).
Contribuição dos autoresMaurício de Quadros: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Roberto Carlos Freitas Bugs: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Renata de Oliveira Soares: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Adriana Medianeira Rossato: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Lisiane da Luz Rocha: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Pedro Alves d’Azevedo: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Quadros M, Bugs RCF, Soares RO, Rossato AM, Rocha LL, d’Azevedo PA. Identifying gram‐positive cocci in dermatoscopes and smartphone adapters using MALDI‐TOF MS: a cross‐sectional study. An Bras Dermatol. 2020;95:298–306.
Trabalho realizado no Laboratório de Cocos Gram‐Positivos, Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, RS, Brasil.