Os relatos sobre os fármacos causadores de reações cutâneas adversas na China são indefinidos; diferentes regiões relataram que o espectro de medicamentos difere substancialmente em diferentes condições clínicas.
ObjetivoInvestigar os fármacos que causaram reações cutâneas.
MétodosOs relatos de reações adversas a medicamentos da região central da China foram coletados e divididos em dois grupos: reações cutâneas adversas e reações cutâneas adversas graves. Os casos foram revisados retrospectivamente para identificar os fármacos responsáveis.
ResultadosA proporção entre homens e mulheres foi igual tanto para reações cutâneas adversas quanto reações cutâneas adversas graves. Nas reações cutâneas adversas (n=482), a maior incidência foi observada na faixa entre 51‐60 anos e os três principais medicamentos causadores foram antibióticos (48%), medicamentos tradicionais chineses (16%) e alopurinol (9%). Nas reações cutâneas adversas graves(n=126), a maior incidência foi observada na faixa entre 41–50 anos e os três principais medicamentos causadores foram sedativos‐hipnóticos e antiepilépticos (39%), antibióticos (22%) e alopurinol (15%). A carbamazepina foi o fármaco mais frequentemente usado de forma isolada (16/18) em sedativos‐hipnóticos e antiepilépticos. Dentre os antibióticos, os β‐lactâmicos foram o que mais induziram reações cutâneas adversas e reações cutâneas adversas graves.
Limitações do estudoO pequeno tamanho da amostra, o desenho retrospectivo, a coleta de reações cutâneas adversas e reações cutâneas adversas graves em diferentes intervalos de tempo e locais e a exclusão de pacientes que tomavam mais de cinco medicamentos são limitações do estudo.
ConclusõesO sexo dos pacientes não afetou a incidência de reações cutâneas adversas e reações cutâneas adversas graves. Os três principais medicamentos que induziram reações cutâneas adversas foram antibióticos, medicamentos tradicionais chineses e alopurinol, enquanto aqueles que induziram reações cutâneas adversas graves foram sedativos‐hipnóticos e antiepilépticos, antibióticos e alopurinol. A carbamazepina foi o fármaco usado isoladamente que mais frequentemente induziu reações cutâneas adversas graves. Dentre os antibióticos, os β‐lactâmicos foram o que mais induziram reações cutâneas adversas e reações cutâneas adversas graves.
A erupção por medicamentos é uma reação cutânea simétrica que pode ser observada durante os tratamentos. É conhecida como reação cutânea adversa (RCA) induzida por medicamentos, farmacodermia ou dermatite medicamentosa. Essa condição é geralmente de pequena gravidade e pode desaparecer após a interrupção do uso do medicamento causador; no entanto, alguns casos graves podem ser fatais. Segundo relatos, a erupção por medicamentos afetou mais de 7% da população em geral; estima‐se que 7.000 mortes foram causadas por RCA.1,2 A incidência de RCA graves (RCAG) é geralmente muito baixa. Por exemplo, são observados cerca de 5,76 casos de síndrome de Stevens‐Johnsons (SSJ) e de necrólise epidérmica tóxica (NET) em cada um milhão de pessoas por ano.3–5 Quando tais reações são observadas, a literatura indica que a mortalidade total pode ser de 30%,6 38%7 ou 32%,8.
Os principais fármacos que induzem erupção medicamentosa grave são antibióticos, antiepilépticos, anti‐inflamatórios não esteroidais (AINEs) e alopurinol. Os dados da literatura indicam que os principais medicamentos causadores foram os antibióticos (NET, 40%; SSJ, 40%) e analgésicos (NET, 23%; SSJ, 33%); entre os antibióticos, sulfa e β‐lactâmicos foram os principais agentes causadores de RCA.9,10 O espectro de fármacos que induzem RCA varia substancialmente em diferentes condições clínicas. A identificação dos medicamentos causadores não só permite a interrupção precoce do processo, mas também melhora o prognóstico. Considerando‐se que os dados epidemiológicos sobre RCA são limitados na China, os autores analisaram pacientes hospitalizados com erupção medicamentosa na China central para identificar os principais medicamentos que causam RCA na população chinesa.
MétodosPacientesEste foi um estudo retrospectivo observacional que incluiu 482 pacientes com RCA admitidos no Hospital N°. 1 de Wuhan de 2010 e 2011 e 126 pacientes com RCAG internados no Hospital Xiangya de 2009 a 2014 (tabela 1). As informações gerais dos pacientes, os medicamentos causadores, manifestações clínicas e os desfechos foram analisados. O diagnóstico de erupção medicamentosa foi feito com base na história de uso de medicação do paciente, manifestações clínicas e período de latência, descartaram‐se outras doenças infecciosas e erupções cutâneas semelhantes. Observou‐se redução ou eliminação completa das erupções após a interrupção do fármaco causador. A erupção medicamentosa manifestou‐se de maneira típica e simétrica, com coloração vermelha brilhante e prurido. Se os pacientes tomassem vários medicamentos, a determinação do fármaco causador era mais difícil. Nesses casos, o medicamento suspeito foi determinado pelos médicos assistentes. O estudo incluiu apenas casos nos quais os fármacos causadores foram identificados de forma conclusiva em pacientes que não usassem mais do que cinco medicamentos. Casos de RCA com medicamentos apenas prováveis ou desconhecidos foram excluídos.
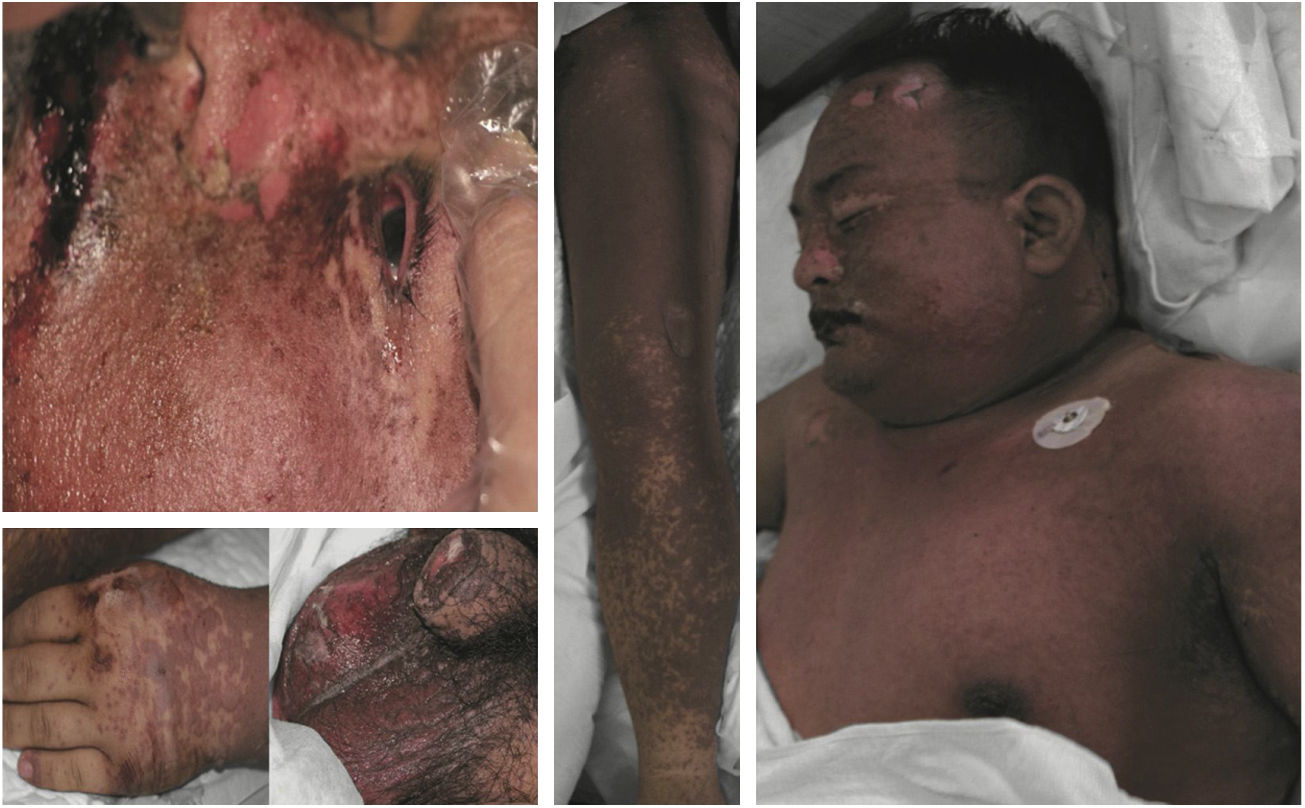
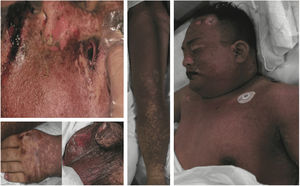
Classificação das manifestações clínicasNo presente estudo, as erupções foram divididas em duas categorias: 1) RCA: erupção fixa medicamentosa, erupção urticariforme, erupção morbiliforme‐escarlatiniforme, erupção medicamentosa eczematosa, erupção medicamentosa púrpura‐símile, eritema multiforme, erupção medicamentosa acneiforme, erupção medicamentosa por fotossensibilidade etc.; 2) RCAG: eritema multiforme grave ou SSJ, erupção medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), epidermólise bolhosa, NET, eritrodermia e pustulose exantemática.9,11 A figura 1 apresenta um paciente com NET.
Manifestações dermatológicas de um paciente com necrólise epidérmica tóxica. Mais de 30% da área total da superfície corporal foi acometida. A descamação mucocutânea foi observada na boca, nos olhos e na área anogenital. Observou‐se descolamento epidérmico no pescoço, região dorsal e extremidades.
Os fármacos que mais induziram erupção medicamentosa foram divididos nas seguintes categorias: (1) antibióticos; (2) analgésicos‐antipiréticos, tais como aspirina e paracetamol, entre outros; (3) hipnóticos sedativos e drogas antiepilépticas, como fenobarbital, fenitoína sódica, carbamazepina etc.; (4) soros e vacinas, tais como antitoxina tetânica, vacina antirrábica, soro antiofídico etc.; (5) agentes biológicos. Além disso, o medicamento anti‐hiperuricemia alopurinol, medicamentos antitireoidianos e fenotiazínicos também foram incluídos.
Análise estatísticaTodas as variáveis numéricas deste artigo foram apresentadas como média±erro padrão da média (EPM). O teste t de Student foi aplicado nas variáveis numéricas de amostras independentes. Nas variáveis categóricas (dados de grupos enumerados), usou‐se o teste de qui‐quadrado. O software SPSS v. 13.0 (SPSS, Inc. – Chicago, IL, EUA) foi usado para a análise dos dados. Valores‐p <0,05 foram considerados significativos.
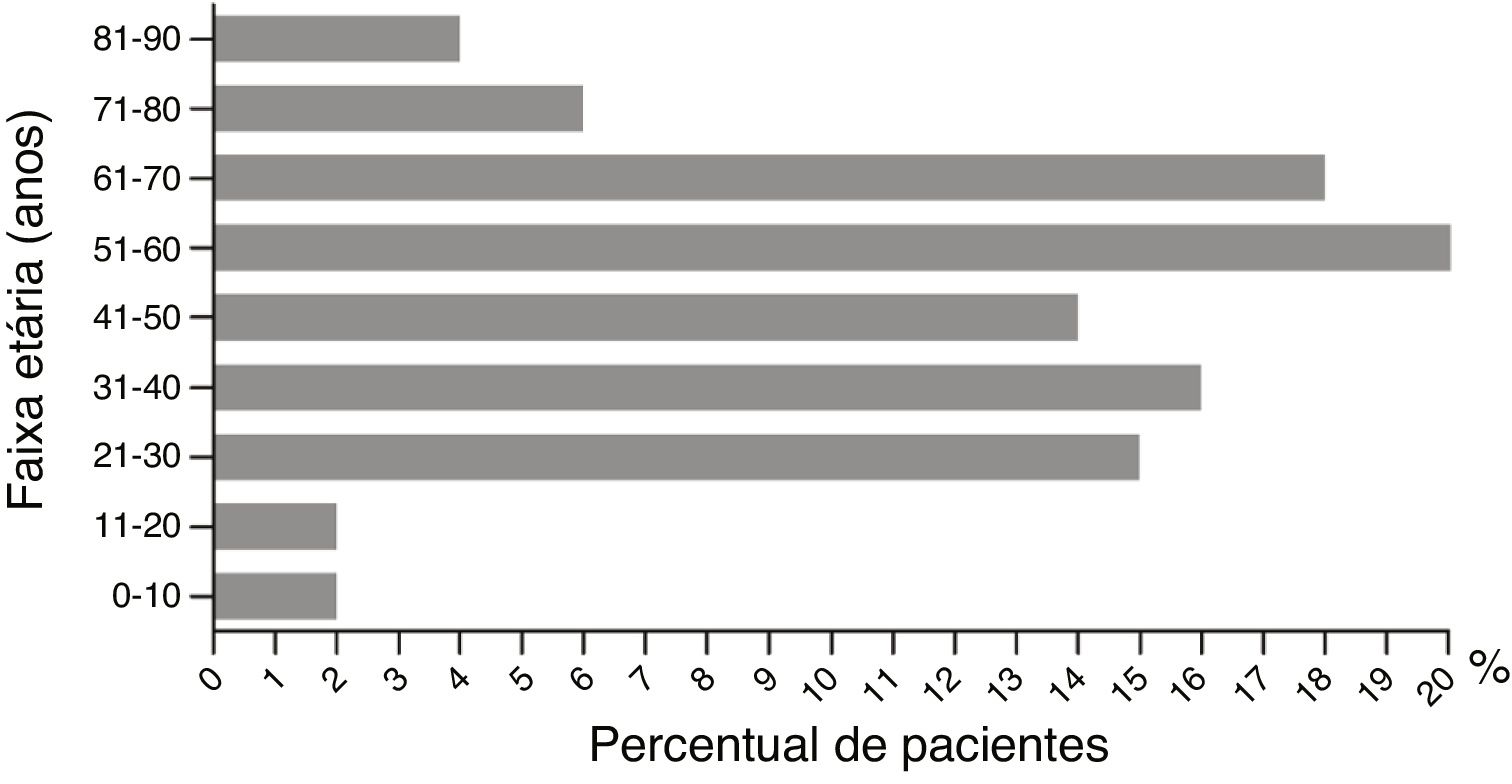
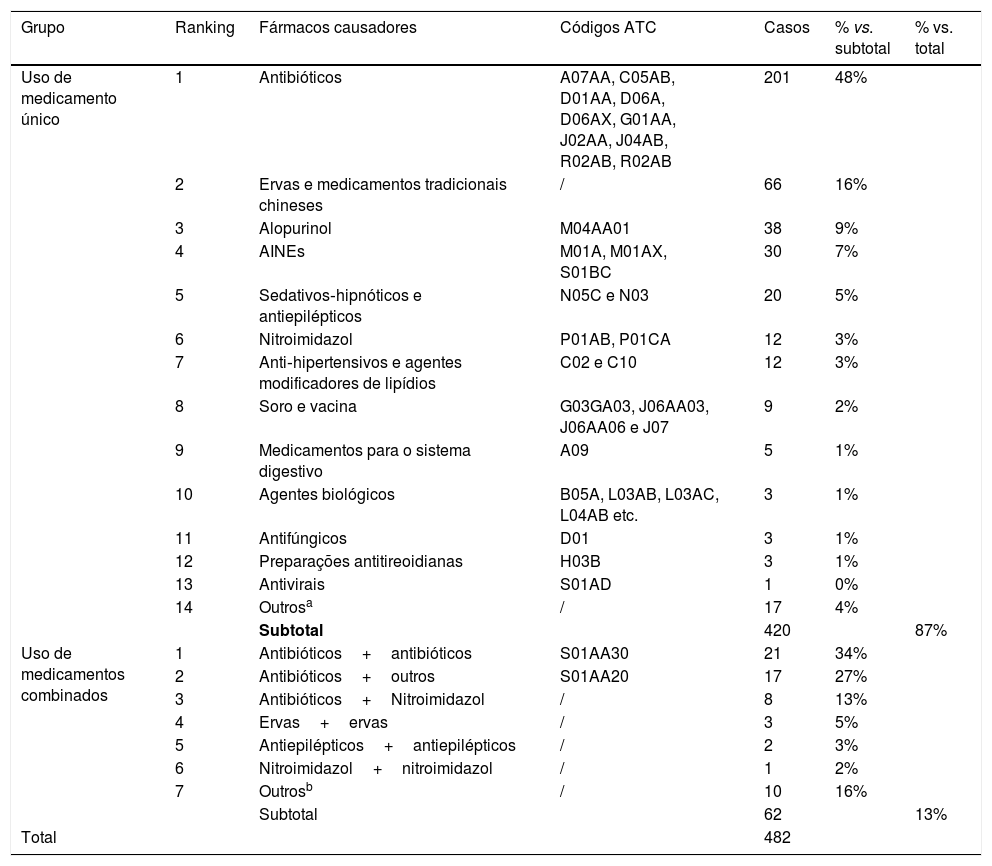
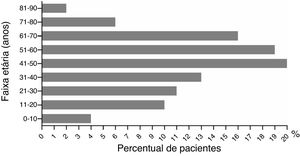
Resultados482 casos de RCAEntre os 482 casos de RCA no Hospital Wuhan n° 1, a diferença entre o número de pacientes do sexo masculino e feminino não foi estatisticamente significativa (49%, 238/482 vs. 51%, 244/482; p> 0,05). A distribuição etária entre homens e mulheres não foi estatisticamente diferente (48,71±1,90 vs. 46,24±1,26 anos; p> 0,05). A maior incidência de RCA foi observada na faixa entre 51 e 60 anos; as faixas etárias entre 71 e 80, 81 e 90, 0 e 10 e 11 e 20 anos apresentaram a menor incidência (fig. 2). Os pacientes foram divididos em dois grupos: “medicamento único” e “medicamentos combinados”. Os fármacos causadores foram então subdivididos em subcategorias (tabela 2). No grupo medicamento único, os mais frequentes foram antibióticos (48%, 201/420), seguidos por medicamentos tradicionais chineses (16%, 66/420) e alopurinol (9%, 38/420). Esses foram seguidos por AINEs, drogas antiepilépticas hipnóticas sedativas, nitroimidazol, anti‐hipertensivos e agentes modificadores de lipídios, soros e vacinas, medicamentos para o sistema digestivo, agentes biológicos, antifúngicos, antitireoidianos e antivirais. Outros agentes incluíram fármacos contra hiperplasia prostática, pesticidas e manga, entre outros. No grupo medicamentos combinados, a combinação mais comum foi a de antibióticos com outros fármacos. Nesse grupo, 34% (21/62) dos participantes associação de antibióticos. Antibióticos combinados com outros fármacos, como soros, analgésicos antipiréticos, anticoagulantes, antivirais e medicamentos tradicionais chineses, foram observados em 27% (17/62) dos pacientes desse grupo. A terceira principal combinação foi a de antibióticos com nitroimidazol, representando 13% (8/62), seguida pela combinação de dois medicamentos tradicionais chineses, combinação de dois medicamentos antiepiléticos e combinação de dois nitroimidazólicos.
Categorias de fármacos causadores em 482 casos de reações adversas cutâneas
| Grupo | Ranking | Fármacos causadores | Códigos ATC | Casos | % vs. subtotal | % vs. total |
|---|---|---|---|---|---|---|
| Uso de medicamento único | 1 | Antibióticos | A07AA, C05AB, D01AA, D06A, D06AX, G01AA, J02AA, J04AB, R02AB, R02AB | 201 | 48% | |
| 2 | Ervas e medicamentos tradicionais chineses | / | 66 | 16% | ||
| 3 | Alopurinol | M04AA01 | 38 | 9% | ||
| 4 | AINEs | M01A, M01AX, S01BC | 30 | 7% | ||
| 5 | Sedativos‐hipnóticos e antiepilépticos | N05C e N03 | 20 | 5% | ||
| 6 | Nitroimidazol | P01AB, P01CA | 12 | 3% | ||
| 7 | Anti‐hipertensivos e agentes modificadores de lipídios | C02 e C10 | 12 | 3% | ||
| 8 | Soro e vacina | G03GA03, J06AA03, J06AA06 e J07 | 9 | 2% | ||
| 9 | Medicamentos para o sistema digestivo | A09 | 5 | 1% | ||
| 10 | Agentes biológicos | B05A, L03AB, L03AC, L04AB etc. | 3 | 1% | ||
| 11 | Antifúngicos | D01 | 3 | 1% | ||
| 12 | Preparações antitireoidianas | H03B | 3 | 1% | ||
| 13 | Antivirais | S01AD | 1 | 0% | ||
| 14 | Outrosa | / | 17 | 4% | ||
| Subtotal | 420 | 87% | ||||
| Uso de medicamentos combinados | 1 | Antibióticos+antibióticos | S01AA30 | 21 | 34% | |
| 2 | Antibióticos+outros | S01AA20 | 17 | 27% | ||
| 3 | Antibióticos+Nitroimidazol | / | 8 | 13% | ||
| 4 | Ervas+ervas | / | 3 | 5% | ||
| 5 | Antiepilépticos+antiepilépticos | / | 2 | 3% | ||
| 6 | Nitroimidazol+nitroimidazol | / | 1 | 2% | ||
| 7 | Outrosb | / | 10 | 16% | ||
| Subtotal | 62 | 13% | ||||
| Total | 482 |
O sistema de codificação do Anatomical Therapeutic Chemical (ATC) divide os medicamentos em diferentes grupos de acordo com o órgão ou sistema em que atuam, ou com suas características terapêuticas e químicas.
Entre esses antibióticos (tabela 3), os β‐lactâmicos foram os mais frequentemente usados (46%, 92/201), seguidos pelas furanonas (22%, 44/201), lincomicina (12%, 24/201), quinolona (12%, 24/201), macrolídeos (4%) e sulfonamidas (3%). Entre os β‐lactâmicos, a amoxicilina foi a mais usada (43%, 40/92). Entre as furanonas, a mais comum foi o nifuratel (95%, 42/44).
Categorias de fármacos causadores em 482 casos de reações adversas cutâneas graves
| Fármaco | Códigos ATC | Casos | % |
|---|---|---|---|
| β‐lactâmicos | J01C, J01CR, J01D | 92 | 46% |
| Furanona | D08AF, J01XE, P01CC | 44 | 22% |
| Lincomicina | J01FF02 | 24 | 12% |
| Quinolona | J01M, J01MA, J01MBS01AE | 24 | 12% |
| Macrolídeos | J01FA | 8 | 4% |
| Sulfonamidas | A07AB, C03BA, C03CA, D06BA, G01AE, S01AB | 7 | 3% |
| Outras | / | 2 | 1% |
| Total | 201 | 100% |
O sistema de codificação Anatomical Therapeutic Chemical (ATC) divide os medicamentos em diferentes grupos de acordo com o órgão ou sistema nos quais atuam, ou com base em suas características terapêuticas e químicas.
126 casos de RCAGEntre os 126 casos de RCAG no Hospital Xiangya, 43,50% (385/885) dos pacientes usavam mais de cinco drogas. Os pacientes que tomavam mais de cinco drogas foram excluídos, uma vez que era excessivamente complicado determinar os medicamentos culpados e/ou fazer a análise estatística.
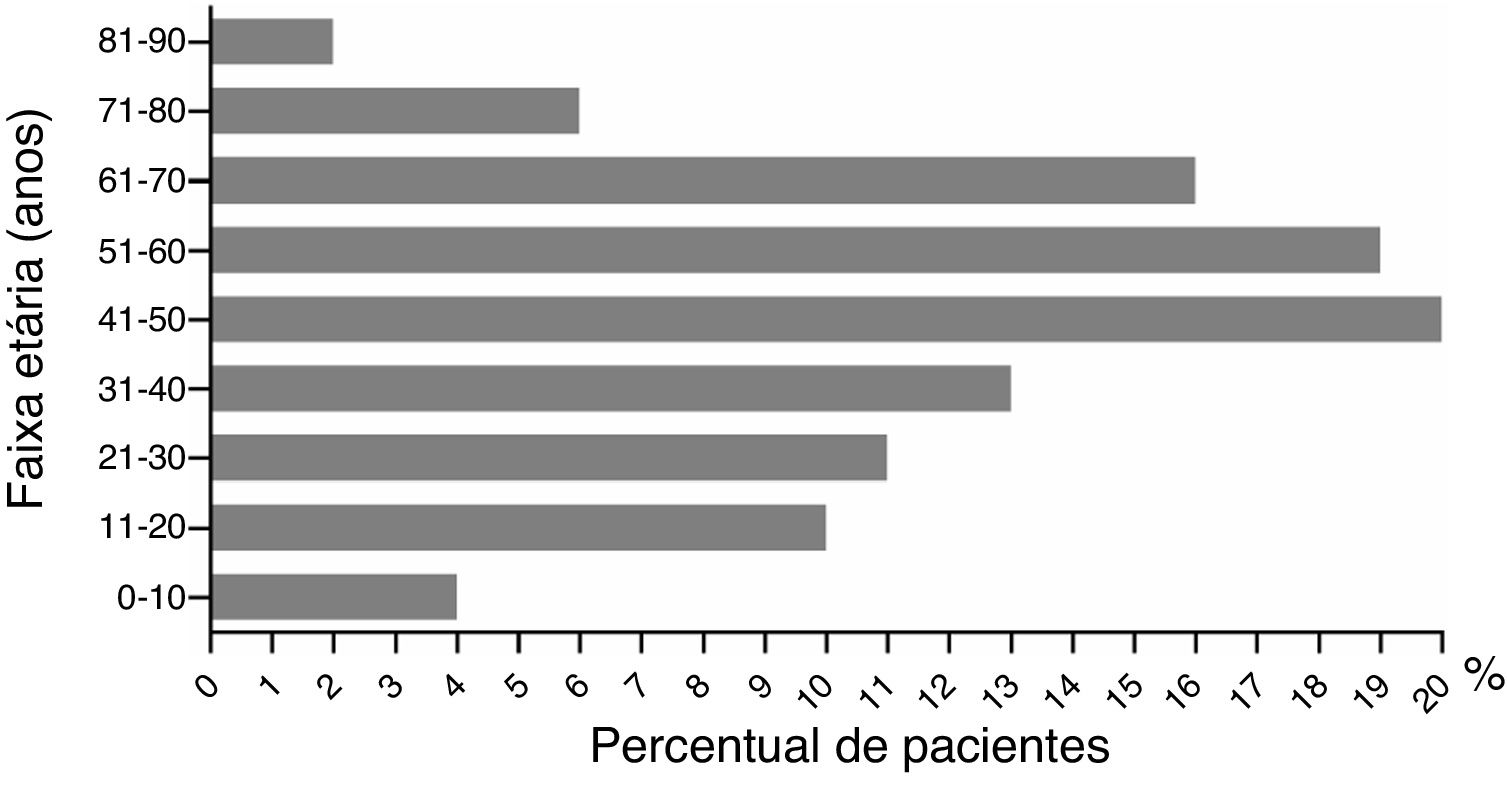
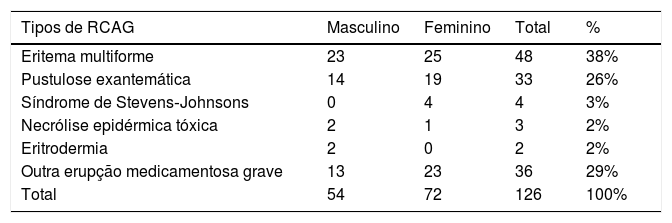
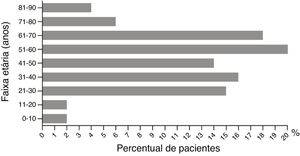
A razão entre homens e mulheres foi de 1 (43%, 54/126) para 1,33 (57%, 72/126; p> 0,05). A média de idade dos pacientes do sexo masculino foi de 48,70±2,65 vs. 43,79±2,30 anos entre as pacientes do sexo feminino (p> 0,05). A idade variou de 2 a 86 anos. Pacientes com idade inferior a 10 anos e aqueles entre 71 a 90 anos apresentaram as menores taxas de incidência: cinco (4%, 5/126) e dez casos (8%, 10/126), respectivamente (fig. 3). A maior incidência foi observada na faixa entre 41 a 50 anos, com proporção de 16% (20/126). A tabela 4 apresenta os tipos dermatológicos de RCAG. O eritema multiforme grave foi o tipo mais comum de RCAG, representou 38% (48/126). O segundo tipo mais comum foi a pustulose exantemática, representou 26% (33/126). NET foi um tipo raro, representou 2% (3/126).
Tipos dermatológicos de 126 casos de reações cutâneas adversas graves
| Tipos de RCAG | Masculino | Feminino | Total | % |
|---|---|---|---|---|
| Eritema multiforme | 23 | 25 | 48 | 38% |
| Pustulose exantemática | 14 | 19 | 33 | 26% |
| Síndrome de Stevens‐Johnsons | 0 | 4 | 4 | 3% |
| Necrólise epidérmica tóxica | 2 | 1 | 3 | 2% |
| Eritrodermia | 2 | 0 | 2 | 2% |
| Outra erupção medicamentosa grave | 13 | 23 | 36 | 29% |
| Total | 54 | 72 | 126 | 100% |
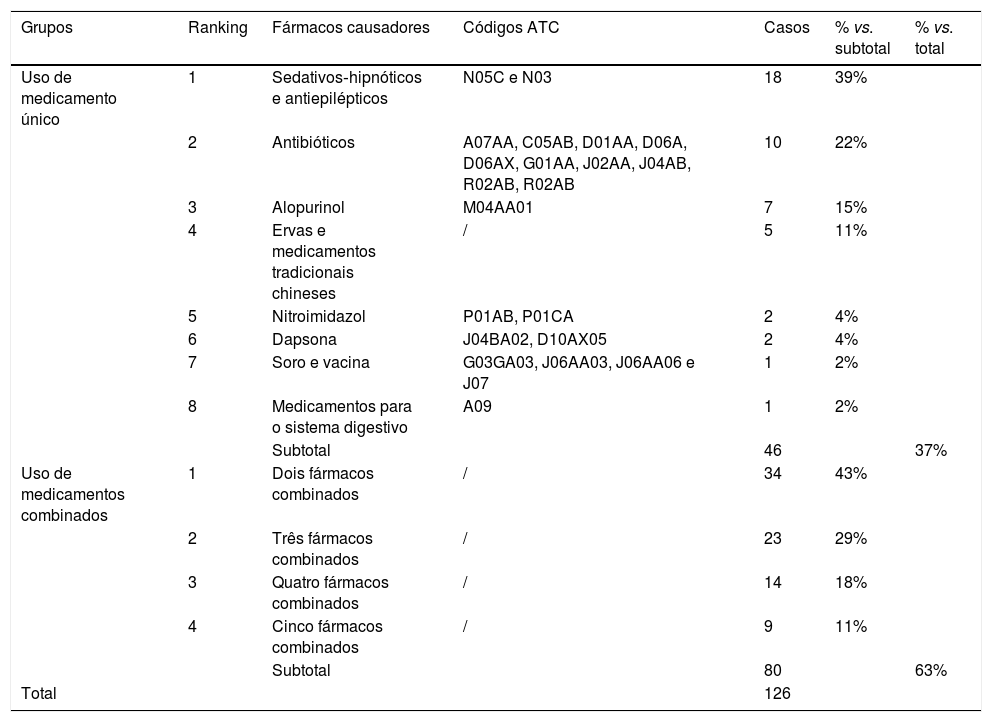
No grupo de medicamentos únicos, os mais comuns foram os sedativos‐hipnóticos e antiepilépticos, representaram 39% (18/46; tabela 5). Antibióticos (22%, 10/46) e alopurinol (15%, 7/46) foram a segunda e terceira categorias que mais frequentemente induziram RCAG. Eles foram seguidos por medicamentos tradicionais chineses ou a combinação desses com medicamentos ocidentais, nitroimidazol, dapsona, soro e vacina e medicamentos para o sistema digestivo. Outros agentes (como frutas, verduras e pílulas dietéticas) não foram incluídos no grupo de medicamentos isolados, uma vez que não induziram RCAG. Entre os sedativos‐hipnóticos e antiepilépticos, a carbamazepina foi o medicamento único mais usado (89%, 16/18). Entre os antibióticos, os β‐lactâmicos foram os que mais induziram RCAG.
Categorias de fármacos causadores em 126 casos de reações cutâneas adversas graves
| Grupos | Ranking | Fármacos causadores | Códigos ATC | Casos | % vs. subtotal | % vs. total |
|---|---|---|---|---|---|---|
| Uso de medicamento único | 1 | Sedativos‐hipnóticos e antiepilépticos | N05C e N03 | 18 | 39% | |
| 2 | Antibióticos | A07AA, C05AB, D01AA, D06A, D06AX, G01AA, J02AA, J04AB, R02AB, R02AB | 10 | 22% | ||
| 3 | Alopurinol | M04AA01 | 7 | 15% | ||
| 4 | Ervas e medicamentos tradicionais chineses | / | 5 | 11% | ||
| 5 | Nitroimidazol | P01AB, P01CA | 2 | 4% | ||
| 6 | Dapsona | J04BA02, D10AX05 | 2 | 4% | ||
| 7 | Soro e vacina | G03GA03, J06AA03, J06AA06 e J07 | 1 | 2% | ||
| 8 | Medicamentos para o sistema digestivo | A09 | 1 | 2% | ||
| Subtotal | 46 | 37% | ||||
| Uso de medicamentos combinados | 1 | Dois fármacos combinados | / | 34 | 43% | |
| 2 | Três fármacos combinados | / | 23 | 29% | ||
| 3 | Quatro fármacos combinados | / | 14 | 18% | ||
| 4 | Cinco fármacos combinados | / | 9 | 11% | ||
| Subtotal | 80 | 63% | ||||
| Total | 126 |
No grupo medicamentos combinados, considerando‐se que os fármacos foram combinados aleatoriamente, este estudo analisou apenas a frequência de combinações duplas, triplas, quádruplas e quíntuplas (tabela 5). A combinação dupla foi observada em 43% (34/80); a combinação tripla foi responsável por 29% (23/80); a quádrupla, por 18% (14/80) e a quíntupla, por 11% (9/80). A combinação de fármacos foi mais complexa entre os casos de RCAG do que RCA; por exemplo, alguns pacientes tinham antibióticos combinados com antivirais, soros ou medicamentos tradicionais chineses.
DiscussãoNeste estudo, foram avaliados 608 casos de erupção medicamentosa em uma amostra de pacientes da China central. A análise de 482 casos de RCA sugere que homens e mulheres tinham chances iguais de desenvolver RCA, cuja incidência foi maior na faixa entre 51 e 60 anos. Os principais medicamentos suspeitos pertenceram às seguintes categorias: 1) antibióticos: os β‐lactâmicos foram os antibióticos mais usados; 2) medicamentos tradicionais chineses ou combinação entre esses e medicamentos ocidentais; 3) alopurinol; 4) AINEs; 5) fármacos antiepilépticos hipnóticos sedativos; 6) nitroimidazol; 7) anti‐hipertensivos e agentes modificadores de lipídeos; 8) soro e vacina; 9) medicamentos para o sistema digestivo; 10) agentes biológicos. Neste estudo, as três principais categorias de medicamentos indutores de RCA foram os antibióticos, os medicamentos tradicionais chineses e o alopurinol. β‐lactâmicos, furanonas e clindamicina foram os três principais subgrupos de antibióticos que induziram RCA. Consistente com relatos anteriores, os β‐lactâmicos foram os antibióticos que mais comumente induziram erupção medicamentosa.12–15 Amplamente usados na China, os medicamentos tradicionais chineses (inclusive ervas, medicamentos de patente chinesa, a combinação de medicamentos tradicionais chineses e medicamentos ocidentais e injeções de medicamentos chineses) foram o segundo principal causador de RCA na China central. Devido ao uso indevido de medicamentos tradicionais chineses, problemas farmacêuticos, ingredientes específicos, componentes complexos da medicina chinesa ou talvez interação com outros fármacos, o achado de erupção medicamentosa induzida pela medicina chinesa é comum. Se os ingredientes dos medicamentos tradicionais chineses não estiverem claramente listados, a combinação desses com outros medicamentos deve ser mais cuidadosa, especialmente quando os pacientes apresentam histórico de alergia e uso de múltiplos fármacos. A furanona não é uma causa comum de erupção medicamentosa, mas ficou em segundo lugar entre os antibióticos que induziram RAC. Esse achado pode estar relacionado ao supositório vaginal nifuratel, amplamente usado na cidade de Wuhan. Isso sugere que Wuhan deve prestar uma atenção especial aos β‐lactâmicos (como a amoxicilina e o medicamento supositório ginecológico nifuratel), devido ao alto índice de reações adversas, e considerar a mudança para outro fornecedor.
Foram observados 126 casos de RCAG, mais comuns na faixa entre 40 e 70 anos. RCAG foi mais frequentemente observada em mulheres, mas essa diferença não apresentou significância estatística. Os três principais medicamentos que induziram RCAG foram sedativos‐hipnóticos e antiepilépticos, antibióticos e alopurinol. Entre os sedativos‐hipnóticos e antiepilépticos, a carbamazepina foi o fármaco mais frequentemente usado e o medicamento único que mais frequentemente induziu RCAG. Dentre os antibióticos, os β‐lactâmicos foram os que mais induziram RCAG. O alopurinol foi o terceiro fármaco que mais induziu RCAG, o que é consistente com relatos anteriores que indicam que esse achado é frequente.16–19
Entretanto, verificou‐se que a maioria dos pacientes que apresentavam RCAG usava uma combinação de fármacos e tinham um histórico de medicação complexo, tomavam três, quatro ou cinco medicamentos. Em comparação com o grupo “uso combinado de fármacos” nas RCA, os pacientes com RCAG tinham mais combinações de medicamentos e mais tipos de RCAG. Independentemente do tipo da doença primária, os pacientes com RCAG geralmente usam mais medicamentos, o que aumenta bastante a incidência dessa complicação. Para diminuir a incidência de RCAG é importante evitar a interação entre diferentes medicamentos.
Apesar dos resultados, este estudo apresenta algumas limitações. O pequeno tamanho da amostra é um deles. Nosso estudo analisou apenas os pacientes com RCAG que usaram no máximo cinco medicamentos, pois se acredita que esses casos sejam muito complexos para se determinarem os medicamentos culpados ou fazer análises estatísticas. Desse modo, alguns dados significativos desses casos graves foram eliminados, nos quais o histórico de medicação é complicado. Essa estimativa pode ter sub‐representado as RCAG no Hospital Xiangya.
ConclusõesNa região central da China, o sexo do paciente não afetou a incidência de RCA e RCAG. A maior incidência de RCA foi observada na faixa entre 51–60 anos. Os três principais medicamentos que induziram as RCA foram os antibióticos, os medicamentos tradicionais chineses e o alopurinol. Entre os antibióticos, β‐lactâmicos, nitrofuranos e lincomicina foram as três principais categorias que induziram RCA. No entanto, RCAG são comumente vistas na faixa entre 41 a 50 anos. Os três principais medicamentos que induziram RCAG foram sedativos‐hipnóticos e antiepilépticos, antibióticos e alopurinol. Entre os sedativos‐hipnóticos e antiepilépticos, a carbamazepina foi o fármaco mais frequentemente usado e o medicamento único que mais frequentemente induziu RCAG. Dentre os antibióticos, os β‐lactâmicos foram o que mais induziram RCAG. Apesar dos resultados, este estudo apresenta algumas limitações: o pequeno tamanho da amostra, o desenho retrospectivo, a coleta de RCA e RCAG em diferentes intervalos de tempo e locais e a exclusão de pacientes que tomavam mais de cinco medicamentos.
Suporte financeiroDoações da National Science Foundation of China (N°. 81603200).
Contribuição dos autoresJun Zhao: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Lei Hu: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Lihua Zhang: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Maosong Zhou: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Lichen Gao: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Lin Cheng: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Ao Dr. Ji Li, do Departamento de Dermatologia, Hospital Xiangya, Universidade do Sul Central, Dr. Liming Tian, do Hospital Wuhan N°. 1, Universidade de Ciência e Tecnologia de Huazhong, e Prof. Hong‐Hao, Zhou do Departamento de Clínica Farmacológica, Hospital Xiangya, Universidade Central do Sul, por sua ajuda na coleta de casos clínicos.
Como citar este artigo: Zhao J, Hu L, Zhang L, Zhou M, Gao L, Cheng L. Causative drugs for drug‐induced cutaneous reactions in central China: a 608 case analysis. An Bras Dermatol. 2019;94:664–70.
Estudo realizado na Universidade Centro‐Sul, Changsha, China; Universidade Médica de Wenzhou, Wenzhou, China.