Atualmente, o tratamento da urticária crônica (UC) segue um consenso internacional. Quando a UC não responde a anti‐histamínicos por até quatro semanas, orienta‐se o uso do omalizumabe na dose de 300mg subcutâneo (SC) a cada quatro semanas, por pelo menos seis meses.1,2 Há contraindicação formal de vacinação com vírus vivo atenuado em pacientes utilizando imunobiológicos.
A partir de julho de 2017, no Brasil, houve uma epidemia de febre amarela (FA); a Organização Mundial da Saúde (OMS) recomendou a imunização com a vacina da febre amarela (VFA) na dose fracionada, em caráter temporário, como estratégia de bloqueio da doença.3–5
Como o omalizumabe age exclusivamente na IgE dos mastócitos e basófilos, e não atua na imunidade celular, nosso grupo recomendou a VFA em doentes com UC, moradores de áreas de risco para a FA.6
O presente trabalho teve como objetivo avaliar a ocorrência de reações adversas à VFA nos doentes com UC com e sem uso de omalizumabe e/ou anti‐histamínico. Como objetivo secundário, foi avaliado o motivo da não vacinação por alguns pacientes em uso de omalizumabe. Conduziu‐se um estudo transversal e observacional coletando os dados demográficos de 89 doentes com UC que estavam em seguimento no ambulatório de urticária, no período entre janeiro e abril de 2019.
Um questionário foi aplicado aos pacientes com UC e a pessoas sadias, sobre eventos adversos à imunização 30 dias após a vacinação, e outro questionário para os doentes com UC que não receberam a imunização, a fim de se conhecer a motivação que os levaram a não receber a VFA. Foram excluídos os doentes que não concordaram em participar do trabalho e assinar o termo de consentimento livre e esclarecido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição sob o n° 2.853.158.
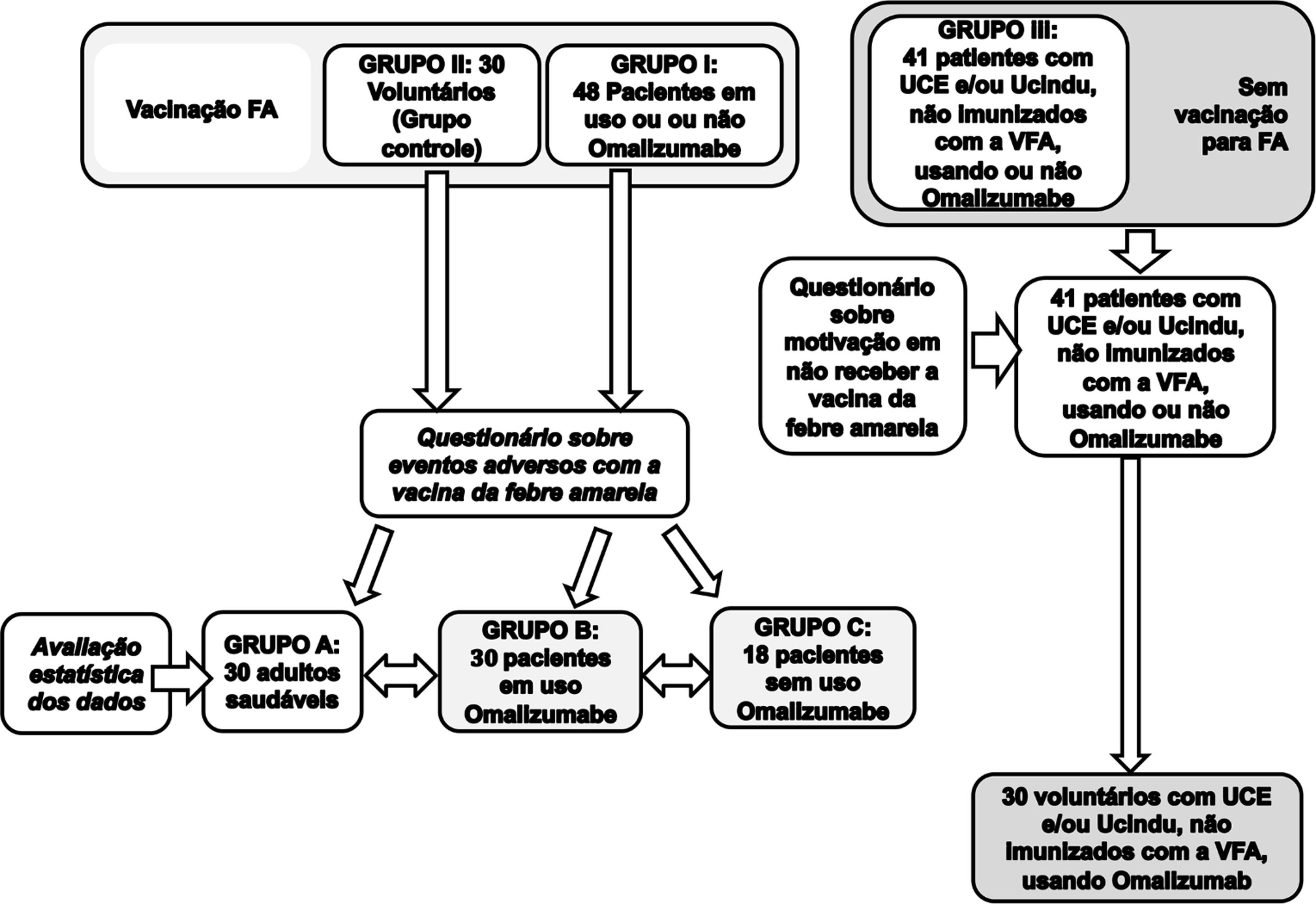
Os pacientes foram divididos nos seguintes grupos: (Grupo I) 48 pacientes com UC em uso ou não de omalizumabe/anti‐histamínico que receberam a VFA, (grupo III) 41 pacientes com UC que não receberam a VFA e (grupo IIA) 30 indivíduos normais (sadios) que fizeram uso da VFA (grupo A). No grupo I, 48 indivíduos receberam a VFA – 30 deles estavam em uso de omalizumabe (grupo B), e 18 não utilizavam omalizumabe (grupo C, fig. 1).
As variáveis qualitativas foram apresentadas por frequência absoluta e frequência relativa, e as variáveis quantitativas foram apresentadas por média, desvio‐padrão, valores máximo e mínimo, mediante teste de normalidade dos dados de Shapiro‐Wilk (p> 0,05). Para comparar as variáveis qualitativas foi utilizado o teste exato de Fischer. Para todas as análises, o nível de significância adotado foi α=0,05. O programa estatístico utilizado foi Stata versão 1.
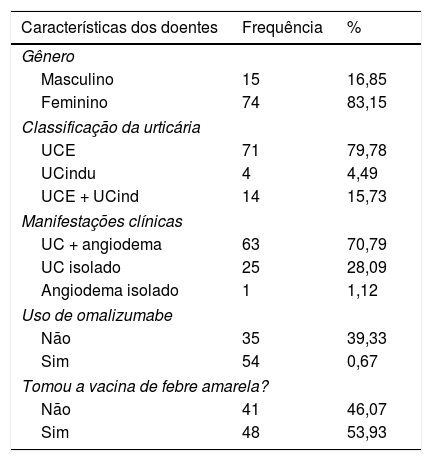
Foram aplicados questionários aos 89 pacientes com UC, e aos 30 indivíduos sadios que receberam a VFA (fig. 1). Na tabela 1 estão os resultados dos dados demográficos, subtipos de UC e tratamento dos pacientes incluídos no estudo no período entre janeiro e abril de 2019.
Dados demográficos, tipo de urticária, uso do omalizumabe e imunização contra a febre amarela entre os 89 doentes com urticária participantes do estudo
| Características dos doentes | Frequência | % |
|---|---|---|
| Gênero | ||
| Masculino | 15 | 16,85 |
| Feminino | 74 | 83,15 |
| Classificação da urticária | ||
| UCE | 71 | 79,78 |
| UCindu | 4 | 4,49 |
| UCE + UCind | 14 | 15,73 |
| Manifestações clínicas | ||
| UC + angiodema | 63 | 70,79 |
| UC isolado | 25 | 28,09 |
| Angiodema isolado | 1 | 1,12 |
| Uso de omalizumabe | ||
| Não | 35 | 39,33 |
| Sim | 54 | 0,67 |
| Tomou a vacina de febre amarela? | ||
| Não | 41 | 46,07 |
| Sim | 48 | 53,93 |
UC, urticária crônica.
Dos pacientes com UC, 48 (53,93%) receberam a VFA concomitante ao tratamento e 41 (46,07%) não a receberam. Todos os 48 pacientes que tomaram a VFA responderam ao questionário sobre reações adversas. A maioria dos pacientes (89,58%) não referiu nenhuma reação adversa à vacina, em concomitância com o tratamento com o omalizamabe. Foram relatados três (6,25%) casos com reação local à aplicação da VFA, um (2,08%) de astenia e um (2,08%) com exacerbação da doença apresentando angioedema.
Ao grupo de pacientes com UC que respondeu não ter tomado voluntariamente a VFA, a maioria (31,71%) não procurou a imunização em virtude de já ter sido imunizado anteriormente ao tratamento da UC; 26,83% referiram “Foi informado que não deveria tomar por causa do tratamento por outro profissional da saúde”; 21,95% referiram “Decidiu não tomar”; 12,20% tiveram “Receio de tomar a vacina devido à doença”. Os demais pacientes responderam ao questionário com as seguintes afirmações: “Não teve tempo, orientado a não tomar a vacina por causa de cirurgia bariátrica” e “Orientada a não tomar a vacina devido à gravidez” – cada resposta destas compreendeu 2,44% das respostas.
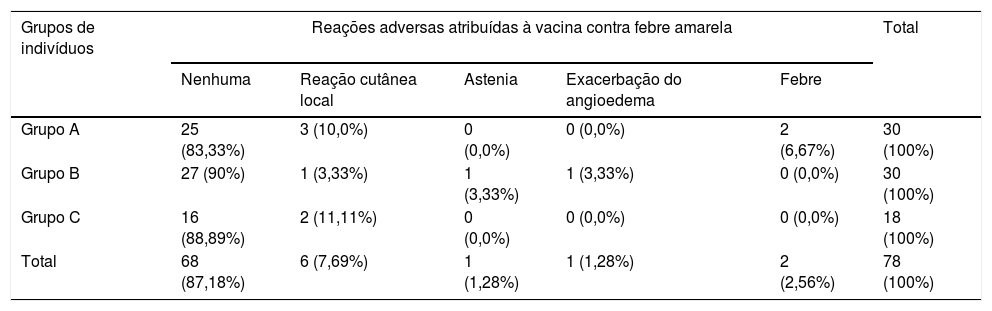
Na tabela 2 encontram‐se descritos os eventos adversos em 30 indivíduos sadios, 30 doentes com UC tratados com omalizumabe e 18 doentes com UC sem uso de omalizumabe.
Comparação entre o relato de reações adversas atribuídas à vacinação contra a febre amarela, entre indivíduos sadios (grupo A), doentes com urticária crônica tratados com omalizumabe (grupo B) doentes com urticária crônica sem uso de omalizumabe (grupo C)
| Grupos de indivíduos | Reações adversas atribuídas à vacina contra febre amarela | Total | ||||
|---|---|---|---|---|---|---|
| Nenhuma | Reação cutânea local | Astenia | Exacerbação do angioedema | Febre | ||
| Grupo A | 25 (83,33%) | 3 (10,0%) | 0 (0,0%) | 0 (0,0%) | 2 (6,67%) | 30 (100%) |
| Grupo B | 27 (90%) | 1 (3,33%) | 1 (3,33%) | 1 (3,33%) | 0 (0,0%) | 30 (100%) |
| Grupo C | 16 (88,89%) | 2 (11,11%) | 0 (0,0%) | 0 (0,0%) | 0 (0,0%) | 18 (100%) |
| Total | 68 (87,18%) | 6 (7,69%) | 1 (1,28%) | 1 (1,28%) | 2 (2,56%) | 78 (100%) |
A análise estatística, utilizando o teste exato de Fischer, não demonstrou diferenças entre a presença ou não de reações adversas entre os grupos A (indivíduos sadios), B (doentes com UC tratados com omalizumabe) e C (doentes com UC sem uso de omalizumabe), com p=0,553.
Não há relatos na literatura a respeito do uso de omalizumabe concomitante à imunização contra a FA. A imunização contra a FA nos pacientes com UC em uso de omalizumabe foi aconselhada, pois as reações mediadas pela IgE, nos mastócitos e basófilos, não são cruciais ao combate de infecções virais.
Apenas três pacientes (6,25%) mencionaram reação cutânea no local da aplicação da vacina. A frequência desse evento é de 4% na população que recebe a VFA.6 Um indivíduo (2,08%) referiu astenia. A ocorrência de manifestação sistêmica é de 1% a 6% dos indivíduos. Por fim, um paciente (2,08%) referiu exacerbação do angioedema ao tomar a vacina, o que pode estar ligado tanto a uma possível reação à VFA quanto à flutuação na atividade do controle da urticária em tratamento.
Comparando‐se os grupos doentes em uso do omalizumabe que tomaram a VFA e doentes com UC sem omalizumabe que tomaram a VFA, não houve diferença estatística. No grupo controle das 30 pessoas sadias comparando‐se aos 30 doentes com UC que faziam uso do omalizumabe e tomaram a VFA também não se observou diferença estatística em relação aos efeitos adversos.
Nosso estudo mostrou que os doentes com UC em tratamento com anti‐histamínicos e/ou omalizumabe não referiram eventos adversos após a imunização contra a FA, quando comparados aos indivíduos sadios, sem UC, que receberam a imunização no mesmo período, com a mesma vacina fornecida pelo Ministério da Saúde do Brasil.
Suporte financeiroNenhum.
Contribuição dos autoresLaura Ramos de Almeida: Análise estatística; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Roberta Fachini Criado: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Paulo Ricardo Criado: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Luis Felipe Ensina: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica da literatura.
Beatrice Martinez Zugaib Abdalla: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Juarez Antônio Simões Quaresma: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica da literatura.
Conflito de interessesNenhum.
Como citar este artigo: Almeida LR, Criado RF, Criado PR, Ensina LF, Abdalla BMZ, Quaresma JAS. Adverse events of the yellow fever vaccine in chronic urticaria: evaluation of patients treated or not with omalizumab compared to healthy individuals. An Bras Dermatol. 2021;96:497–9.
Trabalho realizado na Faculdade de Medicina do ABC, Santo André, SP, Brasil.