5‐fluorouracil (5‐FU) é medicamento de primeira linha para tratar campo de cancerização cutâneo (CCC). Há poucos ensaios clínicos com colchicina (COL) tópica.
ObjetivoAvaliar a eficácia do creme de COL 0,5% versus creme de 5‐FU 5% no tratamento do CCC.
MétodoEnsaio clínico randomizado, aberto, autocontrolado. Quarenta e cinco pacientes (90 antebraços), com 3 a 10 ceratoses actínicas (CA) em cada antebraço, utilizaram creme de COL 0,5% 2×/dia por sete dias em um antebraço, e creme 5‐FU 5% 2×/dia, por 21 dias, no outro antebraço. As posologias foram definidas a partir de ensaios clínicos prévios para cada medicamento. Efeitos adversos foram avaliados após 14 dias e os desfechos, após 90 dias da inclusão. O desfecho primário foi a eliminação completa de CA, e os secundários: eliminação parcial (≥ 50%), redução na contagem de CA, avaliação da escala de fotoenvelhecimento dos antebraços (EFA), escala de gravidade das CA (EGCA) e efeitos adversos.
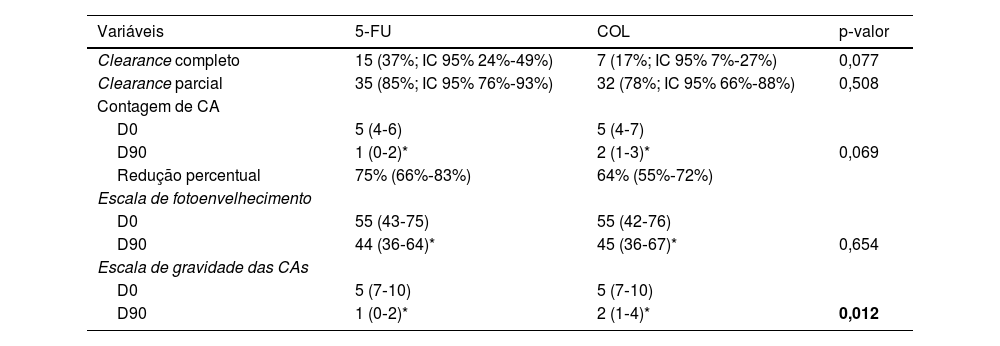
ResultadosApós 90 dias, houve eliminação completa das CA em 37% (95% IC 24%‐49%) e eliminação parcial em 85% (95% IC 76%‐93%) dos antebraços tratados com 5‐FU, versus 17% (95% IC 7%‐27%) e 78% (95% IC 66%‐88%) para COL (p>0,07). Houve redução percentual de 75% na contagem de CA dos antebraços tratados com 5‐FU (95% IC 66%‐83%) e de 64% nos tratados com COL (95% IC 55%‐72%). Quanto à EFA e EGCA, houve melhora em ambos os grupos, sem diferença quanto à EFA (p=0,654), com superioridade do 5‐FU para EGCA (p=0,012).
Limitações do estudoEstudo monocêntrico.
Conclusões5‐FU e COL são eficazes para tratamento do CCC, sem superioridade entre eles na redução de contagem de CA.
Ceratoses actínicas (CA) são proliferações atípicas de queratinócitos induzidas por radiação, em especial ultravioleta, decorrente de exposição solar crônica.1 Classicamente, são consideradas lesões pré‐malignas, com potencial de evolução para carcinoma espinocelular (CEC) de até 0,075% ao ano para lesão individual.2 Para além da análise de lesões individuais, pacientes com múltiplas CA apresentam incidência acumulada de CEC muito superior à dos pacientes sem CA.3 O campo de cancerização cutâneo (CCC) é caracterizado por múltiplas CA e/ou CEC in situ, ocorrendo em área cronicamente exposta à radiação ultravioleta.4
O tratamento das CA e do CCC visa melhorar a qualidade de vida dos pacientes, erradicar lesões, prevenir a emergência de malignidades cutâneas e evitar recidivas.5 As opções terapêuticas podem ser direcionadas para o tratamento de lesões individuais (terapias destrutivas) ou do CCC.6,7 Uma vez que as atipias que predispõem o surgimento de neoplasias malignas ocorrem mesmo em áreas sem lesões clinicamente visíveis, é recomendável tratar todo o CCC e, nesse contexto, os tratamentos tópicos são as opções mais utilizadas.
5‐FU é análogo de pirimidina com ação antitumoral descrita primariamente em 1957,8 e há mais de 50 anos é usado para tratamento de lesões cutâneas pré‐malignas e malignas.9 Sua ação decorre principalmente da inibição da timidilato sintase e, como interfere no processo de replicação celular, células com alto índice mitótico são mais suscetíveis ao seu efeito citotóxico, enquanto células normais aparentam ser bem menos sensíveis a esses efeitos.10 As reações adversas locais são um empecilho à aderência completa ao tratamento, que costuma durar de 14 a 28 dias.11
A colchicina (COL) é um dos fármacos mais antigos ainda em uso na atualidade. É alcaloide natural extraído do cormo da planta Colchicum autumnale e outras espécies do gênero Colchicum.12 O uso para tratamento de CA foi descrito em 1968 por Marshall e se fundamenta na ação antimitótica do fármaco, uma vez que compromete a composição dos microtúbulos e a divisão celular. Em 2000, o primeiro ensaio clínico que avaliou a eficácia da COL para tratamento das CA evidenciou clearance total de 70% nas CA do couro cabeludo de pacientes tratados com COL após 60 dias.13
A busca por novas opções de tratamento, que ofereçam maior tolerância, aderência, eficácia e/ou segurança que as existentes, é desejável. Apesar de décadas terem se passado desde os primeiros relatos de seu uso para tratamento de CA, há poucos ensaios clínicos publicados que permitam estabelecer a eficácia e a segurança da COL para tratamento de CA e CCC. Além disso, não há estudo comparando COL a 5‐FU no tratamento para CCC. Este estudo, então, tem por objetivo avaliar a eficácia do creme de COL 0,5% versus creme de 5‐FU 5% no tratamento do CCC em pacientes imunocompetentes com múltiplas CA nos antebraços.
MétodosEnsaio clínico randomizado, aberto, autocontrolado, comparando creme de COL 0,5% versus creme de 5‐FU 5%, realizado no Ambulatório de Dermatologia do Instituto Lauro de Souza Lima (ILSL) em Bauru/SP. O estudo foi aprovado pelo comitê de ética institucional (n° 3.751.592), registrado no Registro Brasileiro de Ensaios Clínicos (https://ensaiosclinicos.gov.br/rg/RBR‐487ctp) e financiado pelo Fundo de Apoio à Dermatologia (FUNADERM).
Após concordância e assinatura do termo de consentimento, foram incluídos 45 pacientes imunocompetentes, de ambos os sexos, com mais de 18 anos e com diagnóstico clínico de três a dez CA em cada antebraço, que não tivessem realizado quaisquer tratamentos para CA ou CCC nos últimos seis meses.
Os critérios de exclusão definidos foram: dermatoses extensas afetando um dos antebraços, hipersensibilidade ou alergia sabida a alguma das substâncias estudadas, imunossupressão por medicamentos e/ou doenças, gestação, amamentação e uso de retinoides, anti‐inflamatórios ou qualquer outro tratamento tópico na região avaliada.
Os participantes foram randomizados para definir em qual antebraço receberiam 5‐FU ou COL, em alocação de 1:1, gerada por simulação computacional (randomização em bloco). A randomização foi executada por pesquisador não envolvido na avaliação dos pacientes, com alocação sequencial, e a inclusão e avaliação dos pacientes foi realizada por outro pesquisador. Cada indivíduo foi submetido aos dois tratamentos, um em cada antebraço. 5‐FU foi aplicado 2×/dia por 21 dias, e COL 2×/dia por sete dias. Os pacientes também receberam filtro solar para uso regular em ambos os antebraços durante todo o período do estudo. A aplicação das medicações e do filtro solar foi realizada pelos próprios pacientes.
Na inclusão, cada participante recebeu um pacote correspondente ao seu grupo de randomização, contendo: 1) três tubos de 15g de creme de 5‐FU 5% (Efurix®, Valeant); 2) um frasco resistente à luz airless de 20g (liberação de 1g por pump) de creme de COL 0,5% (produto manipulado, Pharmácia Specífica Ltda.); 3) dois tubos de 200mL de filtro solar (Protetor Solar Corporal Neutrogena® Sun Fresh FPS30); 4) folha com orientações de uso, telefone para contato e com ilustração demonstrando área e lado em que cada medicação deveria ser utilizada, além do modo de uso de acordo com grupo de randomização. Todas as embalagens das medicações foram etiquetadas em “direito” ou “esquerdo” (com ilustração do antebraço correspondente) e com a forma de uso de cada fármaco, obedecendo à randomização dos antebraços, para diminuir o risco de confusão entre os tratamentos.
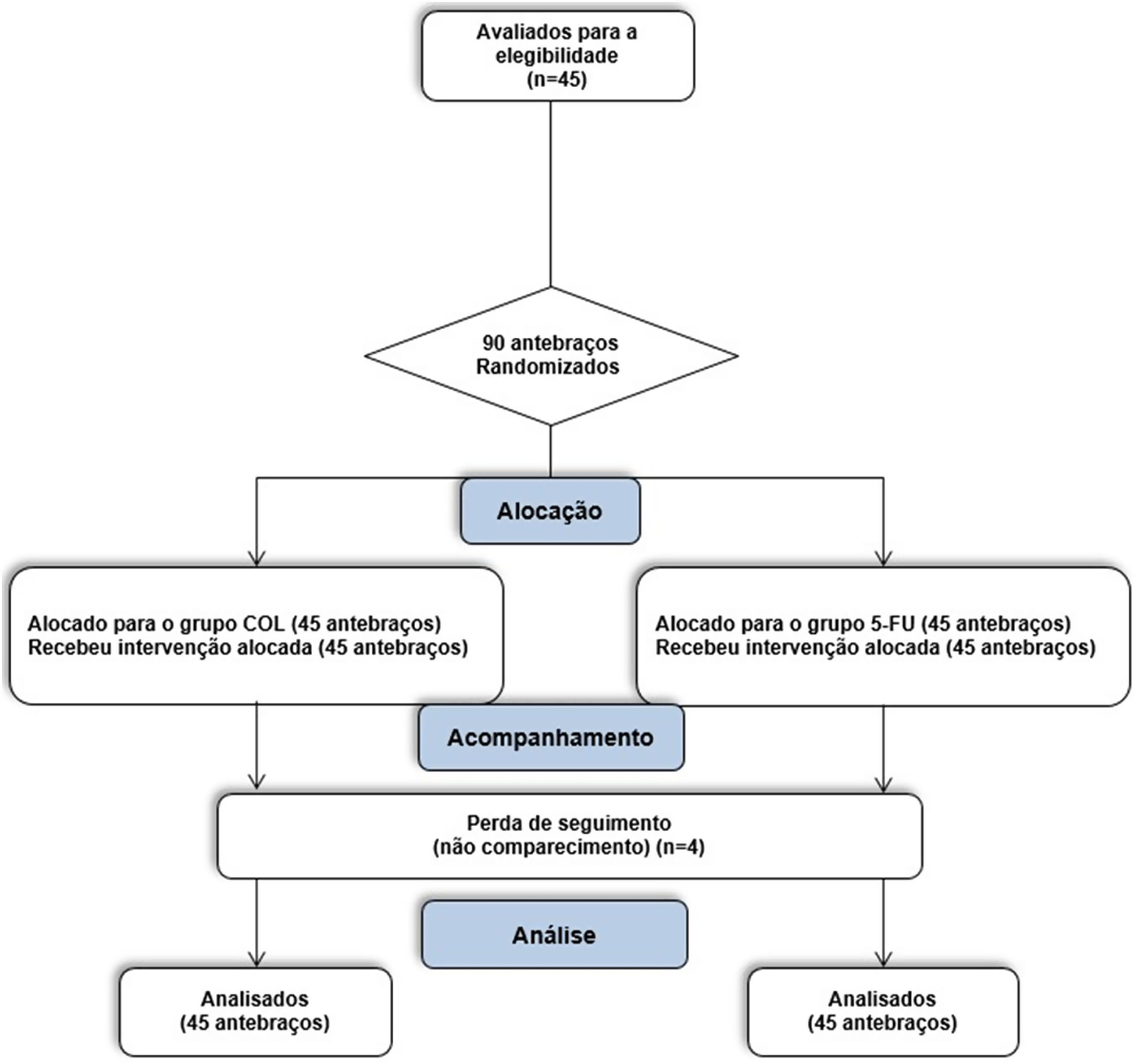
Para cada paciente, o estudo teve 90 dias de duração, com três avaliações: 1) D0 ‐ inclusão, contagem de CA em cada antebraço, escala de fotoenvelhecimento de antebraços (EFA) e escala de gravidade das CA (EGCA); 2) D14 ‐ avaliação de tolerabilidade e efeitos adversos; 3) D90 ‐ contagem de CA, EFA e EGCA (fig. 1).
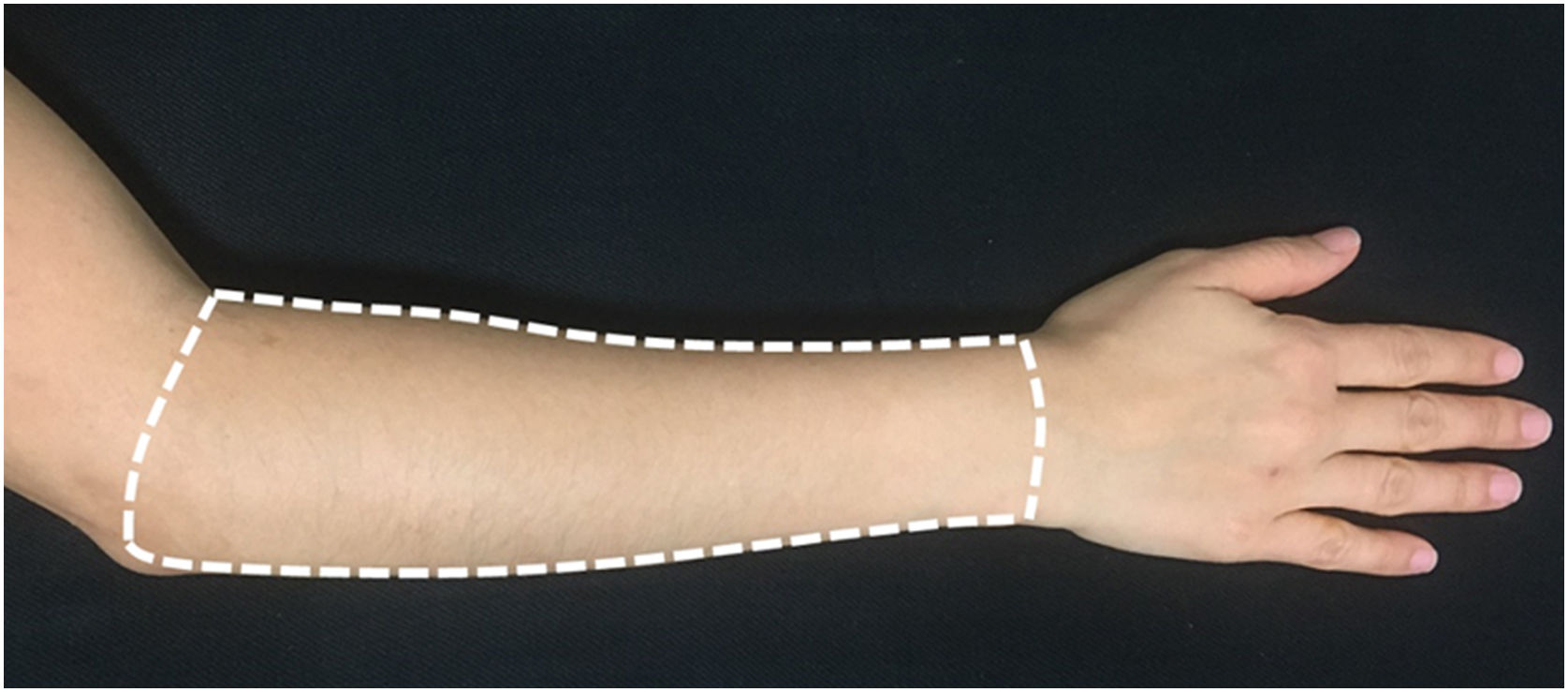
Para a avaliação e tratamento, foi definida a face dorsal de cada antebraço, como a área delimitada por linha imaginária que liga os processos estiloides da ulna e do rádio, a borda medial do antebraço, borda lateral do antebraço e uma linha que une o epicôndilo lateral à fossa antecubital (fig. 2).
Após marcação das CA com caneta, foi realizada contagem e confirmação da contagem para cada antebraço, pelo mesmo avaliador (A.S.T.) em ambas as avaliações.
A EFA é uma escala validada, que mensura o grau de envelhecimento dos antebraços por meio do número de CA superficiais e hipertróficas, quantidade e gravidade de rugas, lentigos solares, púrpuras visíveis, cicatrizes atróficas estelares, elastose e perda de elasticidade. Cada critério tem um peso e, ao final da avaliação, os valores são somados resultando em número que varia de 0 a 192.14
A EGCA permite avaliar resposta a modalidades terapêuticas para CCC de maneira qualitativa, e é complementar à contagem de CA. Diâmetro em milímetros, grau de hiperceratose e exulceração de cada CA são parâmetros considerados, e o valor final da EGCA é dado pela somatória da pontuação de todas as CA na área avaliada.15
O desfecho primário avaliado foi a taxa de clearance completo de CA em cada antebraço. Os desfechos secundários foram clearance parcial (redução ≥ 50% da contagem de CA), redução na contagem de CA, melhora da EFA, redução da EGCA e avaliação dos efeitos adversos.
A comparação dos efeitos adversos provocados por terapias tópicas com posologias distintas em um mesmo paciente pode ser complexa, uma vez que o ápice das reações locais ocorre em momentos diferentes. O creme de COL teve seu uso avaliado, na maioria dos estudos, no esquema de 2×/dia por 10 dias.16–18 Ensaios clínicos prévios com COL tópica realizados pelo nosso grupo de pesquisa revelaram que os últimos dias de tratamento levaram a reações locais mais acentuadas.16,17 No presente estudo, adotamos curso mais curto, de sete dias, de modo a avaliar se a redução do período de tratamento demonstraria a mesma eficácia, mas com menos efeitos adversos. De outro modo, a posologia usual do creme de 5‐FU 5% para o tratamento de CA é de 2×/dia por duas a quatro semanas, e os efeitos adversos são mais intensos quanto mais prolongado o esquema terapêutico.19 Diante do exposto, foi estabelecido curso de tratamento de sete dias para COL, de 21 dias para 5‐FU e a avaliação de efeitos adversos foi realizada após 14 dias do início dos tratamentos, momento considerado oportuno para não supervalorizar a ocorrência de reações locais por nenhuma das terapias.
A amostra foi dimensionada a fim de detectar 30% ou mais de diferença na taxa de clearance completo de CA (D90) entre os grupos (p. ex., 16% vs. 46%). Adotou‐se o poder de 0,85; alfa de 0,05 e estimativa de dropout de até 20%, resultando 45 pacientes (90 antebraços).20
Todos os pacientes incluídos no estudo e randomizados fizeram parte da população ITT (intention to treat). Clearance de CA, a EFA e a EGCA dos antebraços foram comparados por tempo e grupos (ao longo do tempo) usando o modelo linear generalizado de efeitos mistos, estrutura de covariância robusta, covariância matriz autorregressiva tipo 1, comparação post‐hoc de Šidák, e ajuste de probabilidade gama ou binomial negativa, quando indicado. Os casos faltantes tiveram seus valores imputados pelo modelo misto.
O tamanho do efeito foi calculado como a diferença nas médias de cada variável em D0 e D90, e o intervalo de confiança usando a técnica de bootstrap com 1.000 reamostras. Os dados foram analisados no IBM SPSS 25v. A significância foi definida como p<0,05.21
ResultadosDe maio de 2021 a abril de 2022 foram incluídos 45 pacientes elegíveis, submetidos a tratamento com creme de 5‐FU 5% em um antebraço e creme de COL 0,5% no antebraço contralateral (total de 90 antebraços).
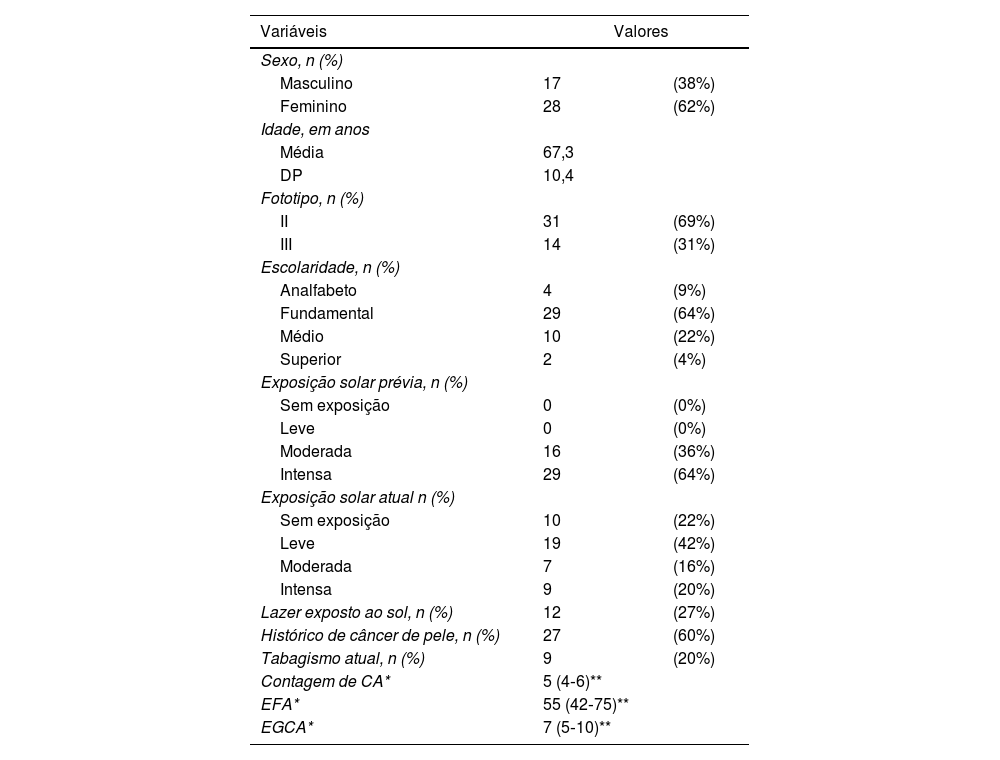
Os principais dados clínicos e demográficos dos 45 participantes na inclusão (D0) estão expostos na tabela 1. Houve predominância de mulheres (62%); a idade média dos participantes foi de 67,3 anos; fototipo II foi o mais comum (69%); e a maioria dos pacientes tinha antecedente pessoal de câncer de pele (60%) e intensa exposição solar prévia (64%).
Dados demográficos dos 45 participantes no momento da inclusão (D0)
| Variáveis | Valores | |
|---|---|---|
| Sexo, n (%) | ||
| Masculino | 17 | (38%) |
| Feminino | 28 | (62%) |
| Idade, em anos | ||
| Média | 67,3 | |
| DP | 10,4 | |
| Fototipo, n (%) | ||
| II | 31 | (69%) |
| III | 14 | (31%) |
| Escolaridade, n (%) | ||
| Analfabeto | 4 | (9%) |
| Fundamental | 29 | (64%) |
| Médio | 10 | (22%) |
| Superior | 2 | (4%) |
| Exposição solar prévia, n (%) | ||
| Sem exposição | 0 | (0%) |
| Leve | 0 | (0%) |
| Moderada | 16 | (36%) |
| Intensa | 29 | (64%) |
| Exposição solar atual n (%) | ||
| Sem exposição | 10 | (22%) |
| Leve | 19 | (42%) |
| Moderada | 7 | (16%) |
| Intensa | 9 | (20%) |
| Lazer exposto ao sol, n (%) | 12 | (27%) |
| Histórico de câncer de pele, n (%) | 27 | (60%) |
| Tabagismo atual, n (%) | 9 | (20%) |
| Contagem de CA* | 5 (4‐6)** | |
| EFA* | 55 (42‐75)** | |
| EGCA* | 7 (5‐10)** | |
CA, ceratose actínica; EFA, escala de fotoenvelhecimento dos antebraços; EGCA, escala de gravidade das ceratoses actínicas.
a Por antebraço.
b Mediana (p25‐p75).
No que concerne aos desfechos clínicos, 15 antebraços tratados com 5‐FU apresentaram clearance completo das CA em D90 (37%; 95% IC 24%‐49%), enquanto entre os tratados com COL, sete alcançaram esse desfecho (17%; 95% IC 7%‐27%), (p=0,077). Já o clearance parcial (redução ≥ 50% no número de CA) foi obtido por 35 dos antebraços 5‐FU (85%; 95% IC 76%–93%) e por 32 dos COL (78%; 95% IC 66%–88%; p=0,508).
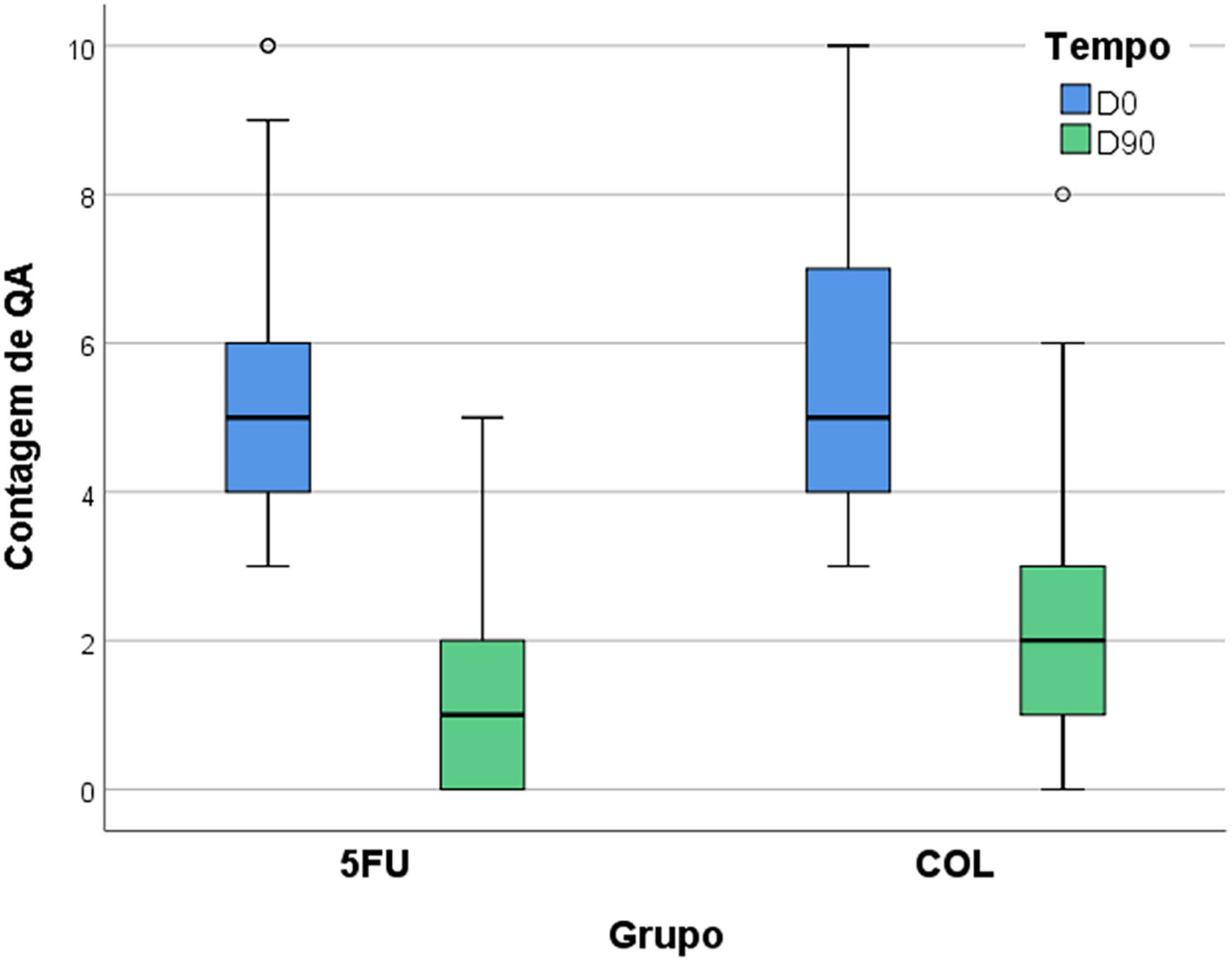
Em D90, houve redução percentual de 75% na contagem de CA para os antebraços submetidos ao tratamento com 5‐FU (95% IC 66%–83%) e de 64% nos tratados com COL (95% IC 55%–72%), havendo melhora ao longo do tempo para ambos os tratamentos (p<0,05), porém, sem diferença entre eles (p=0,069). Nenhum participante apresentou piora da contagem de CA.
A diferença intergrupos da melhora da EFA também não foi relevante (p=0,654); por outro lado, ambos os tratamentos levaram à redução significante da EGCA, e nesse quesito houve superioridade do 5‐FU (p=0,012; tabela 2, fig. 3).
Principais desfechos clínicos entre os antebraços
| Variáveis | 5‐FU | COL | p‐valor |
|---|---|---|---|
| Clearance completo | 15 (37%; IC 95% 24%‐49%) | 7 (17%; IC 95% 7%‐27%) | 0,077 |
| Clearance parcial | 35 (85%; IC 95% 76%‐93%) | 32 (78%; IC 95% 66%‐88%) | 0,508 |
| Contagem de CA | |||
| D0 | 5 (4‐6) | 5 (4‐7) | |
| D90 | 1 (0‐2)* | 2 (1‐3)* | 0,069 |
| Redução percentual | 75% (66%‐83%) | 64% (55%‐72%) | |
| Escala de fotoenvelhecimento | |||
| D0 | 55 (43‐75) | 55 (42‐76) | |
| D90 | 44 (36‐64)* | 45 (36‐67)* | 0,654 |
| Escala de gravidade das CAs | |||
| D0 | 5 (7‐10) | 5 (7‐10) | |
| D90 | 1 (0‐2)* | 2 (1‐4)* | 0,012 |
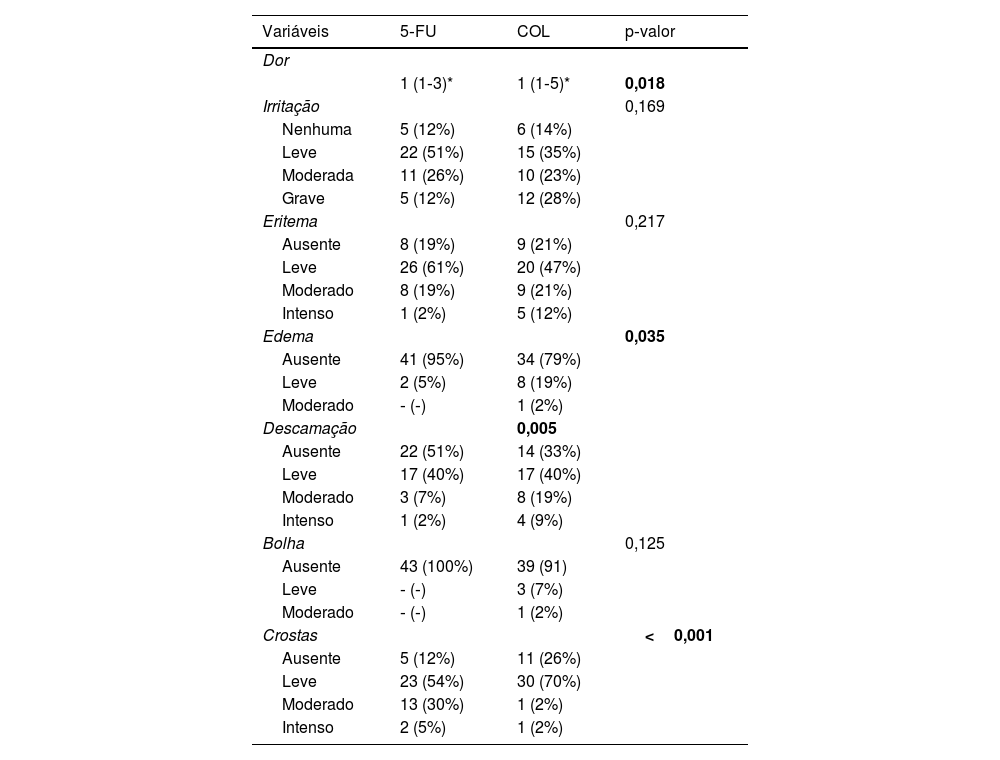
A respeito dos efeitos adversos, este estudo demonstrou que COL provocou mais dor que 5‐FU, além de causar mais edema e desencadear descamação mais intensa. Em contrapartida, 5‐FU levou à maior formação de crostas (tabela 3). Contudo, apenas um participante (2,2%) referiu não estar disposto a realizar novamente os tratamentos caso fosse necessário.
Principais efeitos adversos dos tratamentos em D14 (n=43)
| Variáveis | 5‐FU | COL | p‐valor |
|---|---|---|---|
| Dor | |||
| 1 (1‐3)* | 1 (1‐5)* | 0,018 | |
| Irritação | 0,169 | ||
| Nenhuma | 5 (12%) | 6 (14%) | |
| Leve | 22 (51%) | 15 (35%) | |
| Moderada | 11 (26%) | 10 (23%) | |
| Grave | 5 (12%) | 12 (28%) | |
| Eritema | 0,217 | ||
| Ausente | 8 (19%) | 9 (21%) | |
| Leve | 26 (61%) | 20 (47%) | |
| Moderado | 8 (19%) | 9 (21%) | |
| Intenso | 1 (2%) | 5 (12%) | |
| Edema | 0,035 | ||
| Ausente | 41 (95%) | 34 (79%) | |
| Leve | 2 (5%) | 8 (19%) | |
| Moderado | ‐ (‐) | 1 (2%) | |
| Descamação | 0,005 | ||
| Ausente | 22 (51%) | 14 (33%) | |
| Leve | 17 (40%) | 17 (40%) | |
| Moderado | 3 (7%) | 8 (19%) | |
| Intenso | 1 (2%) | 4 (9%) | |
| Bolha | 0,125 | ||
| Ausente | 43 (100%) | 39 (91) | |
| Leve | ‐ (‐) | 3 (7%) | |
| Moderado | ‐ (‐) | 1 (2%) | |
| Crostas | <0,001 | ||
| Ausente | 5 (12%) | 11 (26%) | |
| Leve | 23 (54%) | 30 (70%) | |
| Moderado | 13 (30%) | 1 (2%) | |
| Intenso | 2 (5%) | 1 (2%) |
a Mediana (p25‐p75).
Não houve surgimento de neoplasias malignas nas regiões tratadas durante o seguimento de 90 dias. No período do estudo, houve quatro dropouts, de modo que 41 participantes (82 antebraços) passaram por todas as três avaliações (D0, D14 e D90). Os dropouts não ocorreram em virtude dos efeitos adversos da intervenção, mas por não comparecimento dos pacientes no dia agendado para a avaliação e impossibilidade de reagendamento (fig. 1). Os participantes faltantes foram contactados e não compareceram por motivos ligados à pandemia de COVID‐19.
DiscussãoO presente estudo não demonstrou diferença quanto à eficácia no tratamento de CA entre 5‐FU 5% e COL 0,5% nas posologias e tempo de uso testados. Uma vez que 5‐FU é tratamento consagrado e fortemente recomendado para tratamento de CA e CCC,7 esse dado reforça COL também como opção terapêutica, de custo acessível e posologia que facilita a aderência, em que pesem efeitos adversos mais intensos.
Entre os antebraços tratados com 5‐FU, 37% apresentaram clearance completo das CA, resultado muito semelhante ao encontrado em um ensaio clínico randomizado duplo‐cego, com 932 pacientes, em que foi avaliada a eficácia de creme de 5‐FU 5% seis meses após um curso de tratamento de 2×/dia por quatro semanas na face e orelhas (clearance completo 5‐FU 38% versus placebo 17%).22
Outro ensaio clínico randomizado, envolvendo 602 pacientes, que comparou 5‐FU 5% a outras três opções de tratamento para CA na cabeça, evidenciou clearance ≥ 75% em 90,6% dos pacientes após três meses do término de tratamento.23 De maneira similar, verificamos 85% de clearance parcial (≥ 50%) nos antebraços tratados com 5‐FU em nosso estudo.
No que tange ao tratamento de CA em membros superiores, um ensaio clínico autocontrolado comparou o uso de creme de 5‐FU 5% 2×/dia em dois ciclos de 15 dias separados por 15 dias de pausa versus quatro sessões quinzenais de peeling de ácido glicólico 70% + solução de 5‐FU 5%, apontando redução de 85,7% no número de CA nos membros tratados com 5‐FU creme.24 A menor amostragem do referido estudo, área de tratamento incluindo as mãos, bem como a posologia diferente, que pode interferir na aderência ao tratamento, são características que podem explicar a discreta diferença, a favor, em relação à redução de 75% na contagem de CA encontrada em nosso estudo.
Foi observado clearance completo de 17% nos antebraços submetidos ao curso de sete dias de creme de COL 0,5%, 2×/dia. A mesma taxa foi constatada em um estudo que utilizou COL 0,5% em antebraços 2×/dia por 10 dias em 36 antebraços estudados.16 Esses dados sugerem que um curso mais curto, de sete dias, pode apresentar a mesma eficácia na melhora de CA e CCC. Não é possível inferir resultados decorrentes de cursos mensais, sequenciais.
Ensaio clínico mais recente comparando COL (2×/dia por sete dias) versus mebutato de ingenol ou filtro solar, associados ou não a Polypodium leucatomos via oral, evidenciou clearance completo, após 60 dias, de 14,7% para COL, 16,1% para o mebutato de ingenol e 2,8% para filtro solar.17 O presente estudo e os dois ensaios clínicos citados apresentam taxa de clearance similar para COL, o que demonstra sua consistência como opção de tratamento do CCC.16,17
Constatamos redução de 64% na contagem de CA nos antebraços tratados com COL comparando D0 com D90. Estudo anterior evidenciou resultado superior da COL nos membros superiores, com redução de 73,4%.18 Essa superioridade pode justificar‐se por, no referido estudo, ter sido realizado um segundo curso de tratamento de 10 dias nos pacientes que apresentaram pouca ou nenhuma resposta inflamatória ao primeiro curso.
O primeiro ensaio clínico que testou o uso de COL para tratamento de CA comparou a aplicação de gel de COL 2×/dia por 10 dias ao placebo, verificando total resolução das lesões em sete dos 10 pacientes tratados, enquanto no grupo placebo nenhum paciente apresentou resposta. Em contraposição ao nosso estudo, esse ensaio clínico não era controlado, não houve período de washout antes da inclusão (quantidade não informada de participantes havia realizado outros tratamentos para CA pouco antes do estudo), a concentração utilizada de COL foi de 1% em veículo gel, a área tratada foi a fronte e a amostragem foi consideravelmente menor,13 diferenças que podem justificar a discrepância na taxa de clearance completo.
Não há apresentações tópicas industrializadas de COL, mas é possível obter formulações de uso tópico contendo COL por meio de farmácias de manipulação. Em relação à solubilidade, 1g de COL dissolve‐se em 22mL de água, 220mL de éter, 100mL de benzeno, livremente em álcool ou clorofórmio e é praticamente insolúvel em éter de petróleo ou vaselina.25 Utilizamos como veículo neste estudo o creme não iônico, por apresentar bom perfil de solubilidade para COL, propiciando a penetração do fármaco. Dois ensaios clínicos prévios16,17 desse grupo de pesquisa utilizaram a mesma formulação, produzida pela mesma farmácia de manipulação (Pharmácia Specífica Ltda), atingindo taxas de clearance muito similares, o que sugere constância e estabilidade das formulações. A COL escurece quando exposta à luz,26 motivo pelo qual optamos por frascos resistentes à luz e airless para armazenamento do creme de COL.
Para o tratamento do fotoenvelhecimento de antebraços, 5‐FU demonstrou previamente melhorar aspecto visual da pele, além de aumentar a expressão de pró‐colágeno I na avaliação seis meses após o tratamento.27 Ambos os tratamentos investigados no presente estudo levaram à melhora na EFA. Esse resultado faz refletir se a COL poderia trazer benefícios também no tratamento do fotoenvelhecimento, suscitando a importância de estudos com desenho dedicado a elucidar essa questão.
A EGCA foi o desfecho em que evidenciamos superioridade significante do 5‐FU em relação à COL (p=0,012). Os critérios que definem essa escala são diâmetro das lesões, grau de hiperceratose e presença de exulceração.15 É importante considerar que, para o paciente, a melhora de hiperceratose e exulceração, ainda que não haja resolução completa da lesão, pode trazer mais satisfação e conforto.
Diferenças relevantes foram encontradas em relação aos efeitos adversos dos tratamentos: COL provocou mais dor, mais edema e mais descamação que 5‐FU; em compensação, 5‐FU ocasionou maior formação de crostas. A ocorrência de reações adversas pode ser motivo para o paciente não aderir apropriadamente ao tratamento; entretanto, o principal fator que compromete a aderência a tratamentos tópicos para CA e CCC é a duração prolongada de tratamento.28 Assim, ainda que a COL esteja mais associada a alguns dos efeitos adversos, o fato de ter curso mais curto de tratamento comparativamente ao 5‐FU a posiciona como vantajosa opção de tratamento de CA e CCC.
Em um estudo que avaliou reações cutâneas em decorrência do uso de 5‐FU 5% 2×/dia por quatro semanas evidenciou‐se que eritema intenso foi a reação mais frequente (46,7%), seguido por prurido (28,9%), sensação de queimação (21,5%) e descamação (18,5%).11 Em nosso estudo, houve eritema em 82% e descamação em 49% dos antebraços tratados com 5‐FU. Todavia, na presente pesquisa, o eritema foi classificado como intenso em apenas 2% dos casos. A diferença pode ser explicada pelo fato de que o estudo acima mencionado determinou a ocorrência de efeitos adversos por meio do relato telefônico dos participantes, enquanto em nosso estudo as reações foram aferidas por exame dermatológico.
Ademais, o papel adicional dos filtros solares no tratamento do CCC não deve ser negligenciado; em estudo com população semelhante que incluiu 40 indivíduos (80 antebraços) com CA nos antebraços, houve redução de cerca de 30% na contagem de lesões, após 60 dias.29
São limitações do presente estudo a relativa homogeneidade da população estudada, por tratar‐se de estudo unicêntrico.
É extremamente válida a investigação de outros esquemas posológicos de COL, a fim de identificar formas de uso mais eficazes e cômodas. É também pertinente que sejam realizados mais estudos comparativos com COL em outras áreas, como a face e couro cabeludo.
Conclusões5‐FU e COL são eficazes para tratamento de CCC, com taxas de clearance completo e parcial que não tiveram diferença estatística após 90 dias. 5‐FU foi superior em reduzir a gravidade das CA; COL provocou mais dor, edema e descamação que 5‐FU, mas este último ocasionou mais crostas.
Suporte financeiroFundo de Apoio à Dermatologia (FUNADERM).
Contribuição dos autoresAmanda Soares Teixeira: Desenho do projeto; coleta dos dados; revisão da literatura; escrita e aprovação do texto.
Ivanka Miranda de Castro Martins: Coleta dos dados; escrita e aprovação do texto.
Anna Carolina Miola: Desenho do projeto; revisão da literatura; escrita e aprovação do texto.
Hélio Amante Miot: Desenho do projeto; análise dos dados; revisão da literatura; escrita e aprovação do texto.
Conflito de interessesNenhum.
Como citar este artigo: Teixeira AS, Martins IMC, Miola AC, Miot HA. Efficacy and safety of 0.5% colchicine cream versus 5% 5‐fluorouracil cream in the treatment of cutaneous field cancerization: a randomized clinical trial. An Bras Dermatol. 2024;99:527–34.
Trabalho realizado no Departamento de Dermatologia, Instituto Lauro de Souza Lima, Bauru, SP, Brasil.