A vasculopatia livedoide (VL) manifesta‐se como úlceras e cicatrizes atróficas nacaradas nas extremidades inferiores. O principal fator etiopatogênico é a hipercoagulabilidade, com a formação de trombos seguida de inflamação. Trombofilia, doenças do colágeno e doenças mieloproliferativas podem levar à VL, mas a forma idiopática (primária) predomina. Bartonella spp. podem causar infecção intraendotelial; as manifestações cutâneas da infecção por essas bactérias podem ser diversas, incluindo vasculite leucocitoclástica e úlceras.
ObjetivoA partir de um caso clínico, o objetivo deste estudo foi investigar a bacteremia por Bartonella spp. em pacientes com úlceras crônicas de difícil controle diagnosticadas como VL primária.
MétodosForam aplicados questionários e realizados testes moleculares (PCR convencional, PCR de dupla amplificação e PCR em tempo real), culturas líquidas e sólidas em amostras sanguíneas e pellets de células de 16 pacientes com VL primária e 32 voluntários saudáveis.
ResultadosO DNA de Bartonella henselae foi detectado em 25% dos pacientes com VL e em 12,5% dos indivíduos do grupo controle (p=0,413).
Limitações do estudoPela raridade da VL primária, o número de pacientes estudados foi pequeno e houve maior exposição do grupo controle a fatores de risco para infecção por Bartonella spp.
ConclusõesEmbora sem diferença estatística significante entre os grupos, o DNA de B. henselae foi detectado em um de cada quatro pacientes, o que reforça a necessidade de investigar a infecção por Bartonella spp. em pacientes com VL primária.
A vasculopatia livedoide (VL) manifesta‐se como úlceras dolorosas localizadas distalmente nos membros inferiores que evoluem lentamente para lesões atróficas esbranquiçadas, com telangiectasias puntiformes, pigmentação acastanhada, acompanhadas de livedo racemoso. A etiopatogenia mais aceita da VL são fenômenos vaso‐oclusivos decorrentes de estados de hipercoagulabilidade. Condições como trombofilia, colagenoses, doenças mieloproliferativas e estase sanguínea são reconhecidamente associadas à doença, porém a forma idiopática (primária) é a predominante.1,2
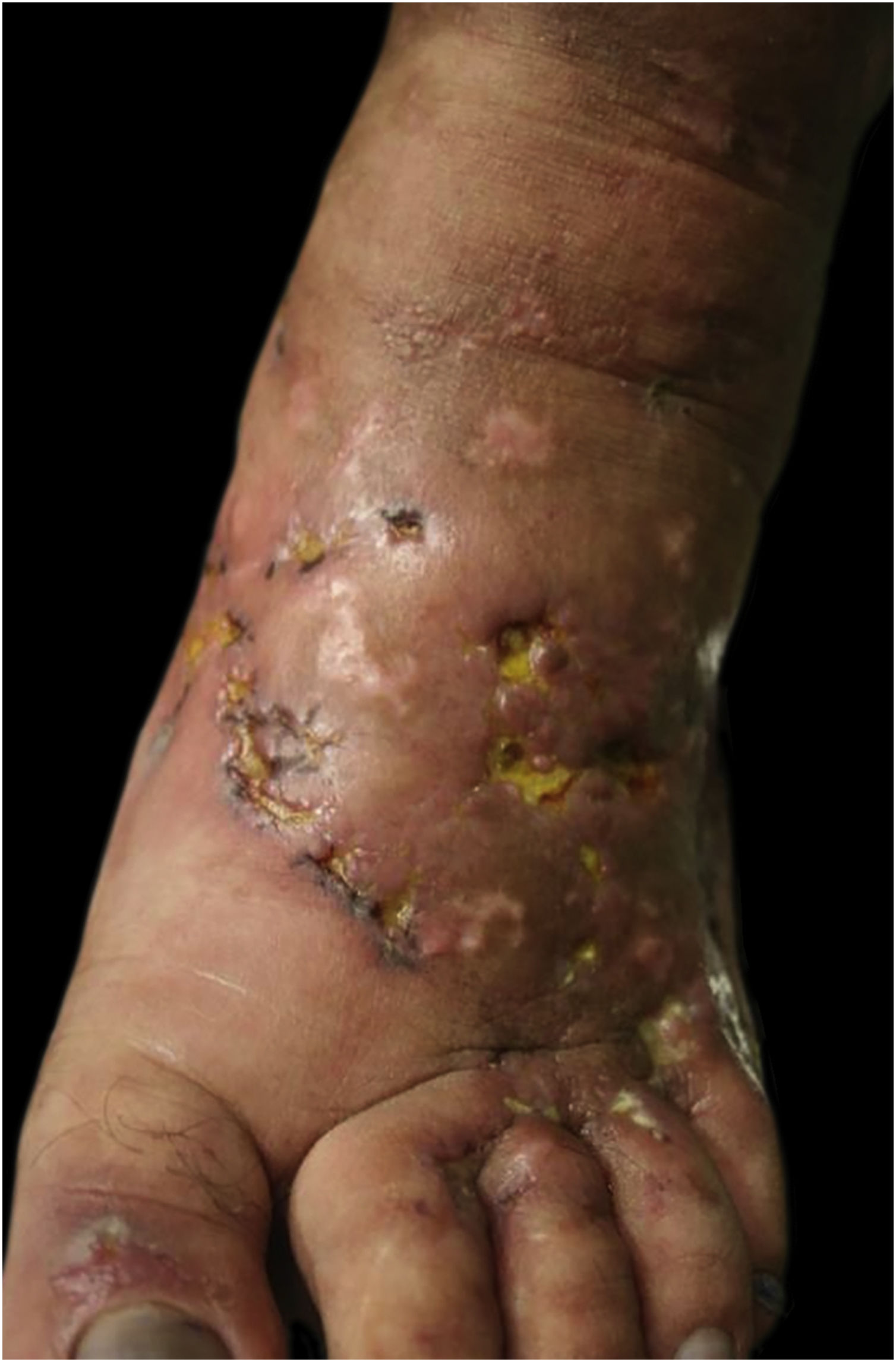
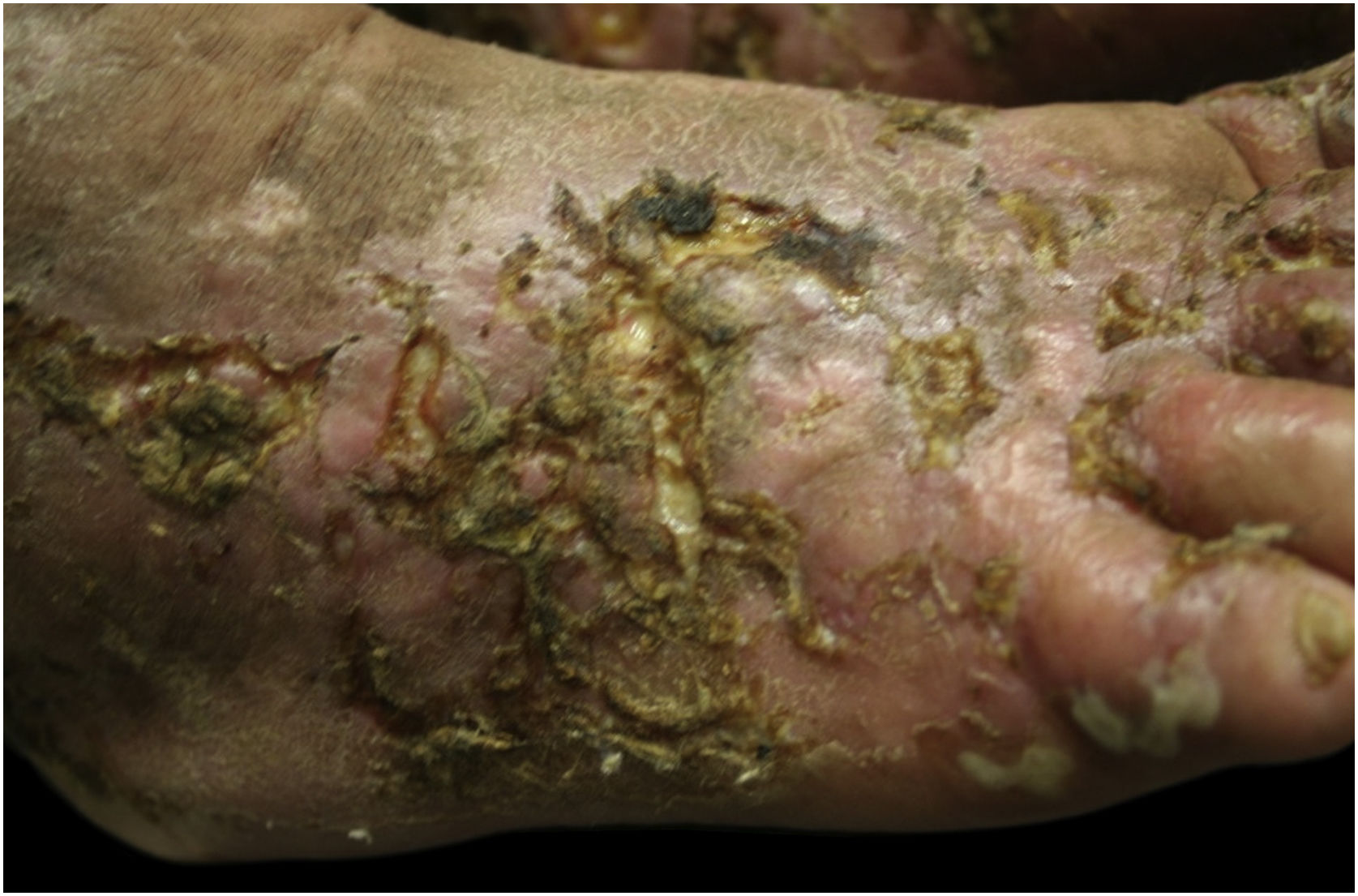
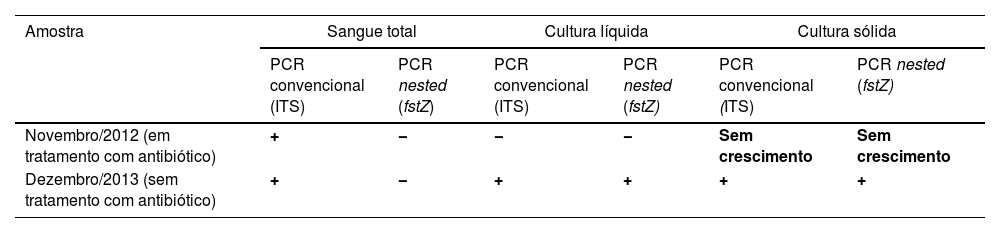
Este estudo foi realizado a partir da observação clínica de paciente do sexo feminino de 41 anos, com história de contato com gatos e que apresentava lesões ulceradas dos membros inferiores de difícil controle havia 12 anos (figs. 1 e 2). O exame anatomopatológico evidenciou hipodermite em atividade associada à vasculite leucocitoclástica e presença de trombos hialinos frequentes, com necrose fibrinoide da parede de pequenos vasos. Observou‐se também depósito de mucina e de hemossiderina, além de proliferação vascular (fig. 3). Excluídas outras doenças, a paciente foi conduzida como VL primária e tratada, ao longo dos anos, com vasodilatadores, antiagregantes plaquetários, corticosteroides e ciclos de antibióticos (metronidazol, penicilina e ciprofloxacina), com melhoras transitórias. Considerada a forte epidemiologia de contato com gatos, foi sugerida a pesquisa de Bartonella spp. O DNA de Bartonella henselae foi detectado por reação em cadeia da polimerase (PCR) no sangue da paciente, e houve pronta melhora das úlceras crônicas com o tratamento da infecção por B. henselae com doxiciclina 200 mg/dia por um ano. Com a suspensão do tratamento, porém, houve recorrência das lesões de VL. A bactéria pode ser isolada, e seu DNA novamente detectado a partir de nova amostra sanguínea (tabela 1).
Úlcera crônica: (A) epiderme hiperplásica na borda (seta vermelha), vasos com paredes hialinizadas na borda e no leito da úlcera (setas pretas), agregados de células inflamatórias e fibrose da derme reticular e hipoderme; (B) hialinose da parede e trombose oclusiva da luz dos vasos da derme e hipoderme (setas amarelas), com exsudato inflamatório contendo neutrófilos polimorfonucleares. Hematoxilina‐eosina, x40 (A) e x100 (B).
Resultados das pesquisas moleculares no caso índice de vasculopatia livedoide primária com bacteremia confirmada por Bartonella henselae
| Amostra | Sangue total | Cultura líquida | Cultura sólida | |||
|---|---|---|---|---|---|---|
| PCR convencional (ITS) | PCR nested (fstZ) | PCR convencional (ITS) | PCR nested (fstZ) | PCR convencional (ITS) | PCR nested (fstZ) | |
| Novembro/2012 (em tratamento com antibiótico) | + | − | − | − | Sem crescimento | Sem crescimento |
| Dezembro/2013 (sem tratamento com antibiótico) | + | − | + | + | + | + |
+, DNA detectado; −, DNA não detectado.
Bartonella spp. são bactérias fastidiosas e, por isso, dificilmente isoladas. Embora mundialmente distribuídas, são negligenciadas e potencialmente fatais. Muitas vezes vivem no interior de eritrócitos e de células endoteliais. A infecção por essas bactérias pode ser assintomática, mas também pode causar quadros clínicos variados em humanos, incluindo febre de origem indeterminada, endocardite e doença da arranhadura do gato (DAG).3 As manifestações cutâneas também variam e incluem vasculite leucocitoclástica e úlceras, como revisto por Lins et al. em recente revisão sobre as manifestações cutâneas das bartoneloses publicada neste periódico.4 O objetivo principal deste estudo foi investigar a bacteremia por Bartonella spp. em pacientes com VL primária com úlceras de difícil controle.
MétodosFoi obtido o Termo de consentimento livre e esclarecido de cada participante após avaliação e autorização do Comitê de Ética em Pesquisa da Universidade Estadual de Campinas – Unicamp (CAAE: 48163015.8.0000.5405). Foram incluídos pacientes com mais de 18 anos, com diagnóstico de VL primária em seguimento no Ambulatório de Dermatologia da Unicamp e voluntários sem queixas clínicas como grupo controle (estudantes e/ou funcionários da Unicamp, com mais de 18 anos e não gestantes). Cada participante respondeu a um questionário para avaliar a exposição de risco para adquirir a infecção por Bartonella spp. Foram coletadas amostras de sangue dos pacientes e dos indivíduos do grupo controle com técnica asséptica em tubos com ácido etilenodiamina tetra‐acético (EDTA) e em tubos sem anticoagulante.
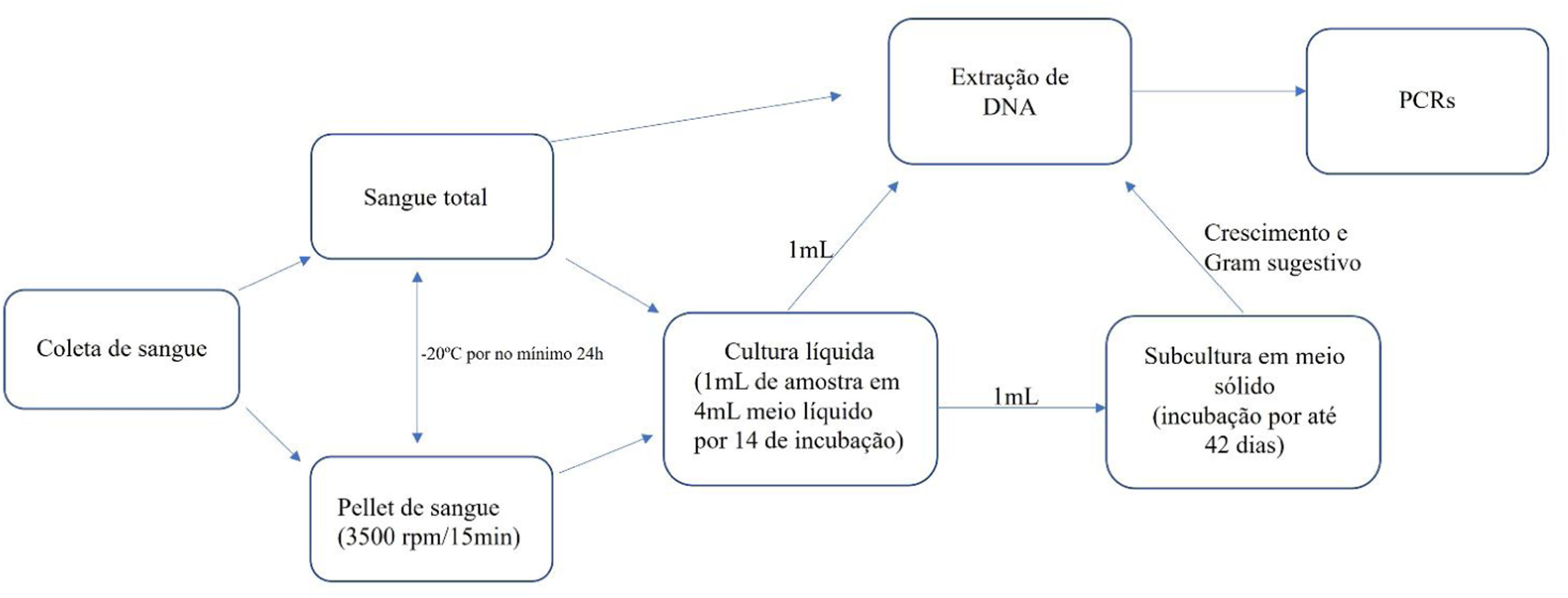
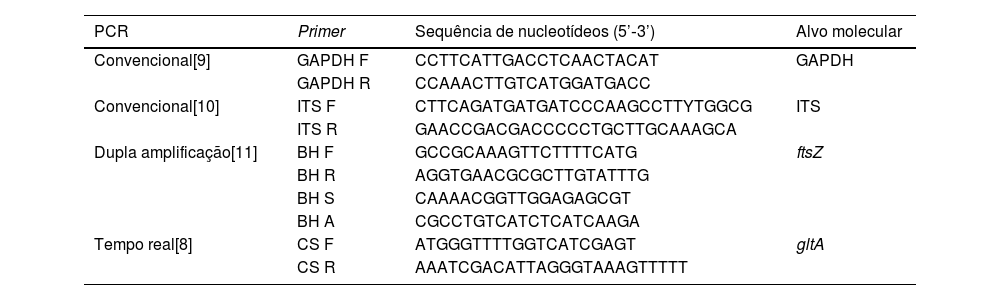
O laboratório onde as análises foram realizadas segue normas para assegurar o controle de qualidade descrito por Pitassi et al.5 Foram realizadas culturas líquidas de amostras do sangue e do pellet de células (coágulo de sangue coletado do tubo sem coagulante) e culturas sólidas de todas as culturas líquidas, conforme descrição prévia.6,7 O DNA foi extraído de amostras sanguíneas, dos pellets de células e das culturas líquidas utilizando QIAamp DNA minikit (Qiagen Inc., EUA). Além de PCR convencional para gene constitutivo de mamíferos, o GAPDH, foram realizadas PCR convencional gênero‐específica para Bartonella spp. e PCRs espécie‐específicas de dupla amplificação (nested) e em tempo real para B. henselae. Em todos os procedimentos foram adicionados três controles (controle negativo de extração, controle negativo de PCR e controle positivo de PCR ‐ cepa 3715 de B. henselae registrada na Seção de Coleção de Culturas do Instituto Adolfo Lutz). Além disso, em cada reação foram testadas diluições de B. henselae para determinar a sensibilidade e o limite de detecção de cada PCR. Todos esses métodos já foram descritos anteriormente.6–11 Os primers utilizados na investigação molecular dos pacientes e voluntários estão descritos na tabela 2. Os amplificados obtidos que apresentaram qualidade para o sequenciamento foram enviados para comparação de similaridade com material depositado previamente. O fluxograma dos procedimentos realizados está apresentado na figura 4.
Primers usados na investigação molecular dos grupos de pacientes e controles
| PCR | Primer | Sequência de nucleotídeos (5’‐3’) | Alvo molecular |
|---|---|---|---|
| Convencional[9] | GAPDH F | CCTTCATTGACCTCAACTACAT | GAPDH |
| GAPDH R | CCAAACTTGTCATGGATGACC | ||
| Convencional[10] | ITS F | CTTCAGATGATGATCCCAAGCCTTYTGGCG | ITS |
| ITS R | GAACCGACGACCCCCTGCTTGCAAAGCA | ||
| Dupla amplificação[11] | BH F | GCCGCAAAGTTCTTTTCATG | ftsZ |
| BH R | AGGTGAACGCGCTTGTATTTG | ||
| BH S | CAAAACGGTTGGAGAGCGT | ||
| BH A | CGCCTGTCATCTCATCAAGA | ||
| Tempo real[8] | CS F | ATGGGTTTTGGTCATCGAGT | gltA |
| CS R | AAATCGACATTAGGGTAAAGTTTTT |
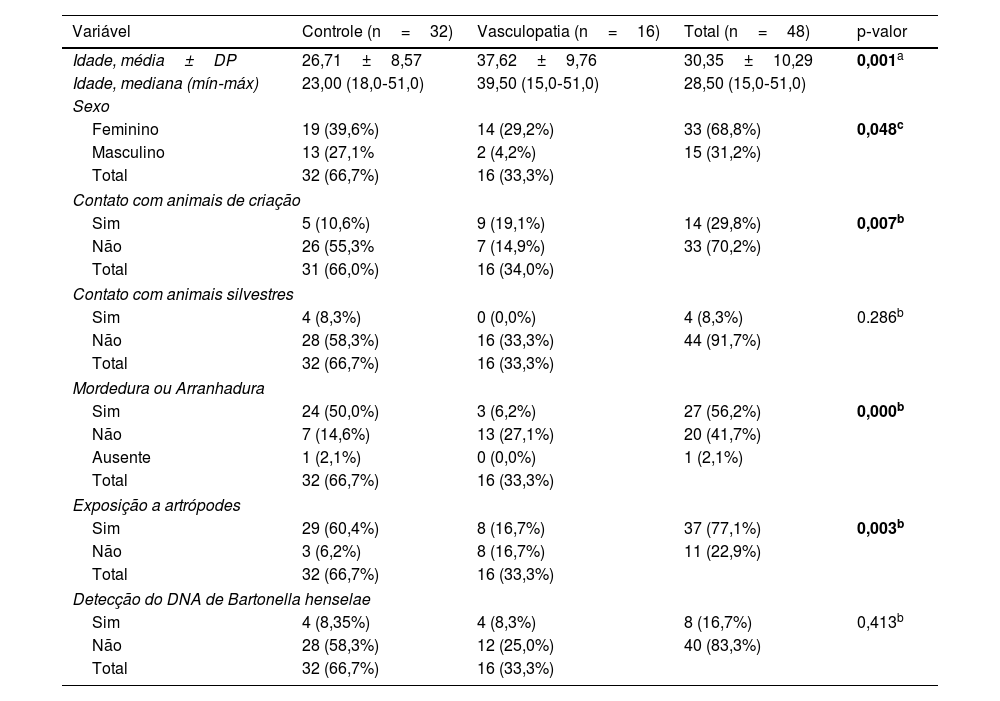
Participaram do estudo 16 pacientes com VL primária e 32 indivíduos sem queixas clínicas. Todos responderam a um questionário cujos dados são apresentados na tabela 3. Pode‐se observar que o grupo controle era mais jovem (p=0,001), com média etária de 26,71 anos; já entre os pacientes, a média foi de 37,62 anos. O grupo controle foi composto por mais homens que o grupo dos pacientes (p=0,048). Os indivíduos do grupo controle tiveram mais contato com animais de criação (p=0,007), foram mais mordidos e/ou arranhados (p=0,000) e foram mais expostos a artrópodes (p=0,003). Não houve diferença significante (p> 0,05) na comparação entre essas características dentre aqueles que tiveram detecção do DNA de Bartonella spp. e os que não tiveram, em cada um dos grupos separadamente.
Comparação entre o grupo controle e grupo de pacientes com vasculopatia
| Variável | Controle (n=32) | Vasculopatia (n=16) | Total (n=48) | p‐valor |
|---|---|---|---|---|
| Idade, média±DP | 26,71±8,57 | 37,62±9,76 | 30,35±10,29 | 0,001a |
| Idade, mediana (mín‐máx) | 23,00 (18,0‐51,0) | 39,50 (15,0‐51,0) | 28,50 (15,0‐51,0) | |
| Sexo | ||||
| Feminino | 19 (39,6%) | 14 (29,2%) | 33 (68,8%) | 0,048c |
| Masculino | 13 (27,1% | 2 (4,2%) | 15 (31,2%) | |
| Total | 32 (66,7%) | 16 (33,3%) | ||
| Contato com animais de criação | ||||
| Sim | 5 (10,6%) | 9 (19,1%) | 14 (29,8%) | 0,007b |
| Não | 26 (55,3% | 7 (14,9%) | 33 (70,2%) | |
| Total | 31 (66,0%) | 16 (34,0%) | ||
| Contato com animais silvestres | ||||
| Sim | 4 (8,3%) | 0 (0,0%) | 4 (8,3%) | 0.286b |
| Não | 28 (58,3%) | 16 (33,3%) | 44 (91,7%) | |
| Total | 32 (66,7%) | 16 (33,3%) | ||
| Mordedura ou Arranhadura | ||||
| Sim | 24 (50,0%) | 3 (6,2%) | 27 (56,2%) | 0,000b |
| Não | 7 (14,6%) | 13 (27,1%) | 20 (41,7%) | |
| Ausente | 1 (2,1%) | 0 (0,0%) | 1 (2,1%) | |
| Total | 32 (66,7%) | 16 (33,3%) | ||
| Exposição a artrópodes | ||||
| Sim | 29 (60,4%) | 8 (16,7%) | 37 (77,1%) | 0,003b |
| Não | 3 (6,2%) | 8 (16,7%) | 11 (22,9%) | |
| Total | 32 (66,7%) | 16 (33,3%) | ||
| Detecção do DNA de Bartonella henselae | ||||
| Sim | 4 (8,35%) | 4 (8,3%) | 8 (16,7%) | 0,413b |
| Não | 28 (58,3%) | 12 (25,0%) | 40 (83,3%) | |
| Total | 32 (66,7%) | 16 (33,3%) | ||
Valores de p em negrito nas tabelas são estatisticamente significantes.
O gene constitutivo (GAPDH) foi detectado em todas as amostras de pacientes e voluntários, garantindo a qualidade do DNA extraído para as análises e a ausência de inibidores para as reações moleculares.
Na PCR convencional para Bartonella spp., o limite de detecção foi de 50 cópias, e de 10 cópias na PCR nested e na PCR em tempo real.
O DNA de B. henselae foi detectado em quatro pacientes em, pelo menos, uma reação espécie‐específica. No grupo controle, o DNA foi detectado em quatro voluntários. Puderam ser sequenciados os amplificados de seis participantes dos oito com detecção do DNA bacteriano, e todos os amplificados apresentaram 99% a 100% de similaridade com B. henselae (número de acesso GenBank: CP020742.1).
Não foi observado crescimento de Bartonella spp. em cultura sólida de nenhuma amostra dos 48 participantes. Não houve significância estatística pelo teste de Fischer na detecção do DNA da bactéria entre os dois grupos (p=0,413), como também observado na tabela 3.
Considerando que a VL primária é manifestação rara, e utilizando o teste exato de Fisher para estabelecer o cálculo amostral do estudo e definindo o nível de significância em 5% (erro alfa ou tipo I) com poder amostral de 80% (erro beta ou tipo II de 20%), com base nos dados obtidos, pode‐se estabelecer que a amostra mínima para que os resultados tenham significância estatística seria de 106 pacientes.
DiscussãoNão foi encontrado pelos autores nenhum trabalho na literatura relacionando infecção por Bartonella spp. à VL.
Da mesma maneira que foi proposto para o SARS‐CoV‐2,12 é possível que a infecção persistente por Bartonella spp. também cause dano vascular direto ou promova estado de hipercoagulabilidade.
Sabe‐se que a VL é uma doença vaso‐oclusiva com hialinização e trombose de vasos dérmicos; muitos pacientes se queixam de dor e parestesia. Todos os pacientes do estudo referiram dor intensa associada à presença de úlceras, e a maioria referiu parestesia ou dor leve após a cicatrização.1 Há vários artigos que relacionam dores crônicas à infecção por Bartonella spp.13–15 Estudos translacionais documentam hipersensibilidade dolorosa em camundongos infectados com B. henselae.16,17 Esses micro‐organismos causam infecção intraendotelial e poderiam estimular a sínteses de endotelina (ET‐1), um potente vasoconstritor, que é relacionado à parestesia e dor, incluindo dor crônica.13,16,18,19
Em três quartos dos pacientes não foi possível detectar o DNA de Bartonella spp., o que não surpreende, já que a VL é uma manifestação cutânea de diferentes enfermidades. Além disso, B. henselae causa bacteremia cíclica, e as amostras sanguíneas podem ter sido obtidas nos intervalos em que a bactéria não estava circulando. Diferentes autores mostram que a infecção por Bartonella spp. tem maior chance de ser diagnosticada por biópsia de fragmentos teciduais em vez de amostra sanguínea, e que os resultados dessa diferença podem ser de maior importância e significância estatística.19–23 Por questões éticas, foram coletadas apenas amostras sanguíneas para minimizar os danos aos voluntários do grupo controle.
Além disso, não há método padrão ouro de diagnóstico para infecção por Bartonella spp., e resultados falso‐negativos são frequentes, mesmo quando usada plataforma com técnicas moleculares e microbiológicas. A necessidade de múltiplos testes para detecção adequada desse micro‐organismo visando reduzir falso‐negativos já foi discutida por Drummond et al. As técnicas moleculares têm como limitação baixa sensibilidade (mínimo de 4.000 cópias/mL no laboratório onde foram realizadas as análises).6 Mesmo em doenças em que há o envolvimento tecidual, a identificação do agente no exame anatomopatológico tem baixa sensibilidade.4 Historicamente, as colorações com impregnação de prata são utilizadas para a detecção de espécies de Bartonella; no entanto, como a coloração não é específica, a leitura pode ser difícil em decorrência da formação de precipitado de prata. Estudo de Caponetti et al. avaliou o uso da imuno‐histoquímica (IHQ) para identificação de B. henselae na DAG em 24 casos de linfadenite, a partir de biópsias fixadas em formalina e incluídos em parafina, e comparou os resultados com impregnação por prata (IP) e PCR. Os casos positivos foram os seguintes: IP, 11 (46%); PCR, 9 (38%); e IHQ, 6 (25%). Apenas dois casos (8%) foram positivos para todos os três estudos. A IP mostrou‐se mais sensível, mas menos específica. Apesar de 11 (46%) dos casos do estudo terem sido positivos usando IP, apenas seis dessas amostras foram concomitantemente positivas por análise IHQ e/ou PCR. Esse achado sugere que vários dos casos interpretados como positivos pela IP podem representar falso‐positivos, e que a sensibilidade diagnóstica desses três testes é baixa para DAG.24 Outro estudo com 106 casos de endocardite comparou os resultados de IHQ, Western blotting e PCR em tempo real de sangue total, soro e tecido valvar. A IHQ e a coloração de Warthin‐Starry foram as técnicas menos sensíveis. Neste estudo, a coloração de Warthin‐Starry foi o mais sensível desses dois métodos (cinco amostras foram positivas para coloração de Warthin‐Starry e negativas na análise IHQ). Entretanto, esta coloração histológica não é específica para Bartonella spp. Como o processo infeccioso pode ser localizado, um resultado imuno‐histoquímico negativo não exclui definitivamente o diagnóstico de endocardite por Bartonella spp.20 Já o isolamento de Bartonella spp. é difícil mesmo em condições específicas e ideais.
A bacteremia pôde ser documentada no caso índice, pelo isolamento da bactéria em meio sólido mesmo após um ano de tratamento com doxiciclina, mas não houve isolamento de Bartonella spp. em nenhum dos participantes do estudo. A dificuldade de tratar a infecção com antibióticos, como observado na febre das trincheiras (causada por Bartonella quintana) e na febre de Oroya (que é a primeira manifestação da doença bifásica da doença de Carrión, que pode evoluir para verruga peruana e é causada por Bartonella bacilliformis), sugerem que essas bactérias não são erradicadas. Essa potencial persistência da infecção impossibilita garantir que manifestações observadas na VL sejam reações imunes infecciosas ou pós‐infecciosas, como se tem aventado.25
Poucos grupos de pesquisa realizam cultura sólida para isolamento de Bartonella spp. Isso porque o isolamento depende de meios específicos e incubação prolongada. Além disso, o crescimento fastidioso e a falta de sucesso no primo‐isolamento fazem com que esse tipo de diagnóstico não seja viável.
Como a VL é a expressão cutânea de diferentes doenças, a infecção por Bartonella spp. poderia ser apenas uma das causas dessa manifestação. Além disso, por infectar as células endoteliais e ser o único gênero conhecido de bactérias a estimular sua proliferação em humanos,26 a pesquisa em amostras sanguíneas pode não representar a real condição do paciente em relação à infecção por essas bactérias, pois a bacteremia costuma ser cíclica.
Dados coletados no questionário de fatores de risco para bartonelose (tabela 3) mostraram que os voluntários do grupo controle eram significantemente mais jovens, uma vez que a maioria desses voluntários é composta por estudantes da Unicamp. A VL acomete mais mulheres, e houve diferença estatística entre a proporção dos sexos dos grupos. Uma limitação do estudo é que os voluntários eram mais expostos a fatores de risco para adquirir a infecção por Bartonella spp., fatores esses observados em estudo realizado com doadores de sangue do Hemocentro da Unicamp,27 uma vez que relataram, em maior número em relação aos pacientes, terem sofrido mordidas e arranhaduras, contato com animais de criação e exposição a artrópodes. Mesmo com menor exposição de risco, o grupo de pacientes com VL apresentou o dobro da taxa de infecção (25%; 4/16), o que pode indicar que a prevalência da infecção por B. henselae nos pacientes seja maior e que essas bactérias possam, de fato, ter relação com o desencadeamento da doença. Outra justificativa para não ter sido encontrada diferença estatística é o pequeno número de pacientes do estudo, que avalia pacientes com doença rara e que foi realizado como piloto em uma única instituição. Como descrito nos resultados, usando como controle voluntários com as mesmas características, seria necessário um número de pacientes quase sete vezes maior para documentar a significância estatística.
A inexistência de padrão ouro, aliada à grande dificuldade em se detectar a bacteremia causada por Bartonella spp., reforçam a necessidade de se utilizar métodos diversos e complementares visando aumentar a sensibilidade e a precisão do diagnóstico. Essa combinação de métodos e de testagem de diferentes amostras torna o diagnóstico laboratorial mais eficaz e tem sido utilizada por diferentes grupos de pesquisa.6,20,28–30
ConclusãoO DNA de B. henselae foi detectado em um de cada quatro pacientes com VL primária, o que reforça a necessidade de investigar a infecção por Bartonella spp. nesses indivíduos, ainda que não tenha havido diferença estatística entre o grupo de pacientes e o grupo controle.
Suporte financeiroBolsa de Doutorado CNPq 170501/2018‐3 (Santos, LS); bolsa de Pós‐Doutorado Fapesp 2018/12565‐6 (Drummond, MR); bolsa produtividade CNPq 301900/2015‐9 (Velho, PENF); Fundo de Apoio à Dermatologia de São Paulo (Funadersp)/Sociedade Brasileira de Dermatologia, Regional São Paulo (França, AFEC).
Contribuição dos autoresMarina Rovani Drummond: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Luciene Silva dos Santos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Lais Bomediano Souza: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Gabriela Nero Mitsuushi: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica da literatura; participação seleção dos pacientes e coleta das amostras.
Maria Letícia Cintra: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Andrea Fernandes Eloy da Costa França: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Elemir Macedo de Souza: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Paulo Eduardo Neves Ferreira Velho: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação seleção dos pacientes e coleta das amostras; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Agradecemos ao Fundo de Apoio à Dermatologia do Estado de São Paulo – Sebastião Sampaio (Funadersp) pelo auxílio à pesquisa concedido para a realização desta pesquisa. Também agradecemos ao Conselho Nacional de Desenvolvimento Científico e Tecnológico pelas bolsas concedidas: n° 170501/2018‐3 (LSS), n° 313762/2021‐0 (PENFV) e n° 151006/2021‐0 (MRD). Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Como citar este artigo: Drummond MR, Santos LS, Souza LB, Mitsuushi GN, Cintra ML, França AF, et al. Detection of Bartonella henselae DNA in the blood of patients with livedoid vasculopathy. An Bras Dermatol. 2023;98:472–9.
Trabalho realizado na Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.