A grande maioria das publicações em dermatologia tem como referência a pele clara; poucos trabalhos abordam as peculiaridades da pele negra, além de não haver consenso sobre o que é ser pele negra nas diferentes regiões do mundo. A falta de conhecimento sobre o assunto dificulta o reconhecimento e o manuseio das dermatoses nesse tipo de pele. Este artigo tem como objetivo revisar a literatura sobre características intrínsecas, assim como aspectos epidemiológicos e clínicos das manifestações cutâneas de diferentes dermatoses na pele negra. Foi verificado que há diferenças, às vezes marcantes, entre os aspectos estruturais, biológicos e funcionais das peles negra e clara. Também há alterações fisiológicas que precisam ser reconhecidas para se evitar intervenções desnecessárias. Algumas dermatoses têm maior incidência na pele negra, tais como acne, eczemas, discromias e dermatofitoses. Por outro lado, várias dermatoses são mais específicas da pele negra, tais como pseudofoliculite da barba, queloide, dermatose papulosa negra, úlceras da anemia falciforme, ainhum, papilomatose confluente e reticulada de Gougerot e Carteaud, algumas enfermidades do cabelo e do couro cabeludo (incluindo cabelo frágil e quebradiço, alopecia de tração, acne queloideana da nuca, foliculite dissecante e alopecia cicatricial central centrífuga). Um espectro de aspectos peculiares de dermatoses específicas, dentre elas sarcoidose, líquen plano (com destaque para a variante pigmentosa), psoríase, lúpus eritematoso, vitiligo, sífilis, pitiríase versicolor e neoplasias, são destacados. Nessas últimas, são comparadas características do carcinoma basocelular, carcinoma espinocelular e melanoma, além de ressaltados aspectos inusitados do linfoma cutâneo primário de células T, sarcoma de Kaposi endêmico e dermatofibrosarcoma protuberans.
A grande maioria das publicações em dermatologia tem como referência a pele clara; poucos trabalhos abordam as peculiaridades na pele negra. Essa falta de conhecimento sobre o assunto dificulta o reconhecimento das dermatoses na pele negra e pode gerar temor nos dermatologistas em realizar procedimentos mais invasivos nesses pacientes, sobretudo a respeito da indução de cicatrizes e alterações pigmentares.1,2
A população negraNão há definição única do que é ser negro. Assim, deve‐se levar em consideração essa subjetividade para a interpretação dos estudos. Segundo os antropologistas, existem cinco raças: caucasoides, mongoloides, australoides, negroides/congoides e capoides. Já etnia refere‐se a um grupo social com afinidades linguísticas, culturais e ancestrais.1–4 No dicionário Aurélio, a definição de negro é “aquele de cor muito escura; preto”. Levando‐se em consideração a classificação dos fototipos de Fitzpatrick, os negros se enquadram nos tipos IV, V e VI, aqueles que raramente ou nunca se queimam pelo sol e se bronzeiam com facilidade.1,3
Enquanto nos Estados Unidos negro é aquele que tem ancestral negro em qualquer ponto da árvore genealógica, independente do tom da pele, no Brasil, o Instituto Brasileiro de Geografia e Estatística (IBGE) distingue as variedades pela cor da pele, que pode ser branca, preta, amarela, parda e indígena, considerando negros os pardos e os pretos.3 O termo pardo aplica‐se à miscigenação entre índios, brancos e negros, ou seja, pessoas com ancestralidade indígena, europeia e africana.3 Em virtude do alto grau de miscigenação da população brasileira, há pouca precisão em identificar um negro, prevalecendo para fins estatísticos o critério da autodeclaração.3
De acordo com dados da Pesquisa Nacional por Amostra de Domicílios (PNAD contínua) 2021, 43% dos brasileiros se declararam brancos, 47% pardos e 9,1% pretos.4
Aspectos estruturais, biológicos e funcionais da pele negraEpidermeEstrato córneoNão há variação significante na espessura do estrato córneo, embora os negros apresentem maior número de camadas e essas sejam mais compactas e coesas.5,6 Na pele clara, são necessárias 6 a 15 tiras de fita para remover o estrato córneo; na pele negra, de 8 a 25. Em virtude da maior coesão, vesículas e bolhas permanecem mais tempo intactas na pele negra que na pele clara.7
Composição lipídicaA pele negra apresenta níveis menores de ceramidas e maior perda transepidérmica de água,5,7 além de um índice de 2,5 vezes maior de descamação espontânea que a branca, justificando maior xerose nessa população.8
Melanócitos/melanossomosNão há diferença no número de melanócitos na pele negra, e sim nas características dos melanossomos (maiores, não agregados e degradados mais lentamente quando comparados aos da pele branca). Sua distribuição também difere, estando em toda a epiderme. Além disso, os melanossomos têm pH mais neutro e maior atividade da tirosinase.5,7,9,10
Há maior melanogênese nos negros, e o conteúdo de melanina confere naturalmente fator de proteção solar (FPS) de 13,4 em comparação com 3,4 nos brancos.11 A pele escura transmite 7,4% de raios ultravioleta (RUV) B em comparação com 29,4% na pele clara,7,12,13 ou seja, aproximadamente quatro vezes menos RUV atingem a derme superior, minimizando o fotoenvelhecimento e a propensão aos tumores cutâneos.7,12 Porém, como os RUV deterioram o sistema de defesa, a pele negra também requer fotoproteção.7,12
A composição relativa de eumelanina e feomelanina independe do grau de pigmentação, mas há baixo teor de eumelanina fotoprotetora nas peles mais claras, explicando a maior sensibilidade aos RUV.14
DermeNão há diferença na espessura da derme entre os grupos étnicos, mas sim a nível celular.5,7,9 Os feixes de fibras colágenas são menores. Os macrófagos são maiores e mais numerosos, enquanto os mastócitos diferem apenas no tamanho dos grânulos, que são maiores.5,7,9 Os fibroblastos são maiores, mais numerosos, bi ou multinucleados e hiperreativos, o que, associado à diminuição constitucional da colagenase, explica a maior predisposição a queloides.1 Essas características protegem dos efeitos da idade, retardando a atrofia da derme nos negros. Não há diferenças no tecido elástico.7,9
Glândulas anexasAs variações das glândulas anexas apresentam estudos conflitantes. Alguns relatam que não existem diferenças no número de glândulas écrinas. No entanto, a maioria concorda que as glândulas apócrinas apresentam‐se em maior número, tamanho e também produzem grande quantidade de secreção, com odor característico.5,7 As glândulas sebáceas não apresentam diferenças no número, mas são maiores e produzem maior quantidade de sebo,7 o que pode favorecer o surgimento de lesões de acne.8
Couro cabeludo, folículos pilosos e cabelosCouro cabeludoO couro cabeludo apresenta máculas semelhantes a asteriscos, escamas e resíduos de cosméticos; eritema é comum. A cor, vista na tricoscopia, varia entre o marrom claro e o preto e não se correlaciona com a cor da pele; uma rede pigmentada perifolicular, ou padrão em favo de mel, formada por linhas pigmentadas (correspondentes aos melanócitos da crista da rede) que circundam áreas hipocrômicas (menos melanócitos na epiderme suprapapilar) é visível. Uma característica única e normal é a presença de pontinhos brancos entre as unidades foliculares, semelhante ao sinal de fibrose da alopecia cicatricial.15
Folículos pilososA densidade e o número de folículos pilosos são menores e há diferenças na sua forma: são curvados, em forma de espiral, cuja secção transversal é elíptica. Há assimetria na forma e na distribuição celular do bulbo capilar e das bainhas radiculares interna e externa.16,17 Os melanossomos estão presentes na bainha radicular externa e no bulbo dos pelos velinos, por isso são mais fortemente pigmentados. As glândulas sebáceas estão em menor quantidade e são menos ativas, secretando menos sebo, contribuindo para o ressecamento.16–18 O fluxo sanguíneo está diminuído, aumentando a suscetibilidade à alopecia cicatricial. A ancoragem do tecido elástico ao folículo piloso está reduzida, favorecendo à alopecia por tração.7
CabelosO cabelo negroide é a característica fenotípica mais distinta nos negros. São difíceis de pentear, resultando em práticas distintas de cuidados; além de lavagem menos frequente, formam nós, rachaduras e fissuras longitudinais ao longo da haste.7,19,20 Há vários graus de cachos, e a fragilidade mecânica aumenta com graus mais altos de curvatura. A haste apresenta menor diâmetro, cutícula mais fina e ressecamento (menor conteúdo de água e sebo), apresentando menor resistência tênsil, o que favorece à quebra.1 Várias proteínas extracelulares da matriz e as junções de adesão estão diminuídas,16,17 levando a diferenças na textura, na resistência e na capacidade de gerenciamento do cabelo. As unidades foliculares comumente apresentam fios de cabelo emergindo juntos e as fibras onduladas emergem angularmente ao couro cabeludo. A composição química é semelhante à dos outros grupos, como a de queratina e aminoácidos. Pequenas diferenças foram relatadas no número de proteínas com baixo e alto teor de enxofre (pontes dissulfeto).17,18 Quando colocado na água, o cabelo afro‐americano tem porcentagem menor de absorção radial do que o asiático e o caucasiano, talvez em virtude das diferenças no teor de lipídios.16,19,20
As principais diferenças entre a pele negra e a pele clara são demonstradas na tabela 1.
Diferenças entre a pele negra e a pele clara
| Características | Pele negra | Pele clara |
|---|---|---|
| Estrato córneo | Igual espessura | Igual espessura |
| Células do extrato córneo compactas, com grande coesão intercelular. Mais camadas de células | Células menos compactas, menos camadas de células | |
| Melanócitos | Igual em número | Igual em número |
| Melanossomas | Longos, não são agrupados, presentes em toda a epiderme | Pequenos, agrupados, ausentes nas camadas superficiais da epiderme |
| Conteúdo de melanina | Maior | Menor |
| Pelo | Espiral | Liso, helicoidal, ondulado |
| Síndrome de degeneração folicular | ++ | ‐ |
| Alopecia de tração | ++ | ‐ |
| Mastócitos | Grânulos grandes | Grânulos pequenos |
| Prurido | ++ | + |
| Fibras colágenas | Pequenas e empilhadas | Fragmentos de fibras ocasionalmente presentes. |
| Cicatrização e formação de queloide | +++ | + |
| Fibroblastos | Longos e em maior número | Pequenos e em menor número |
| Produção de vitamina D | + | +++ |
Fonte modificada de Zaid, 2017.7
Há variações na pele negra que podem ser confundidas com anormalidades. Por outro lado, algumas dermatoses são mais frequentes ou praticamente exclusivas dos negros e outras apresentam‐se de maneira particular, com características inerentes à intensa pigmentação e à tendência a padrões peculiares de reação. Essas particularidades requerem habilidade para o reconhecimento e o manuseio apropriado e estão classificadas, segundo os temas, na figura 1.1,3
Os negros tendem a ter quatro padrões patológicos de reação:1 1) labilidade pigmentar (tendência à formação de lesões pigmentares, resultando em hiperpigmentação e hipopigmentação); 2) resposta folicular e doenças foliculares; 3) resposta mesenquimal (fibroblástica e granulomatosa); 4) resposta bolhosa.
Vale ressaltar que as dermatoses vermelhas ou marrons na pele clara, mascaradas pela pigmentação, aparecem pretas, cinzas ou roxas na pele negra. As lesões foliculares, papulares e anulares são mais frequentes em afro‐caribenhos.7
Peculiaridades fisiológicas da pele negraAs alterações fisiológicas da pele negra são demonstradas na tabela 2.21–27
Peculiaridades fisiológicas da pele negra
| Alteração | Incidência | Etiopatogenia | Características clínicas |
|---|---|---|---|
| Melanose da área malar21 | Igual quanto ao sexo; maior acima de 50 anos | Desconhecida. Em mulheres jovens, parece relacionar‐se à atopia | Hipercromia, de limites imprecisos, distribuída simetricamente nas regiões malares |
| Hiperpigmentação perioral21 | Mais em mulheres | Desconhecida; parece não ser sequela de inflamação | Hipercromia na pele adjacente aos ângulos da boca |
| Melanose periorbital22 | Mais em mulheres | Multifatorial: genética, hiperpigmentação pós‐inflamatória, edema periorbitário, hipervascularização e sombreamento | Hipercromia periorbital e palpebral bilateral, às vezes até a parte superior do nariz e glabela. Há aumento da quantidade de melanina na derme papilar com vasodilatação na derme reticular e macrófagos contendo pigmento na derme |
| Hiperpigmentação maturacional22 | 4‐5ª década de Fitzpatrick tipos de pele IV‐V | Exposição crônica ao sol e possivelmente obesidade e diabetes | Manchas hipercrômicas, com bordas pouco nítidas que eventualmente desaparecem na pele normal afetando áreas expostas ao sol, incluindo as faces laterais da face e dorso das mãos e pés. Na Histopatologia, proliferação de melanócitos com relatos de proliferação epidérmica papilomatosa |
| Linhas de Voigt‐Futcher7,23 | 17% a 40% dos negros; mais em mulheres | Desconhecida. Congênita ou adquirida (hormonal – gravidez) | Linhas bem demarcadas bilaterais, que separam áreas mais pigmentadas de áreas mais claras. Pode ocorrer nos membros, tórax ou abdome, seguindo dermátomo |
| Hipopigmentação da linha média7 | 30% a 40% dos negros; mais em homens; menos visível com a idade | Herança autossômica dominante | Faixa linear hipocrômica na região esternal, podendo estender‐se até a linha alba e região infraclavicular |
| Hiperpigmentação palmoplantar7 | Comum e mais frequente quanto maior a pigmentação da pele | Máculas hipercrômicas pequenas, bem delimitadas, em número e tamanho variável, nas superfícies palmoplantares | |
| Melanoníquia ungueal estriada7,24 | Mais frequente quanto maior a pigmentação da pele; até 77% dos adultos jovens afro‐americanos e quase 100% nos maiores de 50 anos, aumentando a intensidade com a idade | Ativação melanocítica na matriz, com deposição de melanina na lâmina ungueal. Menos comumente, hiperplasia melanocítica na matriz ou no leito ungueal | Pigmentação em faixas longitudinais ou difusa na unha, desde a matriz até a ponta, mais comum nos1° e 2° quirodáctilos. Na dermatoscopia, fundo homogêneo acinzentado, com linhas acinzentadas longitudinais e paralelas. Pode ser visto o sinal pseudo‐micro‐Hutchinson (pigmentação da cutícula) |
| Hiperpigmentação da mucosa oral7 | Desenvolve durante as duas primeiras décadas de vida | Ativação melanocítica com deposição de melanina no epitélio | Manchas hipercrômicas, localizadas ou disseminadas. Nas gengivas, são mais comuns einestéticas, especialmente com linha de sorriso alta |
| Mancha mongólica25 | 40% a 90% dos recém‐nascidos negros. Costuma desaparecer até os 7 anos de idade | Desconhecida. Quando extensa, associa‐se com condição sistêmica, como erros congênitos do metabolismo | Mancha azul‐acinzentada, geralmente única, na região lombossacra. Melanócitos na derme |
| Leucoedema oral26 | 70% a 90% dos negros adultos e 50% das crianças; mais em homens | Fisiológico, mas a irritação por fumo ou má higiene oral precária são fatores. Há acúmulo de líquido nas células epiteliais | Placas branco‐acinzentadas, edematosas, na mucosa jugal, bilateralmente, que desaparecem se a mucosa é distendida. Dobras ou linhas brancas podem cruzar a área afetada |
| Pápulas peroladas penianas27 | 14% a 48% dos homens negros; na idade pós‐puberal ou início da idade adulta, declinando com a idade | Acredita‐se que sejam estruturas vestigiais | Pápulas assintomáticas, benignas, branco‐peroladas, em cúpula ou filiformes, de 1 a 4mm, ao redor da glande, em fileira única ou dupla. A dermatoscopia mostra padrão de paralelepípedos ou uva com vasos centrais pontilhados ou em vírgula. A histopatologia mostra ser angiofibroma |
Cinco principais diagnósticos em dermatologia destacam‐se nos afro‐americanos: acne, eczema não especificado, dermatite atópica, dermatite seborreica e discromia.28
Na população angolana de fototipo V‐VI, em Luanda, destaca‐se a prevalência de acne, dermatofitose e dermatite atópica. Em indivíduos com 13 anos ou mais, as principais queixas foram acne (23,6%), dermatofitose (11,0%) e pitiríase versicolor (8,6%). Na população pediátrica, dermatite atópica (29,4%), tinea capitis (13,7%) e molusco contagioso (12,5%) foram os distúrbios mais frequentes. Nas mulheres adultas, a acne (31,3%) foi a principal condição, enquanto nos homens adultos, a dermatofitose (13,5%).29
Hábitos socioculturais nas comunidades negras, visando mascarar alterações da pigmentação com produtos emolientes, produzem foliculites. O uso de pomadas, óleos e cremes nos cabelos, em geral, causam alopecia e acne cosmética na região frontal.7
AcneA acne é uma das condições mais comuns, observada em crianças e adolescentes negros. Sua patogênese é semelhante entre os diferentes grupos étnicos, mas produtos usados frequentemente na pele e nos cabelos por indivíduos negros podem ser comedogênicos. As lesões nódulo‐císticas são menos frequentes, mas mesmo lesões sem inflamação clínica, como as comedoneanas, apresentam alto grau de inflamação histológica, o que pode explicar a hiperpigmentação pós‐inflamatória. Cicatrizes queloideanas são sequelas frequentes no tórax, no dorso e na linha mandibular.1,30,31
EczemasEczema de contatoOs negros são menos suscetíveis a irritantes. Isso é atribuído à maior coesão das células do estrato córneo na pele escura. Essa diferença é indetectável se o estrato córneo é removido.7 As características clínicas em pacientes com pele escura incluem liquenificação, hiperpigmentação e erupção papular ou folicular precoce com mínimo eritema.
Nos testes de contatos, verifica‐se semelhança na frequência geral de alergia entre negros e brancos, mas há diferenças na sensibilização aos alérgenos, com positividade a níquel, mistura de fragrâncias, bacitracina, bálsamo do Peru e parafenilenodiamina (PFD). A PFD, encontrada na tintura de cabelo, e a imidazolidinilureia, um conservante liberador de formaldeído, foram mais frequentemente alergênicos em homens negros em comparação aos brancos.32 O uso de tinturas de cabelo mais escuras na comunidade negra pode explicar a maior sensibilização a PFD. As diferenças nos padrões de sensibilização, provavelmente, se devem a práticas culturais.33
Dermatite atópicaA patogênese da dermatite atópica (DA) inclui fatores genéticos e ambientais, variando entre diferentes populações étnico raciais. Indivíduos negros têm sete vezes mais chances de procurar atendimento para DA que brancos.34 Há diferenças nas propriedades de barreira da pele que podem ter implicações na DA.28 Diferenças nas cepas de S. aureus, incluindo variabilidade na presença de genes superantígenos, foram demonstradas entre brancos e negros com DA.35 Clinicamente, há expressões diferenciadas de eritema, em virtude da melanina de fundo, manifestando‐se com placas marrom‐avermelhadas, violáceas, cinzas ou intensamente hipercrômicas, em vez de vermelho vivo. Há maior visibilidade da descamação e do ressecamento. Localizam‐se mais frequentemente nas áreas extensoras do que nas flexurais. O prurido é mais frequente e mais grave. Pápulas foliculares e perifoliculares, morfologia liquenoide ou papulonodular são frequentes, além de hipercromia e liquenificação periorbitária. Hiperpigmentação pós‐inflamatória é mais frequente e persistente.35
Dermatite seborreicaA dermatite seborreica (DS) está entre os cinco diagnósticos mais comuns em negros.29 Em adultos e adolescentes, o eritema subjacente é pouco visível e há hipopigmentação nas áreas clássicas de envolvimento,36 possivelmente pela inibição da função da tirosinase no melanócito por metabólitos da Malassezia, com menor produção de pigmento.37,38 Crianças negras frequentemente apresentam eritema, descamação e hipopigmentação das áreas afetadas e DA sobrejacente, que acentua a hipopigmentação.37,39
A DS do couro cabeludo é proeminente entre mulheres negras e pode ser exacerbada pelo uso excessivo de óleos ou pomadas capilares e pela lavagem infrequente.38 Nas crianças, em geral, não tem a “crosta láctea”, vista em caucasianos.38,39 Em outras faixas etárias, a DS petaloide, com lesões circinadas, anéis policíclicos coalescentes, rosa ou hipopigmentados, com descamação furfurácea, é observada na linha de implantação capilar ou em outras áreas do rosto.39
DiscromiasOs distúrbios pigmentares são a terceira condição mais comum na pele de negros,28 podendo ser tanto a hiperpigmentação como a hipopigmentação/acromia, a última psicologicamente devastadora, em virtude do contraste marcante com a pele normal, além da resistência ao tratamento.7
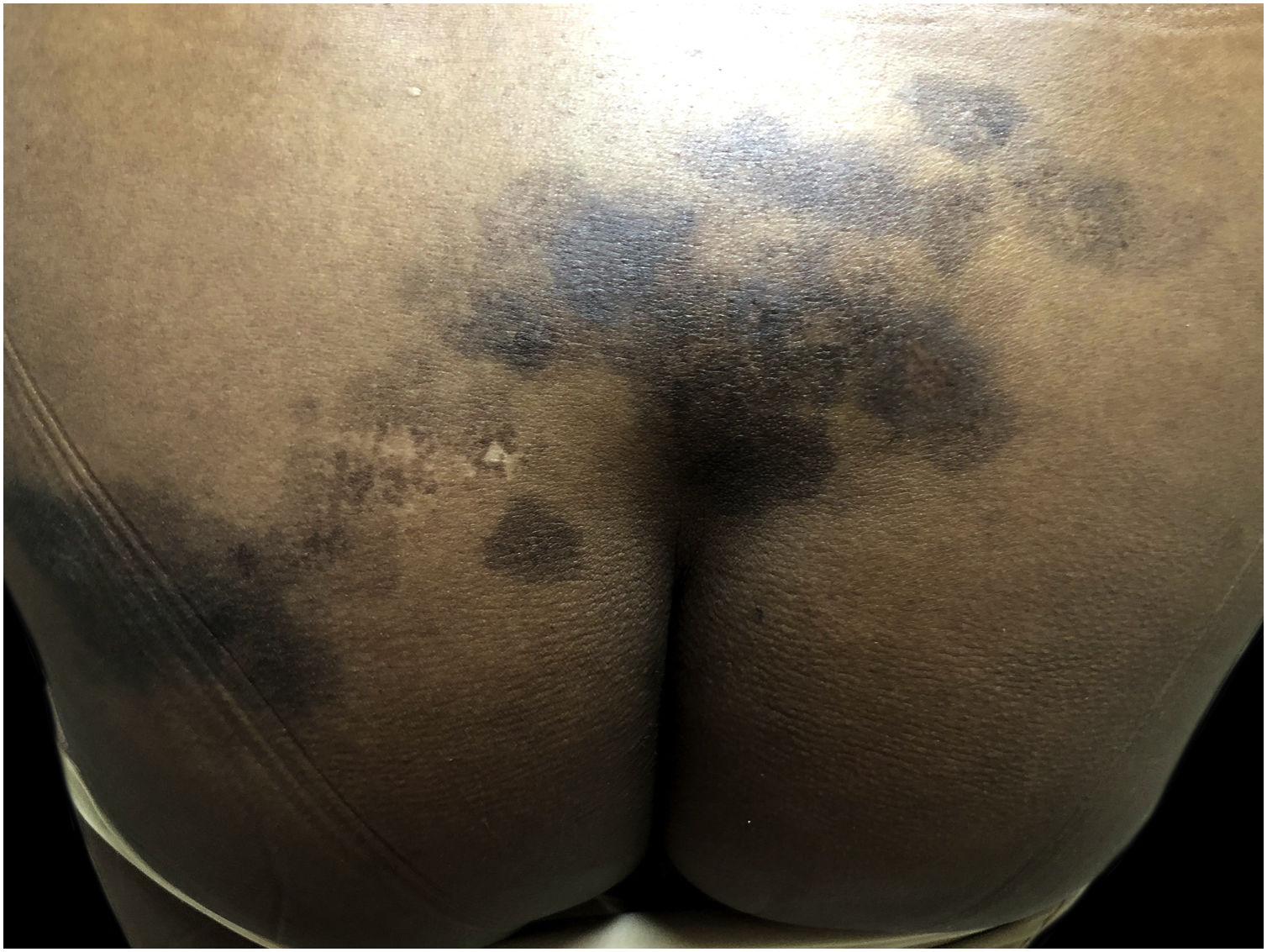
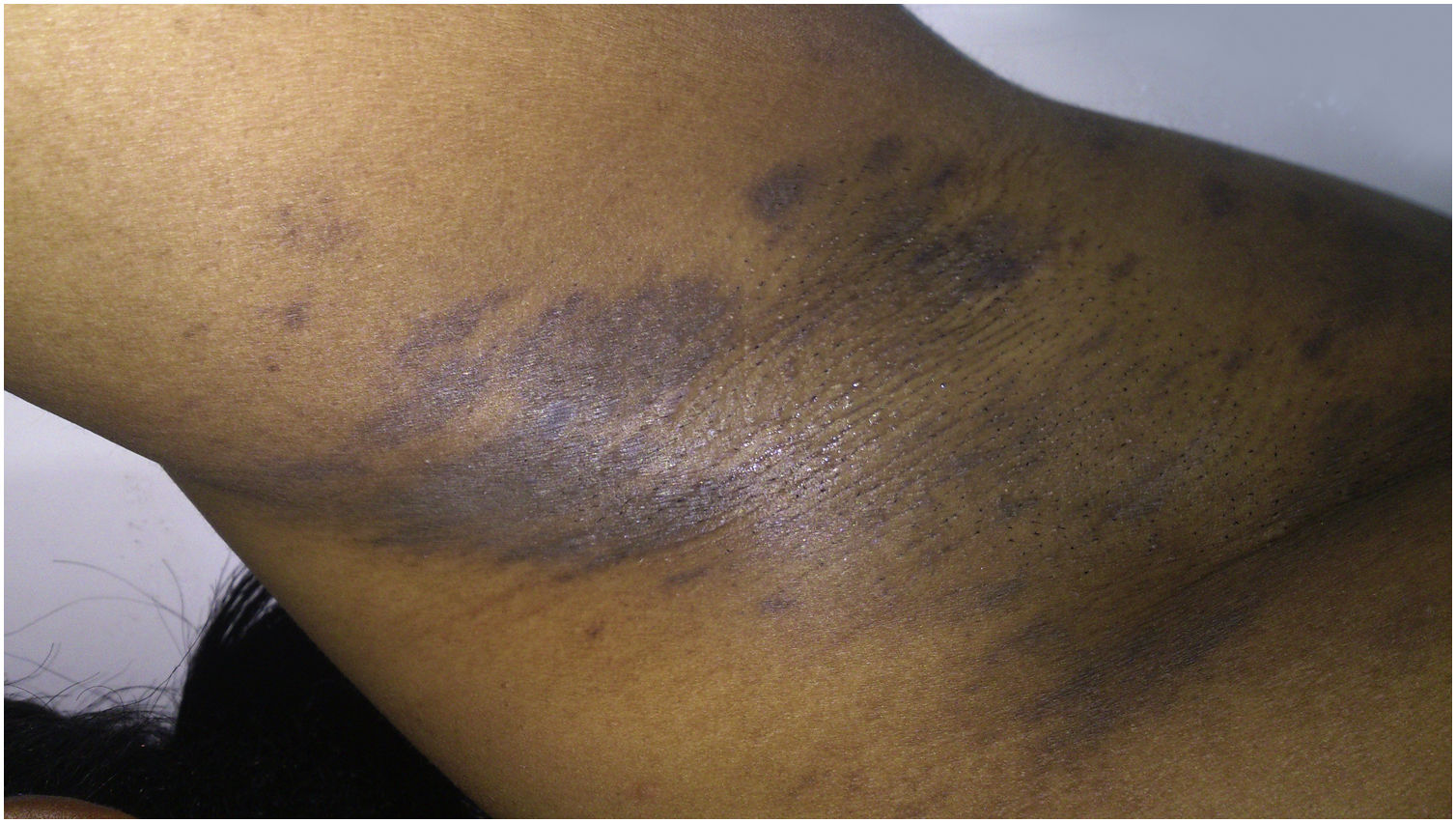
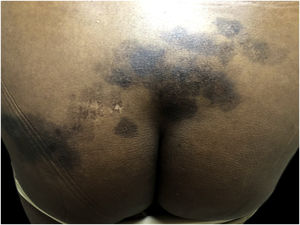
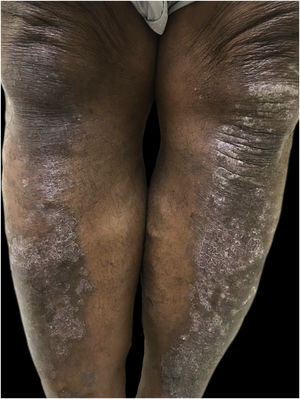
Hiperpigmentação pós‐inflamatóriaEntre os distúrbios da pigmentação na pele negra, a hiperpigmentação pós‐inflamatória (HPI) é o mais comum. Ocorre após inflamação ou injúria cutânea,30,40,41 resultante da produção excessiva ou dispersão irregular de melanina.2 Várias são as etiologias, incluindo infecções, doenças inflamatórias e injúria cutânea por agentes físicos ou químicos, inclusive procedimentos cosmiátricos. A HPI se manifesta como máculas na mesma distribuição que o processo inflamatório inicial, cuja intensidade pode ter correlação direta com os fototipos (fig. 2).41
Hipopigmentação pós‐inflamatóriaA hipopigmentação pós‐inflamatória é mais comum e mais evidente em pessoas com pele escura. Resulta de condições, como inflamatórias (DA, DS, dermatite de contato, psoríase etc.), neoplásicas (micose fungoide), infecciosas (sífilis), traumáticas (feridas, queimaduras) ou iatrogênicas (pós‐laser, crioterapia ou peelings químicos). Apresenta‐se na forma de mácula única ou múltiplas, de tonalidade hipocrômica, sem descamação.7
Hipomelanose macular progressivaA hipomelanose macular progressiva (HMP) é dermatose comum e mal diagnosticada. Distribui‐se mundialmente e é mais frequente nos países tropicais em negros, afetando, preferencialmente, mulheres jovens. Acredita‐se que C. acnes produza um fator despigmentante, visto que essa bactéria pode ser cultivada a partir dos folículos nos pontos hipopigmentados, mas não na pele vizinha de aparência normal. Caracteriza‐se por manchas hipopigmentadas confluentes, mal definidas, não descamativas, localizadas no tronco, em torno da linha média e, raramente, estendendo‐se às extremidades proximais e às regiões da cabeça e do pescoço.31 Não há prurido, dor ou inflamação prévia. É estável ou progride lentamente por anos, com desaparecimento espontâneo após a meia‐vida.31 A luz de Wood pode mostrar fluorescência folicular vermelha nos pontos hipopigmentados. A dermatoscopia revela áreas esbranquiçadas, mal definidas, sem descamação.42 O exame histopatológico exibe diminuição de melanina na epiderme, e a derme tem aparência normal.43,44
Pitiríase albaA pitiríase alba (PA) inicia‐se em torno dos 3 a 16 anos, sem predileção por sexo, ocorrendo mais comumente na pele mais escura.31 Sua etiopatogenia permanece desconhecida; contudo, acredita‐se que represente dermatite inespecífica com hipopigmentação pós‐inflamatória residual. Achados associados incluem glândulas sebáceas atróficas, anemia por deficiência de ferro e baixos níveis de cobre sérico.44 As crianças negras podem ser geneticamente predispostas à xerose, o que pode levar à PA.31 Fatores ambientais como exposição solar, banhos longos e frequentes e esfoliação mecânica parecem ser fatores predisponentes na pele suscetível.31 É importante indagar sobre a história pessoal ou familiar de atopia, pois é um dos critérios menores para a DA.31,44 Na pele escura, lesões precoces se apresentam como dermatite subclínica e o eritema é pouco evidente.31 As lesões iniciais são pápulas descamativas que evoluem para manchas hipocrômicas bem visíveis, diferente da pele clara, em virtude do contraste com a pele sã, acometendo geralmente a face, o pescoço e os braços; os achados histológicos são inespecíficos.31,44
MelasmaO melasma é hiperpigmentação adquirida comum, ocorrendo tipicamente na face, com alta prevalência em mulheres e tipos de pele mais escuras. A história familiar, principalmente na pele mais escura, é importante fator de risco.45,46 Clinicamente, a pigmentação é mais intensa e persistente. Na histopatologia, os melanófagos têm sido detectados na derme superficial, com distribuição muito heterogênea, variando de uma região da lesão para outra num mesmo paciente e até mesmo dentro de um determinado melasma.46
Dermatoses mais específicas da pele negraPseudofoliculite da barbaA pseudofoliculite da barba (PFB), também conhecida como pili incarnati ou sicose da barba, é doença crônica comum, vista quase exclusivamente nos homens negros, entre 14 e 25 anos de idade, com prevalência entre 45% e 83%. A condição causa problemas em profissões que necessitam de aparência barbeada.47 A etiopatogenia é uma reação inflamatória de corpo estranho ao redor do pelo, em virtude de suas características estruturais e pela direção de seu crescimento, que curva para baixo e penetra na epiderme e na derme (penetração extrafolicular) ou cresce dentro do folículo, perfura sua parede e penetra na derme (penetração transfolicular). Essa última, em geral, resulta da técnica de barbear incorreta, como esticando a pele, e o uso de lâminas que puxam o pelo em vez de cortá‐lo, resultando na sua retração com a ponta abaixo da superfície da pele. Estudos de biologia molecular verificaram a substituição de um único nucleotídeo na queratina específica das camadas do folículo piloso (K6hf).48 Acredita‐se que a mutação em K6hf leva a um citoesqueleto enfraquecido, aumentando as chances de pelos encravados. Os portadores do polimorfismo A12T do gene que codifica a queratina têm chance seis vezes maior de desenvolver PFB. Cerca de 76% dos homens que fazem a barba regularmente e que carregam o polimorfismo A12T desenvolvem PFB, o que torna este um fator de risco significante para a doença. Por fim, a PFB foi associada ao uso de ciclosporina e de corticosteroides em pacientes com transplante renal e também à pressão do violino sob a mandíbula (pescoço de violinista).49 Clinicamente, são papulo‐pústulas foliculares, onde o pelo pode ser visto num sulco linear. Acomete, principalmente, a face e o pescoço do homem, mas também é vista em mulheres em áreas onde se pratica depilação, tais como as axilas, a região púbica e as pernas no climatério ou em jovens hirsutas. As pústulas podem ser secundárias à infecção, geralmente por Staphylococcus epidermidis. Pode ocorrer hiperpigmentação pós‐inflamatória e queloides. O exame histopatológico mostra invaginação da epiderme, infiltrado inflamatório neutrofílico, microabscessos, granulomas do tipo corpo estranho e fibrose.49
QueloideOs queloides e as cicatrizes hipertróficas são considerados tipos distintos de cicatrizes. São crescimentos benignos excessivos de tecido cicatricial em locais de injúrias cutâneas. Clinicamente, queloides são pápulas, placas ou nódulos lisos, brilhantes e firmes, vermelhos ou rosados, com hiperpigmentação progressiva, que se espalham na pele normal circundante. Cicatrizes hipertróficas não crescem além dos limites da injúria original. Na histopatologia, queloides tendem a apresentar grande volume de colágeno hialino, eosinofílico e espesso e muitos vasos sanguíneos; o contrário ocorre nas cicatrizes hipertróficas. No entanto, a cicatriz pode apresentar crescimento e características histológicas tanto de cicatrizes hipertróficas quanto de queloides, sugerindo que ambos sejam manifestações de uma mesma doença fibroproliferativa, diferindo apenas na intensidade e na duração da inflamação.50,51
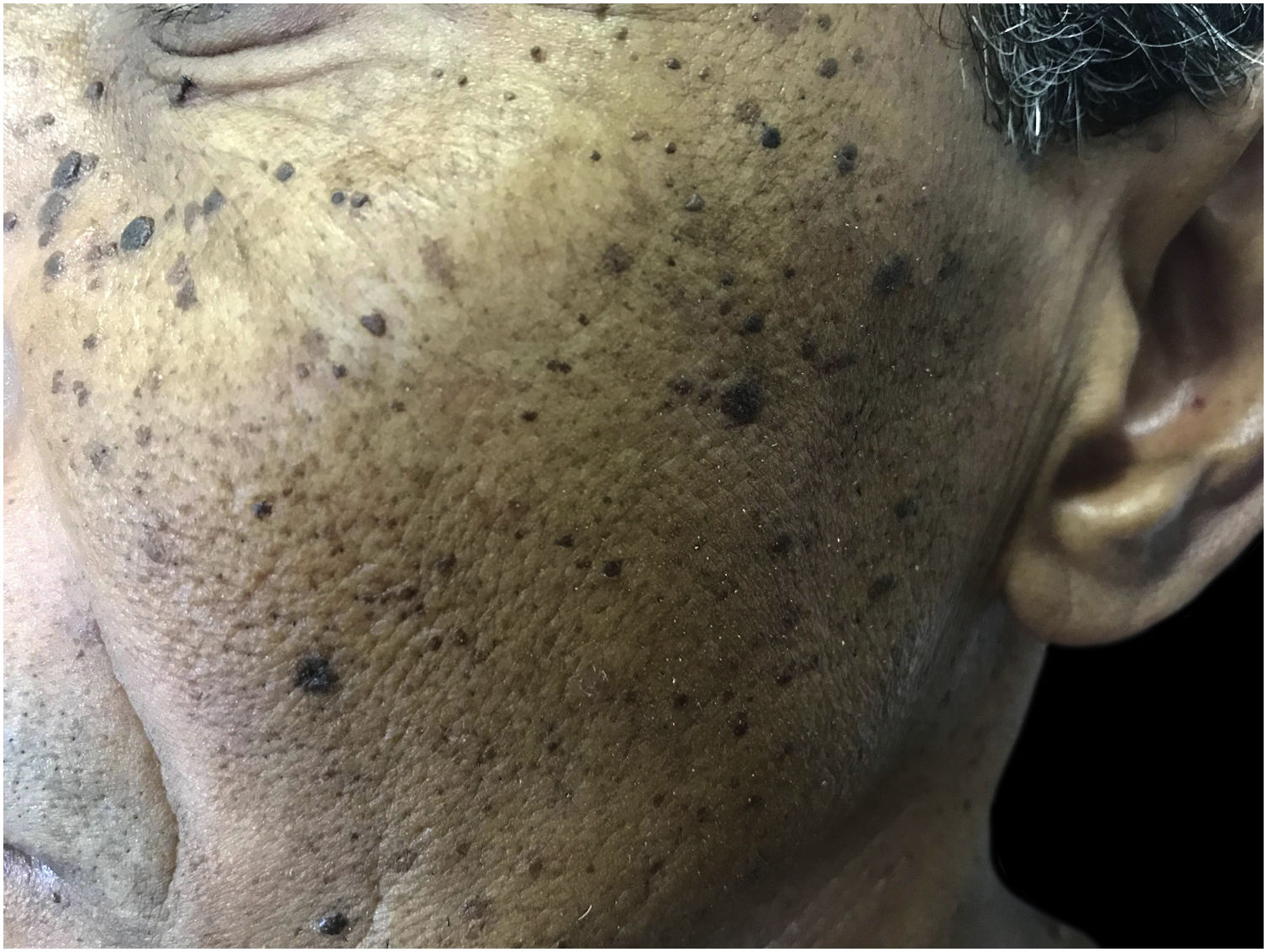
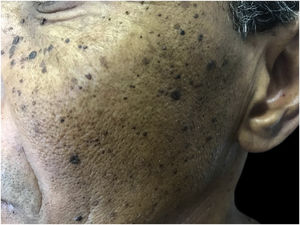
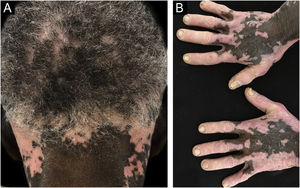
Dermatose papulosa negraSão lesões benignas da pele, de etiologia desconhecida, mas com predisposição genética, com mais de 50% dos pacientes relatando história familiar.7 A maior prevalência é em negros, entre 10% e 30%. Inicia‐se após a puberdade, como múltiplas pápulas hiperpigmentadas, arredondadas ou filiformes, com 1 a 5mm, na face, no pescoço e no tronco, aumentando gradativamente em número (fig. 3). Em geral, são assintomáticas, embora possam irritar e coçar.7
Úlceras da anemia falciformeAs úlceras são complicação frequente da doença falciforme. A origem geográfica é um fator na ocorrência dessa doença.52,53 Os genótipos dos pacientes são, em ordem decrescente de frequência: anemia falciforme SS homozigótica, talassemia Sb0 heterozigótica composta e hemoglobina do traço falciforme. A incidência das úlceras varia com a taxa de hemoglobina total e a taxa de hemoglobina fetal. Quando baixas, estão associadas a risco aumentado. São úlceras muito dolorosas, localizadas nas pernas, com difícil cicatrização. O prognóstico associa‐se às suas características clínicas, e não às características biológicas da doença falciforme. A cura completa foi alcançada em 6 meses em 75% dos casos, quando a área era inferior a 8cm2 e a duração inferior a 9 semanas, comparável às taxas de cura observadas em úlceras venosas.52,53
AinhumTambém conhecido como dactilólise espontânea ou ayun (na língua iorubá, significa cortar), é de ocorrência mundial, porém mais comum em países africanos, com prevalência baixa (0,015%). No Brasil, acomete indivíduos com fenótipos diversos.54
O quadro tem início com fissura assintomática na base do quinto pododáctilo, evoluindo para anel constritivo fibroso, com dor, levando à mutilação por isquemia. Eventualmente, pode ser bilateral.55,56 Diferencia‐se do pseudoainhum, secundário a condições que causam constrição, por seu início espontâneo e idiopático. O diagnóstico clínico inclui pelo menos um dos três critérios a seguir: constrição dos tecidos moles, alargamento bulboso dos dedos dos pés e adelgaçamento ou lise dos ossos da falange, além da confirmação radiográfica.56
Papilomatose confluente e reticulada de Gougerot e CarteaudA papilomatose confluente e reticulada de Gougerot e Carteaud (PCRGC) é dermatose que afeta adolescentes e adultos jovens, especialmente mulheres, e é duas vezes mais frequente em negros do que em brancos. Pode associar‐se com resistência à insulina e obesidade.31 Caracteriza‐se por pápulas finas, escamosas, inicialmente eritematosas e, posteriormente, marrons, que se fundem em placas reticuladas, hiperceratóticas ou verrucosas, no peito e nas costas, assintomáticas ou levemente pruriginosas. A histopatologia evidencia hiperceratose, com papilomatose irregular, acantose focal e aumento de melanina. Acantose nigricante é o principal diagnóstico diferencial.31
Enfermidades do cabelo e do couro cabeludoCabelo frágil e quebradiçoA quebra é problema comum no cabelo negroide, levando ao crescimento deficiente e à alopecia, em virtude das características intrínsecas de fragilidade e resistência à tração reduzida. A fragilidade resulta da forma elíptica das hastes decorrente do folículo curvo, dos diferentes diâmetros capilares e do couro cabeludo seco. A assimetria transversal, com pontos de fraqueza, reduz a resistência à tração.57,58 Contribui para a quebra os danos na haste consequentes à remoção de proteínas ou do ácido 18‐metil eicosanóico (18‐MEA), principal lipídio da cutícula do cabelo, por uso excessivo do calor ou de agentes químicos, além de penteados que exercem tração.17,59,60
A dermatoscopia (tricoscopia) evidencia a tricorrexe nodosa, onde a haste está nodularmente dilatada e mais clara, e a tricoptilose distal (rachadura das pontas) ou central (divisão longitudinal na parte central do eixo capilar).17,61–63
Alopecia de traçãoCausada pela tensão repetitiva nos cabelos por tranças, rabos de cavalo, turbantes, coques, dreadlocks, tramas, extensões, entre outras.64 Em geral, começa na infância.64,65 O padrão é característico, refletindo a distribuição da tração, afetando as regiões temporais, pré‐auriculares e acima das orelhas, podendo envolver outras partes do couro cabeludo. Foliculite, redução da densidade capilar e cabelos quebrados são vistos nessas áreas, além do sinal da franja (pelos terminais longos anteriores à área de alopecia, constituída por pelos residuais finos ou miniaturizados). Pode associar cefaleia, aliviada ao soltar os cabelos.65,66 O diagnóstico precoce é importante, pois ainda é reversível. A tricoscopia no estágio inicial mostra o padrão em favo de mel do couro cabeludo preservado, eritema perifolicular, densidade capilar reduzida e velos. O estágio avançado caracteriza‐se por perda das aberturas foliculares.17,65,66 As características histopatológicas no estágio inicial evidenciam número normal de folículos pilosos, porém maior de folículos telógenos e catágenos, além de tricomalácia (restos de hastes nos óstios). Em estágios avançados, há diminuição na contagem de folículos terminais, substituídos por tratos fibróticos. Não há infiltrado inflamatório no curso dessa doença.66
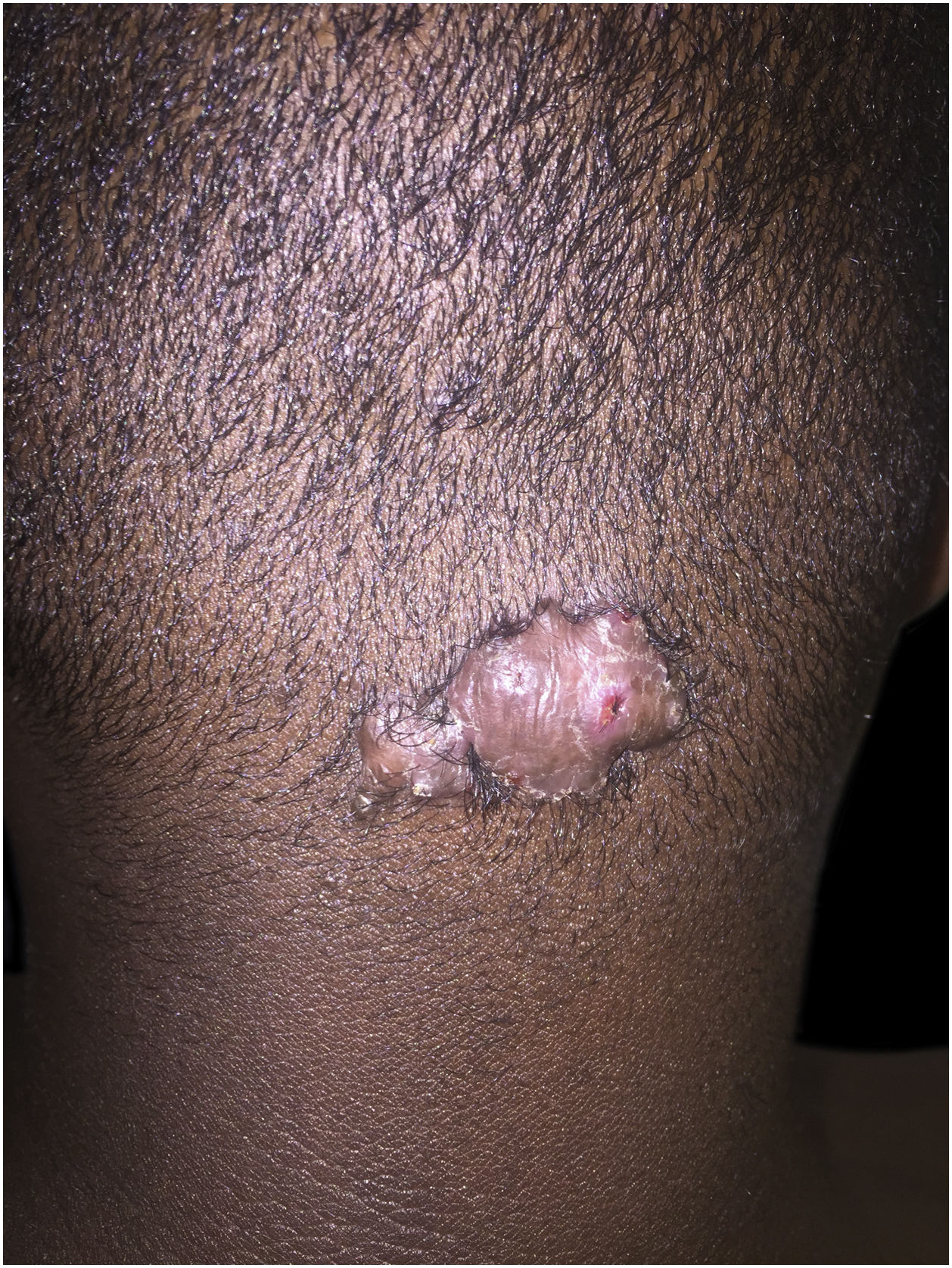
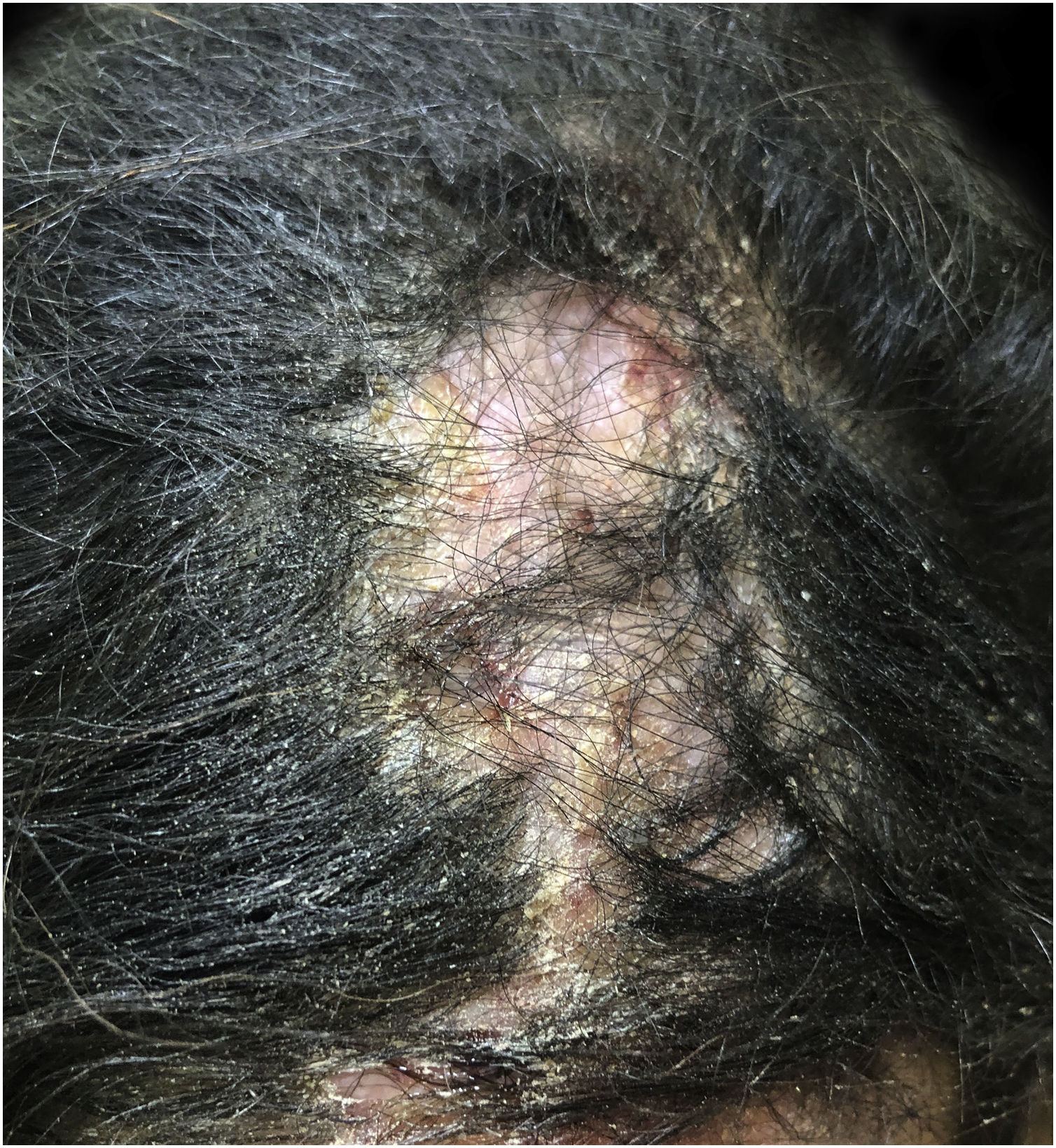
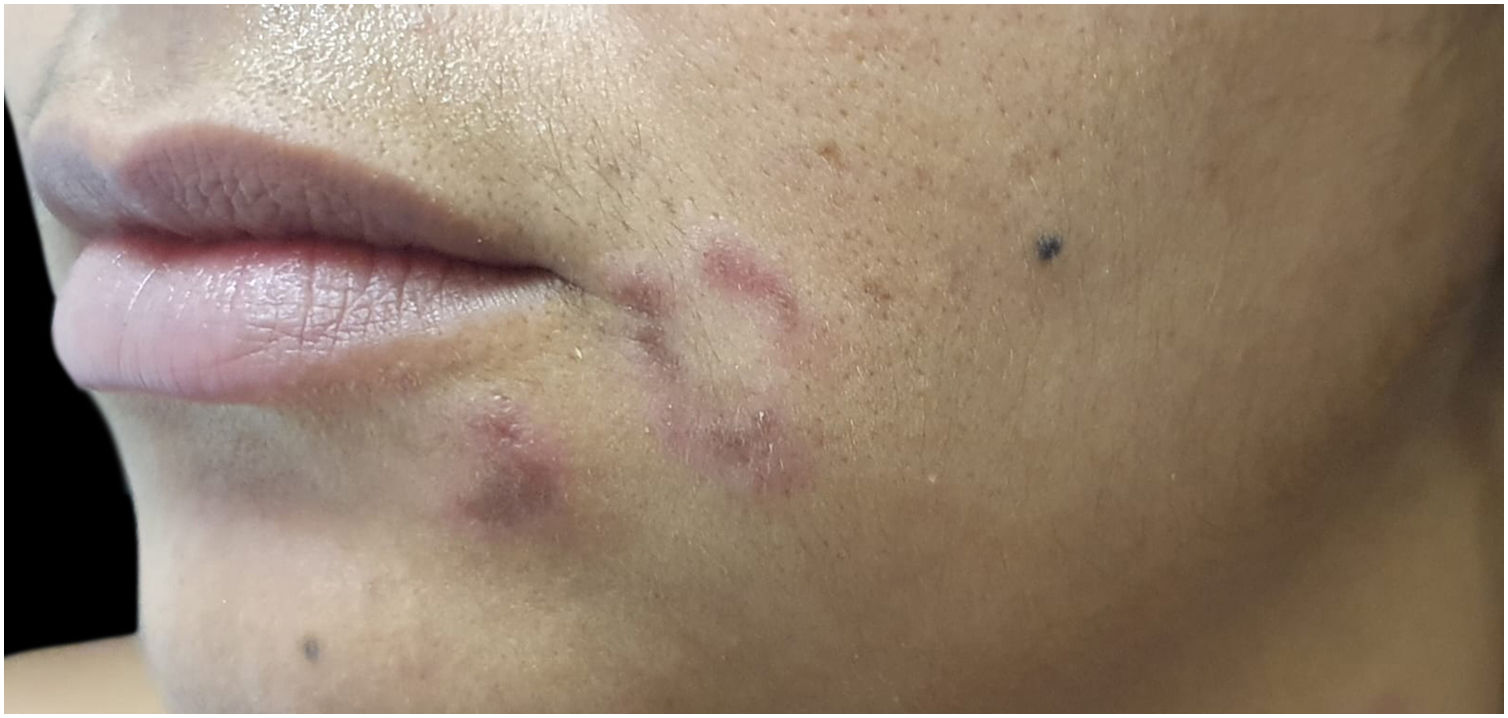
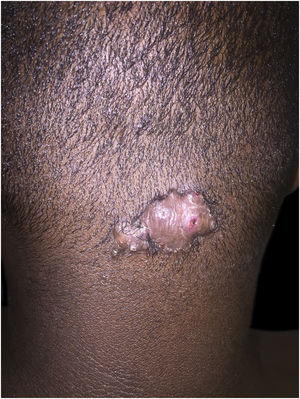
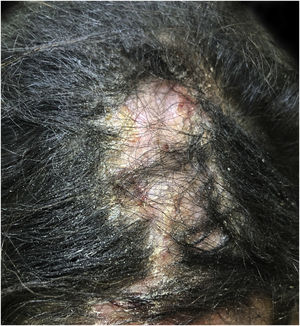
Foliculite queloideana da nucaOcorre pelo encravamento dos pelos, pela penetração extrafolicular ou transfolicular da pele, geralmente secundária ao corte do cabelo negroide.67,68 Apresenta‐se como pápulas, pústulas, placas e nódulos na região posterior do couro cabeludo, comumente associadas à alopecia e associada a queloides. A tricoscopia mostra pelos quebrados com tufos, pelos encravados e moldes peripilares (fig. 4).67,68
Foliculite (celulite) dissecanteTambém chamada de foliculite abscedante ou perifoliculite capitis abscedens et suffodiens, trata‐se de distúrbio crônico do couro cabeludo, observado principalmente em homens jovens. As lesões, inicialmente papulopustulosas, evoluem para nódulos inflamatórios dolorosos e multifocais, conectados por seios intercomunicantes, que resulta em alopecia cicatricial.7,69 Na tricoscopia, observa‐se, inicialmente, características de alopecia não cicatricial, com pontos brancos pontiagudos, regularmente distribuídos, aberturas foliculares aumentadas, pontos amarelos “em 3D” (acúmulo de sebo e queratina), pontos pretos e cabelos fraturados. No estágio terminal, aparecem lesões cicatriciais, caracterizadas por áreas confluentes branco‐marfim, sem óstios foliculares.68–70
Alopecia cicatricial central centrífugaAnteriormente conhecida como alopecia por pente quente (método de alisar cabelos), pseudopelada e síndrome da degeneração folicular, a alopecia cicatricial central centrífuga (ACCC) é mais comum em mulheres jovens a meia‐idade, de ascendência africana. Apresenta etiologia desconhecida, mas com aparente influência de fatores genéticos, tração, calor e produtos químicos. Caracteriza‐se por distúrbio crônico e progressivo no vértice do couro cabeludo, que progride de maneira centrífuga e simétrica, com atividade na zona periférica, circundando a zona central de alopecia cicatricial.7,71–73 Sinais de inflamação estão ausentes, embora eritema, pústulas foliculares e descamação possam surgir. É usualmente assintomática, mas pode ocorrer dor, prurido ou queimação no couro cabeludo.73,74 Há redução espontânea da inflamação após anos ou décadas.75 A tricoscopia mostra a preservação da rede pigmentada em favo de mel e pontos brancos com distribuição irregular. Um halo branco‐acinzentado peripilar é sinal específico e sensível, correspondente, na histopatologia, aos óstios foliculares cercados por fibrose.74,75 Outras características incluem variabilidade da haste capilar, eritema perifolicular, cabelos quebrados como pontos pretos dentro da abertura folicular ou como hastes quebradas curtas, máculas pigmentadas semelhantes a asteriscos, com fios terminais esparsos e semelhantes a velos e manchas brancas espalhadas.74–76 Alterações histológicas precoces mostram infiltrado linfocítico perifolicular com fibroplasia perifolicular. Em estágios posteriores, há destruição do epitélio folicular e retenção de fragmentos da haste capilar com inflamação granulomatosa, seguido pela substituição do epitélio folicular por tecido conjuntivo e tufagem/politriquia dos folículos pilosos.76
Algumas dermatoses com aspectos peculiares na pele negraSarcoidoseOs afro‐americanos tendem a desenvolver sarcoidose em idade mais jovem e apresentam maior risco de desenvolver doenças pulmonares e cutâneas graves. O lúpus pérnio está associado ao pior prognóstico tanto na doença sistêmica quanto nas lesões cutâneas mais crônicas.77,78 Negros apresentam sarcoidose em idade mais jovem, na média de 40 anos, e mulheres mais que homens. Na maioria das vezes, as lesões iniciais são assintomáticas; a primeira consulta costuma ser motivada pela desfiguração. Pápulas na face e no pescoço são as principais lesões observadas. Eritema nodoso é menos frequente do que em pessoas brancas. Há maior propensão à doença mais grave, com maior número de órgãos extracutâneos envolvidos; os pulmões, os linfonodos e o coração são os órgãos mais comumente afetados. As taxas de mortalidade são mais altas.77,78 O lúpus pérnio está associado ao pior prognóstico tanto na doença sistêmica quanto nas lesões cutâneas mais crônicas.7
Líquen planoOs tipos de líquen plano (LP) hipertrófico, pigmentoso e actínico são característicos de indivíduos de pele escura.7 A cor violácea, típica da pele clara, é menos visível na pele escura, e a HPI é intensa. Na dermatoscopia, as características mais comuns incluem alterações pigmentares, estruturas brancas peroladas e fundo violeta.79
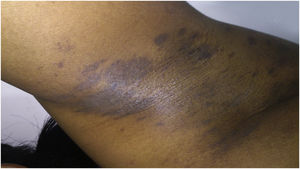
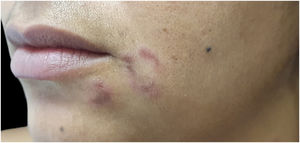
Líquen plano pigmentosoO LP pigmentoso (LPP) é variante rara do LP, que se inicia após os 30 anos, predominantemente em mulheres com pele negra.80 Embora a patogênese seja a mesma do LP clássico,81 a luz solar é fator importante, além de agentes químicos (contactantes e drogas) e micro‐organismos.80,81 As lesões iniciais são pequenas máculas redondas ou ovais, cinza ou marrom, de bordas irregulares e mal definidas, que coalescem formando áreas pigmentadas difusas, reticuladas, perifoliculares ou anulares,80,82 distribuídas principalmente nas áreas expostas ao sol, iniciando na face e no pescoço, espalhando‐se às extremidades superiores e tronco, simetricamente, acometendo raramente a mucosa oral, o couro cabeludo, as unhas, as palmas e as plantas.80,82 Não há estrias de Wickham.82 Eventualmente, há lesões de LP clássico. O prurido é discreto ou ausente.81 Uma variante é o LPP inversus, que afeta pele não exposta ao sol, particularmente áreas flexurais e intertriginosas, observando‐se transição de pápulas para máculas (fig. 5). Estímulos mecânicos são gatilhos. Outras variantes de LPP são: localizado, segmentar, linear, zosteriforme e da mucosa oral.80–82
Na dermatoscopia do LPP inversus, observam‐se áreas homogêneas marrons (pigmentação epidérmica), além de pontos e glóbulos cinza‐marrom ou cinza‐azulados (incontinência pigmentar), os quais são inicialmente agrupados em padrão difuso de pigmentação preta. Com o tempo, convergem formando padrões reticulares, lineares e de paralelepípedos. Os pontos brancos são secundários à falta de pigmentação nas aberturas foliculares, e a ausência de pigmento nos sulcos pode ser decorrente da falta de exposição ao atrito.82
Histopatologicamente, o infiltrado inflamatório liquenoide é semelhante ao LP clássico,81 porém este regride rapidamente, sem a proliferação de queratinócitos, e a melanina dérmica resultante permanece por meses a anos.82 A imunofluorescência direta raramente é positiva, com IgM e C3 na junção dermoepidérmica e IgG e IgA em queratinócitos.81,82 Pode associar‐se à hepatite C, endocrinopatias, doenças autoimunes e malignidades, bem como outras variantes de LP.80–82
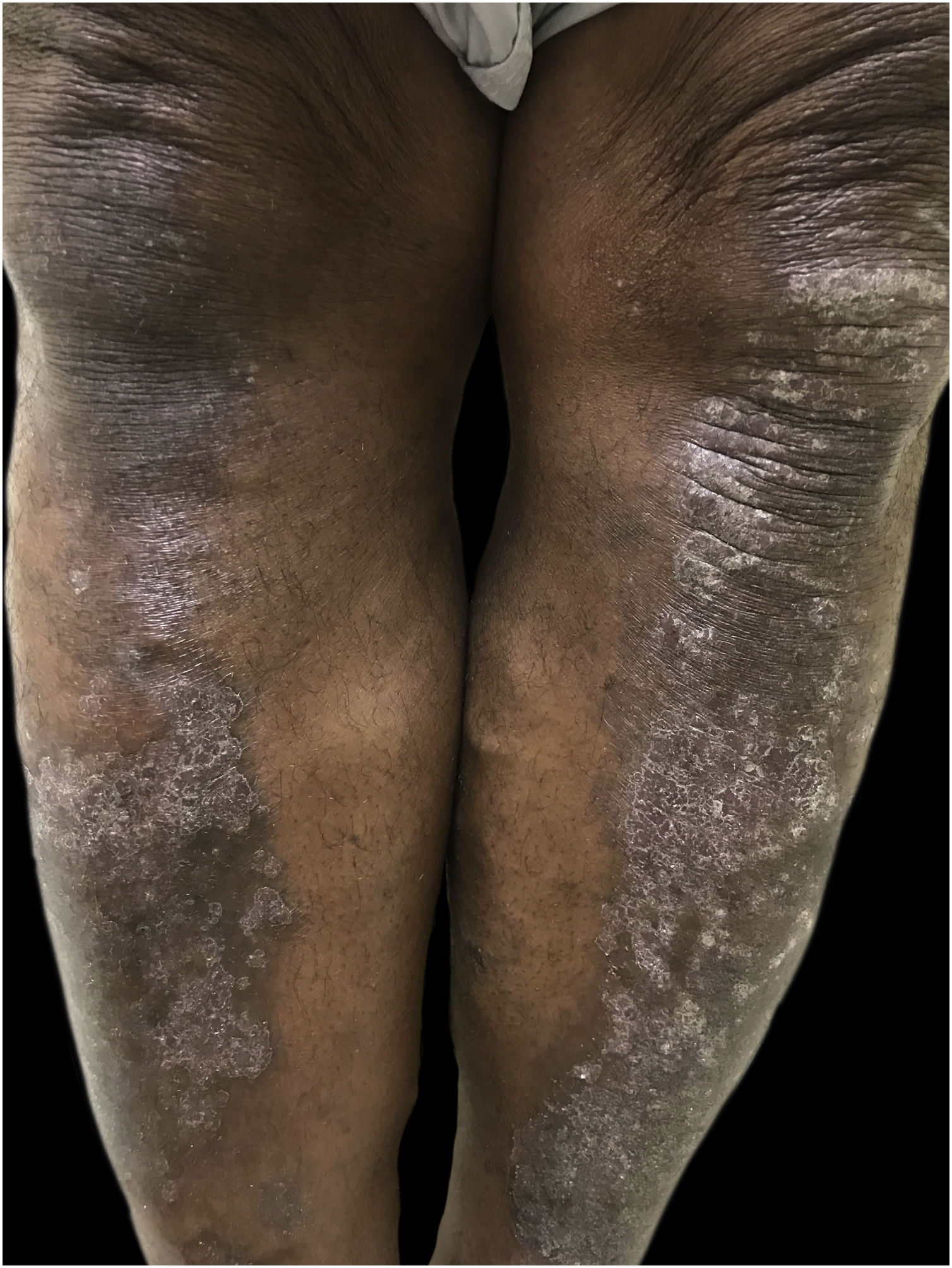
PsoríaseA psoríase em pacientes de pele escura caracteriza‐se por placas com eritema menos distinguível, mais espessas, com maior descamação e maior envolvimento corporal (fig. 6). A resolução das lesões deixa alterações pigmentares (hiper e hipopigmentação). A frequência da artrite psoriásica em negros é aproximadamente a metade que em caucasianos.83 As características dermatoscópicas mais comuns incluem: fundo vermelho claro, vasos pontilhados vermelhos, vasos regulares, escamas brancas, distribuição irregular e alterações pigmentares.79
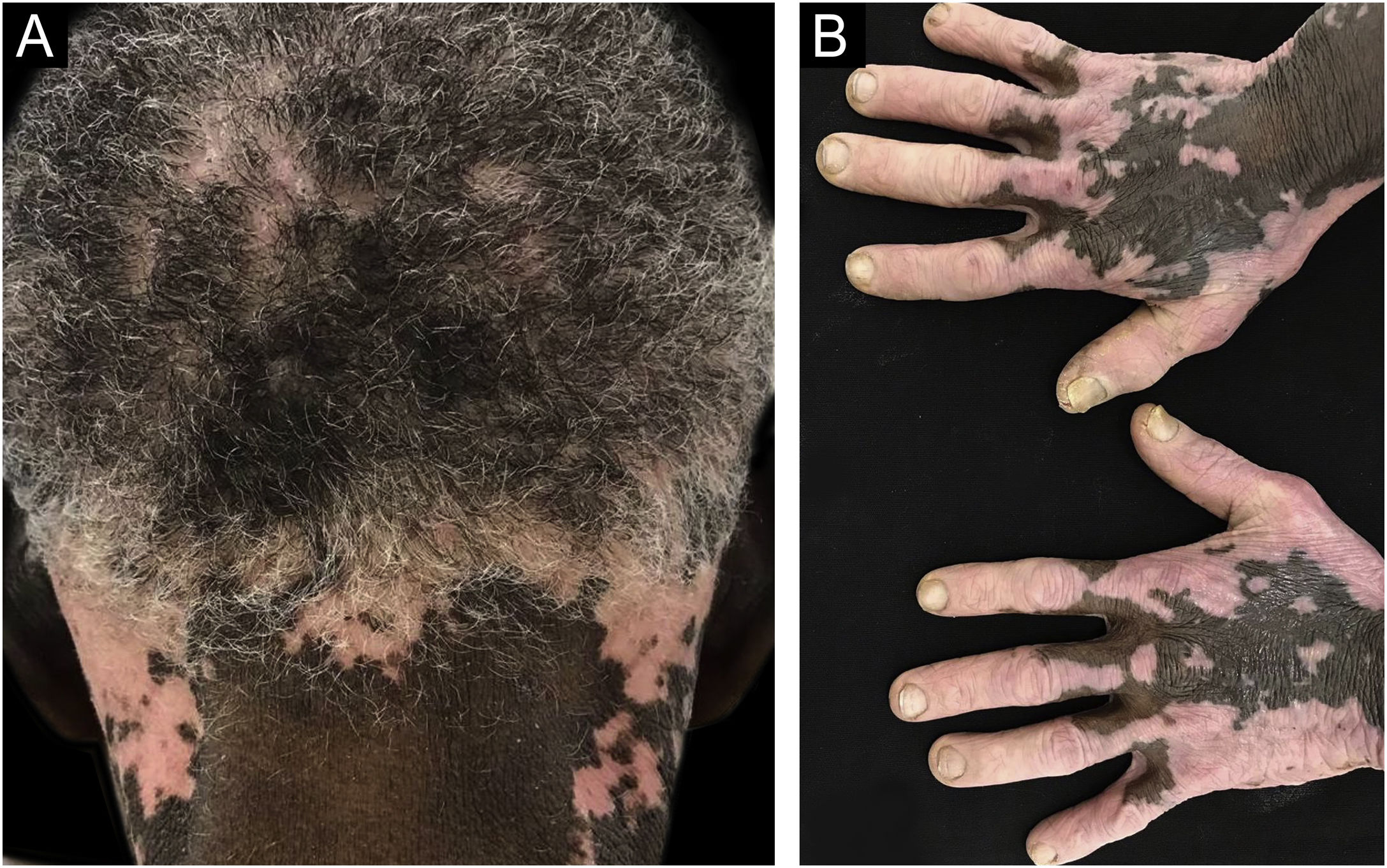
Lúpus eritematosoO lúpus eritematoso discoide (LED) tem maior incidência e gravidade em mulheres negras.84 Em sua maioria, as lesões ocorrem em áreas expostas, com maior envolvimento do couro cabeludo e da orelha; a despigmentação e a alopecia cicatricial são proeminentes (fig. 7).84 As lesões variam de escamosas a hipertróficas ou verrucosas e tendem à morfologia anular. A despigmentação é óbvia, podendo ser desfigurante.84 Também a HPI é proeminente,84,85 com risco de cicatrizes hipertróficas. Práticas de cuidados com os cabelos contribuem para a alopecia cicatricial, mais frequente e grave.84
A prevalência do LE sistêmico (LES) é aproximadamente três vezes maior entre os negros, com maior acometimento entre as mulheres.86 O LES apresenta progressão rápida e maior gravidade, com danos renais e cardiovasculares e taxa de mortalidade maiores e mais precoces.86,87 As causas dessas disparidades são multifatoriais, incluindo genética, epigenética, socioeconômica e discriminação racial.87 Envolvimento cutâneo ocorre em cerca de 80% dos casos, a maioria por lesões específicas, que estão associadas a doença menos severa.88 Dentre as lesões inespecíficas, fenômeno de Raynaud, úlceras orais e melanoníquia difusa acometem quase 40% dos pacientes. LE agudo, a forma mais comum no LES em caucasianos, é incomum em negros e associa‐se com doença renal, livedo reticular, alopecia não cicatricial e úlceras orais. LED ocorre em cerca de 50% dos casos e associa‐se com artrite. LE subagudo é raro, talvez porque erupções eritematosas sutis e fotossensibilidade são difíceis de detectar.89
VitiligoO vitiligo é muito debilitante na pele escura em virtude de seu caráter altamente inestético, com efeito profundo na qualidade de vida dos pacientes. Sua prevalência é muito variável dentro de uma mesma raça e entre as várias raças. Além dos fatores etiopatogênicos usuais, o fenômeno de Koebner é incriminado na pele escura. A doença tem predileção por áreas expostas ao sol, principalmente os lábios. Os órgãos genitais também são frequentemente afetados. Segundo a intensidade da acromia, o vitiligo salpicado e o tricrômico parecem específicos da pele negra, com lesões altamente contrastantes com a pele sã (fig. 8).90
SífilisNa sífilis secundária em negros, algumas vezes a descamação é intensa, conferindo aspecto psoriasiforme às lesões. Na face, as pápulas tendem a agrupar‐se em volta do nariz e da boca, simulando dermatite seborreica. As lesões periorificiais assumem configurações anulares e circinadas características (sifílides elegantes) – figura 9. Na região inguinocrural, em virtude do atrito e da umidade, as pápulas, ricas em treponemas, tornam‐se vegetantes e maceradas (condiloma plano). Na mucosa oral observam‐se placas brancas vegetantes sobre base erosada, também contagiosas.91
Pitiriase versicolorAlguns estudos relatam a predileção da pitiriase versicolor (PV) por indivíduos de pele mais escura. A PV apresenta‐se inicialmente como máculas redondas ou ovais hipopigmentadas ou menos frequentemente hiperpigmentadas, medindo 3–5mm, distribuídas simetricamente no tronco superior, nos ombros ou nas áreas flexurais. O envolvimento facial e cervical é mais comum. Posteriormente, disseminam‐se e coalescem formando manchas maiores de formato irregular. Quando ativas, há descamação sutil associada a prurido. Após o tratamento, as alterações pigmentares sem descamação podem persistir por meses.92
NeoplasiasEmbora o risco de câncer de pele seja menor em negros, a exposição aos RUV é também fator de risco,30 porém o reparo dos danos ao DNA, induzidos pela radiação UV, é mais eficiente em negros.93 Indivíduos negros são menos propensos a se proteger do sol, pois acreditam que seja desnecessário.30 A tabela 393–95 ilustra as principais características e diferenças entre o câncer não melanoma e melanoma.
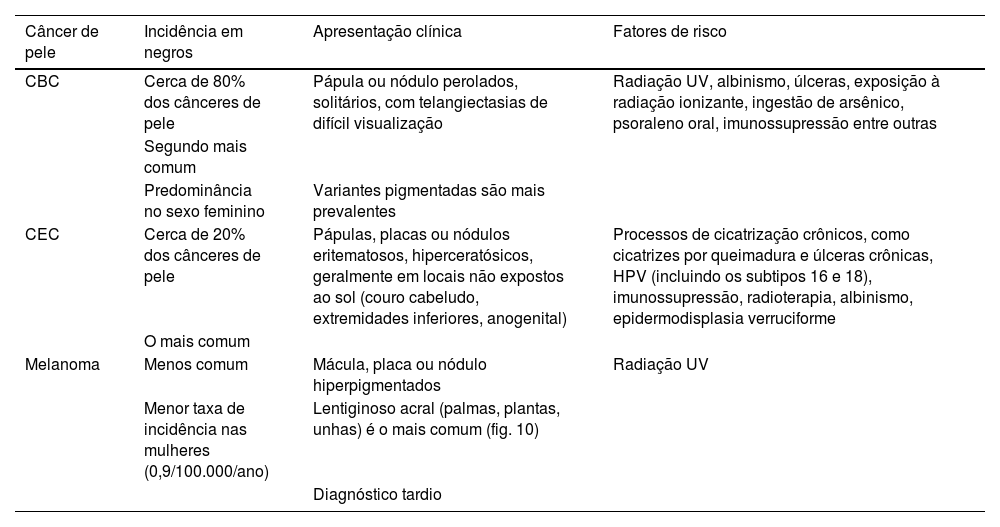
Principais características entre os cânceres de pele não melanoma e o melanoma30,93–95
| Câncer de pele | Incidência em negros | Apresentação clínica | Fatores de risco |
|---|---|---|---|
| CBC | Cerca de 80% dos cânceres de pele | Pápula ou nódulo perolados, solitários, com telangiectasias de difícil visualização | Radiação UV, albinismo, úlceras, exposição à radiação ionizante, ingestão de arsênico, psoraleno oral, imunossupressão entre outras |
| Segundo mais comum | |||
| Predominância no sexo feminino | Variantes pigmentadas são mais prevalentes | ||
| CEC | Cerca de 20% dos cânceres de pele | Pápulas, placas ou nódulos eritematosos, hiperceratósicos, geralmente em locais não expostos ao sol (couro cabeludo, extremidades inferiores, anogenital) | Processos de cicatrização crônicos, como cicatrizes por queimadura e úlceras crônicas, HPV (incluindo os subtipos 16 e 18), imunossupressão, radioterapia, albinismo, epidermodisplasia verruciforme |
| O mais comum | |||
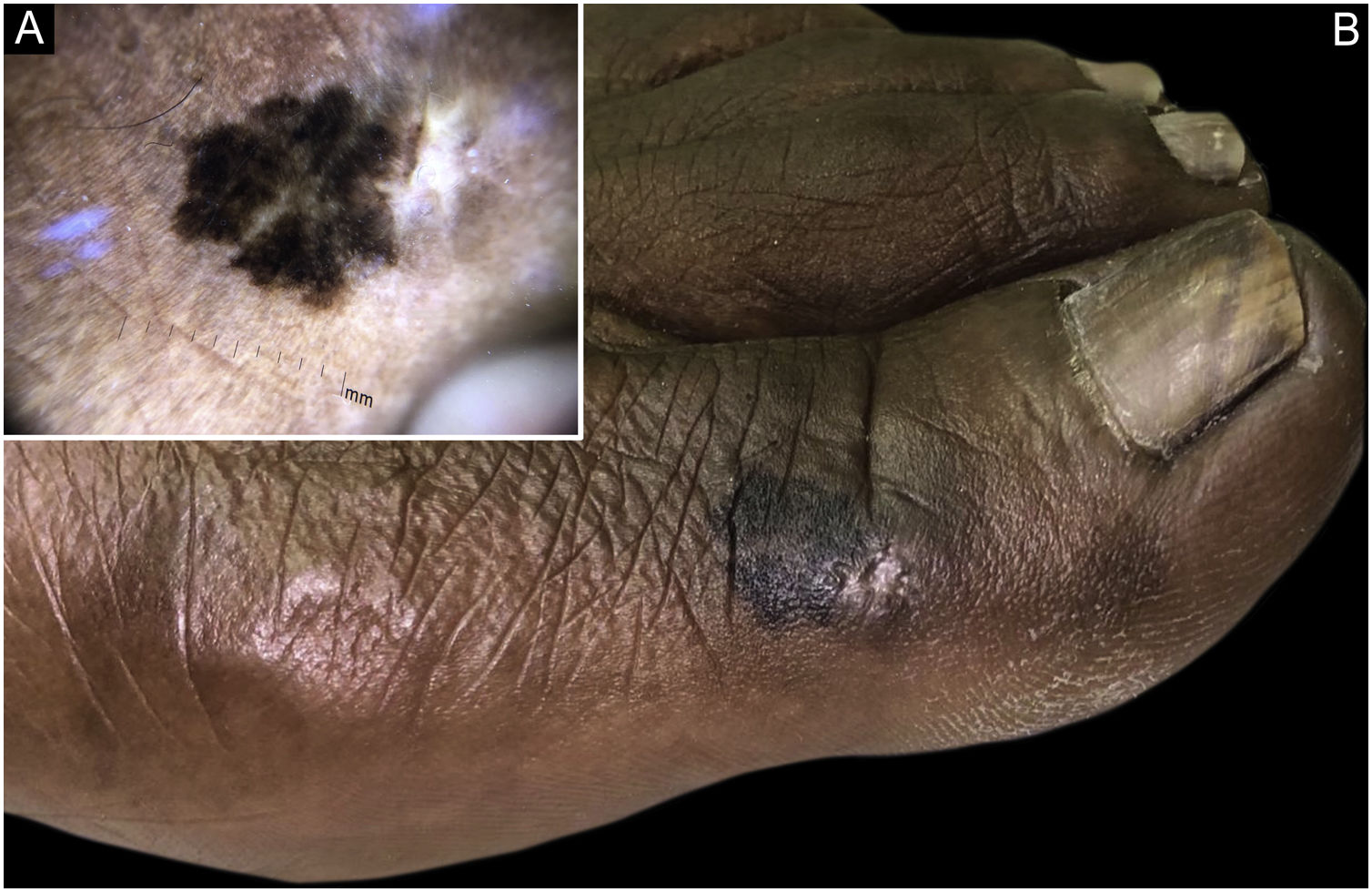
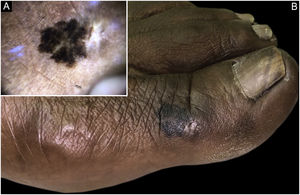
| Melanoma | Menos comum | Mácula, placa ou nódulo hiperpigmentados | Radiação UV |
| Menor taxa de incidência nas mulheres (0,9/100.000/ano) | Lentiginoso acral (palmas, plantas, unhas) é o mais comum (fig. 10) | ||
| Diagnóstico tardio |
CBC, carcinoma basocelular; CEC, carcinoma espinocelular; HIV, vírus da imunodeficiência humana; HPV, vírus do papiloma humano; UV, ultravioleta.
A micose fungoide (MF) é o tipo de linfoma mais comum na pele negra, correspondendo a mais de 50% dos linfomas cutâneos primários de células T (LCCT),30 com taxa de incidência de 4,0 e 6,1/100.000 para pacientes brancos e negros, respectivamente.96,97 Negros apresentam MF em idade mais precoce e em estágio T mais alto do que brancos. Clinicamente, a MF geralmente se apresenta como manchas, placas ou tumores localizados, preferencialmente, em áreas cobertas, mas pode cursar com eritrodermia. As lesões são hiperpigmentadas na pele mais escura, em vez de eritematosas, havendo variante hipopigmentada. As lesões hiperpigmentadas correlacionam com menor sobrevida, enquanto as hipopigmentadas com maior sobrevida e curso indolente.96
A síndrome de Sezary (SS) é variante leucêmica rara do LCCT, definida pela tríade eritrodermia, células T neoplásicas (células de Sezary) no sangue e linfadenopatia. Assim como a MF, a SS também tem maior prevalência em indivíduos negros em comparação com brancos. Assim como ocorre com a pele clara, pode ser difícil diferenciar de outras erupções cutâneas difusas. A maior preocupação é que o prurido e as alterações secundárias ao ato de coçar sejam atribuído à xerose.96,97
Sarcoma de Kaposi endêmicoO sarcoma de Kaposi limita‐se à África subsaariana e é tipicamente observado em homens negros jovens, dos 25 aos 40 anos, HIV negativos. As manifestações clínicas podem ser indolentes a agressivas e letais. Sua apresentação pode ser localmente invasiva ou agressiva com/ou envolvimento mucocutâneo. Há quatro subtipos: nodular benigno; localmente agressivo, invadindo tecidos moles e ossos; florido disseminado, com envolvimento da pele e vísceras; e linfadenopático, disseminando‐se rapidamente para linfonodos e vísceras. O último subtipo é a forma mais agressiva e associa‐se a crianças africanas de 1 a 5 anos.7,98
Dermatofibrosarcoma protuberans (DFSP)Dermatofibrosarcoma protuberans (DFSP) é neoplasia rara de células fusiformes, de crescimento lento, localizada na derme ou no tecido subcutâneo. A incidência entre negros é o dobro, e os tumores são maiores que em brancos, o que explica a demora no diagnóstico.99 O DFSP é mais frequente no tronco do que na cabeça e no pescoço, sem diferença quanto às extremidades.100 O risco de morte em negros é 1,7 vez maior do que nos brancos e dependente do tamanho.99,100
Há variante pigmentada rara, chamada tumor de Bednar, que ocorre em 5% dos casos, principalmente em negros,100 observada em adultos jovens e de meia‐idade, ocasionalmente na faixa etária pediátrica. A histogênese é inexplicável, podendo relacionar‐se a remanescentes de tecido mamário embrionário ou a traumas locais, havendo duas teorias propostas: diferenciação neuroectodérmica ou colonização melanocítica.99,100 Foi relatado em associação com melanocitose dérmica (nevo de Ito) e acredita‐se que a célula de origem seja neuromesenquimal. Localiza‐se mais comumente no tronco, especialmente nos ombros e no dorso, podendo afetar a cabeça e o pescoço, além das extremidades.99,100 Clinicamente, assemelha‐se ao queloide. A maioria se apresenta como massas, placas ou nódulos salientes, firmes, multilobulados, de base larga e de crescimento lento, na derme e no tecido subcutâneo. Histologicamente, é composto por células fusiformes, com leve pleomorfismo.99,100 As células dendríticas carregadas de pigmento distinguem essa lesão do DFSP convencional.100 Na imuno‐histoquímica, as células são CD34 positivas.99 O comportamento biológico é o de malignidade intermediária. Deve ser diferenciado de outras lesões cutâneas fusiformes pigmentadas.99,100
Suporte financeiroNenhum.
Contribuição dos autoresMaurício Mota de Avelar Alchorne: Concepção e desenho do estudo; Revisão crítica do conteúdo intelectual importante; Participação efetiva na orientação da pesquisa; Aprovação final da versão final do manuscrito.
Katleen da Cruz Conceição: Revisão crítica da literatura; Levantamento dos dados; Redação do artigo; Aprovação final da versão final do manuscrito.
Leonardo Lora Barraza: Revisão crítica da literatura; Levantamento dos dados; Redação do artigo; Aprovação final da versão final do manuscrito.
Marilda Aparecida Milanez Morgado de Abreu: Concepção e desenho do estudo; Revisão crítica do conteúdo intelectual importante; Redação do artigo; Aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.