A patogênese da psoríase vulgar envolve alterações nas moléculas de DNA, instabilidade genômica, atrito dos telômeros e alterações epigenéticas. Essas alterações também são consideradas importantes mecanismos de envelhecimento em células e tecidos.
ObjetivoEste estudo avaliou os danos por oxidação, comprimento dos telômeros e estado de metilação no DNA do sangue periférico de 41 pacientes com psoríase e 30 controles saudáveis.
MétodosO dano oxidativo do DNA/RNA sérico foi determinado por análise imunoquímica. A PCR em tempo real foi utilizada para análise do comprimento dos telômeros. A técnica de ELISA determinou os níveis de 5‐metilcitosina no DNA das células sanguíneas.
ResultadosO dano oxidativo do DNA/RNA sérico foi maior nos pacientes do que nos controles (mediana, 3.758 vs. 2.286 pg/mL; p<0,001). Comprimento maior de telômeros por cromossomo foi encontrado no DNA de células inteiras dos pacientes do que nos controles (3,57 vs. 3,04 quilobases; p=0,011). Correlação negativa do comprimento dos telômeros com a idade dos indivíduos controle revelou rho de Spearman=‐0,420; p=0,028. Níveis diferentes não significantes de 5‐metilcitosina foram observados nos pacientes em comparação com os controles (33,20 vs. 23,35%; p=0,234). Não foram encontradas influências de sexo, tabagismo, IMC, escore PASI e síndrome metabólica no estado de metilação.
Limitações do estudoNúmero relativamente pequeno de participantes, particularmente para análises confiáveis de subgrupo; origem caucasiana dos participantes, possivelmente influenciando os resultados dos parâmetros determinados; e a atividade da telomerase não foi medida diretamente no soro ou nas células sanguíneas.
ConclusãoO estudo demonstrou níveis aumentados de moléculas de DNA/RNA oxidado no soro de pacientes com psoríase vulgar exacerbada. Os resultados foram minimamente influenciados por sexo, presença de síndrome metabólica ou tabagismo. No DNA das células sanguíneas dos pacientes com psoríase, foram observados telômeros mais longos em comparação aos controles saudáveis, principalmente no sexo feminino. A maior metilação global do DNA não significante em casos de psoríase em comparação com os controles indicou importância clínica marginal desse teste epigenético realizado no DNA das células sanguíneas.
A patogênese da psoríase vulgar envolve muitos processos metabólicos que influenciam a vida útil das células afetadas na pele por meio de proliferação aumentada, diferenciação aberrante e regulação negativa de genes pró‐apoptóticos.1 As células presentes em uma placa de psoríase induzem a liberação de interleucina‐1, interleucina‐6, fator de necrose tumoral‐α, interferon‐γ e outras citocinas que contribuem para reações imunopatológicas crônicas dessa doença.2
Além das manifestações cutâneas, comorbidades, como artrite psoriásica, doença inflamatória intestinal, doenças cardiovasculares, diabetes mellitus, linfoma ou depressão, são comumente encontradas em pacientes psoriáticos e encurtam seu tempo de vida.3 Na teoria atual do envelhecimento, instabilidade genômica, atrito dos telômeros, alterações epigenéticas, perda de proteostase, detecção de nutrientes desregulada, disfunção mitocondrial, senescência celular, exaustão de células‐tronco e comunicação intercelular alterada desempenham papéis importantes.4,5 Os três primeiros mecanismos mencionados associam‐se a alterações no DNA que podem ser potencializadas em células e tecidos de pacientes com psoríase.
O processo de instabilidade genômica é induzido por inflamação sistêmica e aumento do estresse oxidativo presente na psoríase leve e moderada a grave.6 Artigo anterior dos mesmos autores do presente estudo demonstrou níveis séricos elevados de nucleobases oxidadas de DNA/RNA, por exemplo, 8‐hidróxi‐2’‐deoxiguanosina, 8‐hidroxiguanosina e 8‐hidroxiguanina na psoríase, particularmente em pacientes que sofrem de síndrome metabólica.7 A superprodução de espécies reativas de oxigênio e danos ao DNA em suas células podem induzir envelhecimento celular acelerado e apoptose.8
Os telômeros formam as extremidades de cromossomos eucarióticos lineares, cuja composição em humanos consiste em repetições em tandem de 5’‐TTAGGG‐3’. Uma diminuição progressiva de 50‐150 pb de suas extremidades terminais aparece em cada ciclo de replicação. O encurtamento crítico dos telômeros leva à senescência celular, parada de fase Gap0/Gap1 e apoptose. Assim, os telômeros são considerados o relógio molecular das células.9 Subsequentemente, o comprimento dos telômeros nas células sanguíneas é considerado marcador promissor de idade biológica e de distúrbios relacionados ao envelhecimento.10,11 Tamayo et al. relataram anteriormente comprimento de telômero mais longo em artrite reumatoide, artrite psoriásica e espondilite anquilosante em comparação com indivíduos saudáveis.12 Em contraste, outros estudos encontraram tendência oposta ou não significante no encurtamento dos telômeros na psoríase e nas doenças reumatológicas.13–16
Os estudos de associação genômica ampla (genome wide association studies ‐GWAS) com base familiar revelaram aproximadamente 60 loci genéticos associados à psoríase, incluindo vários polimorfismos em genes para DNA metiltransferases (DNMT).17,18 Essas enzimas realizam o processo epigenético de metilação do DNA e regulam a expressão gênica e proliferação celular no corpo. Foi observado que a expressão de DNTM1 estava significantemente elevada em células mononucleares do sangue periférico de indivíduos com psoríase.19 Na pele, vários genes metilados diferencialmente foram associados à diferenciação epidérmica e de queratinócitos e à regeneração celular. Promotores hipermetilados nos genes p15, p16, p21, ID4, IFNG e HLA‐C afetam sua expressão na psoríase. O aumento da metilação do promotor de p16 e HLA‐C e a diminuição da metilação do promotor de HLA‐DRB1 estão significantemente associados ao escore Psoriasis Area Severity Index (PASI).20 Por outro lado, não foi encontrada anteriormente metilação significantemente aumentada de p53, isto é, do gene cujo produto proteico faz mediação da apoptose em pacientes com psoríase.21
O objetivo do presente estudo é fornecer informações mais detalhadas sobre danos de oxidação, comprimento dos telômeros e estado de metilação em moléculas de DNA originadas de células do sangue periférico e investigar suas possíveis relações na psoríase vulgar exacerbada. No presente estudo, os autores preferiram a análise de soro sanguíneo e DNA de sangue total aos ácidos nucleicos da pele. Espera‐se que os resultados correspondam melhor ao caráter sistêmico da doença, já que desequilíbrios no sistema imunológico afetam mais tecidos e órgãos do que a pele, e aos processos de envelhecimento biológico.
MétodosPacientesO grupo experimental consistiu em 41 pacientes com psoríase (21 homens e 20 mulheres com média de idade de 53 anos; variação de 20 a 79 anos) da Clínica de Doenças Dérmicas e Venéreas, Charles University Hospital em Hradec Kralove. A condição da doença foi estabelecida utilizando uma avaliação clínica de eritema, descamação e infiltração da pele (escore PASI).22 De acordo com o escore PASI, a gravidade da psoríase foi classificada como leve (PASI 0‐9), moderada (10–29) ou grave (≥ 30). Os pacientes não tinham recebido qualquer tipo de tratamento para psoríase nos três meses antes do estudo. Foram excluídos do estudo os indivíduos com doenças inflamatórias (como doenças infecciosas, neoplasias malignas e doenças reumáticas inflamatórias), gravidez e aqueles em uso de medicamentos anti‐inflamatórios não esteroides. O grupo controle incluiu 30 doadores de sangue saudáveis (12 homens e 18 mulheres; 53 anos; 21‐64 anos) do Departamento de Transfusão Médica do Charles University Hospital em Hradec Kralove. Uma análise de capacidade foi realizada para estimar o número necessário de pacientes a serem incluídos no estudo.
Todos os indivíduos deram seu consentimento informado para inclusão antes de participarem do estudo. O estudo foi conduzido de acordo com a Declaração de Helsinque, e o protocolo foi aprovado pelo Comitê de Ética do Charles University Hospital em Hradec Kralove, República Tcheca (Código de identificação do projeto: PROGRES Q40‐09 e Q40‐10, número de referência 201705 I83P, data de 2 de maio de 2017).
Para fins do estudo, os indivíduos dos grupos experimental e controle foram divididos em subgrupos de acordo com a presença/ausência de síndrome metabólica. A presença de síndrome metabólica (SM) foi avaliada de acordo com o National Cholesterol Education Program Adult Treatment Panel (NCE/ATPIII). O diagnóstico de SM foi estabelecido quando três dos seguintes critérios estavam presentes: circunferência da cintura aumentada ou obesidade abdominal, glicemia de jejum mais alta ≥ 5,6 mmoL/L ou tratamento conhecido para diabetes, nível elevado de triglicerídeos, nível reduzido de lipoproteínas de alta densidade e pressão sanguínea elevada.
Danos oxidativos de ácidos nucleicosO soro de sangue venoso (tubos de amostras BD Vacutainer) foi separado por centrifugação e armazenado a −70°C até a análise; repetidos descongelamentos e congelamentos foram evitados. O nível de dano oxidativo aos ácidos nucleicos foi medido pelo kit DNA/RNA Oxidative Damage EIA da Cayman Chemical Company, EUA. Os valores de dano foram expressos como a soma de 8‐hidroxi‐2’‐deoxiguanosina liberada do DNA, 8‐hidroxiguanosina do RNA e 8‐hidroxiguanina do DNA ou RNA. Subsequentemente, o nível de dano de DNA/RNA foi calculado como picogramas de todas as espécies de guanina por mililitro de soro. O limite de detecção do kit era de 33 pg/mL.
Comprimento dos telômerosO DNA genômico dos pacientes e controles foi extraído de amostras de sangue venoso com EDTA de acordo com as instruções do fabricante (QIAamp Blood Mini Kit, Alemanha). O comprimento dos telômeros foi determinado utilizando‐se o Absolute Human Telomere Length Quantification qPCR Assay Kit (ScienCell, EUA) com base na medida direta do comprimento médio dos telômeros pela tecnologia de PCR em tempo real (Rotor‐Gene 6000, Corbett Research, Austrália). De acordo com as instruções do fabricante, os dados obtidos foram normalizados para a amostra de DNA genômico humano de referência fornecida no kit. Finalmente, os resultados foram expressos como o comprimento médio dos telômeros (quilobases, kb) por extremidade do cromossomo.
Metilação global do DNAO DNA genômico obtido acima (100 ng) foi usado para análise da metilação global do DNA. O nível de 5‐metilcitosina (5‐mC) foi determinado utilizando o kit 5‐mC DNA ELISA (Zymo Research Corporation, EUA) de acordo com as instruções do fabricante. Amostras desnaturadas de DNA de fita simples foram colocadas sobre a superfície dos poços de uma placa de microtitulação. O anticorpo monoclonal anti‐5‐metilcitosina e o anticorpo secundário conjugado com HRP foram adicionados aos poços. Após a adição do revelador HRP, seguiu‐se a detecção fotométrica de 5 mC. A porcentagem de 5 mC nas amostras de DNA foi quantificada de acordo com uma curva padrão construída utilizando padrões comerciais incluídos no kit.
Análise estatísticaCom base no teste de Anderson‐Darling para distribuição dos dados, utilizou‐se o teste paramétrico ou não paramétrico para garantir a sensibilidade do teste (para as diferenças entre os pacientes psoriáticos e o grupo controle). Os dados foram processados estatisticamente com o software R, versão 3.3.2, utilizando os pacotes “nortest” e “ggplot2”. As associações entre todos os parâmetros clínicos e/ou laboratoriais foram avaliadas pelos testes de correlação de Pearson ou de correlação de postos de Spearman; as diferenças entre os grupos foram avaliadas usando o teste t de Student ou o teste de soma de postos de Wilcoxon. As diferenças foram consideradas estatisticamente significantes quando o nível de probabilidade (p) estava abaixo do nível alfa de 0,05.
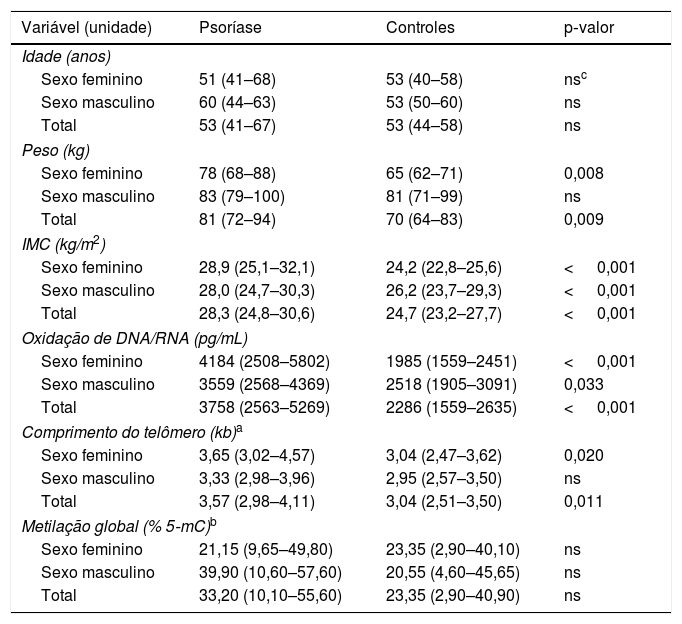
ResultadosA mediana do escore PASI nos pacientes foi de 16 (intervalo interquartil 13‐22). Cinco pacientes tinham a forma leve (mediana de PASI 8, variação 6–9), 30 pacientes tinham a forma moderada (15, 13–17) e seis deles tinham a forma grave de psoríase em placas (39, 34–43). Os valores do peso e IMC dos pacientes diferiram significantemente dos controles (81 vs. 70kg, p=0,009 e 28,3 vs. 24,7kg/m2, p <0,001, respectivamente). Vinte e três pacientes (56%) e cinco controles (16%) apresentaram sinais de síndrome metabólica.
Como mostrado na tabela 1, os pacientes com psoríase tiveram mediana significantemente aumentada de dano oxidativo ao DNA/RNA quando comparados aos controles (3.758 vs. 2.286 pg/mL; p <0,001). Os valores dos pacientes foram significantemente maiores do que os dos controles em ambos os sexos (sexo masculino, 3.559 vs. 2.518 pg/mL; p=0,033; sexo feminino, 4.184 vs. 1.985 pg/mL; p <0,001). Avaliando os danos de oxidação separadamente nos indivíduos não fumantes, foram observados valores significantemente mais elevados de danos ao DNA/RNA nos pacientes com psoríase não fumantes (n=25) do que nos controles não fumantes (n=27): 4.228 vs. 2.287 pg/mL; p <0,001. Os dados sobre danos ao DNA/RNA dos pacientes com SM não diferiram daqueles sem SM (3.559 vs. 3.774 pg/mL; p=0,928). Os pacientes sem SM (n=18) apresentaram parâmetros significantemente maiores de danos ao DNA/RNA do que os controles sem SM (n=25; 3.774 vs. 2.287 pg/mL; p=0,001). A análise estatística não incluiu controles com sinais de SM em razão de seu baixo número no estudo (n=5).
Dados clínicos e laboratoriais expressos em medianas e intervalos interquartis
| Variável (unidade) | Psoríase | Controles | p‐valor |
|---|---|---|---|
| Idade (anos) | |||
| Sexo feminino | 51 (41–68) | 53 (40–58) | nsc |
| Sexo masculino | 60 (44–63) | 53 (50–60) | ns |
| Total | 53 (41–67) | 53 (44–58) | ns |
| Peso (kg) | |||
| Sexo feminino | 78 (68–88) | 65 (62–71) | 0,008 |
| Sexo masculino | 83 (79–100) | 81 (71–99) | ns |
| Total | 81 (72–94) | 70 (64–83) | 0,009 |
| IMC (kg/m2) | |||
| Sexo feminino | 28,9 (25,1–32,1) | 24,2 (22,8–25,6) | < 0,001 |
| Sexo masculino | 28,0 (24,7–30,3) | 26,2 (23,7–29,3) | < 0,001 |
| Total | 28,3 (24,8–30,6) | 24,7 (23,2–27,7) | < 0,001 |
| Oxidação de DNA/RNA (pg/mL) | |||
| Sexo feminino | 4184 (2508–5802) | 1985 (1559–2451) | < 0,001 |
| Sexo masculino | 3559 (2568–4369) | 2518 (1905–3091) | 0,033 |
| Total | 3758 (2563–5269) | 2286 (1559–2635) | < 0,001 |
| Comprimento do telômero (kb)a | |||
| Sexo feminino | 3,65 (3,02–4,57) | 3,04 (2,47–3,62) | 0,020 |
| Sexo masculino | 3,33 (2,98–3,96) | 2,95 (2,57–3,50) | ns |
| Total | 3,57 (2,98–4,11) | 3,04 (2,51–3,50) | 0,011 |
| Metilação global (% 5‐mC)b | |||
| Sexo feminino | 21,15 (9,65–49,80) | 23,35 (2,90–40,10) | ns |
| Sexo masculino | 39,90 (10,60–57,60) | 20,55 (4,60–45,65) | ns |
| Total | 33,20 (10,10–55,60) | 23,35 (2,90–40,90) | ns |
ns, não significante.
Maiores comprimentos médios de telômeros por cromossomo foram observados nas células sanguíneas dos pacientes em comparação com os controles (3,57 vs. 3,04kb; p=0,011), particularmente no sexo feminino (3,65 vs. 3,04kb; p=0,020). Nos indivíduos do sexo masculino com psoríase, os telômeros eram mais longos, sem significância estatística, em comparação com os controles masculinos (3,33 vs. 2,95kb; p=0,084). O comprimento dos telômeros nos pacientes com psoríase não fumantes era significantemente maior do que nos pacientes fumantes (3,88 vs. 3,24kb; p=0,048) e nos controles não fumantes (3,88 vs. 3,03kb; p=0,002). Os pacientes com psoríase sem SM apresentaram telômeros mais longos (3,84kb) do que os pacientes com SM (3,38kb; p=0,024) e os controles sem SM (3,03kb; p=0,001). Correlação negativa do comprimento dos telômeros com a idade dos indivíduos controle foi revelada (rho de Spearman=−0,420; p=0,028).
O nível de metilação global do DNA psoriásico (expresso em porcentagem de DNA 5‐mC) foi maior do que nos controles, porém a diferença não atingiu significância estatística (33,20 vs. 23,35%; p=0,234). Foram observadas influências não significantes do sexo, tabagismo, IMC, escore PASI e SM no estado de metilação. Associação significante do estado de metilação e IMC nos pacientes psoriáticos com SM foi encontrada (rho de Spearman=0,417; p=0,048). Nenhuma outra associação significante das variáveis testadas foi observada.
DiscussãoOs ácidos nucleicos contidos nas células dos pacientes psoriáticos são considerados alvo de alterações genéticas e epigenéticas, podendo qualificar processos biológicos como a apoptose e o envelhecimento prematuro.
Nossos dados mostraram que o grupo experimental e o grupo controle foram pareados pela distribuição da idade cronológica. Os pacientes com psoríase apresentaram peso e IMC significantemente maiores do que os controles saudáveis. Esse achado está em concordância com artigos anteriores, que relataram número maior de indivíduos psoriáticos com síndrome metabólica.7,23
O estresse oxidativo pode ser causado tanto pela presença de espécies reativas de oxigênio quanto pela diminuição do número de antioxidantes no organismo.24 Estudos anteriores mostraram que as alterações oxidativas nos ácidos nucleicos dos pacientes com psoríase se correlacionavam positivamente com os valores do escore PASI.25 No presente estudo, encontramos maior conteúdo oxidativo no DNA/RNA sérico tanto de indivíduos do sexo feminino como do sexo masculino com psoríase em comparação com os controles. Assim, o estresse oxidativo presente nos indivíduos com psoríase vulgar exacerbada de ambos os sexos pode contribuir para o envelhecimento celular acelerado. Além disso, foi encontrado conteúdo significantemente aumentado de dano oxidativo ao DNA/RNA no grupo de pacientes sem SM em comparação com os controles sem SM. Os dados oxidativos dos pacientes com SM não diferiram daqueles sem SM. Os dados do presente estudo sugerem que as alterações oxidativas que aparecem nos ácidos nucleicos como resultado da inflamação sistêmica crônica são parte comum da fisiopatologia da psoríase, independentemente da presença ou ausência de SM.
Os telômeros são elementos repetitivos de nucleotídeos nas extremidades dos cromossomos que os protegem da degradação e perda de informação genética. As células diploides normais perdem telômeros em cada ciclo celular, e seu comprimento real pode prever o tempo de vida da célula. Os comprimentos dos telômeros no DNA sanguíneo estão de acordo com os de outros tecidos, e o encurtamento induzido dos telômeros está ligado a muitos problemas de saúde, incluindo envelhecimento, distúrbios relacionados ao envelhecimento e câncer.26,27 No presente estudo, os autores hipotetizaram que o comprimento dos telômeros em células sanguíneas de pacientes com psoríase estaria inversamente associado com o nível de moléculas de DNA/RNA oxidadas. Estudos publicados anteriormente forneceram dados um tanto controversos sobre esse tópico. O comprimento dos telômeros das células sanguíneas e os níveis urinários de guanina oxidada mostraram correlação negativa em indivíduos idosos.28 As células T de pacientes com psoríase apresentaram comprimento de telômero mais curto.13 Em contraste, Svenson et al. mostraram que o estresse oxidativo intenso alonga os telômeros em granulócitos e células T naïve.11 Comprimento de telômero mais longo também foi relatado em leucócitos de indivíduos com artrite reumatoide, artrite psoriásica, espondilite anquilosante, esclerodermia sistêmica e doença de Parkinson.
Nos pacientes com psoríase, os presentes resultados mostraram telômeros significantemente mais longos por cromossomo em comparação com os controles da mesma idade. Da mesma maneira, como em outros estudos, o comprimento dos telômeros nos controles saudáveis se correlacionou negativamente com a idade.12 Esse fato mostrou correspondência com a teoria geral do envelhecimento.5 No entanto, não foi observada relação semelhante nos indivíduos com psoríase. Os dados revelaram diferenças entre os sexos; os comprimentos dos telômeros nos indivíduos do sexo feminino com psoríase, mas não nos indivíduos do sexo masculino com a doença, foram significantemente maiores do que os encontrados nos indivíduos do sexo feminino saudáveis.
Em decorrência do estresse oxidativo, o tabagismo deveria causar atrito mais rápido dos telômeros em indivíduos não fumantes. Entretanto, os resultados de muitos estudos mostraram efeitos contraditórios do tabagismo nos telômeros. Alguns deles relataram atrito dos telômeros em fumantes, e outros estudos não encontraram associações entre tabagismo e o comprimento dos telômeros, enquanto outros descobriram telômeros curtos em leucócitos de fumantes, mas a taxa de atrito dos telômeros foi mais lenta no longo prazo.9 Para minimizar a influência do tabagismo no processo de atrito dos telômeros, avaliou‐se também o comprimento dos telômeros apenas nos indivíduos não fumantes. Nesse subgrupo, foram encontrados telômeros significantemente mais longos nos pacientes sem SM em comparação com os controles apropriados; apesar de nenhuma associação do comprimento dos telômeros com o desenvolvimento de SM ou doenças cardiovasculares na psoríase ter sido publicada anteriormente.29
Com base em dados preliminares, o comprimento dos telômeros nas células sanguíneas não parece corresponder ao alto dano oxidativo nas moléculas de DNA presentes na circulação de indivíduos com psoríase. A razão para esses achados não está completamente elucidada, e muitos fatores exógenos e endógenos de atrito mais lento dos telômeros podem ser considerados, incluindo citocinas liberadas de imunócitos ativados, atividade monocitopoiética aumentada da medula óssea psoriásica, hiperplasia de fagócitos e outros.30 Várias possíveis explicações para esses achados foram sugeridas por Tamayo et al.: i) estimulação da atividade da telomerase em leucócitos psoriáticos ou progenitores hematopoiéticos primitivos, ii) disfunção do complexo sheltering/telossomo necessário para o processo de capeamento, iii) outro mecanismo imunológico celular ou sistêmico garantindo as funções corretas dos telômeros, ou iv) efeito epigenético da metilação de sequências repetidas de DNA subteloméricas.12
A atividade catalítica da telomerase adiciona cópias extras da sequência repetida de DNA para compensar a perda de telômeros da divisão celular. Em circunstâncias normais, essa atividade da transcriptase reversa é restrita principalmente a tipos de células com alta proliferação, ou seja, células germinativas e progenitores hematopoiéticos. Nas células sanguíneas, a atividade da telomerase foi encontrada nas células T, mas não nos neutrófilos.9,10 Na artrite reumatoide, as células T exibiram capacidade diminuída de regulação positiva da atividade da telomerase, apesar de outros autores terem mostrado que os linfócitos dos pacientes apresentam aumento da atividade da telomerase.31,32 Anteriormente, verificou‐se que a psoríase induzia a atividade da telomerase nas células T e nas células mononucleares do sangue periférico, o que se correlacionava positivamente com a gravidade da doença.13,33 Dessa maneira, as células sanguíneas podem retardar o encurtamento dos telômeros, prolongar sua capacidade de replicação na circulação sanguínea e auxiliar a resposta imune de pacientes com psoríase.
A última parte do presente estudo foi focada no estado de metilação do DNA psoriásico nas células do sangue periférico. A adição de um grupo metila às bases de citosina na posição 5 do anel de citosina afeta os genes ligados à resposta imune, regulação do ciclo celular e apoptose, e pode desempenhar papel importante na patogênese da psoríase.19 Alterações na metilação do DNA foram encontradas tanto na pele quanto nas células mononucleares do sangue periférico. Foram descobertas mais de mil ilhas CpG diferencialmente metiladas nas células da pele, incluindo hipermetilação dos promotores dos genes p14 e p16.34,35
Nas células mononucleares da medula óssea psoriásica, foi observada a desmetilação dos promotores dos genes p15, p16 e p21, reduzindo a proliferação de células hematopoiéticas.30 Por outro lado, o gene FOXP3, cuja proteína codifica o regulador mestre do desenvolvimento de células Treg reguladoras, foi encontrado hipermetilado.36 Outro estudo, avaliando as diferenças de metilação do sangue total na psoríase, identificou três regiões nos loci do cromossomo 8 e cromossomo 6 MICA, IRIF1, PSORS1C3 e TNFSF4 hipermetilados na doença transmitida pelos pais, enquanto PSORS1C1 estava hipometilado.37
Além disso, foi demonstrado aumento significante da metilação global do DNA em células mononucleares psoriásicas.19 Células T CD4+e CD8+isoladas do sangue total não mostraram diferenças significantes na metilação ou expressão gênica entre irmãos afetados e não afetados, apesar de terem sido relatados estados hipermetilados e hipometilados em pacientes com psoríase em comparação com controles saudáveis.38 Recentemente, os autores utilizaram análise do relógio epigenético com base no sequenciamento de mais de 500 loci gênicos associados à idade no DNA do sangue psoriásico; com base em seu status de metilação, observou‐se que os indivíduos do sexo feminino que sofrem de psoríase eram epigeneticamente mais velhos do que os controles saudáveis.3
O presente estudo determinou a metilação global do DNA utilizando o anticorpo monoclonal anti‐5‐metilcitosina e detecção colorimétrica. O nível de metilação nos pacientes com SM se correlacionou positivamente com o IMC; entretanto, não foram encontradas diferenças de metilação entre os pacientes e o grupo controle. Anteriormente, o nível de metilação do DNA determinado em amostras de pele, mas não em células mononucleares do sangue periférico, correlacionou‐se positivamente com os escores PASI.19 Nenhum dos resultados do presente estudo apoia qualquer importância da determinação do status de metilação global do DNA no sangue de indivíduos com psoríase. Embora a mediana de 5 mC de DNA, determinada nos pacientes (33,20%), tenha sido aparentemente maior do que nos controles (23,35%), a significância estatística da diferença foi desabilitada por grande flutuação dos valores de 5 mC de DNA em ambos os grupos (10,10–55,60% nos pacientes vs. 2,90–40,90% nos controles; ver tabela 1) e por número relativamente baixo de casos relatados no estudo. É possível que milhares de sítios hipo e hipermetilados nos genes fisiopatologicamente associados à psoríase possam ocultar alterações individuais de metilação que aparecem no DNA das células sanguíneas psoriásicas.
Resumindo os presentes achados, este estudo mostrou consequências do dano oxidativo ao DNA/RNA e modificações dos telômeros com a fisiopatologia da psoríase. Ambos os processos podem influenciar significantemente as atividades de proliferação das células. Níveis elevados de ácidos nucleicos oxidados no soro de indivíduos com psoríase refletem a presença de inflamação sistêmica crônica, principalmente em pacientes com maior peso e IMC e com SM. Níveis elevados de 8‐hidroxi‐2’‐deoxiguanosina, 8‐hidroxiguanosina e 8‐hidroxiguanina parecem ser biomarcadores séricos promissores do dano oxidativo em ácidos nucleicos e envelhecimento celular acelerado. Seus níveis podem ser terapeuticamente influenciados pelo tratamento antioxidante.
Em células sanguíneas psoriásicas, são observados telômeros mais longos do que em controles saudáveis. No entanto, os papéis fisiopatológicos das alterações teloméricas na psoríase não são claros. Suas vias bioquímicas podem levar a atividade induzida da telomerase, menor número de células suscetíveis à apoptose e resposta imune mais forte. Foi relatado que várias substâncias, como a tapsigargina, modificam experimentalmente o comprimento dos telômeros e a atividade catalítica da telomerase em queratinócitos.39
O presente estudo mostra, no entanto, várias limitações. Primeiro, seu desenho é transversal e conta com número limitado de participantes incluídos, particularmente para análises confiáveis de subgrupos. Outra limitação do estudo é a origem caucasiana dos participantes. Como etnia, clima, geografia e outros fatores ambientais podem influenciar os resultados dos parâmetros determinados, estudos multicêntricos mais amplos devem verificar os resultados preliminares do presente estudo. Terceiro, a atividade da telomerase no soro ou células sanguíneas não foi determinada diretamente. Finalmente, mais estudos com olhar mais atento à oxidação, telômero, atividade da telomerase e processos de metilação em vários locais da pele, linhagens celulares individuais e genes específicos podem ajudar a entender melhor esses processos na patogênese da psoríase vulgar.
ConclusãoO estudo demonstrou níveis aumentados de moléculas de DNA/RNA oxidadas no soro de pacientes com psoríase vulgar exacerbada. Os resultados foram minimamente influenciados por sexo, presença de síndrome metabólica ou tabagismo. No DNA das células sanguíneas psoriásicas, foram observados telômeros mais longos em comparação aos controles saudáveis, principalmente no sexo feminino. A maior metilação global do DNA não foi significante em casos de psoríase em comparação com os controles, indicando importância clínica marginal desse teste epigenético realizado no DNA das células sanguíneas.
Suporte financeiroEsta pesquisa foi financiada pelos projetos COOPERATIO UK e SVV‐260543/2020da Charles University, Faculdade de Medicina em Hradec Kralove, República Tcheca.
Contribuição dos autoresMartin Beranek: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito;
Pavel Borsky: Obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; análise estatística; concepção e planejamento do estudo.
Zdenek Fiala: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Ctirad Andrys: Obtenção, análise e interpretação dos dados; concepção e planejamento do estudo.
Kvetoslava Hamakova: Participação efetiva na orientação da pesquisa; concepção e planejamento do estudo.
Marcela Chmelarova: Obtenção, análise e interpretação dos dados.
Helena Kovarikova: Obtenção, análise e interpretação dos dados.
Adam Karas: Obtenção, análise e interpretação dos dados.
Jan Kremlacek: Análise estatística.
Vladimir Palicka: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Lenka Borska: Participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Os autores gostariam de agradecer a Dana Knajflova pela revisão do manuscrito.
Como citar este artigo: Beranek M, Borsky P, Fiala Z, Andrys C, Hamakova K, Chmelarova M, et al. Telomere length, oxidative and epigenetic changes in blood DNA of patients with exacerbated psoriasis vulgaris. An Bras Dermatol. 2023;98:68–74.
Trabalho realizado no University Hospital Hradec Kralove e na Faculdade de Medicina, Hradec Kralove, Charles University, Praga, República Tcheca.