Os linfomas extranodais representam 25% a 35% de todos os linfomas não Hodgkin (LNH). O local mais comum de envolvimento é o trato gastrointestinal, seguido pela pele.1,2
O linfoma centro folicular cutâneo primário (LCF) é a forma mais comum de linfoma cutâneo de células B, representando 50% a 60% dos casos.3,4 O LCF afeta principalmente adultos, com excelente prognóstico e sobrevida específica em cinco anos superior a 95%.2 Sua disseminação extracutânea é extremamente rara, mas as recorrências são frequentes.4
O linfoma primário do trato genital feminino (LPTGF) é extremamente raro, representando 0,2% a 1,1% de todos os linfomas extranodais, com estimativa de 165 novos casos anualmente nos EUA.1 Envolvimento secundário por linfoma nodal é mais frequente. O sítio mais comum é o ovário, seguido pelo colo uterino, e o subtipo histológico mais comum é o linfoma difuso de grandes células B, seguido pelo linfoma folicular.1,5,6
Em relação a fatores de risco, sugere‐se que um possível estímulo antigênico crônico possa ter papel causal, mas nenhum fator foi ainda bem estabelecido. Nos linfomas cutâneos de células B da zona marginal, sugere‐se relação com Borrelia burgdorferi, mas nem essa associação pôde ser confirmada.7 Em se tratando de transgêneros, levanta‐se a questão do papel do estímulo hormonal no desenvolvimento de neoplasias. Para neoplasias hormônio‐dependentes, como câncer de mama, esse risco existe; para LNH, há hipótese do papel hormonal em alguns estudos, mas essa relação é sugerida para reposição de hormônios femininos, e não foi descrita para hormônios masculinos, como seria o caso de homens transgêneros, como apresentado neste estudo.8
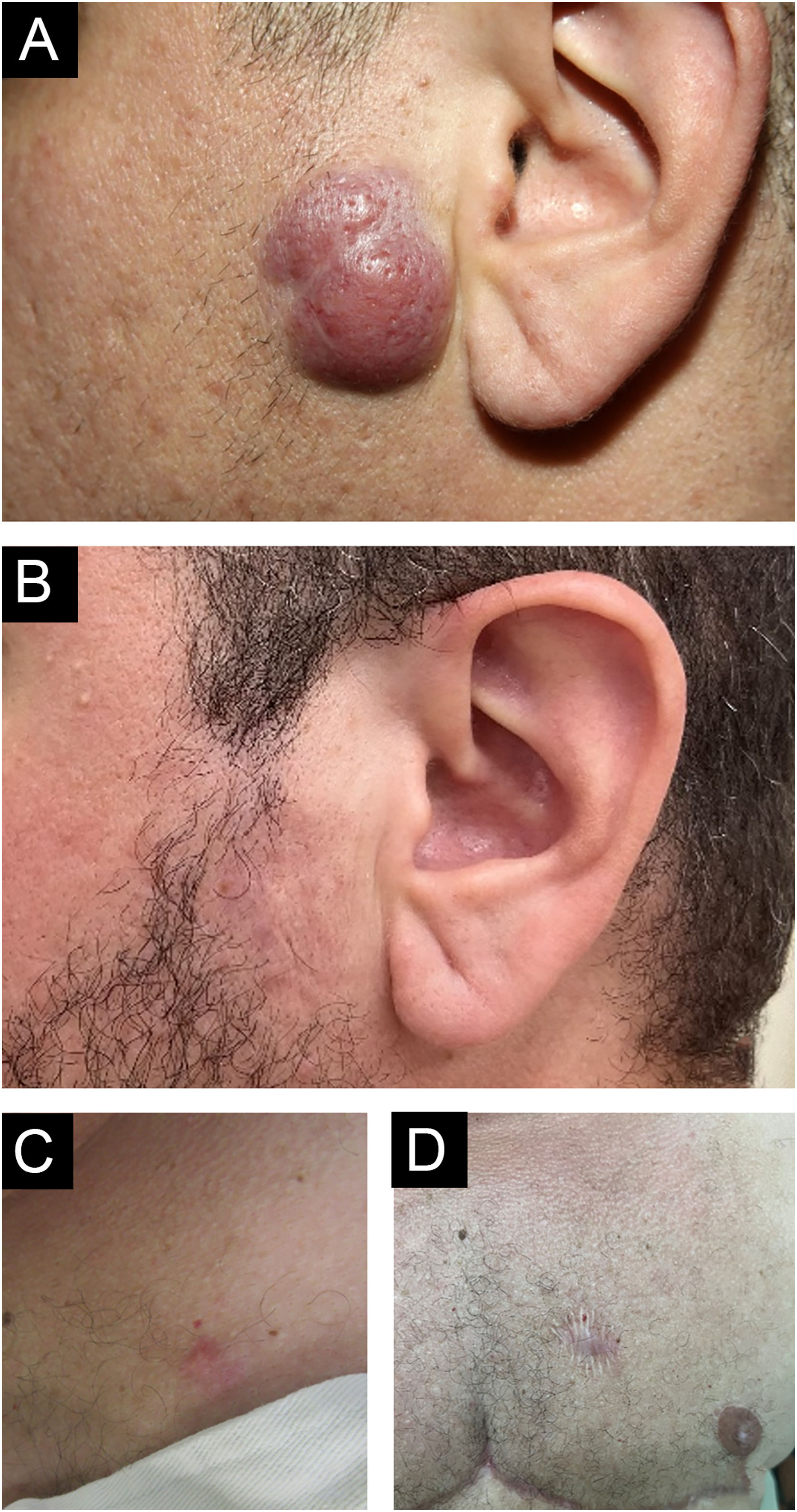
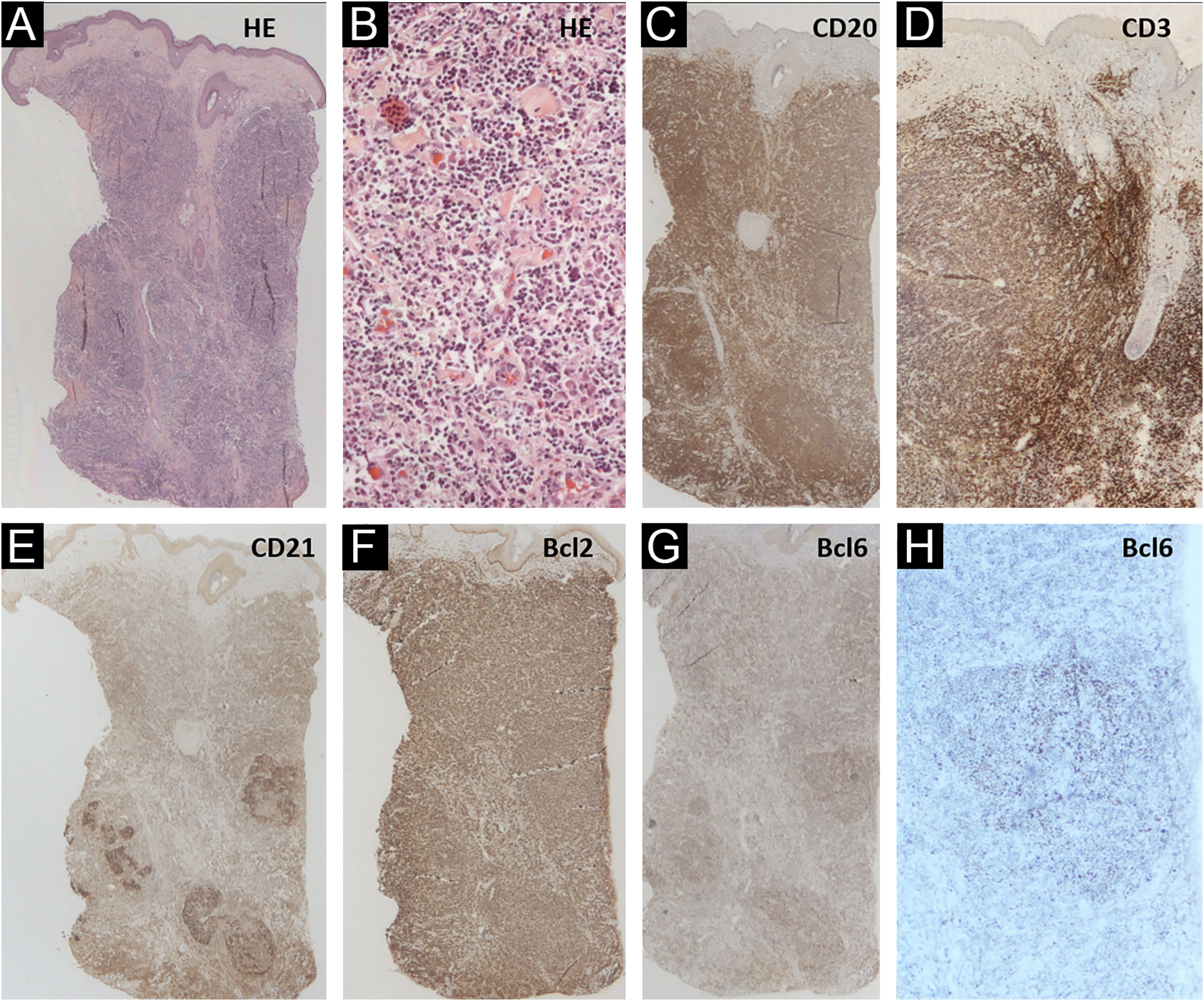
Descrevemos um paciente trans masculino de 42 anos, sem comorbidades, que se apresentou ao Ambulatório de Dermatologia com tumor eritematoso, infiltrado, de 3cm, assintomático, de crescimento lento, na região pré‐auricular esquerda (fig. 1). A biopsia de pele revelou infiltrado de pequenos linfócitos, com padrão de crescimento nodular, botton‐heavy, sem alterações epidérmicas. As células neoplásicas foram CD20+ e CD10− e MUM1−; com marcação para CD21 evidenciando os folículos linfoides; BCL6+ tanto dentro (mais evidente) quanto fora dos folículos; BCL2+ em células B e T; CD3 e CD5 revelaram fundo de células T reativas, mas foram negativos nas células atípicas (fig. 2). O exame de reação em cadeia da polimerase (PCR, do inglês polymerase chain reaction) mostrou monoclonalidade para o gene IgH na população de células B. O diagnóstico de LCF foi estabelecido e nenhuma evidência de doença extracutânea foi encontrada após o estadiamento com tomografias de tórax, abdome, pelve e cervical e biopsia de medula óssea. O paciente foi tratado com corticoide intralesional com resposta completa (fig. 1B).
Biopsia de pele. (A e B) Hematoxilina & eosina (10×e 200×) mostrando infiltrado botton‐heavy de pequenos linfócitos, com padrão de crescimento nodular e sem alterações epidérmicas. (C) CD20 (10×) destacando as células B neoplásicas. (D) CD3 (10×) evidenciando o rico infiltrado de células T associado. (E) CD21 evidenciando áreas com esboços de folículos. (F) Bcl2+ (10×) em células B e T. (G e H) Bcl6+ (10×e 40×) dentro e fora dos centros germinativos
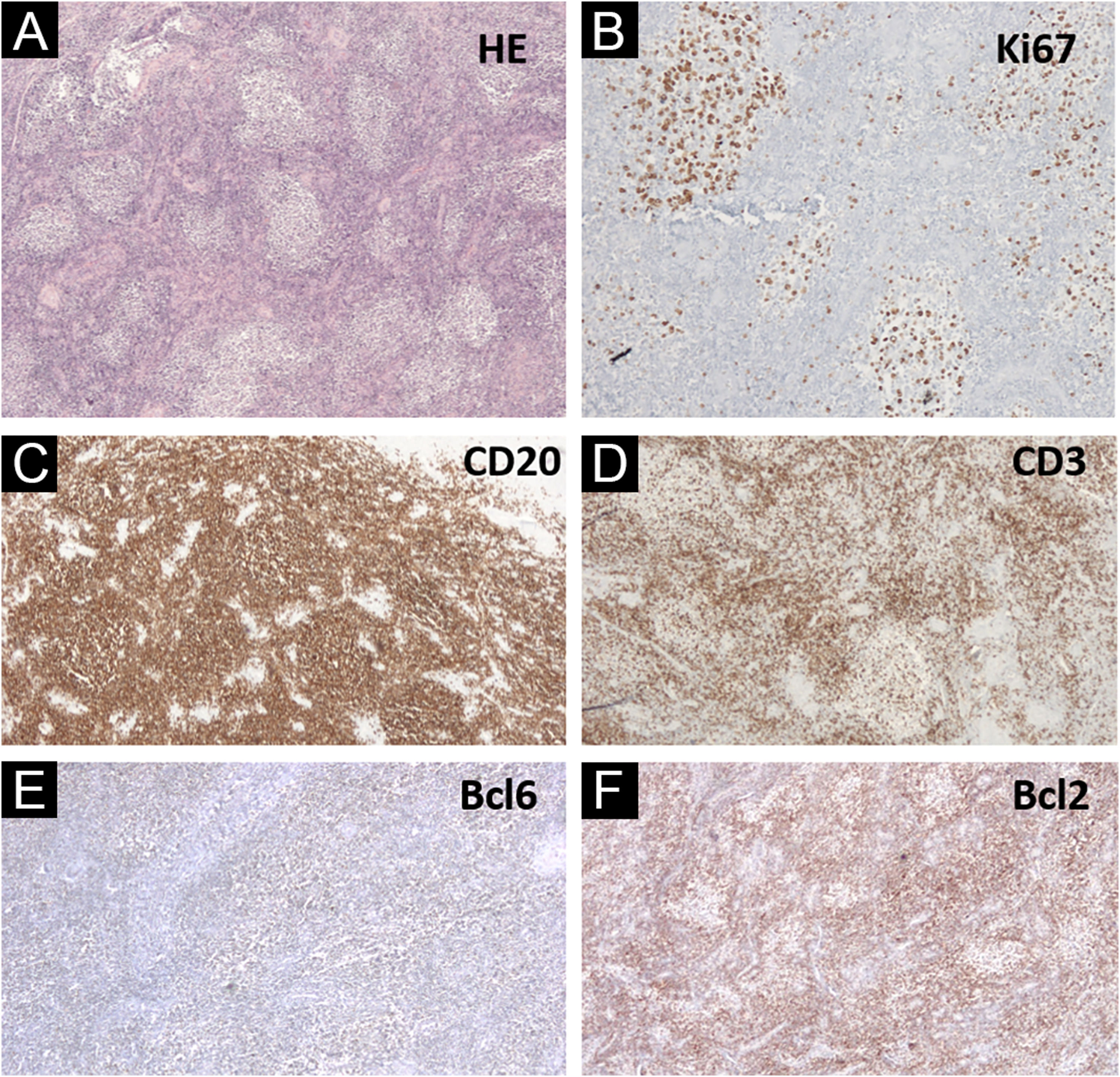
Em relação à identidade de gênero, o paciente iniciou transição hormonal (com testosterona) aos 40 anos. Dois anos após o diagnóstico de linfoma cutâneo, o paciente continuou a transição realizando histero‐salpingo‐ooforectomia total. A análise histológica do colo uterino revelou agregados linfoides em padrão nodular, folicular, com fenótipo semelhante à lesão cutânea – CD20+, CD23 evidenciando os nódulos, num fundo rico em células T CD3+ e CD5+, BCL6+ fraco, mas assemelhando‐se mais a distribuição das células CD20+, CD10−, MUM−, Bcl2− no centro germinativo, assemelhando‐se mais a distribuição das células CD3+ e KI67 apresentando falta de polarização dentro dos folículos neoplásicos (fig. 3). A análise de PCR para imunoglobulina foi inconclusiva. A pesquisa da translocação t(14;18) em parafina, tanto no colo quanto na pele da face, foi negativa. O paciente não apresentava sintomas B e nenhum sinal de doença residual no estadiamento com PET‐CT e nova biopsia de medula óssea; portanto, optou‐se por acompanhamento clínico sem tratamento adicional.
Biopsia de colo uterino. (A) Hematoxilina & eosina (40×) mostrando agregados linfoides em padrão nodular e folicular. (B) Ki67 (200×) com falta de polarização dentro dos folículos neoplásicos. (C) CD20 (40×) destacando as células B esboçando folículos. (D) CD3+ nas células ao redor dos folículos linfoides. (E) Bcl6+ fraco, mas assemelhando‐se às células CD20+. (F) Bcl2− (40×) nos folículos linfoides, com distribuição semelhante às células CD3+
Dois anos depois, um novo nódulo cutâneo no tórax direito, com mesmo aspecto clínico ao apresentado na face, foi excisado cirurgicamente, com achados histológicos também semelhantes e compatíveis com o diagnóstico de LCF (fig. 1C e D). O paciente está em remissão completa há dois anos.
Após várias discussões multidisciplinares, nenhuma conclusão pôde ser alcançada na unificação dos achados cutâneos e uterinos. Inicialmente, foi feito o diagnóstico de LCF. No entanto, a disseminação extracutânea do LCF é rara e, quando presente, é mais frequente para linfonodos locais.4 Não foi encontrada descrição prévia de disseminação para o colo uterino.
Uma possibilidade seria a de um linfoma nodal primário afetando secundariamente a pele e o colo uterino. No entanto, não foram encontrados sinais de envolvimento nodal no estadiamento com tomografia e posteriormente PET‐CT, nem na biopsia de medula óssea, no momento de cada um dos diagnósticos da pele e colo uterino. Além disso, os linfomas nodais são geralmente Bcl2+ nos centros germinativos.9
Isso levou a uma terceira proposição de dois diferentes linfomas de células B foliculares extranodais primários: um LCF e um LPTGF. Também para essa associação, não foi encontrada descrição prévia.
Outra possibilidade seria a do envolvimento de o colo uterino representar um pseudolinfoma. Lesões linfoma‐like do colo uterino foram descritas pela primeira vez em 1985, com outros relatos raros.5,10 Au et al. descreveram três casos de linfomas cervicais de células B, mas após revisão, concluíram que dois de três eram, de fato, pseudolinfomas. Os casos relatados geralmente regrediam espontaneamente quando a biopsia era repetida. Como possíveis pistas diagnósticas para o pseudolinfoma, sugere‐se uma distribuição mais superficial do infiltrado, com heterogeneidade das células linfoides e ausência de massas ou ulcerações, mas isso também pode ocorrer em linfomas indolentes. Pode‐se sugerir que a detecção do rearranjo do gene da imunoglobulina por PCR auxilia na diferenciação dessas duas entidades, uma vez que o linfoma é geralmente clonal enquanto espera‐se que o pseudolinfoma, como processo reacional e não neoplásico, seja policlonal. No entanto, estudos anteriores mostraram que o rearranjo clonal também pode ser detectado em condições benignas, relatadas, por exemplo, em 50% das hiperplasias linfoides gástricas benignas e 41% das lesões linfoepiteliais benignas das glândulas salivares.11,12 Assim, mesmo não sendo conclusivo, poderia ser mais uma ferramenta para auxiliar (mas não definir) o diagnóstico. Infelizmente, no presente caso, a detecção clonal na amostra parafinada do colo uterino foi inconclusiva.
Embora não tenha sido possível um diagnóstico definitivo, descrevemos a associação de duas doenças linfoproliferativas raras e as armadilhas diagnósticas desse grupo de doenças.
Suporte financeiroNenhum.
Contribuição dos autoresJade Cury‐Martins: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Marcelo Abrante Giannotti: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Denis Miyashiro: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Juliana Pereira: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Jose Antonio Sanches: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Cury‐Martins J, Giannotti MA, Miyashiro D, Pereira J, Sanches JA. A unique case of a lymphoproliferative disorder affecting the skin and uterine cervix on a male transgender. An Bras Dermatol. 2024;99:135–9.
Trabalho realizado no Hospital das Clínicas, Universidade de São Paulo, São Paulo, SP, Brasil.