Psoríase é doença inflamatória crônica associada à inflamação sistêmica e comorbidades. Alterações na composição do microbioma intestinal estão envolvidas na patogênese de doenças inflamatórias e síndrome metabólica. Caracterizar o microbioma intestinal de pacientes com psoríase pode ser relevante no entendimento do seu curso clínico e na prevenção de comorbidades.
ObjetivoCaracterizar o microbioma intestinal de homens com psoríase em comparação a controles (sem psoríase) onívoros e vegetarianos.
MétodoEstudo transversal envolvendo 42 homens adultos: 21 com psoríase onívoros, 14 controles onívoros e 7 controles vegetarianos. A caracterização do microbioma intestinal foi realizada por análise metagenômica. Avaliaram‐se os níveis séricos da proteína ligadora de lipopolissacarídio (LPB) e proteína C reativa (PCR).
ResultadosOs grupos diferiram entre si quanto aos aspectos nutricionais e do microbioma. Pacientes com psoríase apresentaram maior consumo de proteínas e menor de fibras. Níveis de LPB, PCR e a relação Firmicutes/Bacteroidetes foram maiores no grupo com psoríase que no grupo controle vegetariano (p <0,05). Os gêneros Prevotella, Mogibacterium, Dorea, Bifidobacterium e Coprococcus diferiram no grupo com psoríase em comparação com vegetarianos; já os gêneros Mogibacterium, Collinsella e Desulfovibrio diferiram dos onívoros. Identificou‐se padrão de microbioma ligado à psoríase (plsPSO) que se associou a maiores níveis de LPB (rho = 0,39; p=0,02) e menor ingesta de fibras dietéticas (rho=−0,71; p <0,01).
Limitações do estudoApenas homens adultos foram avaliados.
ConclusãoHouve diferença no microbioma intestinal de homens adultos com psoríase em relação a onívoros e vegetarianos saudáveis. O padrão de microbioma encontrado correlacionou‐se com a ingesta de fibras alimentares e com os níveis séricos de LPB.
Psoríase é doença crônica inflamatória sistêmica que afeta entre 1% e 2% da população.1 Sua patogênese é multifatorial, não sendo totalmente esclarecida, mas que envolve, além de uma base genética e estímulos ambientais, a ativação do sistema imune (inato e adaptativo), que desencadeia respostas inflamatórias locais na pele e articulações, assim como promove inflamação sistêmica de baixo grau.2
Comorbidades como obesidade, hipertensão arterial, diabetes mellitus, síndrome metabólica, doença cardiovascular, dislipidemia e transtornos afetivos (depressão, ansiedade) são frequentes em pacientes com psoríase, substanciando o processo inflamatório sistêmico subjacente.3
Microbioma intestinal (MI) consiste em flora inconstante, constituída nos primeiros anos de vida, mas que varia conforme estímulos ambientais, como dieta, estilo de vida (tabagismo, consumo de álcool, exercícios físicos, estresse, sono), higiene, terapêutica com antimicrobianos, localização geográfica, sexo, idade e certas doenças. Cerca de 57% do MI é influenciado pela dieta, e apenas 12% por fatores genéticos.4 No microbioma fecal existem entre uma e 2.000 espécies de bactérias, distribuídas em mais de 50 filos. Cerca de 90% do MI são compostos pelos filos Firmicutes e Bacteroidetes; uma proporção maior de Firmicutes/Bacteroidetes (F/B) é associada a maior estímulo inflamatório sistêmico.5
A disbiose intestinal, caracterizada pelo desequilíbrio da composição do MI, pode levar ao aumento da permeabilidade intestinal e a translocação de mediadores inflamatórios intraluminais. Portanto, a caracterização do MI pode contribuir na compreensão sobre a patogênese de doenças inflamatórias sistêmicas como psoríase, doença de Crohn, artrite reumatoide e obesidade, pois há indícios de que a composição do MI esteja envolvida no curso das mesmas.6
Estudos clínicos foram conduzidos para explorar a relação entre MI e a atividade clínica da psoríase, com resultados ainda conflitantes.7 Entretanto, considera‐se a modulação do MI por meio de tratamento dietético, suplementações com probióticos e transplante fecal, com potencial de interferir, além da atividade da psoríase, no curso de comorbidades, além de maximizar sua resposta terapêutica.8
Lipopolissacarídio (LPS) é uma endotoxina que compõe a parede celular de bactérias gram‐negativas e promove ativação do sistema imune a partir da estimulação direta de macrófagos, monócitos, células dendríticas e linfócitos B, desencadeando febre, vasodilatação (óxido nítrico) e secreção de eicosanoides.9 A proteína de ligação de lipopolissacarídios (LPB) liga‐se ao LPS e transfere monômeros de LPS para as células inflamatórias através de CD14. Os níveis plasmáticos de LPB são influenciados pelas concentrações circulantes de LPS, que têm meia‐vida muito curta. A exposição ao LPS induz um aumento duradouro da produção de LPB no fígado dentro de 15 a 30 minutos, com nível sérico máximo ocorrendo após 24 a 48 horas. O complexo LPS‐LBP‐CD14‐MD2 induz uma resposta pró‐inflamatória pela ativação de NF‐κB mediada pelo receptor Toll‐like‐4 (TLR4) e, como tal, os níveis circulantes de LPB foram associados à inflamação sistêmica. Além disso, níveis plasmáticos da proteína C reativa quantitativa ultrassensível (PCRqt), um biomarcador sérico de inflamação sistêmica sintetizado pelo fígado, estão associadas ao aumento de LPS.10
Na América do Sul, são raros os estudos controlados que caracterizem o MI de pacientes com psoríase. Assim, o objetivo desta investigação foi caracterizar o MI de homens adultos brasileiros com psoríase, comparando‐os com controles onívoros e vegetarianos.
MétodoEstudo transversal envolvendo 42 homens adultos (21‐65 anos) – 21 com psoríase (PSO) e 21 controles sem psoríase, dos quais 14 onívoros (ONI) e sete vegetarianos (VEG).
Todos os participantes incluídos eram não tabagistas, não etilistas, não apresentaram alterações na dieta nos últimos três meses; não usaram antibióticos, laxantes, anti‐inflamatórios, ou referiram alterações intestinais na última semana, ausência de doença inflamatória intestinal, infecções, doenças autoimunes e uso de probióticos. A amostra de homens adultos do interior do estado de São Paulo foi escolhida para reduzir a variabilidade do MI, que também é influenciada por sexo, idade e localização geográfica da população.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos da Faculdade de Medicina de Botucatu (FMB/UNESP) sob o parecer n° 3.743.366. Todos os participante assinaram o Termo de Consentimento Livre e Esclarecido.
A pesquisa foi realizada no Ambulatório de Dermatologia da FMB, no período de março de 2020 a fevereiro de 2021. A população teve origem entre moradores da região de Botucatu (SP), pacientes com diagnóstico de psoríase, seus acompanhantes e convidados vegetarianos.
Foram obtidos dados clínicos, demográficos, socioeconômicos e dietéticos por meio de entrevistas presenciais; as avaliações antropométrica e dietética foram realizadas por nutricionista experiente (T.C.F.P.).
A avaliação dietética foi obtida pelo Recordatório de 24 horas (R24h), a partir do relato detalhado do consumo alimentar nas últimas 24 horas, com dados sobre os tipos de alimentos e bebidas, além do tamanho, porções, volume ou medidas caseiras. Posteriormente, os dados foram transformados em gramas, valores de energia, macronutrientes e micronutrientes pelo software NDSR (Nutritional Data System for Research).
Para estimar a gravidade da doença, foi utilizado o escore PASI (Psoriasis Area and Severity Index), avaliado por dermatologista titulado (L.D.B.M. ou M.R.R.L).
Para avaliar o MI, coletaram‐se amostras de fezes para obtenção do material genético. Os indivíduos foram orientados a realizar a coleta de fezes da primeira evacuação do dia em tubo específico em sua residência. Após a coleta, as amostras foram entregues à pesquisadora responsável (T.C.F.P.) e transportadas refrigeradas (gelo seco: −28°C) até o laboratório Biotecnologia Pesquisa e Inovação (BPI, Botucatu‐SP), e armazenadas em freezer −80°C até o momento da extração do DNA.
Para extração do material genético, foram utilizadas alíquotas de 1g e o kit Quick‐DNA Fungal/Bacterial Miniprep (Zymo Research), de acordo com protocolo descrito pelo fabricante. Posteriormente, o material passou pelo teste de qualidade por meio da quantificação por fluorescência com a utilização do equipamento Qubit® 3.0 Fluorometer (Thermo Fisher Scientific).
Para as reações de amplificação da região 16S foram realizadas triplicatas de amostras, tendo como volume final de 20 μL, contendo 10 μL de GoTaq® Colorless Master Mix 2× (Promega, USL), 0,3 μM de oligonucleotídio forward e 0,3 μM de oligonucleotídio reverse, 3 μL de DNA genômico e água ultrapura estéril suficiente para completar 20 μL. As reações de amplificação foram conduzidas em termociclador VeritiTM Thermal Cycler (Applied Biosystems).
Após a reação de amplificação do DNA de cada amostra, a comprovação da amplificação foi realizada por eletroforese em gel de agarose 2% corado com gel Red (Uniscience), aproximadamente 300 bp (tamanho do amplicon). Submeteu‐se PCR para etapas de purificação utilizando bead magnética Agencourt AMPure XP (Beckman Coulter) para remoção de fragmentos muito pequenos da população total de moléculas e restos de primers da reação. Após essa etapa, foi realizada a quantificação pela metodologia de PCR em tempo real utilizando termociclador QuantStudio 3 Real Time (Applied Biosystems) e kit KAPA‐KK4824 (Library Quantification Kit ‐ Illumina/Universal), todos de acordo com protocolo do fabricante.
Foi gerado um pool equimolar de DNA, por meio da normalização de todas as amostras a 3nM para a realização do sequenciamento, o qual foi conduzido utilizando o sistema Illumina MiSeq de sequenciamento de nova geração (Illumina Sequencing) e kit MiSeq Reagent Kit V2 Nano 300 ciclos – leitura de 2 × 150 pb.
Utilizou‐se o banco de dados Greengenes 13_8 99% OTUs from 515F/806R region of sequences para identificação das sequências de táxons e foram consideradas apenas sequências com mais de 97% de analogia (confiabilidade).
A abundância relativa das unidades taxonômicas (UTN) nas amostras foi explorada a partir de seus componentes extraídos pelo método Partial Least Squares (PLS), com dados escalonados pelos desvios‐padrão.
As principais variáveis do estudo são a diversidade da flora intestinal identificada em cada MI avaliado, segundo cada categoria de UTN: abundância relativa dos grupos, pelos índices de diversidade de Hill (riqueza, Shannon e Simpson), a relação entre os filos Firmicutes/Bacteroidetes, abundância dos gêneros bacterianos (alfa diversidade) e os componentes dos padrões PLS (beta diversidade) identificados para os grupos. Define‐se riqueza como número total de UTN identificadas na amostra.
Foram ainda coletadas amostras de 10mL de sangue dos pacientes no ambulatório de dermatologia, pela médica responsável pelo tratamento dos pacientes (M.R.R.L.), para avaliação do LPB e PCRqt séricos. Após as coletas, as amostras foram imediatamente levadas sob refrigeração para a Unidade de Pesquisa Experimental (UNIPEX) da FMB‐Unesp, para centrifugação e extração do soro. Para a análise do LPB, foi utilizado o método ELISA sandwich, conforme as orientações do fabricante do kit (Human LBP DuoSet ELISA ‐ DY870‐05, R&D Systems, Inc., Minneapolis, MN, EUA). As amostras foram diluídas na fração 1:500. As concentrações finais de LPB foram determinadas conforme a curva padrão. As análises do PCRqt foram realizadas pelo método de imunoturbidimetria. Adotaram‐se como valores normais de PCRqt ≤ 3 mg/dL, e de LPB ≤ 10 mg/mL.
Variáveis qualitativas foram representadas pelos percentuais. Variáveis quantitativas foram representadas como médias e desvios‐padrão, se a normalidade for verificada pelo teste de Shapiro‐Wilk, ou medianas e quartis (P25‐P75), se indicado. As abundâncias dos gêneros foram comparadas entre os grupos pelo teste de Kruskal‐Wallis. Os índices de diversidade ecológica foram comparados entre os grupos por modelos lineares generalizados, ajustado pela idade dos participantes. Os modelos foram ajustados para as distribuições de probabilidade mais adequadas a cada amostra (p. ex., gama), e a correção para múltiplas comparações foi realizada pelo procedimento de Šidák.
As cargas dos componentes PLS foram correlacionadas com dados nutricionais, níveis de LPB e de PCRqt pelo teste de correlação de Spearman, e representado como mapa térmico. Os dados foram tabulados em Excel 2010 e analisados nos softwares IBM SPSS 25v e Statistica 10v. A significância estatística foi definida como p ≤ 0,05; bicaudal.
Como se trata de estudo exploratório, foi utilizada amostragem por conveniência a fim de se determinar o comportamento global dos grupos e fundamentar a análise pormenorizada de amostras a posteriori. Além disso, o método PLS não exige amostragem mínima para sua execução. Para as análises de correlação bivariada, considera‐se suficiente uma amostra de 41 participantes para a detecção de correlação moderada (rho <0,70), considerando α=0,01 e poder de 90%.
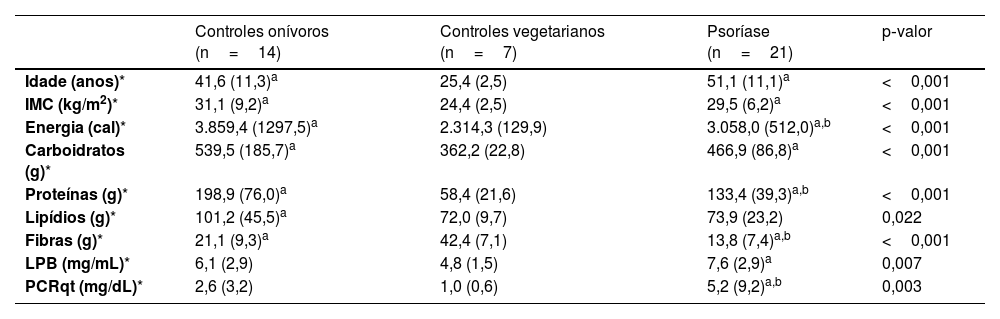
ResultadosOs principais dados clínicos, demográficos, alimentares, LPB sérico e PCRqt estão dispostos na tabela 1. Idade e IMC dos grupos PSO e ONI foram maiores que do grupo VEG. Do ponto de vista alimentar, os grupos PSO e ONI relataram maior consumo de carboidratos e proteínas que o grupo VEG. Quanto às fibras alimentares, o grupo PSO relatou menor ingesta de fibras que ONI e que VEG. Os níveis plasmáticos de LPB, assim como os níveis de PCRqt, foram maiores no grupo PSO em relação ao VEG, porém, PCRqt foi maior no PSO em relação ao ONI.
Principais dados demográficos, alimentares, LPB e PCRqt séricos dos participantes (n=42)
| Controles onívoros (n=14) | Controles vegetarianos (n=7) | Psoríase (n=21) | p‐valor | |
|---|---|---|---|---|
| Idade (anos)* | 41,6 (11,3)a | 25,4 (2,5) | 51,1 (11,1)a | <0,001 |
| IMC (kg/m2)* | 31,1 (9,2)a | 24,4 (2,5) | 29,5 (6,2)a | <0,001 |
| Energia (cal)* | 3.859,4 (1297,5)a | 2.314,3 (129,9) | 3.058,0 (512,0)a,b | <0,001 |
| Carboidratos (g)* | 539,5 (185,7)a | 362,2 (22,8) | 466,9 (86,8)a | <0,001 |
| Proteínas (g)* | 198,9 (76,0)a | 58,4 (21,6) | 133,4 (39,3)a,b | <0,001 |
| Lipídios (g)* | 101,2 (45,5)a | 72,0 (9,7) | 73,9 (23,2) | 0,022 |
| Fibras (g)* | 21,1 (9,3)a | 42,4 (7,1) | 13,8 (7,4)a,b | <0,001 |
| LPB (mg/mL)* | 6,1 (2,9) | 4,8 (1,5) | 7,6 (2,9)a | 0,007 |
| PCRqt (mg/dL)* | 2,6 (3,2) | 1,0 (0,6) | 5,2 (9,2)a,b | 0,003 |
IMC, índice de massa corporal; LPB, proteína ligadora de polissacarídios; PCRqt, proteína C reativa ultrassensível, teste quantitativo.
Nenhum controle VEG nem ONI eutróficos apresentou valores elevados de LPB; porém, um ONI obeso, um PSO eutrófico e dois PSO obesos apresentaram LPB >10 mg/mL. Do mesmo modo, nenhum controle VEG nem ONI eutróficos apresentou valores elevados de PCRqt, porém dois ONI obesos, quatro PSO eutróficos e três PSO obesos apresentaram PCR> 3 mg/mL.
Entre os pacientes com psoríase, oito (32%) apresentavam doença articular, seis (24%) eram tratados exclusivamente com tópicos, seis (24%) utilizavam metotrexato, oito (32%) utilizavam acitretina e cinco (20%) utilizavam secuquinumabe. O PASI variou entre 1 e 18, com mediana (P25‐P75) de 4 (1‐7).
Quanto às comorbidades, entre os pacientes com psoríase encontraram‐se dois (17%) com diabetes mellitus, três (25%) com hipertensão arterial e cinco (42%) com dislipidemia. Entre os onívoros, dois (13%) eram diabéticos, quatro (28%) hipertensos e seis (43%) com dislipidemia. Nenhum dos vegetarianos apresentava comorbidades.
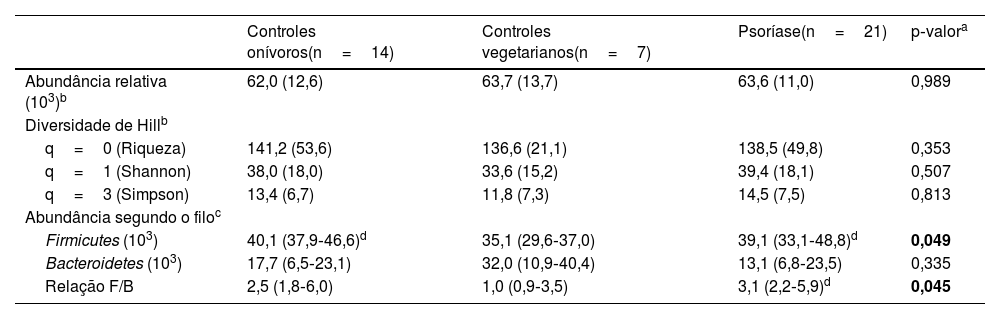
A análise do MI dos participantes resultou na identificação de 1.496 diferentes UTN, reunidos em 94 gêneros (tabela suplementar 1). Os índices de diversidade ecológica do MI diferiram entre os grupos e estão representados na tabela 2. Quando ajustado pela idade e IMC, o filo Firmicutes foi menos abundante em VEG, e a relação F/B foi maior no grupo PSO que no VEG.
Índices de diversidade ecológica do microbioma intestinal entre os grupos (n=42)
| Controles onívoros(n=14) | Controles vegetarianos(n=7) | Psoríase(n=21) | p‐valora | |
|---|---|---|---|---|
| Abundância relativa (103)b | 62,0 (12,6) | 63,7 (13,7) | 63,6 (11,0) | 0,989 |
| Diversidade de Hillb | ||||
| q=0 (Riqueza) | 141,2 (53,6) | 136,6 (21,1) | 138,5 (49,8) | 0,353 |
| q=1 (Shannon) | 38,0 (18,0) | 33,6 (15,2) | 39,4 (18,1) | 0,507 |
| q=3 (Simpson) | 13,4 (6,7) | 11,8 (7,3) | 14,5 (7,5) | 0,813 |
| Abundância segundo o filoc | ||||
| Firmicutes (103) | 40,1 (37,9‐46,6)d | 35,1 (29,6‐37,0) | 39,1 (33,1‐48,8)d | 0,049 |
| Bacteroidetes (103) | 17,7 (6,5‐23,1) | 32,0 (10,9‐40,4) | 13,1 (6,8‐23,5) | 0,335 |
| Relação F/B | 2,5 (1,8‐6,0) | 1,0 (0,9‐3,5) | 3,1 (2,2‐5,9)d | 0,045 |
F/B, Firmicutes/Bacteroidetes.
Quando comparados os obesos com psoríase e controles obesos, a relação F/B não apresentou diferença (p=0,078). Entretanto, quando são comparados eutróficos com psoríase e controles eutróficos, os portadores de psoríase apresentaram maiores valores médios (DP) da relação F/B (12,1 [2,9] vs. 2,0 [1,0]; p <0,01).
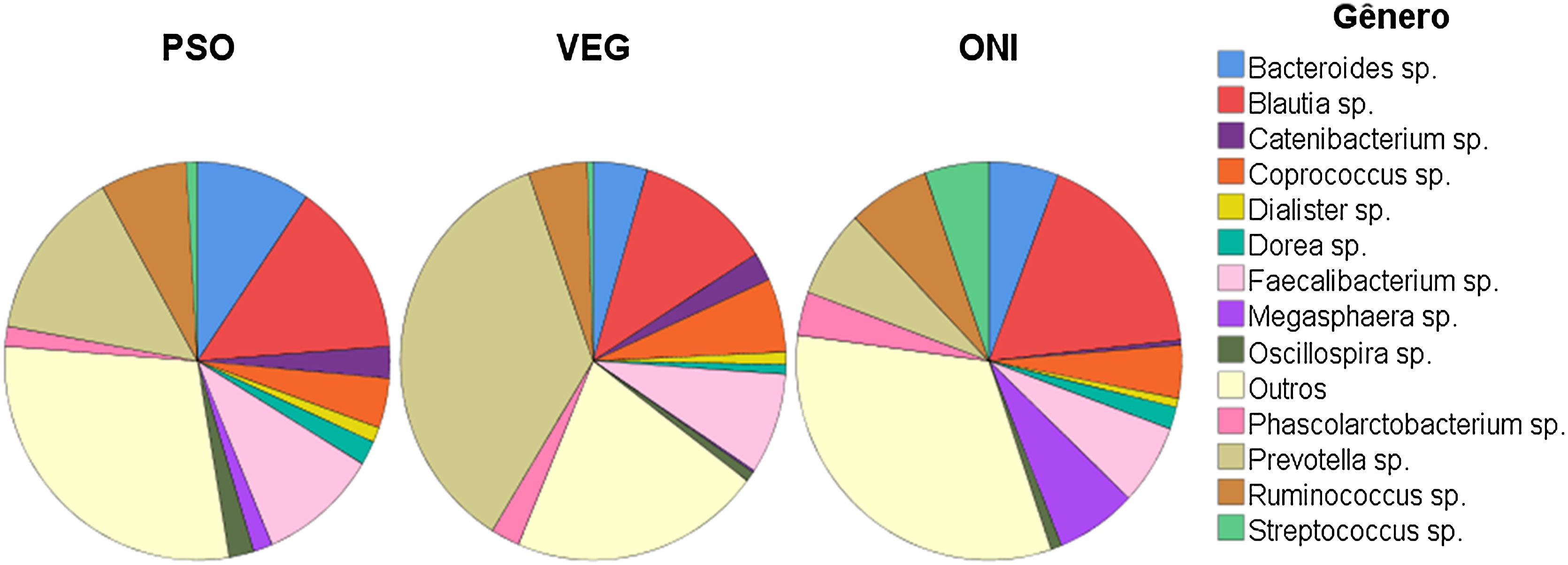
Em relação à alfa‐diversidade, entre os 13 gêneros mais prevalentes nos três grupos (fig. 1), foi identificada maior proporção do gênero Prevotella (36%) no grupo VEG e Blautia em PSO (14%) e ONI (18%).
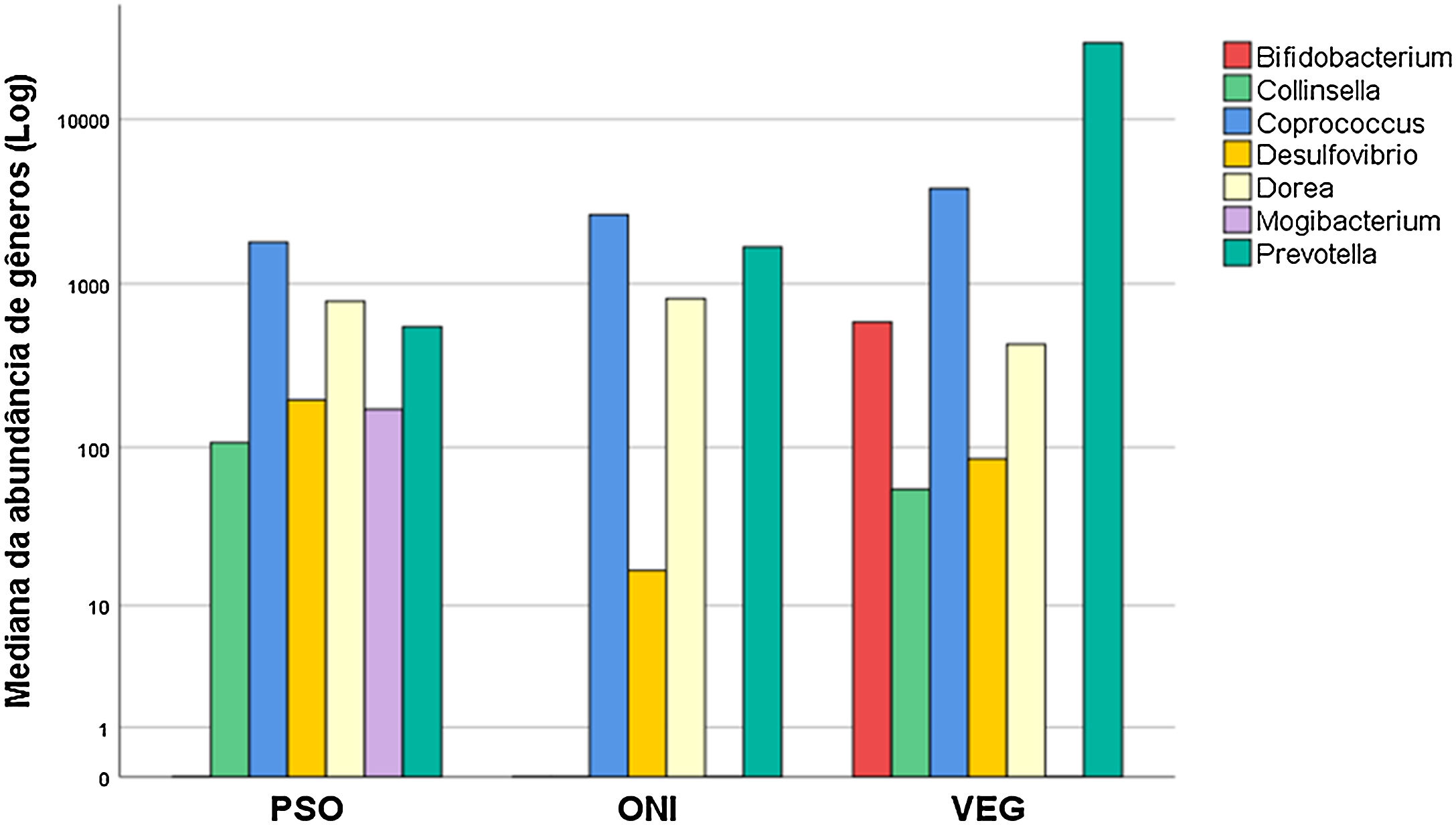
Em relação ao grupo PSO, houve diferença na abundância dos gêneros Prevotella, Mogibacterium, Dorea, Bifidobacterium e Coprococcus, quando compararados com VEG. Já os gêneros Mogibacterium, Collinsella, Desulfovibrio diferiram entre os grupos PSO e ONI (fig. 2).
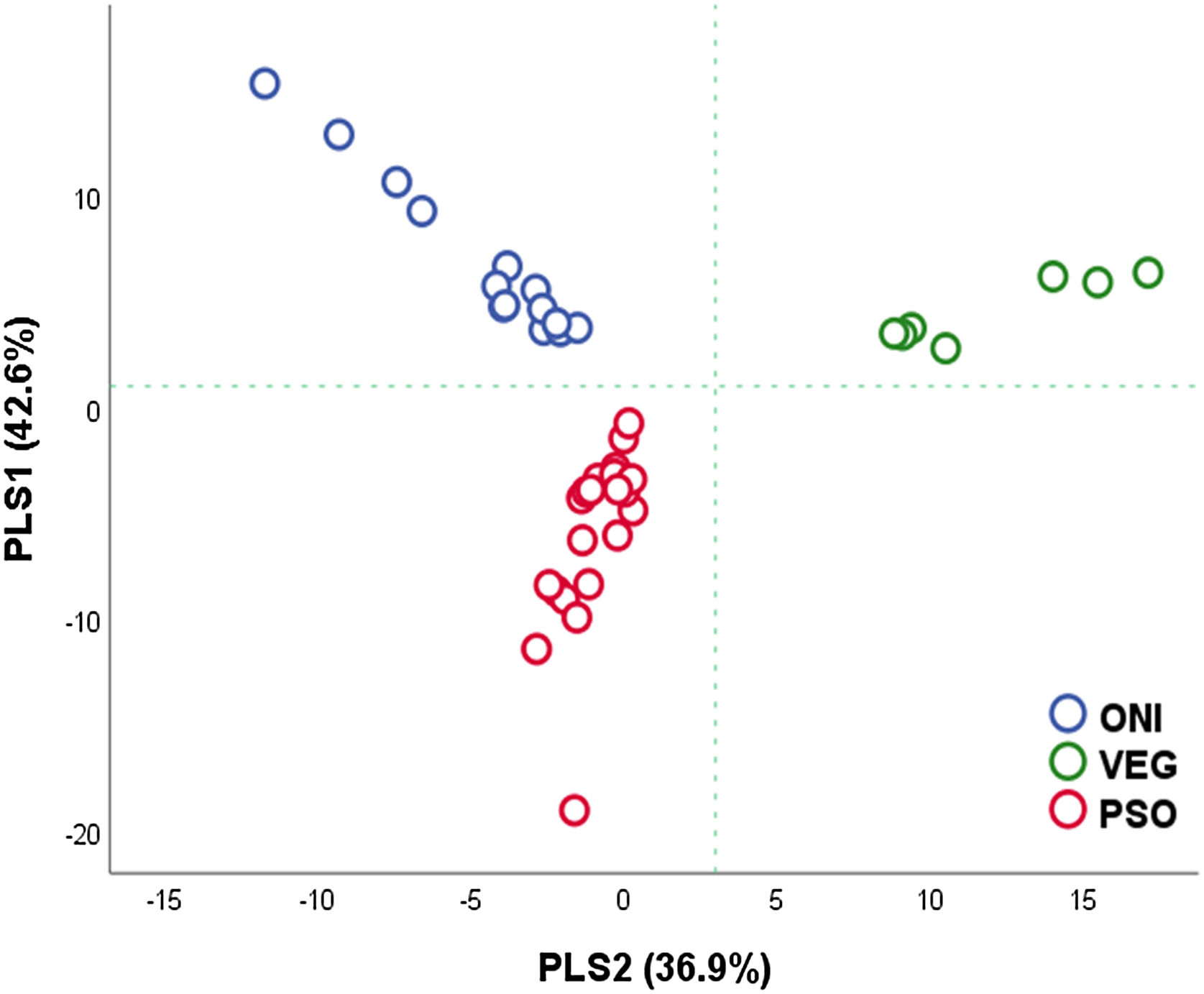
Quanto à beta‐diversidade, dois componentes PLS representaram até 79,5% da variância dos subgrupos. A figura 3 apresenta a projeção dos casos de acordo com a carga de seus componentes, individualizando‐os em quadrantes distintos. O padrão plsPSO pode ser compreendido como os carregamentos negativos de PLS1 e 2 (plsPSO=−PLS1−PLS2); inversamente, o padrão plsVEG pode ser representado pelos carregamentos positivos de PLS1 e 2 (plsPVEG=PLS1+PLS2); já o padrão plsONI pode ser representado pelo carregamento positivo de PS1 e negativo de PS2 (plsONI=PLS1‐PLS2).
Os carregamentos das UTN segundo PLS1 e PLS2 estão dispostos na figura suplementar 1. Segundo os componentes plsPSO, as bactérias com maior carregamento do padrão de MI do grupo PSO foram do gênero Coprococcus, Lachnospira, Paraprevotella, e as espécies Faecalibacterium prausnitzii sp., Prevotella stercorea sp., Prevotella copri sp. e Ruminococcus callidus sp. Já as com menor carregamento foram dos gêneros Lactobacillus, Streptococcus, Dialister, Megasphera, Slackia, e as espécies Bacteroidesfragilis sp., Bacteroides uniformis sp., Blautia producta sp., Butyricoccus pullicaerum sp. e Parabacteroides distasonis sp.
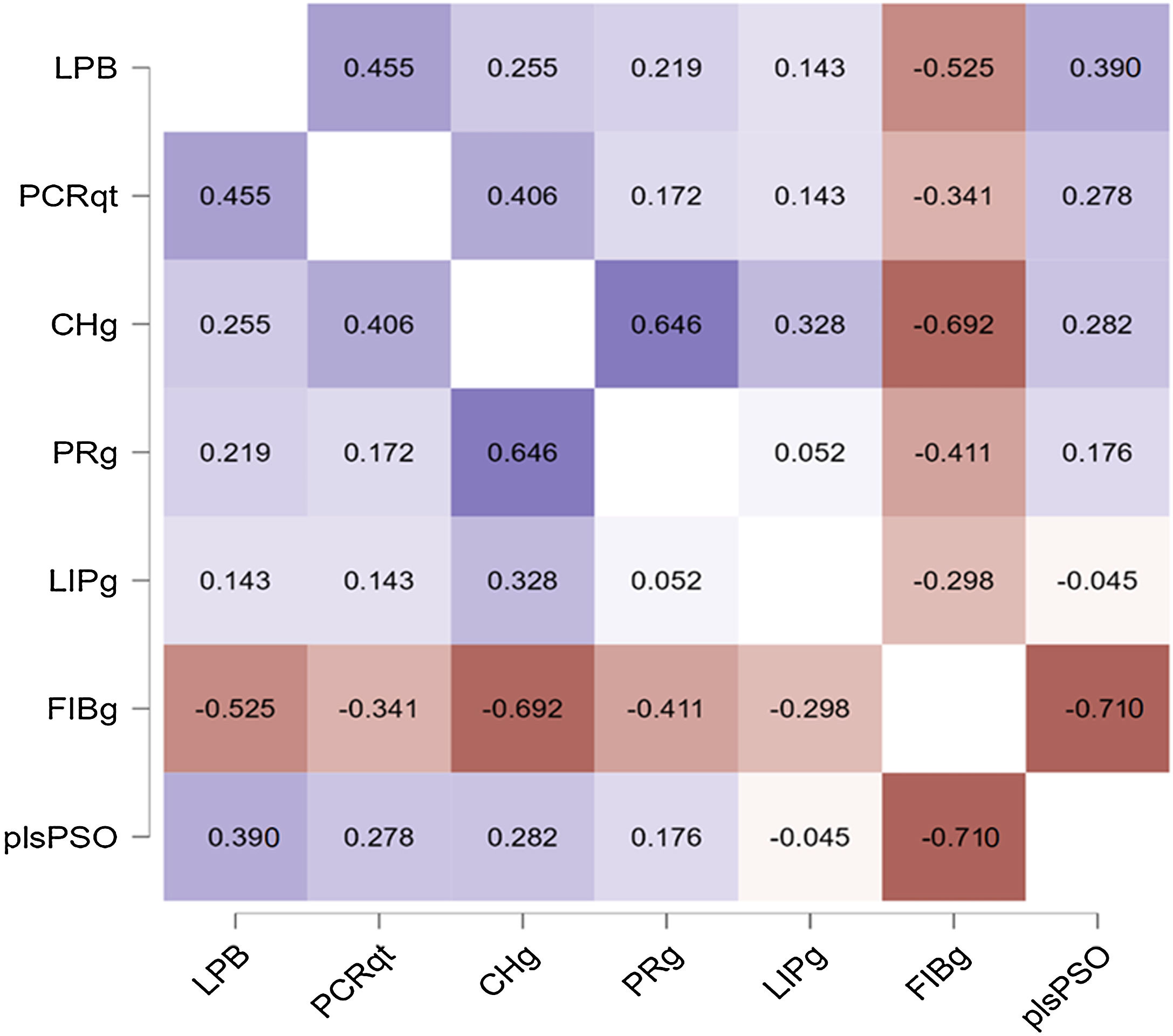
A figura 4 apresenta as correlações entre os níveis de LPB, PCRqt, ingesta nutricional e os padrões de MI: PSO, ONI, e VEG. Os níveis de LPB se correlacionaram inversamente com a ingesta de fibras (rho=‐0,53; p <0,01), porém, positivamente com o componente do padrão de MI dos pacientes com psoríase (rho=0,39; p=0,02). O comportamento do PCRqt não se associou ao componente do padrão plsPSO (rho=0,28, p=0,11), mas com a ingesta de carboidratos (rho=0,41; p=0,02) e com os níveis de LPB (rho=0,46; p <0,01). Do ponto de vista alimentar, o componente do padrão de MI plsPSO se correlacionou de maneira fortemente negativa com a ingesta de fibras (rho=‐0,71; p <0,01), assim como a menor ingesta de fibras se associou a maiores níveis de LPB e PCRqt.
Mapa térmico com as correlações bivariadas entre os níveis de LPB, PCR, características nutricionais da dieta e o padrão de microbioma intestinal dos pacientes com psoríase.
LPB, nível sérico da proteína de ligação de Lipopolissacarídeos; PCRqt, nível sérico da proteína C reativa ultrassensível (teste quantitativo); CHg, carboidratos (em gramas); PRg, proteínas (em gramas); LIPg, lipídios (em gramas); FIBg, fibras (em gramas); plsPSO, componente PLS do microbioma intestinal dos participantes com psoríase
Nosso estudo indicou que características do MI de homens adultos com psoríase diferiram dos controles onívoros e vegetarianos residentes de uma mesma região do Brasil. Aspectos etários, alimentares e de composição corporal também podem contribuir por parte dessas diferenças.11
Nessa amostra, o grupo PSO apresentou maior ingesta de carboidratos, porém baixa ingesta de fibras, mostrando ainda maior relação F/B no MI que o grupo VEG, que contou com maior ingesta de fibras e menor abundância de Firmicutes. Além disso, os hábitos alimentares dos pacientes com psoríase mostraram‐se desequilibrados, pois também foram identifcados aumento de gorduras de baixa qualidade e alta densidade calórica, características da dieta ocidental que é associada à disbiose intestinal e redução de diversidade bacteriana. Tais hábitos dietéticos podem se correlacionar com a gravidade da doença e das comorbidades, já que gorduras saturadas, açúcares, carne bovina e álcool interferem no status inflamatório sistêmico, enquanto a ingesta de fibras alimentares pode contribuir com a supressão de certas vias inflamatórias e na indução de células‐T reguladoras.12–14
A disbiose intestinal também atua no desequilíbrio dos ácidos graxos de cadeia curta (AGCC), dos quais butirato e acetato são os mais estudados, e são produzidos a partir da fermentação de fibras pelas bactérias intestinais. Acetato é associado à produção de grelina, que controla o apetite e a resistência à insulina; já o butirato é fonte de energia para células intestinais, associado com prevenção e redução da inflamação sistêmica e aumento da diversidade bacteriana, favorecendo a proliferação de bactérias do filo Bacteroidetes. Dietas com alto teor de fibras, vegetais e frutas promovem aumento de Bacteroidetes, e por consequência maior diversidade bacteriana. Por outro lado, dietas com excesso de frituras, sódio, proteína e gordura animal podem propiciar maior ativação pró‐inflamatória sistêmica e proporção F/B no MI.15 Além disso, os AGCC são moduladores diretos da síntese de interleucina 17 (IL‐17) por linfócitos‐T.16
A disbiose intestinal pode promover o aumento intraluminal de LPS,17 e dietas com baixa qualidade nutricional (p. ex., dieta ocidental), estresse físico e psicológico, certos medicamentos (p. ex., antimicrobianos) são fatores que favorecem o aumento da permeabilidade intestinal. Um intestino mais permeável propicia a translocação de LPS para a corrente sanguínea (endotoxemia metabólica), favorecendo resistência à insulina, inflamação no tecido adiposo, infiltração tecidual de monócitos/macrófagos, que aumentam o risco de doenças como esteatose hepática, obesidade, diabetes. Assim, parte da resposta inflamatória sistêmica pode ser atribuída à composição do MI.18,19
Em modelo murino de psoríase induzida por imiquimode, a administração oral de Staphylococcus aureus e Streptococcus danieliae levou à inflamação cutânea e ao aumento da expressão de TNF e IL17, subsidiando a hipótese de que a disbiose intestinal possa levar à piora clínica da doença.20
Este estudo investigou, de maneira original, relações entre níveis plasmáticos de LPB, PCRqt, e padrão alimentar em onívoros, vegetarianos e pacientes com psoríase, demonstrando que os níveis de LPB se correlacionaram inversamente com o consumo de fibras. Nessa amostra, os participantes com psoríase apresentaram níveis de LPB maiores que os vegetarianos, levando à hipótese de que a modulação do MI (p. ex., pode meio da dieta) contribua com a redução dos níveis de LPB séricos; portanto, esses achados subsidiam que a saúde intestinal pode ser modulada por meio de escolhas alimentares. Além disso, os níveis de PCRqt foram maiores em PSO, associados à ingesta de carboidratos e LPB. Apesar de a permeabilidade intestinal não ser avaliada de maneira direta, os níveis elevados de LPB e PCRqt podem indicar maior permeabilidade intestinal em pacientes com psoríase.
Pesquisas com níveis séricos de LPB em humanos são escassas, mas existem evidências de que o LPB esteja elevado em pacientes com psoríase, havendo correlação com os níveis de PCRqt. Desse modo, LPB pode ser um indicador de inflamação sistêmica e progressão para síndrome metabólica em pacientes com psoríase.21 É importante ressaltar que, recentemente, o LPB revelou‐se um biomarcador para a permeabilidade intestinal em adultos, independentemente de idade, IMC e gênero.22
Em estudos controlados que analisaram o MI de pacientes com psoríase, utilizando grupos populacionais diversos, foram encontrados achados diferentes.23 Em um estudo israelense que avaliou a diversidade beta em pacientes com psoríase (n=24) em comparação com controles (n=46) sem psoríase, pareados por idade, IMC e comorbidades, identificou‐se aumento significante em Ruminoccocus gnavus, Dorea formicigenerans e Collinsella aerofaciens no MI da psoríase, enquanto Prevotella copri e Parabacteroides distasonis foram significantemente menores em comparação com os controles24 – um padrão algo diverso da estrutura de MI encontrada em nossa amostra.
Outro estudo conduzido na China evidenciou que pacientes com psoríase têm perfis de MI significantemente perturbados, pois ao analisar o MI de 35 pacientes com psoríase e 27 controles, mostrou diferença nas abundâncias relativas de Firmicutes e Bacteroidetes, com aumento de Bacteroides, Actinobacteria e redução de Firmicutes, Proteobacteria e Bifidobacterium.25 Em contrapartida, um estudo espanhol de pacientes com psoríase (n=19), em comparação com um grupo controle saudável (n=20), mostrou menor diversidade bacteriana e diferente abundância relativa de certos táxons bacterianos em pacientes com psoríase, com aumento de Actinobacteria, Firmicutes e redução de Bacteroidetes, Proteobacterias e Fecalibacterium.26
Em uma análise do MI de 52 pacientes com psoríase (PASI ≥ 6) em comparação com população saudável (n=300), evidenciou‐se maior frequência do padrão chamado enterótipo 2, com tendência a apresentar translocação bacteriana mais frequente e maior estado inflamatório (71%) do que outros enterótipos, havendo predomínio de Akkermansia, Faecalibacterium, Ruminococcus e menor proporção de Bacteroidetes.27 Nossa amostra também indicou maiores proporções de Faecalibacterium e Ruminococcus, além de menores índices de Bactroidetes no perfil (PLS) dos pacientes com psoríase.
Recentemente, um estudo conduzido na Argentina demonstrou mudanças na composição do MI dependendo do status da psoríase, com aumento de Firmicutes e depleção de Bacteroidetes em 55 pacientes com psoríase, em comparação com 27 controles. Além disso, os gêneros Faecalibacterium e Blautia foram maiores em pacientes com psoríase, enquanto Bacteroides e Paraprevotella foram maiores em controles sem psoríase.28 Como nossos pacientes estavam em tratamento e a maior parte com PASI <4, não foi possível estratificar o MI de acordo com a gravidade da doença.
Outro estudo de caso‐controle na Ásia Central, com pacientes entre 30 e 45 anos, com psoríase (n=20) e controles (n=20), pareados por idade e sexo, encontrou associação com psoríase e níveis elevados de Firmicutes, Faecalibacterium e abundância reduzida de Oscillibacter e Roseburia, mas não houve diferença na diversidade e relação F/B, bastante alinhado com nossos resultados.29
Um estudo brasileiro mostrou menor diversidade no MI de mulheres com psoríase (n=21) em comparação com controles (n=24), identificando aumento do gênero Dialister e da espécie Prevotella copri sp., mas redução nos gêneros Ruminococcus, Lachnospira, Blautia e nas espécies Akkermansia muciniphila sp.30
No presente estudo, o perfil de MI encontrado nos homens adultos portadores de psoríase foi associado aos descritos em outras comorbidades, como na síndrome metabólica, obesidade e doenças afetivas, o que pode decorrer do estilo de vida ocidental. Ainda de acordo com a literatura, o Coprococcus foi associado a doenças afetivas como depressão, obesidade e má qualidade do sono;31Lachnospira foi associado ao desenvolvimento de diabetes mellitus;32 e Paraprevotella com maior ingestão de gorduras.33 Apesar de haver associação com dietas vegetarianas, Prevotella também é relacionada à elevada ingesta de carboidratos, e como apresenta alta diversidade genética dentro e entre espécies, podem explicar sua descrição tanto em MI saudáveis como em disbióticos; uma carga elevada de Prevotella no MI foi associada à obesidade, resistência à insulina, hipertensão e doença hepática gordurosa não alcoólica.34
A composição do MI de psoríase encontrado nessa amostra se opôs à encontrada nos vegetarianos, ricos em Bacteroides e Lactobacillus, associados à menor permeabilidade intestinal. De fato, a prevalência de psoríase em vegetarianos é excepcional, e a dieta vegetariana leva à melhora de lesões cutâneas da psoríase, o que sugere que a modulação do MI possa subsidiar o desenvolvimento de doenças inflamatórias como a psoríase.35,36
Estudos metagenômicos do MI apresentam alta variabilidade de resultados entre as publicações. Diferenças populacionais étnicas, culturais e alimentares podem explicar os resultados controversos entre os estudos que caracterizaram MI em psoríase.
Assim, ainda não foi definido o que constitui um MI saudável, quando excluídas as bactérias sabidamente patogênicas. Por isso, é essencial destacar que as espécies comensais não devem ser consideradas absolutamente “boas” ou “ruins”, já que todas desempenham funções no ecossistema intestinal. A problemática emerge do desequilíbrio, ou seja, a predominância de grupos de espécies comensais que promovem alterações na permeabilidade intestinal. Além disso, quando se caracteriza o MI de um grupo, pretende‐se entender o padrão de desequilíbrio, apesar de a composição do MI ser única em cada indivíduo, adquirida nos primeiros anos de vida e moldada pelas características ambientais, como os hábitos alimentares, ao longo da vida.37–39
Este estudo apresenta limitações ligadas à amostra modesta, não aleatorizada, o que não impediu a identificação de padrões de MI entre os grupos; além disso, a origem comum quanto ao grupo populacional maximiza a homogeneidade da amostra. O efeito dos tratamentos da psoríase no MI é tema a ser investigado, e nossos participantes utilizaram diversos medicamentos diferentes; entretanto, o uso de adalimumabe não mostrou modificar o padrão de MI em 10 pacientes.40 Nossos participantes ainda apresentavam escores de PASI baixos, decorrente do controle da doença com a terapêutica estabelecida. Na verdade, são necessários estudos de MI com pacientes com psoríase sem tratamento sistêmico. Outro aspecto se refere à amostragem do microbioma fecal, que consiste na flora transitória do cólon, em contrapartida à flora permanente que é ligada à mucosa, menos sujeita a variação. Finalmente, LPB é utilizado como proxy da medida de LPS, em decorrência de sua labilidade. As variações alimentares podem dificultar as comparações entre os grupos, visto que mesmo dentro dos grupos onívoros, vegetarianos e psoríase, existem alimentos que podem atuar de maneira diferente no MI.
Estudos clínicos controlados em psoríase que visem a manipulação do MI, quer com transplante de fezes, intervenções dietéticas (p. ex., adequação de fibras), pró/pré‐bióticos ou sais biliares, devem ser conduzidos para melhor compreensão do papel do MI na atividade clínica da psoríase.
ConclusãoIdentificou‐se diferença no MI de homens adultos brasileiros com psoríase em relação a onívoros e vegetarianos saudáveis. O padrão de MI encontrado correlacionou‐se com a ingesta de fibras alimentares, com os níveis séricos de LPB. Mudanças nos hábitos alimentares podem remodelar o MI, e por consequência, auxiliar no controle clínico da psoríase. Ressalta‐se a necessidade de conscientização da importância nutricional no tratamento da doença e no manejo das comorbidades.
Suporte financeiroFUNADERM ‐ Fundo de Apoio à Dermatologia, da Sociedade Brasileira de Dermatologia.
Contribuição dos autoresHélio Amante Miot: Concepção do estudo; análise dos resultados; escrita do texto; revisão e aprovação do texto final.
Tatiana Cristina Figueira Polo: Concepção do estudo; coleta de dados; análise dos resultados; escrita do texto; revisão e aprovação do texto final.
Mariana Righetto de Ré Lai: Concepção do estudo; coleta de dados; análise dos resultados; escrita do texto; revisão e aprovação do texto final.
Luciane Donida Bartoli Miot: Coleta de dados; revisão e aprovação do texto final.
Giovana Fernanda Cosi Bento: Análise dos resultados; revisão e aprovação do texto final.
Márcia Guimarães da Silva: Revisão e aprovação do texto final.
Silvio Alencar Marques: Revisão e aprovação do texto final.
Conflito de interessesNenhum.
Como citar este artigo: Polo TCF, Lai MRR, Miot LDB, Bento GFC, Silva MG, Marques SA, Miot HA. Intestinal microbiome characterization of adult Brazilian men with psoriasis compared to omnivore and vegetarian controls. An Bras Dermatol. 2023;98:635–43.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.