A hanseníase é doença infectocontagiosa causada pela Mycobacterium leprae e caracterizada, principalmente, por lesões de pele e nervos periféricos. No Brasil, é problema de saúde pública devido à sua alta endemicidade. Entretanto, o estado do Rio Grande do Sul apresenta baixa endemicidade.
ObjetivoCaracterizar o perfil epidemiológico da hanseníase no estado do Rio Grande do Sul no período de 2000 a 2019.
MétodosEstudo observacional retrospectivo. Os dados epidemiológicos foram coletados do Sistema de Informação de Agravos de Notificação (SINAN).
ResultadosDos 497 municípios do estado, 357 (71,8%) registraram casos de hanseníase no período, com média de 212 (81,5%) casos novos ao ano. A taxa média de detecção foi de 1,61 casos novos por 100 mil habitantes. O sexo masculino foi o predominante (51,9%), e a média de idade foi de 50,4 anos. Em relação ao perfil clínico epidemiológico; 79,0% dos registros eram casos multibacilares; 37,5% com forma clínica dimorfa; 16% apresentavam grau 2 de incapacidade física no diagnóstico e a baciloscopia foi positiva em 35,4% dos casos. No tratamento, 73,8% dos casos foram tratados com esquema terapêutico multibacilar padrão.
Limitações do estudoDados faltantes/inconsistentes na base de dados utilizada.
ConclusõesAs características observadas neste estudo mostraram que o estado apresenta perfil de baixa endemicidade da doença e os resultados poderão subsidiar políticas de saúde adequadas e pertinentes à realidade do Rio Grande do Sul, inserido em cenário nacional de alta endemia.
A hanseníase é doença infectocontagiosa causada por Mycobacterium leprae, que se caracteriza principalmente por lesões de pele e nervos periféricos. O avanço da doença pode ocasionar lesões em outros órgãos, como fígado, rins, linfonodos, testículos, olhos e glândulas linfáticas.1,2
Os primeiros registros na história foram em 600 a.C. na China, e sua primeira descrição clínica se deu no século III a.C.3,4 A hanseníase é doença de distribuição mundial que ainda causa preconceito; os pacientes passam por sofrimento psicológico e o são vistos com desaprovação pela população em geral.1–4 A partir da introdução da poliquimioterapia com possibilidade de cura, em 1982, houve redução significante no número de casos de hanseníase.4 Em 1991, a Organização Mundial de Saúde (OMS), na 44ª sessão da Assembleia Mundial de Saúde, propôs a aprovação da resolução que estabelecia como meta a eliminação da hanseníase como problema de saúde pública até o ano 2000. Para que a meta acontecesse, era necessário que a prevalência da doença fosse menor que um caso por 10 mil habitantes.5,6
A Índia é o país que apresenta maior número de casos de hanseníase no mundo. O Brasil está em segundo lugar, por conta de sua alta endemicidade.4,7,8 No período de 2010 a 2019, ocorreram 301.638 novos casos no país.9 A taxa de detecção apresentou redução de 37% ao longo do tempo e, em 2019, foi de 13,23 casos por 100 mil habitantes. Nas regiões Norte, Nordeste e Centro‐Oeste do Brasil, o parâmetro é de alta endemicidade, enquanto as regiões Sul e Sudeste apresentam parâmetro médio. Rio Grande do Sul e Santa Catarina são classificados como estados de baixa endemicidade.9 Para classificação de parâmetros de endemicidade, devem‐se considerar as seguintes taxas por 100 mil habitantes:> 40,00 casos (hiperendêmico); 20,00 a 39,99 casos (muito alto); 10,00 a 19,99 casos (alto); 2,00 a 9,99 casos (médio) e <2,00 casos (baixo).2
Segundo o último censo, realizado em 2010, o estado do Rio Grande do Sul tem população de 10.693.929 pessoas, distribuídas em 497 municípios; cerca de 15% residem em zonas rurais, e o índice de desenvolvimento humano é de 0,746.10 O Rio Grande do Sul, ao longo do período de 2010 a 2019, permaneceu como estado de baixa endemicidade, registrando em média 1,16 casos de hanseníase por 100 mil habitantes.2 A classificação de baixa endemicidade não deve ser considerada situação de conforto e resolução da doença; é necessário observar outros parâmetros, como ocorrência de casos em indivíduos menores de 15 anos,11,12 forma clínica da doença, proporção de grau de incapacidade física no diagnóstico e proporção de casos curados.2 Também é preciso conhecer a rede de atenção à saúde das pessoas com hanseníase, sua cobertura e capacidade para diagnóstico, tratamento, avaliação de contatos e seguimento após o tratamento, quando necessário. Atualmente, as ofertas de serviços são resposta às demandas eminentes e, portanto, doenças que aparentemente estão em controle e com menor ocorrência acabam negligenciadas em suas políticas.
O presente estudo teve como objetivo caracterizar o perfil epidemiológico da hanseníase no estado do Rio Grande do Sul e relacionar elementos que contribuam na aproximação de políticas públicas à realidade de nossa situação enquanto estado de baixa endemicidade de casos da doença.
MétodosEstudo observacional retrospectivo realizado no estado do Rio Grande do Sul, Brasil, no período de 2000 a 2019.
Os dados epidemiológicos foram coletados do Sistema de Informação de Agravos de Notificação (SINAN) em julho de 2020 e disponibilizados pelo Centro Estadual de Vigilância em Saúde do Estado do Rio Grande do Sul. As informações sobre a população do estado foram obtidas por meio do Censo Demográfico de 2010, o último realizado até o momento da publicação do estudo, pelo Instituto Brasileiro de Geografia e Estatística (IBGE). As taxas de detecção e prevalência apresentadas seguiram o padrão recomendado pelo Ministério da Saúde, que são coeficiente de detecção por 100.000 habitantes e coeficiente de prevalência por 10.000 habitantes.2
O tratamento de dados foi realizado por meio de banco de dados em planilha Excel 365 com indicadores sociodemográficos (sexo, faixa etária, raça/cor da pele, escolaridade, tipo de residência) e indicadores clínicos epidemiológicos (classificação operacional, classificação clínica, modo de entrada, modo de detecção, grau de incapacidade física, baciloscopia e terapêutica). Para cálculo das taxas de detecção e taxas de prevalência, conforme diretrizes do Ministério da Saúde,2 foram considerados apenas os casos classificados como “caso novo” no modo de entrada do caso. Os outros indicadores sociodemográficos e clínicos foram analisados com a totalidade dos casos, independente do modo de entrada.
As análises estatísticas foram realizadas usando o software Statistical Package for the Social Sciences 26 (SPSS). As medidas estatísticas descritivas utilizadas foram taxas, frequência, porcentagem, média e desvio padrão. As análises bivariadas foram realizadas por meio do teste Qui‐quadrado para variáveis categóricas, utilizando‐se o nível de significância estatística de 5% (bilateral).
O projeto de pesquisa foi submetido ao Comitê de Ética em Pesquisa do Hospital de Clínicas de Porto Alegre (CAAE: 31959120.6.0000.5327) e ao Comitê de Ética da Escola de Saúde Pública do Rio Grande do Sul (CAAE: 3195120.6.5312), e aprovado conforme pareceres 4.075.445 e 4.121.621, respectivamente, respeitando as Resoluções 466/12 e 510/16 do Conselho Nacional de Saúde, que regulamentam a pesquisa com seres humanos.
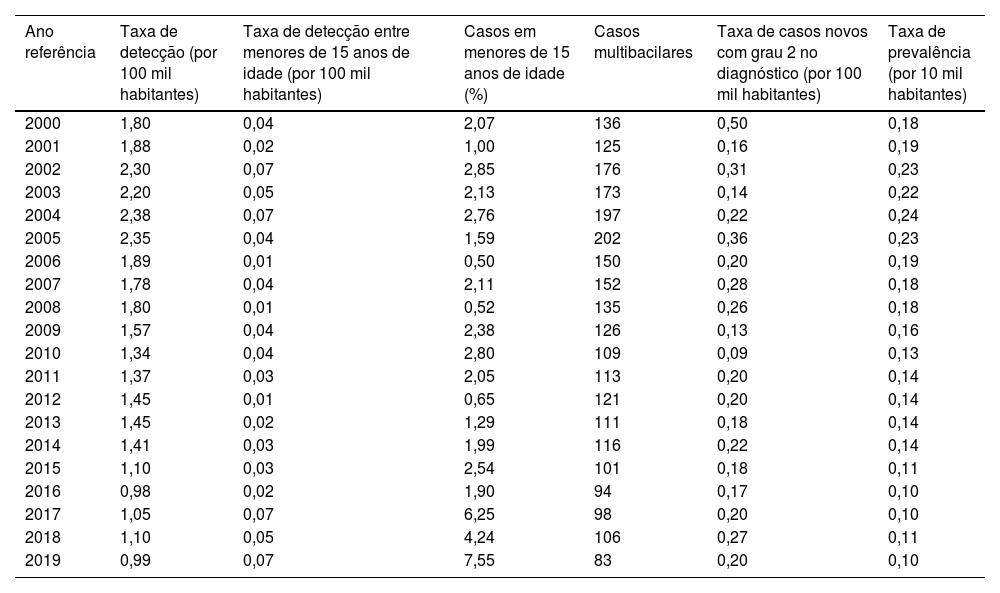
ResultadosNo período de 2000 a 2019, o Rio Grande do Sul teve média de 212 casos ao ano, dos quais 81,6% (n=3.442) foram novos casos. A taxa média de detecção de novos casos foi de 1,61 casos por 100 mil habitantes/ano. Entre menores de 15 anos, essa taxa foi de 0,04 casos por 100 habitantes/ano, correspondendo, em média, a 2,48% do total de novos casos no intervalo estudado. A taxa de prevalência da hanseníase neste estudo sempre foi inferior a um caso por 10 mil habitantes; a média foi de 0,16 casos por 10 mil habitantes (tabela 1). Ao longo do período, a média de novos casos classificados como multibacilares foi de 131,2. Assim, em média, 76,2% dos diagnósticos realizados ao ano, no período estudado, foram multibacilares. A taxa do grau de incapacidade física visível (grau 2), já presente no diagnóstico, oscilou entre 0,09 e 0,50 casos por 100 mil habitantes. Em média, a taxa foi de 0,22 casos por 100 mil habitantes/ano (tabela 1).
Indicadores de controle da hanseníase, do Rio Grande do Sul, conforme o Ministério da Saúde do Brasil, distribuídos por ano, no período 2000‐2019
| Ano referência | Taxa de detecção (por 100 mil habitantes) | Taxa de detecção entre menores de 15 anos de idade (por 100 mil habitantes) | Casos em menores de 15 anos de idade (%) | Casos multibacilares | Taxa de casos novos com grau 2 no diagnóstico (por 100 mil habitantes) | Taxa de prevalência (por 10 mil habitantes) |
|---|---|---|---|---|---|---|
| 2000 | 1,80 | 0,04 | 2,07 | 136 | 0,50 | 0,18 |
| 2001 | 1,88 | 0,02 | 1,00 | 125 | 0,16 | 0,19 |
| 2002 | 2,30 | 0,07 | 2,85 | 176 | 0,31 | 0,23 |
| 2003 | 2,20 | 0,05 | 2,13 | 173 | 0,14 | 0,22 |
| 2004 | 2,38 | 0,07 | 2,76 | 197 | 0,22 | 0,24 |
| 2005 | 2,35 | 0,04 | 1,59 | 202 | 0,36 | 0,23 |
| 2006 | 1,89 | 0,01 | 0,50 | 150 | 0,20 | 0,19 |
| 2007 | 1,78 | 0,04 | 2,11 | 152 | 0,28 | 0,18 |
| 2008 | 1,80 | 0,01 | 0,52 | 135 | 0,26 | 0,18 |
| 2009 | 1,57 | 0,04 | 2,38 | 126 | 0,13 | 0,16 |
| 2010 | 1,34 | 0,04 | 2,80 | 109 | 0,09 | 0,13 |
| 2011 | 1,37 | 0,03 | 2,05 | 113 | 0,20 | 0,14 |
| 2012 | 1,45 | 0,01 | 0,65 | 121 | 0,20 | 0,14 |
| 2013 | 1,45 | 0,02 | 1,29 | 111 | 0,18 | 0,14 |
| 2014 | 1,41 | 0,03 | 1,99 | 116 | 0,22 | 0,14 |
| 2015 | 1,10 | 0,03 | 2,54 | 101 | 0,18 | 0,11 |
| 2016 | 0,98 | 0,02 | 1,90 | 94 | 0,17 | 0,10 |
| 2017 | 1,05 | 0,07 | 6,25 | 98 | 0,20 | 0,10 |
| 2018 | 1,10 | 0,05 | 4,24 | 106 | 0,27 | 0,11 |
| 2019 | 0,99 | 0,07 | 7,55 | 83 | 0,20 | 0,10 |
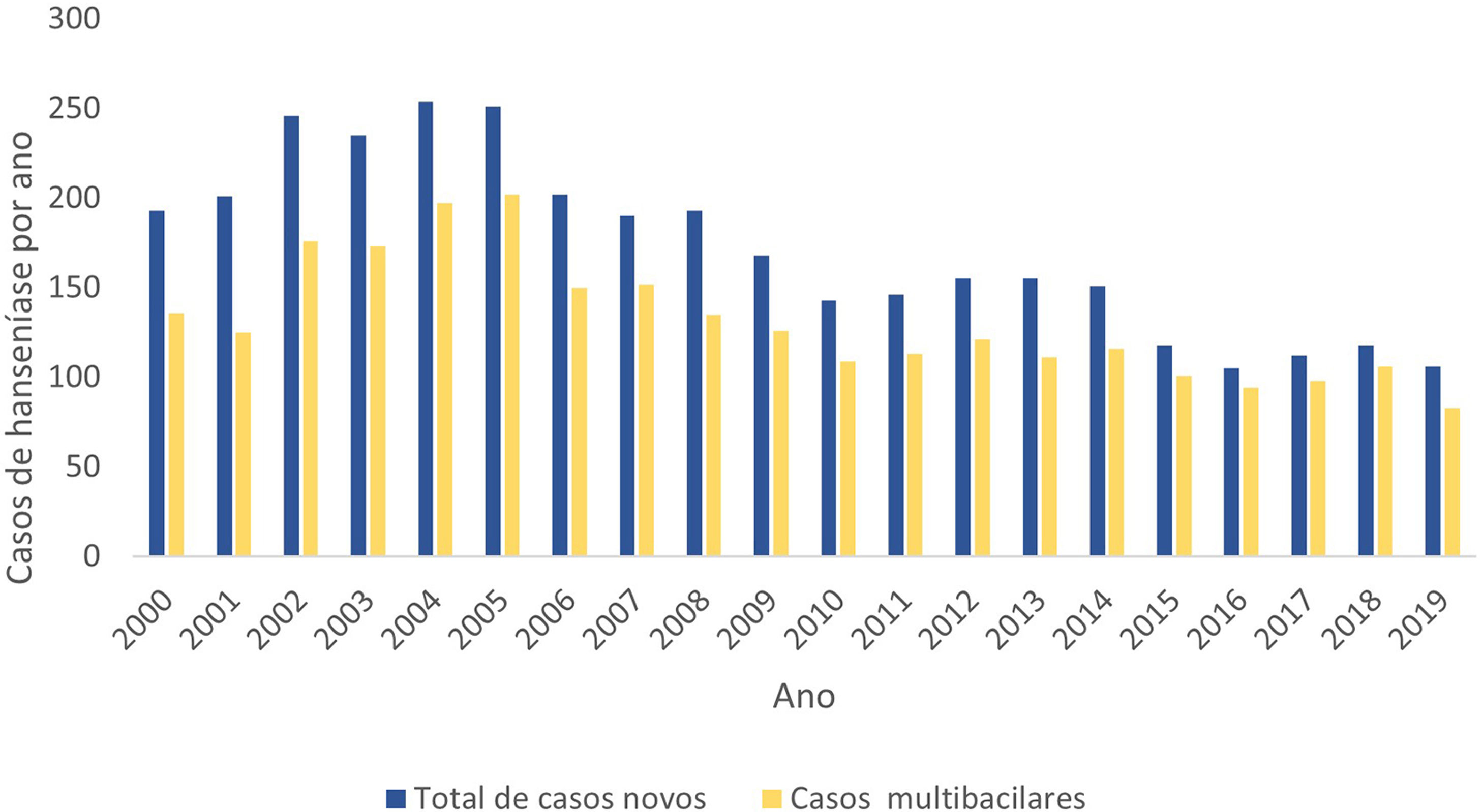
O período de maiores registros neste recorte foi de 2000 até 2006, com média de 226 casos novos ao ano. A partir de 2007, houve início de tendência de queda no número de novos casos, inferiores a 200 novos casos/ano, com média de 162,6 novos casos/ano até 2014, representando redução de 38,4%. A partir de 2015, até 2019, essa queda aumentou para 50,5%, comparado ao período entre 2000 e 2006. A partir de 2006, houve certa estabilidade nos registros de casos novos, que se manteve na média de 112 casos ao ano até 2019. O predomínio foi de casos multibacilares, forma clínica presente no mínimo em 69% dos casos/ano (fig. 1).
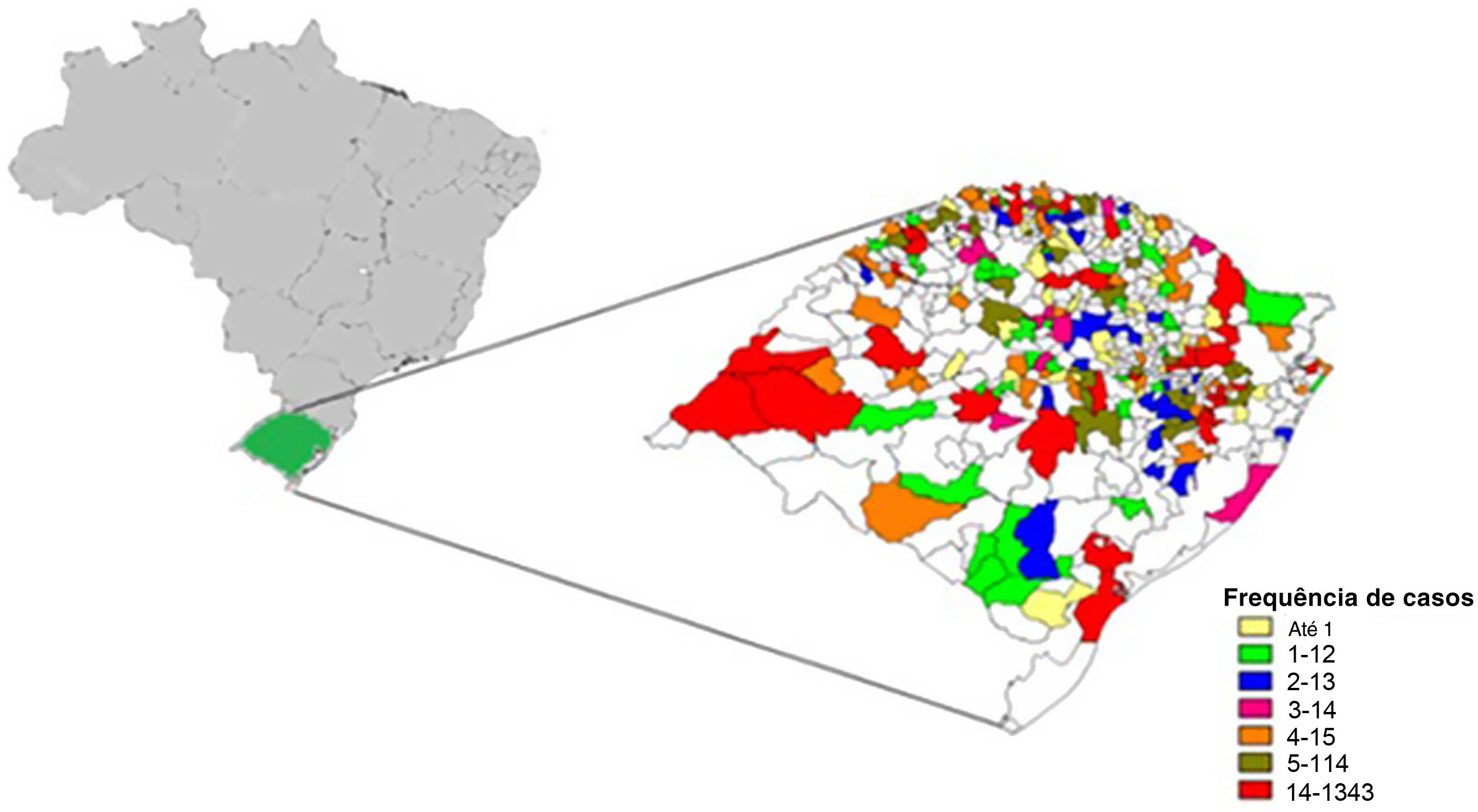
De um total de 497 municípios, 357 (71,9%) tiveram registro de casos de hanseníase. Os municípios com maior número de casos em seus residentes foram, em ordem decrescente, Porto Alegre (n=342), São Borja (n=212) e Uruguaiana (n=193) (fig. 2).
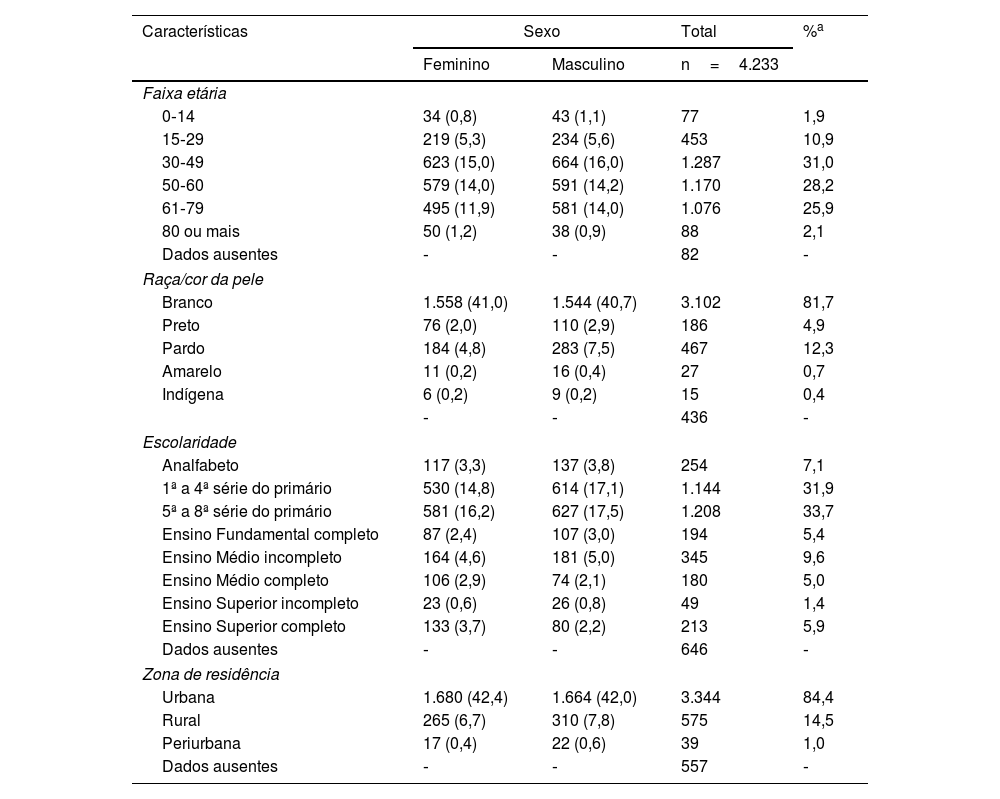
O sexo predominante foi o masculino (51,9%), e a média geral de idade foi de 50,4 anos (DP=16,2); nessa variável, não houve diferença em relação ao gênero. Quando analisada a cor da pele, foi predominante a branca (81,7%). O índice de analfabetismo foi de 7,1%, observando‐se que 72,7% dos pacientes não tinham o Ensino Fundamental completo no momento do diagnóstico. A maioria dos pacientes residia em área urbana (84,3%) (tabela 2).
Perfil sociodemográfico da hanseníase no período 2000‐2019, segundo sexo, no estado do Rio Grande do Sul, Brasil
| Características | Sexo | Total | %a | |
|---|---|---|---|---|
| Feminino | Masculino | n=4.233 | ||
| Faixa etária | ||||
| 0‐14 | 34 (0,8) | 43 (1,1) | 77 | 1,9 |
| 15‐29 | 219 (5,3) | 234 (5,6) | 453 | 10,9 |
| 30‐49 | 623 (15,0) | 664 (16,0) | 1.287 | 31,0 |
| 50‐60 | 579 (14,0) | 591 (14,2) | 1.170 | 28,2 |
| 61‐79 | 495 (11,9) | 581 (14,0) | 1.076 | 25,9 |
| 80 ou mais | 50 (1,2) | 38 (0,9) | 88 | 2,1 |
| Dados ausentes | ‐ | ‐ | 82 | ‐ |
| Raça/cor da pele | ||||
| Branco | 1.558 (41,0) | 1.544 (40,7) | 3.102 | 81,7 |
| Preto | 76 (2,0) | 110 (2,9) | 186 | 4,9 |
| Pardo | 184 (4,8) | 283 (7,5) | 467 | 12,3 |
| Amarelo | 11 (0,2) | 16 (0,4) | 27 | 0,7 |
| Indígena | 6 (0,2) | 9 (0,2) | 15 | 0,4 |
| ‐ | ‐ | 436 | ‐ | |
| Escolaridade | ||||
| Analfabeto | 117 (3,3) | 137 (3,8) | 254 | 7,1 |
| 1ª a 4ª série do primário | 530 (14,8) | 614 (17,1) | 1.144 | 31,9 |
| 5ª a 8ª série do primário | 581 (16,2) | 627 (17,5) | 1.208 | 33,7 |
| Ensino Fundamental completo | 87 (2,4) | 107 (3,0) | 194 | 5,4 |
| Ensino Médio incompleto | 164 (4,6) | 181 (5,0) | 345 | 9,6 |
| Ensino Médio completo | 106 (2,9) | 74 (2,1) | 180 | 5,0 |
| Ensino Superior incompleto | 23 (0,6) | 26 (0,8) | 49 | 1,4 |
| Ensino Superior completo | 133 (3,7) | 80 (2,2) | 213 | 5,9 |
| Dados ausentes | ‐ | ‐ | 646 | ‐ |
| Zona de residência | ||||
| Urbana | 1.680 (42,4) | 1.664 (42,0) | 3.344 | 84,4 |
| Rural | 265 (6,7) | 310 (7,8) | 575 | 14,5 |
| Periurbana | 17 (0,4) | 22 (0,6) | 39 | 1,0 |
| Dados ausentes | ‐ | ‐ | 557 | ‐ |
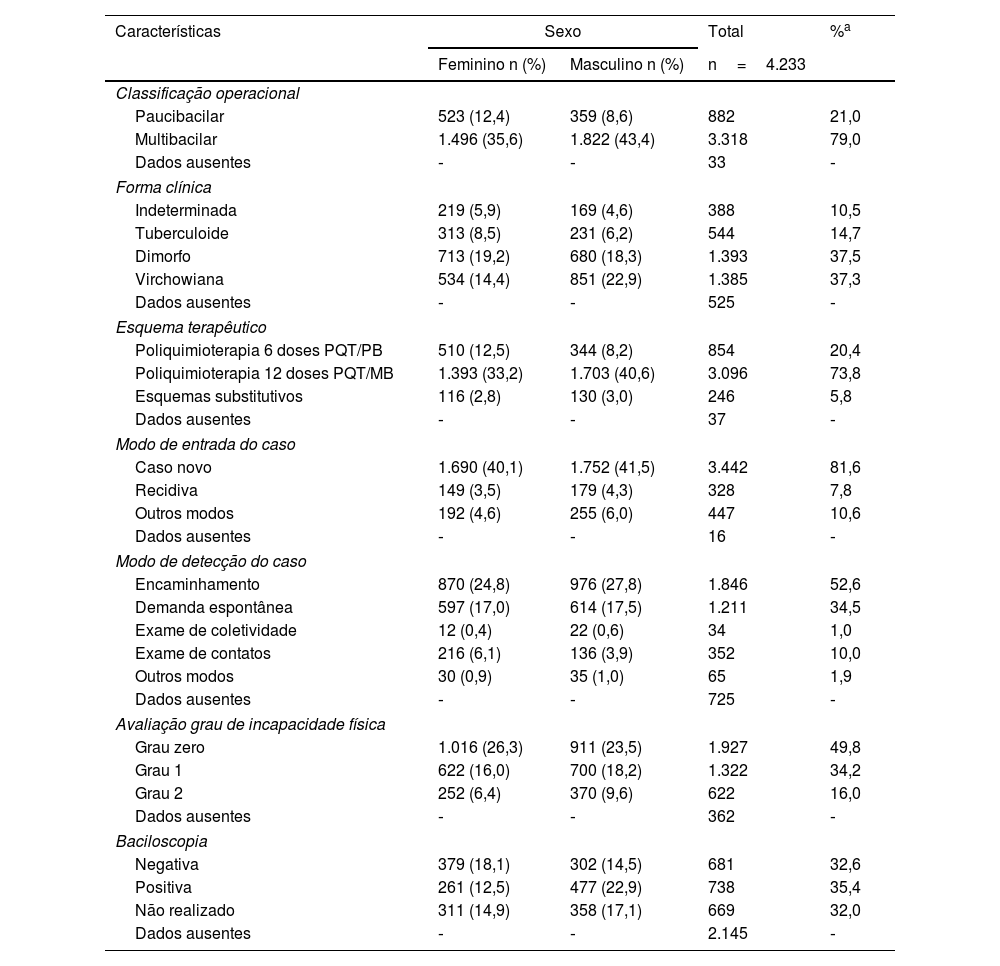
A maior parte dos casos de hanseníase no período foi classificada como multibacilar (79,0%); o sexo masculino foi responsável por 43,4% desses casos. A forma clínica predominante foi a dimorfa (37,5%); o sexo feminino foi o mais prevalente (19,2%). O modo de entrada dos casos, em quase sua totalidade (81,6%), foi de casos novos. As recidivas representaram 7,8% da amostra; em 52,6% dessas, o modo de detecção foi o encaminhamento. Em 16% dos casos já havia grau de incapacidade física visível, grau 2, no diagnóstico, e o sexo masculino foi o mais afetado. A baciloscopia foi realizada em 68% dos casos diagnosticados, com resultado positivo em 35,4% dos exames (tabela 3).
Perfil clínico epidemiológico da hanseníase no período 2000‐2019, segundo sexo, no estado do Rio Grande do Sul, Brasil
| Características | Sexo | Total | %a | |
|---|---|---|---|---|
| Feminino n (%) | Masculino n (%) | n=4.233 | ||
| Classificação operacional | ||||
| Paucibacilar | 523 (12,4) | 359 (8,6) | 882 | 21,0 |
| Multibacilar | 1.496 (35,6) | 1.822 (43,4) | 3.318 | 79,0 |
| Dados ausentes | ‐ | ‐ | 33 | ‐ |
| Forma clínica | ||||
| Indeterminada | 219 (5,9) | 169 (4,6) | 388 | 10,5 |
| Tuberculoide | 313 (8,5) | 231 (6,2) | 544 | 14,7 |
| Dimorfo | 713 (19,2) | 680 (18,3) | 1.393 | 37,5 |
| Virchowiana | 534 (14,4) | 851 (22,9) | 1.385 | 37,3 |
| Dados ausentes | ‐ | ‐ | 525 | ‐ |
| Esquema terapêutico | ||||
| Poliquimioterapia 6 doses PQT/PB | 510 (12,5) | 344 (8,2) | 854 | 20,4 |
| Poliquimioterapia 12 doses PQT/MB | 1.393 (33,2) | 1.703 (40,6) | 3.096 | 73,8 |
| Esquemas substitutivos | 116 (2,8) | 130 (3,0) | 246 | 5,8 |
| Dados ausentes | ‐ | ‐ | 37 | ‐ |
| Modo de entrada do caso | ||||
| Caso novo | 1.690 (40,1) | 1.752 (41,5) | 3.442 | 81,6 |
| Recidiva | 149 (3,5) | 179 (4,3) | 328 | 7,8 |
| Outros modos | 192 (4,6) | 255 (6,0) | 447 | 10,6 |
| Dados ausentes | ‐ | ‐ | 16 | ‐ |
| Modo de detecção do caso | ||||
| Encaminhamento | 870 (24,8) | 976 (27,8) | 1.846 | 52,6 |
| Demanda espontânea | 597 (17,0) | 614 (17,5) | 1.211 | 34,5 |
| Exame de coletividade | 12 (0,4) | 22 (0,6) | 34 | 1,0 |
| Exame de contatos | 216 (6,1) | 136 (3,9) | 352 | 10,0 |
| Outros modos | 30 (0,9) | 35 (1,0) | 65 | 1,9 |
| Dados ausentes | ‐ | ‐ | 725 | ‐ |
| Avaliação grau de incapacidade física | ||||
| Grau zero | 1.016 (26,3) | 911 (23,5) | 1.927 | 49,8 |
| Grau 1 | 622 (16,0) | 700 (18,2) | 1.322 | 34,2 |
| Grau 2 | 252 (6,4) | 370 (9,6) | 622 | 16,0 |
| Dados ausentes | ‐ | ‐ | 362 | ‐ |
| Baciloscopia | ||||
| Negativa | 379 (18,1) | 302 (14,5) | 681 | 32,6 |
| Positiva | 261 (12,5) | 477 (22,9) | 738 | 35,4 |
| Não realizado | 311 (14,9) | 358 (17,1) | 669 | 32,0 |
| Dados ausentes | ‐ | ‐ | 2.145 | ‐ |
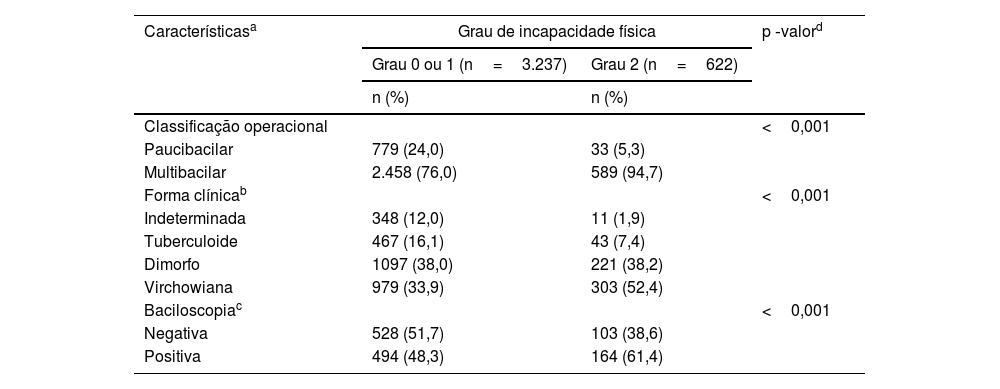
Na análise bivariada, foi encontrada associação (p ≤ 0,001) entre classificação multibacilar e graus de incapacidade física 2, mesmo fato verificado para as formas clínicas dimorfa e virchowiana (p ≤ 0,001). Em relação à baciloscopia, também foi encontrada associação significante (p ≤ 0,001) com os graus de incapacidade física 2 (tabela 4).
Distribuição quantitativa cruzada, relacionando as características: classificação operacional, formas clínicas e baciloscopia com grau de incapacidade física da hanseníase, no período de 2000‐2019, no estado do Rio Grande do Sul, Brasil
| Característicasa | Grau de incapacidade física | p ‐valord | |
|---|---|---|---|
| Grau 0 ou 1 (n=3.237) | Grau 2 (n=622) | ||
| n (%) | n (%) | ||
| Classificação operacional | <0,001 | ||
| Paucibacilar | 779 (24,0) | 33 (5,3) | |
| Multibacilar | 2.458 (76,0) | 589 (94,7) | |
| Forma clínicab | <0,001 | ||
| Indeterminada | 348 (12,0) | 11 (1,9) | |
| Tuberculoide | 467 (16,1) | 43 (7,4) | |
| Dimorfo | 1097 (38,0) | 221 (38,2) | |
| Virchowiana | 979 (33,9) | 303 (52,4) | |
| Baciloscopiac | <0,001 | ||
| Negativa | 528 (51,7) | 103 (38,6) | |
| Positiva | 494 (48,3) | 164 (61,4) | |
O Rio Grande do Sul é estado com baixa endemicidade para casos de hanseníase. No entanto, no período estudado, em mais de 70% de seus municípios houve, no mínimo, um caso registrado. Em relação ao sexo, em outros estudos também foi relatado, com pequena alteração percentual, o predomínio do sexo masculino.13,14 Na África Central, em Ruanda, foi realizado estudo com número menor de casos (77 pacientes), no qual verificou‐se que 75% dos pacientes eram do sexo masculino.15 Entretanto, outros autores encontraram em sua análise predomínio do sexo feminino,16–18 indicando que há variação de gênero conforme o tempo e o local. Em relação às faixas etárias, houve prevalência da faixa entre os 30 a 60 anos (59,2% dos casos), que constitui a faixa etária economicamente ativa. O predomínio de casos nessa faixa etária, entre os 30 e 60 anos, e da cor da pele branca, está de acordo com dados encontrados na literatura.16,19–21
O predomínio da pele branca, em nosso estudo, não deve ser considerado geral para a doença, pois esse dado está mais relacionado com as características étnico‐raciais da região Sul do Brasil. No Rio Grande do Sul, segundo o IBGE, em 2013; 85,9% dos entrevistados se autodeclararam de cor branca. Assim, é esperado que essa cor de pele tenha predomínio nos casos de hanseníase no estado.22 Em outros estudos, a cor da pele predominante foi a parda, enquanto a zona de residência e faixa etária economicamente ativa foram semelhantes aos nossos dados.23–26
A faixa etária seguinte com maior número de casos foi entre 61 e 79 anos (25,9%), o que pode indicar tempo longo de doença e diagnóstico tardio. Nessa faixa etária, a hanseníase pode estar associada a comorbidades; é necessário observar a ocorrência de outras doenças e interações medicamentosas.26,27
Quanto à escolaridade, a não conclusão do Ensino Fundamental foi semelhante a encontrada em outros estudos.16,19–21,23 Em relação à moradia; 84,3% dos pacientes residiam em área urbana, dados que corroboram com as características populacionais do estado do Rio Grande do Sul, onde somente 15% das pessoas residem em áreas rurais.10 As variáveis sociodemográficas são semelhantes em diferentes regiões do Brasil, com predomínio do sexo masculino, faixa etária economicamente ativa, baixa escolaridade e residência urbana, constatada apenas certa variação na cor da pele conforme a região.16,19–21,23
Houve predomínio de casos classificados como multibacilares; somente 21% dos casos foram paucibacilares, corroborando com os dados da literatura.16,19,21 Todavia, em regiões endêmicas, há estudos em que a maioria dos casos foi classificada como paucibacilar.20,28 A classificação operacional se mostrou dado consolidado no SINAN, pois somente em 0,7% (n=33) dos registros esse dado foi ausente. No entanto, em nosso trabalho, as formas clínicas indeterminada e tuberculoide, que são incluídas na classificação paucibacilar, representaram 25,2% dos casos quando unidas, enquanto essa classificação foi realizada em apenas 21,0% dos casos. Isso demonstra incoerência no registro dos dados. Em parte, essa ocorrência pode ser explicada pelos tratamentos substitutivos, que foram realizados em 5,8% dos casos da amostra total. Porém, observamos que mudanças de tratamento podem ocorrer em todas as formas clínicas da doença.28,29 Outras possibilidades são a inadequada transposição de informações ao SINAN e erros no preenchimento dos dados pelos profissionais que realizaram o diagnóstico. O SINAN ainda apresenta limitações em relação à padronização dos registros, duplicidade de casos e ausência de informações. Apesar disso, é fonte importante de informações para doenças de notificação obrigatória no Brasil. Essas situações de inconsistências nos dados são de difícil verificação diante do modelo do presente estudo.
Quanto ao esquema terapêutico, o multibacilar padrão foi realizado em 73,8% dos casos; para 5,8% dos casos de hanseníase, foi indicado o esquema terapêutico substitutivo, no início do tratamento, o que pode sinalizar comorbidades prévias, baixo peso e intolerância prévia a um dos medicamentos da poliquimioterapia. Entretanto, não foi possível definir o motivo da escolha do tratamento substitutivo, uma vez que o SINAN não coleta esse dado. Em outros estudos, o principal fármaco que gera mudança no tratamento padrão é a dapsona, que apresenta efeitos colaterais como anemia hemolítica, alterações hepáticas e problemas gastrintestinais, que geralmente se manifestam nos primeiros quatro meses de tratamento.29–31
Em relação ao modo de entrada dos casos, foi verificado o baixo número de casos diagnosticados por meio de avaliação de contatos (10,0%). Existem estudos que indicam que para um caso índice há chance de até 2,8 vezes da possibilidade de diagnóstico de novos casos entre os contatos.32,33 A falta de avaliação de contatos é um dos fatores que podem explicar o elevado número de casos com grau de incapacidade física instalada no diagnóstico (50,2%), indicador importante de diagnóstico tardio e riscos para incapacidades e sequelas, tanto físicas quanto emocionais.3,19,20,25
A baciloscopia foi realizada na maior parte dos casos (68%) nos quais esse dado foi informado, e sua principal finalidade é determinar a classificação da hanseníase. Quando positiva, indica caso multibacilar, mas se negativa, não permite o descarte do diagnóstico, e não é obrigatória a realização do exame para o diagnóstico da doença.2 Além disso, alguns pacientes multibacilares não apresentam baciloscopia positiva, mesmo virgens de tratamento. Cavalcanti et al. (2012) mostraram que a concordância do resultado da baciloscopia e da classificação operacional ocorreu em apenas 30% dos casos; porém, mesmo assim, o exame contribui positivamente para identificar casos limítrofes. Nessas situações, o uso somente da classificação clínica, pelo número de lesões, levaria casos multibacilares a serem erroneamente classificados e tratados como paucibacilares.2,34 A baciloscopia também auxilia no monitoramento ao término de tratamento, possibilitando comparar o índice bacilar do início do tratamento e do seu término.2 Ressaltamos que, no estado do Rio Grande do Sul, esse exame só é realizado no centro de referência estadual para hanseníase, o Ambulatório de Dermatologia Sanitária, localizado em Porto Alegre.
Ao longo dos 20 anos estudados, o comportamento epidemiológico da hanseníase no estado do Rio Grande do Sul foi de baixa endemicidade, com exceção entre os anos de 2002 e 2005. A partir de 2006, a taxa de detecção anual sempre foi menor que dois casos por 100 mil habitantes.2,35 A taxa de prevalência nesse período sempre foi inferior a um caso por 10 mil habitantes. Assim, a magnitude da hanseníase foi baixa, e esses dados sugerem estabilidade no comportamento da doença ao longo do período estudo, associado ao comportamento em menores de 15 anos, que apresentaram média de 0,04 casos por 100 mil habitantes.2 Entretanto, é necessário avaliar o grau de incapacidade física e o número de casos multibacilares, que podem indicar indiretamente a transmissão da doença e a realização de diagnósticos precoces.2,36,37
A associação (p <0,001) da classificação operacional multibacilar com o grau de incapacidade física 1 ou 2 sugere que os pacientes multibacilares têm maior probabilidade de desenvolver grau de incapacidade física e que os diagnósticos precoces, nas formas paucibacilares, são modo de proteção para a instalação dessas incapacidades.38–40 Em nossa pesquisa, 94,7% dos casos com grau 2 de incapacidade física ao diagnóstico eram multibacilares, sugerindo diagnóstico tardio, possibilidade de continuidade de transmissão da doença e possibilidade de surtos reacionais ou sequelas.24,38 Ressaltamos, ainda, que o Rio Grande do Sul, conforme dados do Ministério da Saúde, é o estado que apresenta o maior índice de incapacidade física grau 1 e 2, confirmando o diagnóstico tardio no território gaúcho.8,9
A associação (p <0,001) entre baciloscopia positiva e grau 2 de incapacidade física ressalta que a combinação desses dois fatores, ao diagnóstico, pode ser determinante para tratamento com episódios de surtos reacionais e riscos físicos ou sequelas.41,42 Incapacidades físicas e sequelas acarretam preconceito e distanciamento social, o que aumenta a possibilidade de abandono de tratamento e/ou necessidade de acompanhamentos pós‐alta.3
ConclusãoDe acordo com o perfil clínico‐epidemiológico da hanseníase no período de 2000 a 2019, o estado do Rio Grande do Sul apresenta baixa endemicidade. Entretanto, diante de outras demandas em saúde como tuberculose, dengue, hepatites e HIV/AIDS, a hanseníase passa despercebida pelas políticas públicas. Não existe rede de cuidado apropriada, assim como centros regionalizados para investigação, diagnóstico e tratamento da doença, e o estado conta apenas com um centro de referência.
Nesse contexto, observamos elevado número de casos multibacilares com grau de incapacidade física já presente no diagnóstico, baciloscopia positiva e baixo número de diagnósticos de hanseníase nos contatos avaliados. Além disso, o número elevado de diagnósticos com grau de incapacidade visível (grau 2) e casos multibacilares podem sugerir a existência de casos ocultos em nosso estado, os quais, de certo modo, são dados esperados para localidades em baixa endemicidade ou em eliminação da doença. Um ponto positivo observado em nosso estudo foi o número reduzido de casos de hanseníase em menores de 15 anos, indicador importante para medir o nível de endemicidade da doença elencado pelo Ministério da Saúde do Brasil.
É necessário ampliar a discussão dos números de casos identificados ao ano, da existência de casos ocultos, do desconhecimento da doença pelos profissionais de saúde e das desinformações da comunidade sobre a doença, para o fortalecimento da autoestima dos portadores de hanseníase e sensibilização dos gestores em saúde pública para ações voltadas buscando visibilidade da doença.
A realização de perfis epidemiológicos em regiões de baixa endemicidade é ação que permite ampliar discussões sobre diagnóstico tardio, incapacidades físicas e autocuidado, principalmente após o diagnóstico e tratamento, possibilitando ainda conhecer o comportamento da doença e seus agravos.
Em doenças com prevalência heterogênea entre regiões, como o caso da hanseníase, é conhecido que as regiões que apresentam maior incidência e prevalência recebem o foco das ações e atenção dos programas nacionais de controle da doença.
É nosso dever, como pesquisadores em saúde pública, chamar a atenção para a hanseníase, que faz parte do grupo de doenças negligenciadas e que não pode ser esquecida enquanto problema de saúde pública no estado do Rio Grande do Sul. Espera‐se que os resultados encontrados nesta pesquisa subsidiem políticas de saúde adequadas e estratégias públicas pertinentes à realidade de baixa endemicidade do Rio Grande do Sul, inserido em cenário brasileiro de alta endemia.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Cezar de Moraes: Análise estatística; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Letícia Maria Eidt: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Alessandra Koehler: Elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Leonardo Girardi Ransan: Revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Maria Lúcia Scroferneker: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Moraes PC, Edit LM, Koehler A, Ransan LG, Scrofeneker ML. Epidemiological characteristics of leprosy from 2000 to 2019 in a state with low endemicity in southern Brazil. An Bras Dermatol. 2023;98:602–10.
Trabalho realizado no Departamento de Dermatologia Sanitária, Ambulatório de Dermatologia Sanitária, Secretaria Estadual de Saúde do Rio Grande do Sul e Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.