Mais opções de medicamentos, cursos de tratamento prolongados e maior sobrevida do paciente contribuem para maior exposição aos medicamentos e, posteriormente, dão origem à incidência de reações adversas cutâneas a medicamentos (RACM).1–3 Embora a maioria dos pacientes com RACM obtenha cura após a descontinuação do medicamento, tipos graves de RACM requerem intervenções hospitalares e são até potencialmente fatais.4,5 O presente relato analisou retrospectivamente as características de pacientes hospitalizados com RACM. Especificamente, o relato enfoca o período de incubação (PI) e fatores associados.
Foram incluídos neste estudo 308 pacientes confirmados com RACM hospitalizados no First Affiliated Hospital da Chongqing Medical University no período de 2013 a 2018. As características demográficas e clínicas desses pacientes foram coletadas do sistema de prontuários médicos eletrônicos. A relação entre o PI e outros fatores foi avaliada por análise de correlação, e as diferenças dos níveis de PI entre os diferentes subgrupos foram comparadas pelo teste de Kruskal‐Wallis. Este estudo foi revisado e aprovado pelo Comitê de Ética do First Affiliated Hospital da Chongqing Medical University.
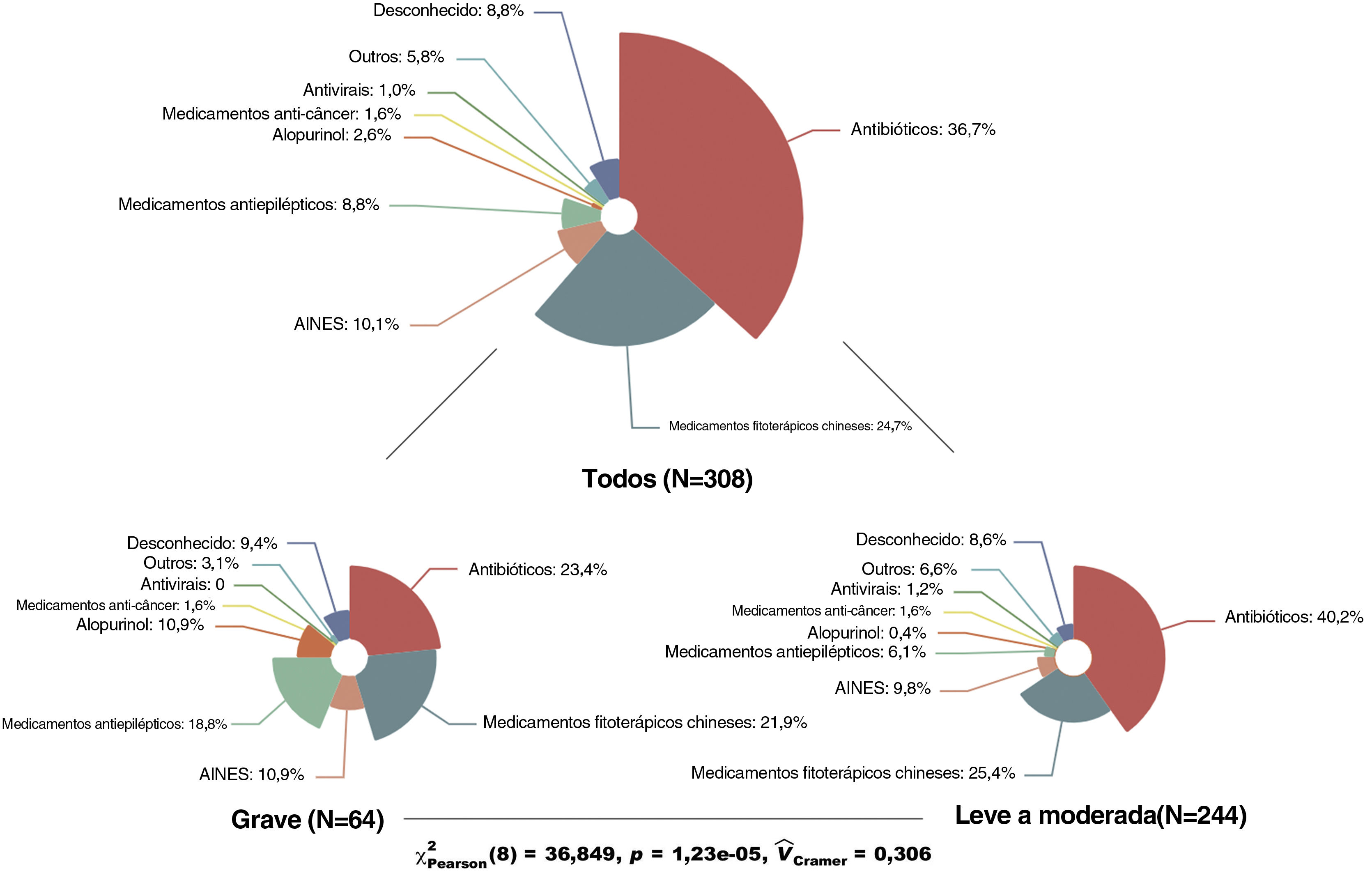
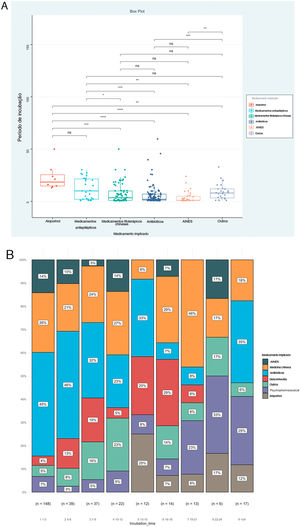
A tabela 1 mostra as características basais dos pacientes avaliados. A média de idade dos pacientes foi de 47 anos; 49,7% eram do sexo feminino. Os resultados mostraram que o eritema multiforme e o exantema maculopapular foram as reações mais comuns, correspondendo a 30,5% e 26,6%, respectivamente. As RACM graves como síndrome de Stevens‐Johnson/necrólise epidérmica tóxica (SJS/NET) e reação cutânea associada à eosinofilia e sintomas sistêmicos (DRESS, drug reaction with eosinophilia and systemic symptoms) foram responsáveis por 21% dos casos. A mediana do PI foi de quatro dias, com mediana do tempo de permanência de sete dias. Além disso, em cerca de 40% dos pacientes as lesões cutâneas afetaram a mucosa e mais de 70% dos pacientes desenvolveram RACM com memdicação por via de administração oral. Em relação aos medicamentos implicados, os antibióticos foram os mais comuns, afetando 36,7% de todos os pacientes, seguidos por medicamentos fitoterápicos chineses (24,7%), anti‐inflamatórios não esteroidais (10,1%) e anticonvulsivantes (8,8%). Além disso, foram comparados os tipos de medicamentos implicados em pacientes com RACM graves e com RACM leves a moderadas. O resultado mostrou diferença significativa entre os dois subgrupos (p <0,001). Os anticonvulsivantes e o alopurinol pareciam estar associados a tipos graves de RACM (fig. 1).
Características clínicas de pacientes com erupções cutâneas adversas a medicamentos
| Todo os pacientes (n=308) | |
|---|---|
| Idade, anos | 47,0 (31,0–62,0) |
| Gênero, feminino | 153 (49,7%) |
| Diagnóstico | |
| SJS/NET | 47 (15,3%) |
| DRESS | 17 (5,5%) |
| Eritema multiforme | 94 (30,5%) |
| EMP | 82 (26,6%) |
| Erupção medicamentosa fixa | 54 (17,5%) |
| Outros | 14 (4,5%) |
| Período de incubação, dias | 4,0 (1,0–10,0) |
| PI do DRESS | 20,0 (4,0–28,5) |
| Envolvimento da mucosa | 128 (41,6%) |
| Tempo de permanência, dias | 7,0 (5,0–11,0) |
| Comorbidades | |
| Hipertensão | 50 (16,2%) |
| Diabetes | 46 (14,9%) |
| Doença renal crônica | 14 (4,5%) |
| Cancer | 10 (3,2%) |
| DPOC | 7 (2,3%) |
| Doença autoimune | 20 (6,5%) |
| Epilepsia | 16 (5,2%) |
| Medicamento implicado | |
| Antibióticosa | 113 (36,7%) |
| Medicamentos fitoterápicos chinesesb | 76 (24,7%) |
| AINEsc | 31 (10,1%) |
| Anticonvulsivantesd | 27 (8,8%) |
| Alopurinol | 8 (2,6%) |
| Medicamentos anti‐câncer | 5 (1,6%) |
| Medicamentos antivirais | 3 (1,0%) |
| Outros | 24 (2,9%) |
| Medicamentos desconhecidos | 21 (6,8%) |
| Via de administração | |
| Oral | 223 (72,4%) |
| Injeção intramuscular | 2 (0,6%) |
| Injeção intravenosa | 62 (20,1%) |
| Desconhecida | 21 (6,8%) |
| Tratamento | |
| Somente anti‐histamínicos | 11 (3,6%) |
| Somente ciclosporina | 2 (0,6%) |
| Somente GC | 266 (86,4%) |
| GC+Azatioprina | 2 (0,6%) |
| GC+Ciclosporina | 9 (2,9%) |
| GC+IgIV | 3 (1,0%) |
| Somente glicirrizina | 9 (2,9%) |
| Metotrexato | 1 (0,3%) |
| Somente cuidados de suporte | 5 (1,6%) |
DPOC, doença pulmonar obstrutiva crônica; DRESS, reação cutânea associada à eosinofilia e sintomas sistêmicos; GC, glicocorticoides; IgIV, imunoglobulina intravenosa; EMP, exantema maculopapular; AINEs, anti‐inflamatórios não esteroidais; SJS, síndrome de Stevens‐Johnson; NET, necrólise epidérmica tóxica.
Antibióticos incluem penicilinas, macrolídeos, quinolonas, cefalosporinas, sulfonamidas, aminoglicosídeos e antibióticos diversos.
Medicamentos fitoterápicos chineses. Eles incluem medicamentos chineses patenteados, amostras de ervas chinesas e ervas de fabricação própria.
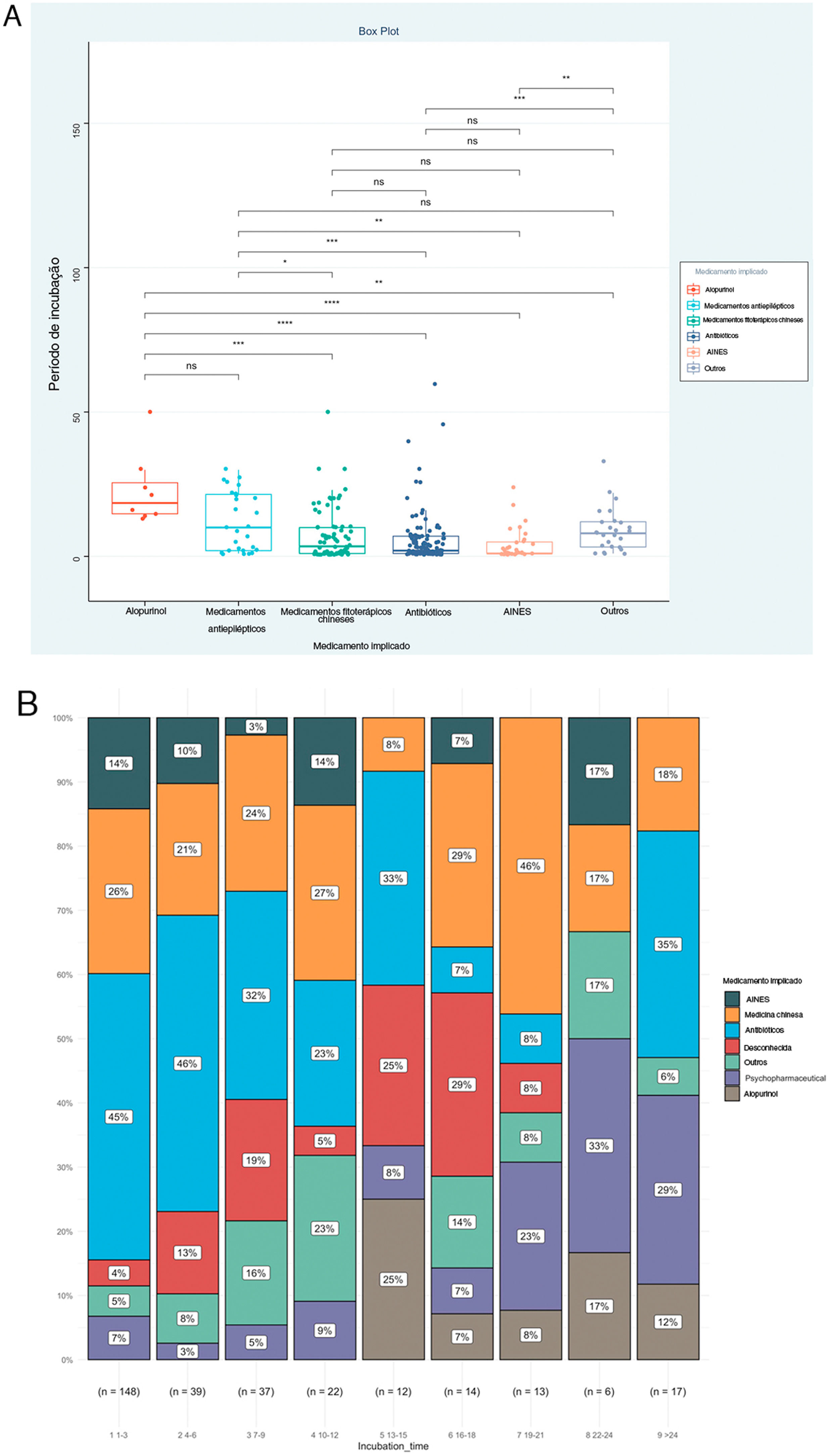
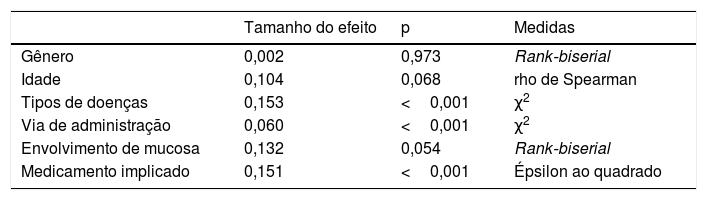
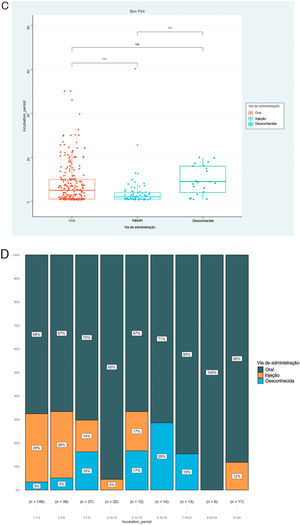
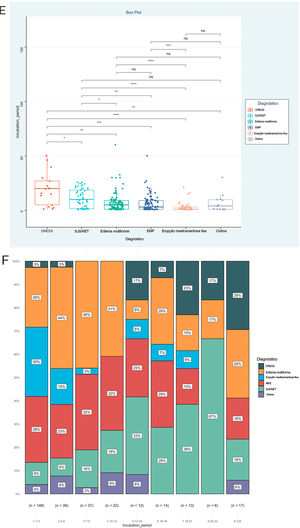
O PI foi a prioridade deste relato e foram analisados ainda os fatores associados ao PI, como mostrado na tabela 2. O resultado mostrou que os tipos de doença (Épsilon ao quadrado=0,153; p <0,001), via de administração (Épsilon ao quadrado=0,060; p <0,001) e medicamentos implicados (Épsilon ao quadrado=0,151; p <0,001) foram os fatores correlacionados de maneira significativa. Entretanto, nenhuma associação significativa foi detectada entre o PI e gênero (rrank‐biserial=0,002; p=0,973), idade (rho=0,104; p=0,068) e envolvimento da mucosa (rrank‐biserial=0,132; p=0,054). Com base nesses resultados, comparamos os níveis de PI entre os diferentes subgrupos (fig. 2). Os pacientes que receberam alopurinol e anticonvulsivantes tiveram PI mais longos do que com outros medicamentos; a administração oral apresentou PI mais longo do que a injetável e RACM graves mais longas do que RACM leves a moderadas (p <0,05 para todos, fig. 2 A–C). A mesma associação também pode ser observada se a proporção de cada subgrupo por PI fosse apresentada a cada três dias (fig. 2 D–F). A figura mostrou que embora quase todos os subgrupos pudessem ser detectados em cada grupo categorizado por PI, a distribuição de cada subgrupo foi distorcida e acumulada em determinada categoria de PI, indicando a associação entre o PI e esses fatores.
Fatores associados ao período de incubação
| Tamanho do efeito | p | Medidas | |
|---|---|---|---|
| Gênero | 0,002 | 0,973 | Rank‐biserial |
| Idade | 0,104 | 0,068 | rho de Spearman |
| Tipos de doenças | 0,153 | <0,001 | χ2 |
| Via de administração | 0,060 | <0,001 | χ2 |
| Envolvimento de mucosa | 0,132 | 0,054 | Rank‐biserial |
| Medicamento implicado | 0,151 | <0,001 | Épsilon ao quadrado |
Níveis e distribuições do período de incubação entre subgrupos de pacientes com reações adversas cutâneas. Os níveis do período de incubação foram comparados pelo teste de Kruskal‐Wallis e a análise post‐hoc foi ajustada pelo teste de Bonferroni. DRESS, reação cutânea associada à eosinofilia e sintomas sistêmicos; EMP, exantema maculopapular; AINEs, anti‐inflamatórios não esteroidais; SJS, síndrome de Stevens‐Johnson; NET, necrólise epidérmica tóxica.
O presente estudo analisou minuciosamente os PI de RACMs baseados na hospitalização e fatores associados. Entretanto, a principal limitação deste estudo é como determinar com precisão os medicamentos implicados e PI. Embora o PI e o medicamento responsável pela RACM de cada paciente tenham sido registrados no sistema de prontuários médicos eletrônicos, o desenho retrospectivo significou que os critérios não foram unificados. Consequentemente, os resultados podem apresentar viés.
Esta análise descritiva sugeriu que tipos graves e leves a moderados de RACM podem ser doenças diferentes, especialmente em relação aos medicamentos implicados e PI. PI mais longos foram significativamente associados a tipos graves, administração oral e uso de alopurinol/anticonvulsivantes. Esse resultado pode ser útil para entender os PI das RACM e avaliar a gravidade das mesmas.
Suporte financeiroEsse estudo foi financiado pela Postdoctoral Research Foundation of Chongqing Medical University (n° 2‐01‐02‐04‐P0474) e Special Foundation for Postdoctoral Research Projects of Chongqing, Número da concessão: 2021XM3080.
Contribuição dos autoresXiaoli Chen: Metodologia; curadoria de dados; visualização.
Li Hu: Concepção; administração do projeto.
Zupeng Xiao: Recursos; redação ‐ revisão e edição.
Hanyi Wu: Validação; curadoria de dados.
Aijun Chen: Investigação; supervisão.
Rentao Yu: Análise formal; aquisição de financiamento; software; redação ‐ rascunho original.
Conflito de interessesNenhum.
Os pacientes descritos neste manuscrito deram consentimento informado por escrito para a publicação dos detalhes de seu caso.
Como citar este artigo: Chen X, Hu L, Xiao Z, Wu H, Chen A, Yu R. Characteristics of cutaneous adverse drug reactions with special respect to the incubation period based on hospitalized patients. An Bras Dermatol. 2023;98:229–35.