O pênfigo foliáceo é extremamente raro em todo o mundo, exceto nas poucas regiões onde ocorre como variante endêmica. Vários fatores podem desencadear mecanismos imunológicos que induzem o pênfigo foliáceo ou pioram o curso da doença.
ObjetivoDeterminar as características demográficas e clínicas dos pacientes com pênfigo foliáceo em uma grande série de um país não endêmico, investigar os fatores desencadeantes e os padrões sazonais.
MétodosOs dados dos pacientes com diagnóstico de pênfigo foliáceo em nosso centro entre 1989‐2018 foram analisados retrospectivamente.
ResultadosSessenta e oito pacientes (média de idade, 45,7 ± 14,5 anos) foram incluídos no estudo. O número de ocorrências atingiu seu pico na primavera‐verão (p=0,008). Um total de 117 recidivas ocorreram em 42 pacientes, e foram mais comuns na primavera‐verão (não significativo). Fatores desencadeantes específicos foram detectados em 45 recidivas. Nas demais 72 recidivas, o pico foi observado na primavera‐verão (p=0,005). Não houve diferenças significativas em termos de variáveis demográficas e clínicas investigadas entre pacientes com recidiva e sem recidiva.
Limitações do estudoDesenho retrospectivo.
ConclusõesOs fatores desencadeantes não puderam ser identificados em mais da metade das recidivas em nossa série. O subgrupo das recidivas (sem causas identificadas), bem como a época de início da doença, apresentou variação sazonal significativa com pico na primavera‐verão; entretanto, a variável sazonal não justificou o grupo total de recidivas. Embora a variação sazonal possa ser causada por uma combinação de fatores, a radiação ultravioleta deve ser considerada um fator desencadeante dos picos primavera‐verão, principalmente na Turquia.
O pênfigo constitui um grupo de doenças cutâneas bolhosas autoimunes, caracterizadas por autoanticorpos direcionados contra as proteínas de superfície dos queratinócitos.1,2 O pênfigo vulgar (PV) e o pênfigo foliáceo (PF) são os dois subtipos principais de pênfigo e apresentam diferenças clínicas, histopatológicas e imunopatológicas.2,3 O PF é muito raro em todo o mundo, exceto nas poucas regiões onde apresenta uma forma endêmica.4–6 Ambas as variantes de PF são caracterizadas por bolhas superficiais e frágeis que são vistas na avaliação histopatológica como acantólise subcórnea.7 Esse padrão superficial às vezes causa uma impressão errada de que é uma doença menos grave com um curso facilmente controlável; entretanto, foi demonstrado que vários fatores pessoais e exógenos desencadeiam mecanismos imunológicos que causam múltiplas recidivas em pacientes suscetíveis com PF.8,9 A radiação ultravioleta (UV) é um dos fatores de risco frequentemente investigados, e foi relatado que ela induz ou exacerba algumas doenças bolhosas autoimunes, incluindo PF, PV, dermatose por IgA linear e penfigoide bolhoso.10–16
Os padrões de agrupamento sazonal em muitas doenças dermatológicas e não dermatológicas, incluindo PV, foram relatados anteriormente.17–21 Como o PF não endêmico é muito raro, pesquisas demográficas ou outras pesquisas em séries específicas de PF de países não endêmicos são limitadas na literatura; no entanto, acreditamos que os fatores desencadeantes evitáveis e os padrões sazonais de recidivas precisam de atenção nesta doença. Neste estudo, objetivamos determinar as características demográficas e clínicas do PF em uma grande série de pacientes de um país não endêmico, bem como investigar os possíveis fatores pessoais e exógenos para recidivas e variações sazonais no curso da doença.
MétodosPacientes e ambienteNeste estudo, revisamos retrospectivamente os prontuários de pacientes com diagnóstico de PF em um centro de referência terciário entre 1989 e 2018. Os pacientes cujo diagnóstico foi confirmado por avaliação histopatológica e pelo menos uma das técnicas de imunofluorescência (imunofluorescência direta/imunofluorescência indireta) foram incluídos no estudo. Os dados de avaliação dos pacientes incluíram: idade, sexo, tempo de atraso até o diagnóstico, distribuição das lesões, tabagismo, comorbidades, profissões, duração do período de seguimento, ocorrência de recidiva e fatores desencadeantes detectados das recidivas. O termo “recidiva” foi adaptado a nosso estudo a partir de uma definição anterior como a ocorrência de novas lesões que não cicatrizaram espontaneamente em uma semana ou a extensão das lesões em um paciente clinicamente estável.22 Pacientes com história de pelo menos uma recidiva e aqueles sem recidiva foram comparados em termos de suas características demográficas e clínicas. As datas do início dos sintomas e recidivas foram registradas por anos, estações e meses. As estações são definidas como inverno (janeiro, fevereiro e março), primavera (abril, maio e junho), verão (julho, agosto e setembro) e outono (outubro, novembro e dezembro). Os números esperados em uma distribuição igual entre os grupos sazonais (primavera‐verão/outono‐inverno) foram calculados em pares e comparados com os números observados. As estações foram agrupadas de modo a comparar as épocas do ano com e sem altos níveis de radiação UV de acordo com o clima de nosso país.
Análise estatísticaA análise estatística foi realizada com o software IBM SPSS Statistics 22.0 (SPSS, Chicago, IL, EUA). Os dados contínuos foram apresentados como média ± desvio padrão (DP), mediana e variação. As diferenças intergrupos foram analisadas por meio de regressão logística binomial para variáveis contínuas e categóricas. Os odds ratio (OR) das variáveis foram medidos por análise de regressão logística. Utilizamos o teste de qui‐quadrado para analisar se havia uma diferença nas recidivas (qualquer desvio significativo de uma distribuição igual) entre os grupos sazonais (primavera‐verão/outono‐inverno). Um valor de p bilateral inferior a 0,05 foi considerado estatisticamente significativo para todos os testes realizados.
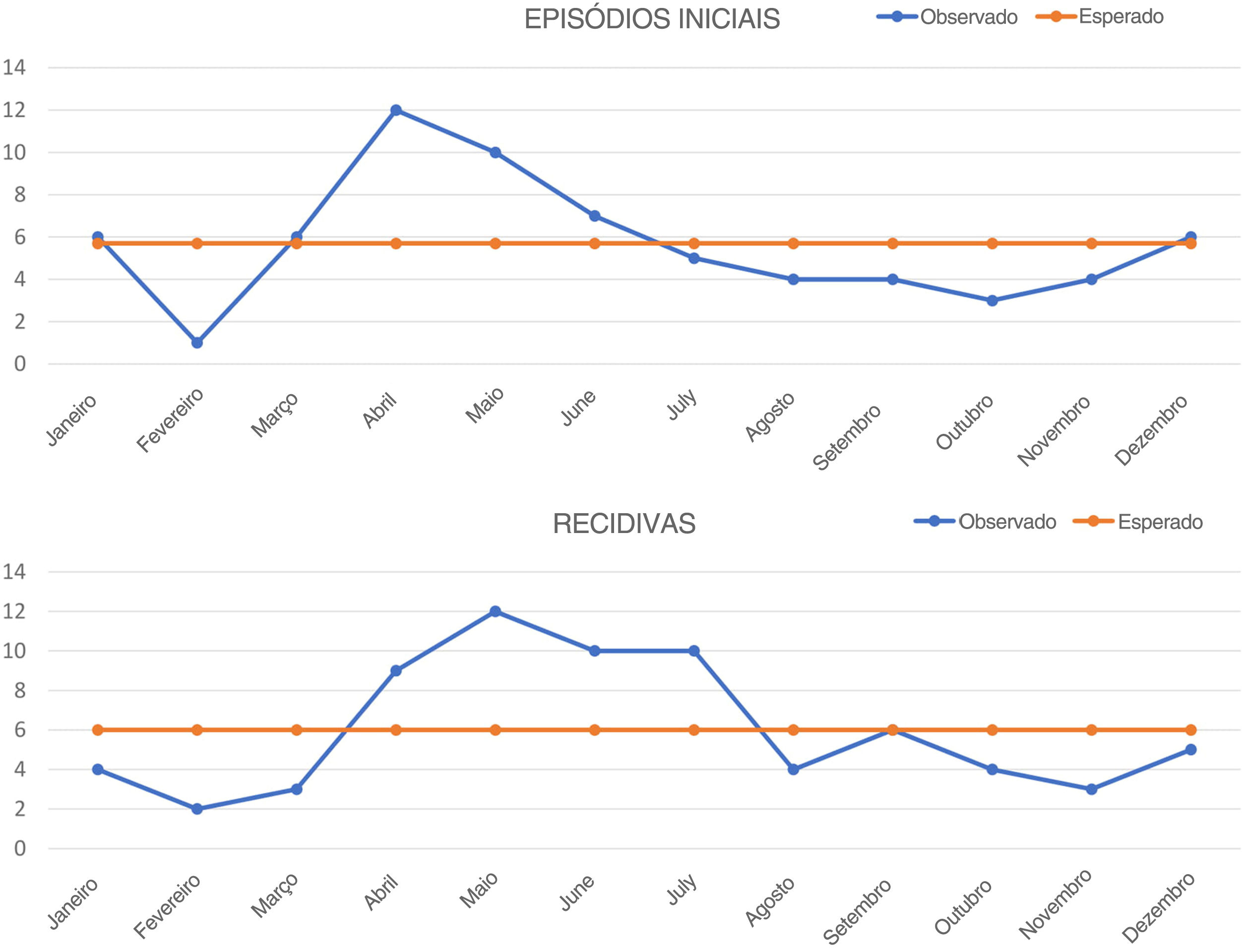
ResultadosUm total de 68 pacientes com PF (35 do sexo masculino, 33 do sexo feminino) foram incluídos no estudo. A média de idade no diagnóstico foi de 45,7 ± 14,5 anos (mediana=44; variação, 20‐75 anos), sem diferença significativa entre homens (47,8 ± 14,3 anos) e mulheres (43,5 ± 14,5 anos). A duração média dos sintomas antes do diagnóstico foi de 1,7 ± 2,7 meses (mediana=1; variação, 0,3‐18 meses). A distribuição das lesões foi a seguinte: lesões faciais em 27 pacientes, lesões no tronco em 57 pacientes, lesões nos membros em 46 pacientes e lesões no couro cabeludo em 33 pacientes. Enquanto quatro pacientes tiveram lesões localizadas, outros apresentaram lesões em várias partes do corpo. Dezoito pacientes (26,5%) eram tabagistas e 22 (32,4%) tinham pelo menos uma comorbidade (diabetes mellitus em nove pacientes, hipertensão em oito pacientes, hipotireoidismo em três e depressão em dois pacientes). Quando as profissões dos pacientes foram agrupadas, os trabalhadores (n=10), os professores (n=7) e as donas de casa (n=24) lideraram. As características gerais dos pacientes estão resumidas na tabela 1. O número de pacientes com diagnóstico de PV nos anos do estudo foi de 408 (dados não publicados), e a proporção PV/PF foi igual a 6. A quantidade de episódios iniciais da doença (de acordo com as lesões iniciais) foi maior em abril (n=12) e menor em fevereiro (n=1) (fig. 1A). O número total de episódios iniciais foi maior na primavera‐verão (n=45) em relação ao outono‐inverno (n=23) (χ2=7,118, p=0,008) (tabela 2).
Características gerais dos pacientes com pênfigo foliáceo
| Pacientes, n | 68 |
| Sexo masculino/feminino, n (%) | 35 (51,5%)/33 (48,5%) |
| Média de idade ao diagnóstico (anos) | 45,70 ± 14,47 (mediana = 44,5; variação, 20‐75) |
| Média do atraso antes do diagnóstico (meses) | 1,7 ± 2,7 (mediana = 1; variação, 0,3‐18) |
| Distribuição das lesões (localizadas / generalizadas), n (%) | 4 (5,9%)/64 (94,1%) |
| Tabagismo, n (%) | 18 (26,5%) |
| Pacientes com comorbidades, n (%) | 22 (32,4%) |
| Período médio de seguimento (anos) | 5,1 ± 3,1 (mediana = 5; variação, 1‐15) |
| Pacientes com recidivas,a n (%) | 42 (73,7%) |
| Pacientes com múltiplas recidivas,a n (%) | 29 (50,9%) |
| Pacientes sem recidivas,a n (%) | 15 (26,3%) |
| Pacientes com eventos adversos associados à terapia,a n (%) | 24 (42,1%) |
Distribuição sazonal do início do pênfigo foliáceo e recidivas
| Início do pênfigo foliáceo (n = 68) | |||
|---|---|---|---|
| Observado | Esperado (68/2) | p‐valor | |
| Primavera-Verão | 45 | 34 | p=0,008 |
| Outono-Inverno | 23 | 34 | |
| Todas as recidivas (n=117) | |||
|---|---|---|---|
| Observado | Esperado (117/2) | p–valor | |
| Primavera-Verão | 66 | 58,5 | p = 0,166 |
| Outono-Inverno | 51 | 58,5 | |
| Subgrupo de recidivas (sem causas identificadas) (n = 72) | |||
|---|---|---|---|
| Observados | Esperados (72/2) | p–valor | |
| Primavera-Verão | 48 | 36 | p = 0,005 |
| Outono-Inverno | 24 | 36 | |
O período médio de seguimento foi calculado como 5,1 ± 3,1 anos (mediana=5; variação, 1‐15 anos) em 57 pacientes com pelo menos um ano de seguimento. Nesses pacientes, corticosteroides sistêmicos foram utilizados como agente terapêutico inicial e pelo menos um agente de terapia adjuvante (azatioprina, ácido micofenólico, dapsona, rituximabe e imunoglobulina intravenosa) foi iniciado em 35 deles durante o seguimento. Vinte e quatro pacientes experimentaram pelo menos um efeito adverso, incluindo diabetes mellitus (n=10), hipertensão (n=7), osteoporose (n=9), catarata (n=7), insuficiência renal aguda (n = 1), pneumonia (n = 1), abscesso (n = 2), anemia (n = 1), pancitopenia (n = 1) e metemoglobinemia (n = 1) durante o tratamento.
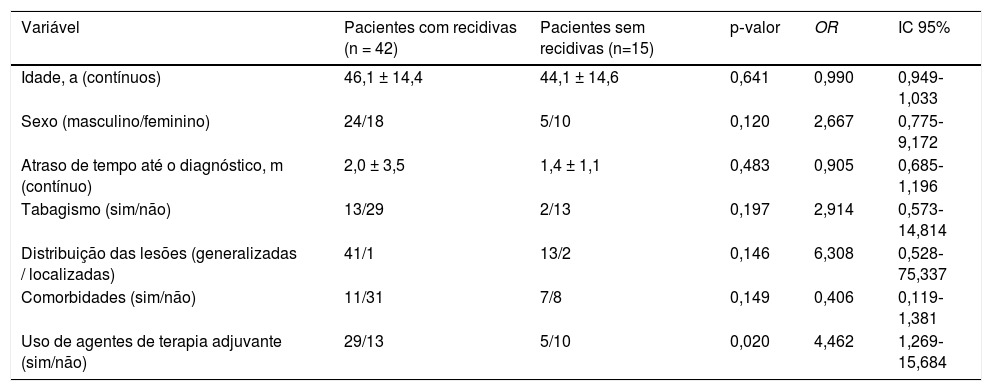
Quarenta e dois pacientes (24 homens, 18 mulheres) apresentaram recidiva pelo menos uma vez durante o seguimento e 29 deles tiveram recidivas múltiplas (duas vezes em 11 pacientes; três vezes ou mais em 18 pacientes). No total, 117 recidivas ocorreram em nossa série. A dose média sistêmica de corticosteroide utilizada no momento das recidivas foi calculada como 8,65 ± 10,55mg (variação, 4‐30mg). A dose diária mais comum no momento das recidivas foi de 4mg (n = 23). Em 21 das recidivas, os pacientes não estavam recebendo nenhum corticosteroide sistêmico. Apenas cinco pacientes apresentaram recidiva enquanto recebiam um agente de terapia adjuvante. Não foram observadas diferenças significativas quanto ao sexo dos pacientes, tabagismo, distribuição das lesões e existência de comorbidades entre pacientes com recidiva e sem recidiva (tabela 3). Embora a média de idade no diagnóstico e atraso antes do diagnóstico tenha sido maior no grupo com recidiva (média de idade, 46,1 ± 14,4 vs. 44,1 ± 14,6 anos; atraso antes do diagnóstico, 2 ± 3,5 vs. 1,4 ± 1,1 meses), as diferenças não foram estatisticamente significativas (tabela 3). A taxa de uso de agentes de terapia adjuvante foi maior em pacientes com recidiva em comparação com os pacientes sem recidiva, com significância estatística (OR = 4,462; IC95% 1,269‐15,684; p = 0,020) (tabela 3). O número de recidivas foi maior em maio (n = 17) e menor em fevereiro (n = 6). O número total de recidivas foi maior na primavera‐verão (n = 66) em relação ao outono‐inverno (n = 51; não significativo; tabela 2). Os fatores desencadeantes das 45 recidivas puderam ser identificados da seguinte maneira: infecções do trato respiratório (n = 18), uso indevido de medicamentos do tratamento (n = 11), estresse (cirurgia, lesão acidental ou trauma psicológico; n = 9), jejum (n = 3) e outras infecções (n = 4). O número total de recidivas observadas sem causas identificadas foi de 72, sendo o maior número em maio (n = 12) e o menor em fevereiro (n = 2) (fig. 1B). O número total dessas recidivas foi maior na primavera‐verão (n = 48) em comparação ao outono‐inverno (n = 24), com significância estatística (χ2 = 8, p = 0,005) (tabela 2).
Análise de regressão logística binomial de variáveis entre pacientes com recidivas e sem recidivas
| Variável | Pacientes com recidivas (n = 42) | Pacientes sem recidivas (n=15) | p‐valor | OR | IC 95% |
|---|---|---|---|---|---|
| Idade, a (contínuos) | 46,1 ± 14,4 | 44,1 ± 14,6 | 0,641 | 0,990 | 0,949‐1,033 |
| Sexo (masculino/feminino) | 24/18 | 5/10 | 0,120 | 2,667 | 0,775‐9,172 |
| Atraso de tempo até o diagnóstico, m (contínuo) | 2,0 ± 3,5 | 1,4 ± 1,1 | 0,483 | 0,905 | 0,685‐1,196 |
| Tabagismo (sim/não) | 13/29 | 2/13 | 0,197 | 2,914 | 0,573‐14,814 |
| Distribuição das lesões (generalizadas / localizadas) | 41/1 | 13/2 | 0,146 | 6,308 | 0,528‐75,337 |
| Comorbidades (sim/não) | 11/31 | 7/8 | 0,149 | 0,406 | 0,119‐1,381 |
| Uso de agentes de terapia adjuvante (sim/não) | 29/13 | 5/10 | 0,020 | 4,462 | 1,269‐15,684 |
a, anos; m, meses; OR, odds ratio; IC, intervalo de confiança.
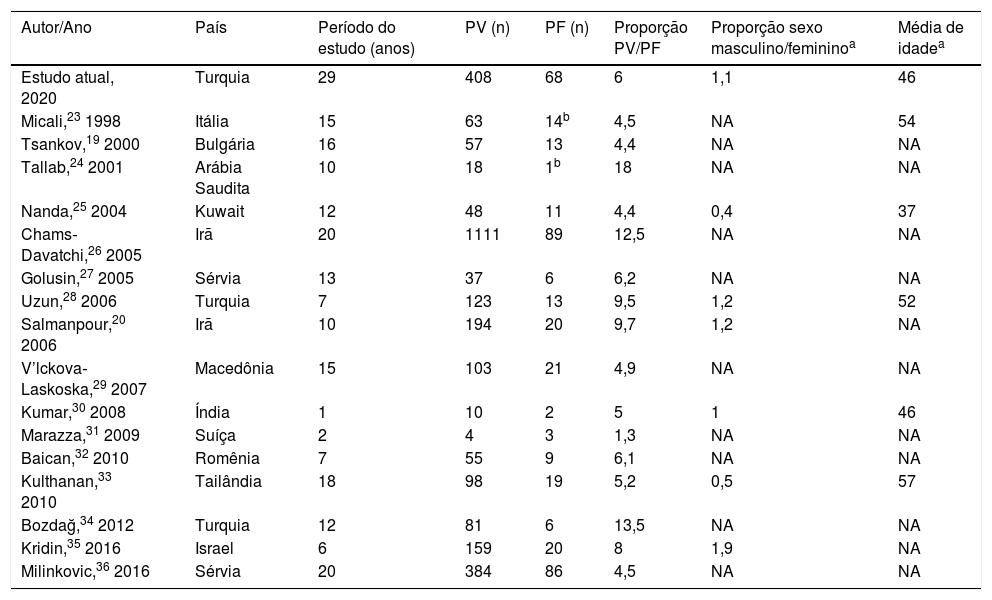
A série apresentada de pacientes com PF não endêmico é a maior da Turquia e uma das maiores do mundo (tabela 4). As características demográficas, incluindo a média de idade no momento do diagnóstico (45,7 ± 14,5 anos), a proporção entre os sexos masculino e feminino (1,1) e entre os subtipos de PV e PF (6) foram geralmente consistentes com a literatura atual (tabela 4).19,20,22–36 Descobrimos em nossa série que o início do PF foi mais comum na primavera‐verão em comparação ao outono‐inverno, com significância estatística; entretanto, os dados de quaisquer fatores desencadeantes detectados nos episódios iniciais não estavam disponíveis em nossos registros. Embora o inverno tenha sido relatado como a época com o maior número de episódios iniciais da doença em um grupo de 223 pacientes com pênfigo (incluindo 20 pacientes com PF) em um estudo, foi relatado que a primavera‐verão produziu o maior número em um grupo de 74 pacientes com pênfigo (incluindo 15 pacientes com PF) em outro estudo.19,20 Em um terceiro estudo, o início foi mais comum na primavera‐verão em 222 pacientes com PV, mas a diferença não foi estatisticamente significativa.21
Estudos demográficos de pênfigo em países não endêmicos
| Autor/Ano | País | Período do estudo (anos) | PV (n) | PF (n) | Proporção PV/PF | Proporção sexo masculino/femininoa | Média de idadea |
|---|---|---|---|---|---|---|---|
| Estudo atual, 2020 | Turquia | 29 | 408 | 68 | 6 | 1,1 | 46 |
| Micali,23 1998 | Itália | 15 | 63 | 14b | 4,5 | NA | 54 |
| Tsankov,19 2000 | Bulgária | 16 | 57 | 13 | 4,4 | NA | NA |
| Tallab,24 2001 | Arábia Saudita | 10 | 18 | 1b | 18 | NA | NA |
| Nanda,25 2004 | Kuwait | 12 | 48 | 11 | 4,4 | 0,4 | 37 |
| Chams‐Davatchi,26 2005 | Irã | 20 | 1111 | 89 | 12,5 | NA | NA |
| Golusin,27 2005 | Sérvia | 13 | 37 | 6 | 6,2 | NA | NA |
| Uzun,28 2006 | Turquia | 7 | 123 | 13 | 9,5 | 1,2 | 52 |
| Salmanpour,20 2006 | Irã | 10 | 194 | 20 | 9,7 | 1,2 | NA |
| V’lckova‐Laskoska,29 2007 | Macedônia | 15 | 103 | 21 | 4,9 | NA | NA |
| Kumar,30 2008 | Índia | 1 | 10 | 2 | 5 | 1 | 46 |
| Marazza,31 2009 | Suíça | 2 | 4 | 3 | 1,3 | NA | NA |
| Baican,32 2010 | Romênia | 7 | 55 | 9 | 6,1 | NA | NA |
| Kulthanan,33 2010 | Tailândia | 18 | 98 | 19 | 5,2 | 0,5 | 57 |
| Bozdağ,34 2012 | Turquia | 12 | 81 | 6 | 13,5 | NA | NA |
| Kridin,35 2016 | Israel | 6 | 159 | 20 | 8 | 1,9 | NA |
| Milinkovic,36 2016 | Sérvia | 20 | 384 | 86 | 4,5 | NA | NA |
PV, pênfigo vulgar; PF, pênfigo foliáceo; NA, não aplicável.
Embora o PF seja conhecido como uma doença mais branda em comparação ao PV, a recidiva não é um risco a ser ignorado. Quarenta e dois pacientes (74%) de nossa série apresentaram recidiva pelo menos uma vez e 29 pacientes (51%) tiveram recidiva mais de uma vez. Cada recidiva exigiu aumento da dose de corticosteroide sistêmico e/ou nova intervenção com agente adjuvante. Não foram observadas diferenças significativas em termos de sexo dos pacientes, idade no diagnóstico, tabagismo, tempo de atraso antes do diagnóstico, distribuição das lesões e presença de comorbidades em pacientes com recidiva e sem recidiva. Embora a taxa de uso dos agentes de terapia adjuvante tenha sido maior no grupo com recidiva, com significância estatística (OR = 4,462; IC95% 1,269‐15,684; p = 0,020), nenhum comentário adicional sobre a relação entre terapias adjuvantes e recidivas pode ser feito devido à falta de dados sobre a gravidade da doença em nosso estudo.
Quando a distribuição sazonal de todas as recidivas (n = 117) foi analisada, observou‐se que o número de recidivas atingiu seu pico na primavera‐verão, mas sem significância estatística. A radiação UV da exposição à luz solar já mostrou induzir ou agravar várias doenças bolhosas autoimunes, como PV, PF, dermatose por IgA linear e penfigoide bolhoso em estudos anteriores.10,16 Foi relatado que a exposição controlada à UVB pode causar acantólise na pele intacta de pacientes com PV e PF, enquanto esse efeito foi negativo na pele dos pacientes controle.14 Esses dados levantam a hipótese de que uma variação sazonal mediada por radiação UV pode existir no curso de doenças bolhosas.21 Entretanto, a radiação UV não é um fator fácil de detectar em recidivas e não é uma causa anotada em nossos registros. Houve fatores desencadeantes comuns em nossos pacientes, como infecções, uso indevido de medicamentos e jejum. As infecções, particularmente as do trato respiratório, são fatores desencadeantes fáceis de detectar através da anamnese, exame físico e exames laboratoriais e são mais comuns no outono‐inverno; entretanto, foram detectadas em menos da metade das recidivas em nosso estudo. Para determinar o papel da radiação UV como um gatilho oculto, foram analisadas 72 recidivas para as quais não foi possível detectar um fator desencadeante, que apresentaram uma variação sazonal significativa, sendo mais comuns na primavera‐verão. O único outro estudo encontrado na literatura que investigou a variação sazonal nas recidivas de pênfigo foi realizado em um grupo de pacientes com PV (tabela 5).14 Ao contrário do estudo apresentado, a primeira e a segunda recidivas experimentadas pelos pacientes foram estudadas em grupos diferentes. Embora o verão tenha se classificado em primeiro lugar na recidiva inicial e na subsequente, a diferença não foi estatisticamente significante. Com base em nossa experiência da prática diária, a influência da radiação UV pode ser mais forte em pacientes com PF do que em pacientes com PV; entretanto, nenhum estudo comparativo foi encontrado na literatura para os subtipos de pênfigo. Para apoiar essa ideia, estudos em grandes séries de pacientes com PF e PV são necessários.
Estudos sobre as variações sazonais do pênfigo
| Referência | Pacientes | Estação de pico do episódio inicial (significância estatística) | Estação de pico das recidivas (significância estatística) |
|---|---|---|---|
| Estudo atual | 68 PF | Primavera-Verão (Significante) | Primavera-Verão (Significante) |
| Tsankov et al.19 | 57 PV | Primavera-Verão (NA) | NA |
| 15 PF | |||
| 2 PH | |||
| Salmonpour et al.20 | 194 PV | Inverno (NA) | NA |
| 20 PF | |||
| 9 PH | |||
| Robati et al.21 | 222 PV | Verão (Não significante) | Primavera (Não significante) |
PF, pênfigo foliáceo; PV, pênfigo vulgar; PH, pênfigo herpetiforme; NA, não aplicável.
A principal limitação do estudo foi seu desenho retrospectivo.
ConclusãoO PF não endêmico é uma doença muito rara, com curso clínico que pode apresentar com recidivas e o manejo das recidivas nem sempre é fácil, em decorrência de fatores desencadeantes ocultos. Nossos registros mostraram que os fatores desencadeantes não puderam ser identificados em mais da metade das recidivas em nossa série. O subgrupo de recidivas que ocorreram com desencadeantes ocultos, bem como o aparecimento inicial da doença, mostrou uma variação sazonal significativa com um pico na primavera‐verão; entretanto, a variável sazonal não justificou o conjunto total de recidivas em nossa série. Embora a variação sazonal apresentada possa ter sido causada por uma combinação de fatores, acreditamos que a radiação ultravioleta deve ser considerada um importante fator desencadeante do pico nas estações primavera‐verão, principalmente na Turquia. Embora a taxa de mortalidade do pênfigo é baixa por causa do tratamento com corticosteroides sistêmicos e outros agentes terapêuticos das últimas décadas, é fundamental compreender os fatores preventivos das recidivas devido ao número notável de morbidades associadas à terapia.37 É aconselhável que os médicos enfatizem a importância da proteção contra os raios ultravioleta para os pacientes em regiões geográficas como na Turquia, onde as estações da primavera‐verão são caracterizadas por intensa radiação UV. Além disso, esse fator deve ser levado em consideração nos planos de tratamento durante a transição para a primavera‐verão.
Declaração éticaEste estudo foi realizado de acordo com os princípios da Declaração de Helsinque. A aprovação foi concedida pelo Comitê de Ética da İstanbul University (20.10.2016/363903).
Suporte financeiroNenhum.
Contribuições dos autoresSıla Kılıç Sayar: Conceitualização; análise dos dados; análise formal; investigação; metodologia; software; supervisão; visualização; elaboração e redação; redação e edição.
Rıfkiye Küçükoğlu: Conceitualização; análise dos dados; análise formal; investigação; metodologia; software; supervisão; visualização; elaboração e redação; redação e edição.
Conflito de interessesNenhum.
Como citar este artigo: Kılıç Sayar S, Küçükoğlu R. Evaluation of non‐endemic pemphigus foliaceus in a large series of patients: single‐center retrospective study from Turkey focuses on the relapses. An Bras Dermatol. 2021;96:422–8.
Trabalho realizado na Istanbul Faculty of Medicine, Istanbul University, Istambul, Turquia.