Não se conhece o papel independente das radiações solares na melanogênese diferencial entre melasma e a pele adjacente.
ObjetivosAvaliar respostas melanogênicas da pele com melasma facial e pele adjacente às irradiações UVB, UVA e luz visível, em modelo ex vivo.
MétodosEstudo quasi‐experimental que envolveu 22 portadores de melasma. Coletaram‐se amostras de pele facial (melasma e adjacente), armazenadas em meio DMEM, em temperatura ambiente. Um fragmento foi acondicionado sob abrigo da luz, enquanto outro foi exposto a uma das radiações UVB, UVA e luz visível (componente azul‐violeta): 166mJ/cm2, 1,524J/cm2 e 40J/cm2. Em seguida, todas as amostras foram mantidas por 72 horas ao abrigo da luz e coradas pelo Fontana‐Masson para avaliar pigmentação da camada basal, dendritos e granulação da melanina.
ResultadosHouve efetiva melanogênese na camada basal no melasma e na pele normal adjacente após todas as irradiações (p < 0,01). A mediana de incremento foi: UVB 4,7% vs. 8,5%; UVA 9,5% vs. 9,9%; e luz visível 6,8% vs. 11,7%, sem diferença significativa entre as topografias. Houve aumento na granulação da melanina (melanossomas mais grosseiros) somente após a irradiação com UVA e apenas na pele com melasma (p = 0,05). Houve aumento da contagem de dendritos dos melanócitos induzidos pela radiação UVB em ambas as topografias (p ≤ 0,05).
Limitações do estudoEmprego de modelo ex vivo, com regimes de irradiações independentes para UVB, UVA e luz visível.
ConclusõesHouve melanogênese tanto no melasma quanto na pele adjacente induzida por UVB, UVA e luz visível. Os padrões morfológicos sugerem que diferentes radiações promovam respostas individualizadas na pele com melasma.
Melasma é hipermelanose crônica e adquirida resultante de uma disfunção da melanogênese: aumento da produção, transferência e maior maturidade dos melanossomos.1 É uma condição frequente na rotina dermatológica, totaliza 3,6% das consultas dermatológicas segundo estudo da Sociedade Brasileira de Dermatologia, em 2018.2 Acomete principalmente mulheres na idade fértil (25‐50 anos) e fototipos intermediários (III‐V). As lesões clínicas do melasma são máculas comumente simétricas, hipercrômicas, bem delimitadas, situadas nas topografias expostas ao sol, especialmente a face.3 A fisiopatologia ainda não está completamente esclarecida, mas há interação entre genética (herança autossômica dominante), fatores hormonais e exposição à radiação solar, o que leva à maior melanogênese focal.3–7
As alterações fenotípicas na pele com melasma decorrem de modificações epidérmicas tanto morfológicas – melanócitos aumentados de tamanho e dendritos proeminentes − quanto disfuncionais, decorrentes da interação complexa entre queratinócitos, melanócitos e componentes da derme superior.8
Há clara relação entre a exposição solar e a pioria do melasma, desde ocorrência exclusiva em áreas fotoexpostas até prevalência em profissionais que se expõem ao sol e melhor resposta terapêutica associada à fotoproteção.9,10 Mesmo com evidências do papel da radiação solar na história clínica da doença, não se conhece o padrão de resposta individualizada do melasma em comparação com a pele normal adjacente às diferentes faixas de radiação solar (UVB, UVA e luz visível – LV).
O conhecimento das diferentes influências da radiação solar na melanogênese do melasma pode levar a melhor compreensão da fisiopatologia da doença, assim como à elaboração de novas opções de tratamento, além de aprimorar as estratégias de fotoproteção.
Este estudo objetivou determinar a resposta melanogênica do melasma facial em comparação com a pele normal adjacente após irradiação com UVA, UVB ou LV em modelo ex vivo.
Material e métodosEstudo quasi‐experimental ex vivo que envolveu fragmentos de pele de 22 portadores de melasma facial diagnosticados por dermatologista experiente. Os participantes foram selecionados entre os pacientes do serviço de dermatologia do Hospital das Clínicas da Faculdade de Medicina de Botucatu (SP) entre setembro de 2018 e janeiro de 2019. O projeto foi aprovado pelo Comitê de Ética em Pesquisa (n° 2.700.889) e todos os participantes assinaram o termo de consentimento antes da inclusão.
Foram elegíveis para o estudo pacientes adultos (> 18 anos), de ambos os sexos, entre os fototipos III‐V, com melasma facial e sem tratamento, exceto filtro solar por, no mínimo, 30 dias. A restrição aos fototipos baseou‐se no fato de que os fototipos I e II representam menos de 10% dos casos de melasma e não apresentam melanogênese satisfatória após irradiação experimental.3,11 Não há descrição de melasma em fototipo VI.
Não foram incluídos no estudo os portadores de outras dermatoses faciais, dermatoses com fotossensibilidade, colagenoses, discrasias sanguíneas, usuários de medicação anticoagulante, imunossuprimidos, gestantes ou lactantes. A amostragem foi feita por conveniência, usaram‐se pacientes consecutivos, concordantes em participar do estudo, durante consultas médicas na instituição.
A coleta de material ocorreu de maneira padronizada e sob procedimento estéril. Duas amostras de cada participante foram coletadas: pele com melasma e pele normal adjacente, distantes até 2cm entre si, sob anestesia local infiltrativa com lidocaína 2% com vasoconstritor. A remoção contemplou até a derme reticular, com punch 3mm e sutura com fio mononylon 6,0. Foram privilegiadas áreas periféricas da face a fim de minimizar cicatrizes inestéticas.
As amostras foram seccionadas longitudinalmente em duas partes e armazenadas em 10mL do meio DMEM (Dulbecco's Modified Eagle's Medium, high glicose – D5796, Sigma Inc, UK) em frasco plástico transparente estéril e mantido em temperatura ambiente, segundo protocolo estabelecido por Olivatti.12 Uma parte do fragmento foi acondicionada imediatamente ao abrigo da luz, enquanto a outra foi exposta a uma das radiações, com uma dose total (efetiva no tecido) UVB, UVA e LV de 166mJ/cm2, 1,524J/cm2 e 40J/cm2 (componente luz azul‐violeta). Os fragmentos foram irradiados a partir de fontes artificiais de UVB (230μW/cm2; fonte FS72T12/UVB/HO) – 12min, UVA (1270μW/cm2; fonte Phillips TL 100W/10R) – 6min e luz LED (110 mW/cm2 na faixa azul‐violeta; fonte GBRLUX 200W) – 20min, com distância padronizada de 10cm. A absorbância dos frascos plásticos foi de cerca de 50% para todas as radiações. A alocação dos participantes em cada tipo de irradiação foi consecutiva (não randomizada).
Após a irradiação, ambos os fragmentos (irradiados e não irradiados) foram cultivados ao abrigo da luz. Passadas 72 horas, as amostras foram retiradas do meio de cultura e mantidas em formol 10% tamponado por 36 horas. Posteriormente, foram desidratadas em álcool 70% por no mínimo 12 horas antes de ser emblocadas em parafina e da coloração dos cortes pelo Fontana‐Masson (FM).
Para estimar a melanização dos fragmentos, capturaram‐se quatro fotografias de áreas centrais e interfoliculares das amostras coradas pelo FM, privilegiaram‐se áreas hotspot. As imagens foram salvas em formato JPG (1264 × 681 pixels). Todo o processo de captura e análise ocorreu de maneira cega quanto à topografia ou ao tipo e regime de irradiação.
As imagens selecionadas foram analisadas no programa ImageJ 1.43, a partir da seleção manual da camada basal, seguida pela limiarização a partir do canal red.13
O principal desfecho do estudo foi o percentual de melanização da camada basal, comparado entre os grupos (melasma vs. pele normal adjacente) para cada radiação (UVB, UVA ou LV). Também foram avaliados o percentual de melanina na derme superficial, a contagem de dendritos e as granulações dos melanossomas (Escore: 1+, granulação fina; 2+, granulação moderada; 3+, granulação grosseira) nas áreas amostradas.
O valor médio do percentual de melanina da camada basal, da derme superior, a contagem de dendritos e os escores de granulação foram tabulados para cada espécime. Os grupos de comparação foram avaliados segundo modelo linear generalizado de efeitos mistos, ajustados pelo fototipo, análise robusta, com matriz de covariância não estruturada e correção post hoc de Sidak.14 As distribuições de probabilidade variaram para o tipo de variável analisada (ordinal e gama).
A amostra foi dimensionada após pré‐teste com a dosimetria de radiação que levava à expectativa de aumento de 10% no percentual de melanização na camada basal avaliada por análise de imagem digital das lâminas coradas pelo FM, consideraram‐se alfa 5% e poder de 20%.15
Os dados foram tabulados em MsExcel 2013, analisados no IBM SPSS 25. Considerou‐se significativo p‐valor ≤ 0,05 bicaudal.
ResultadosForam avaliados 89 fragmentos de pele de 22 portadores de melasma facial (um participante voluntariou‐se para a coleta de quatro amostras com o intuito de testar todas as irradiações). A idade média (desvio‐padrão) dos participantes foi de 42,1 (10,4) anos – 21 do sexo feminino – e quanto aos fototipos, III (46%), IV (27%) e V (27%). Houve contaminação em três fragmentos de cultura (UVA pele normal adjacente pré‐irradiação; UVB pele do melasma pós‐irradiação, UVB pele normal adjacente pós‐irradiação), que não foram incluídos na análise dos resultados.
Os pacientes cujas amostras foram submetidas à irradiação UVB, UVA e LV apresentavam, respectivamente, fototipos: III (33% vs. 37% vs. 0%), IV (44% vs. 37% vs. 71%) e V (22% vs. 25% vs. 28%) (p = 0,35).
Houve melanogênese no melasma e na pele normal adjacente (p < 0,01) após todas as irradiações (figs. 1‐3, tabela 1): mediana de incremento UVB (4,7% vs. 8,5%), UVA (9,5% vs. 9,9%) e LV (6,8% vs. 11,7%), sem diferença significativa na comparação entre as topografias.
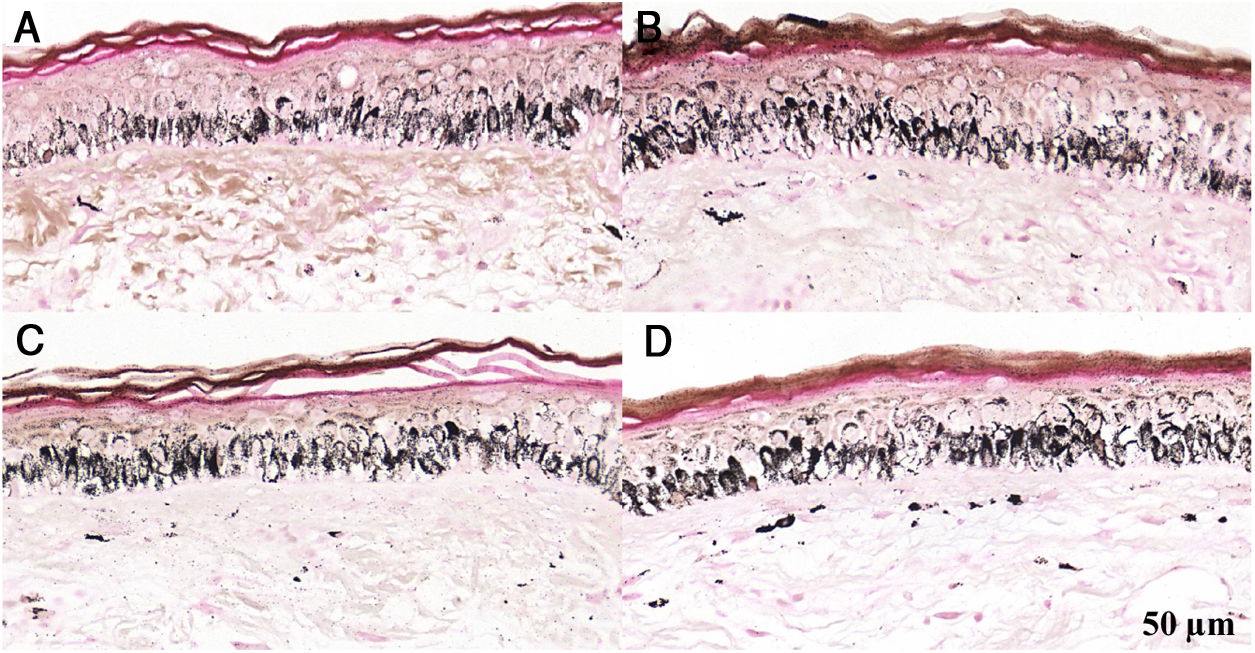
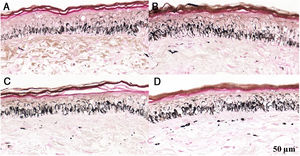
Fragmentos histológicos de pele corados pelo Fontana‐Masson de melasma facial e pele normal adjacente antes e após irradiação com 166mJ/cm2 UVB, revelam aumento da densidade de melanina basal entre as amostras. A, Pele normal adjacente pré‐irradiação UVB; B, pele normal adjacente pós‐irradiação UVB; C, pele com melasma pré‐irradiação UVB; D, pele com melasma pós‐irradiação com UVB.
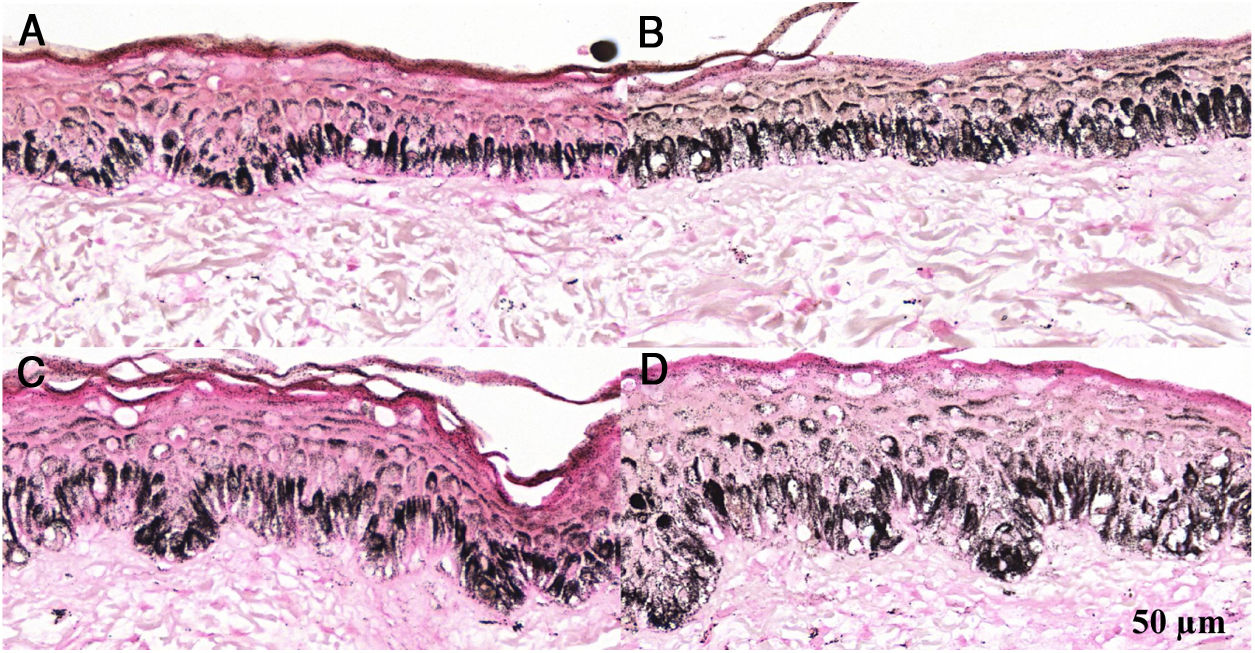
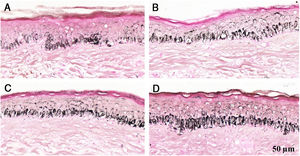
Fragmentos histológicos de pele corados pelo Fontana‐Masson de melasma facial e pele normal adjacente antes e após irradiação com 1.524mJ/cm2 UVB, revelam aumento da densidade de melanina basal entre as amostras. (A), pele normal adjacente pré‐irradiação UVB; (B), pele normal adjacente pós‐irradiação UVB; (C), pele com melasma pré‐irradiação UVB; (D), pele com melasma pós‐irradiação com UVB.
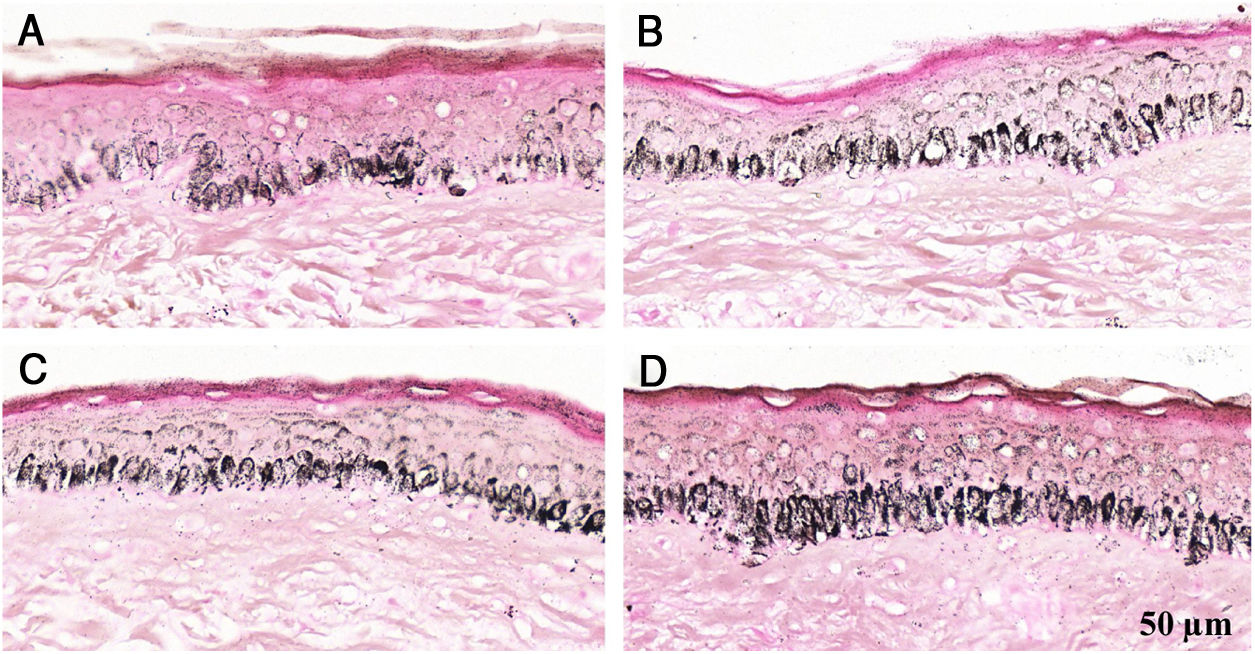
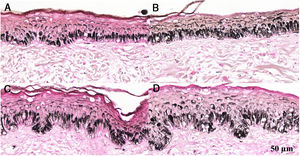
Fragmentos histológicos de pele corados pelo Fontana‐Masson de melasma facial e pele normal adjacente antes e após irradiação com 40J/cm2 luz visível, revelam aumento da densidade de melanina basal entre as amostras. (A), pele normal adjacente pré irradiação LV; (B), pele normal adjacente pós‐irradiação LV; (C), pele com melasma pré‐irradiação LV; (D), pele com melasma pós‐irradiação com LV.
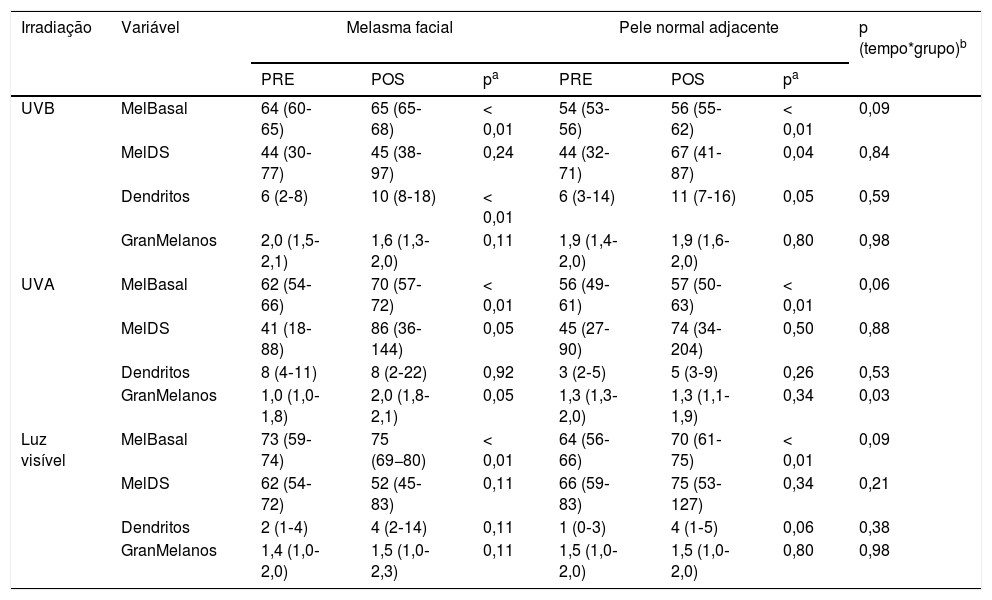
Mediana e quartis (p25‐p75) do percentual de melanina da camada basal, da derme superior, contagem de dendritos e granulação da melanina nos fragmentos de pele de melasma e pele não afetada adjacente, antes e após (PRE e POS) irradiação com UVB, UVA e luz visível (LV). Análise dos dados ajustada por fototipo
| Irradiação | Variável | Melasma facial | Pele normal adjacente | p (tempo*grupo)b | ||||
|---|---|---|---|---|---|---|---|---|
| PRE | POS | pa | PRE | POS | pa | |||
| UVB | MelBasal | 64 (60‐65) | 65 (65‐68) | < 0,01 | 54 (53‐56) | 56 (55‐62) | < 0,01 | 0,09 |
| MelDS | 44 (30‐77) | 45 (38‐97) | 0,24 | 44 (32‐71) | 67 (41‐87) | 0,04 | 0,84 | |
| Dendritos | 6 (2‐8) | 10 (8‐18) | < 0,01 | 6 (3‐14) | 11 (7‐16) | 0,05 | 0,59 | |
| GranMelanos | 2,0 (1,5‐2,1) | 1,6 (1,3‐2,0) | 0,11 | 1,9 (1,4‐2,0) | 1,9 (1,6‐2,0) | 0,80 | 0,98 | |
| UVA | MelBasal | 62 (54‐66) | 70 (57‐72) | < 0,01 | 56 (49‐61) | 57 (50‐63) | < 0,01 | 0,06 |
| MelDS | 41 (18‐88) | 86 (36‐144) | 0,05 | 45 (27‐90) | 74 (34‐204) | 0,50 | 0,88 | |
| Dendritos | 8 (4‐11) | 8 (2‐22) | 0,92 | 3 (2‐5) | 5 (3‐9) | 0,26 | 0,53 | |
| GranMelanos | 1,0 (1,0‐1,8) | 2,0 (1,8‐2,1) | 0,05 | 1,3 (1,3‐2,0) | 1,3 (1,1‐1,9) | 0,34 | 0,03 | |
| Luz visível | MelBasal | 73 (59‐74) | 75 (69−80) | < 0,01 | 64 (56‐66) | 70 (61‐75) | < 0,01 | 0,09 |
| MelDS | 62 (54‐72) | 52 (45‐83) | 0,11 | 66 (59‐83) | 75 (53‐127) | 0,34 | 0,21 | |
| Dendritos | 2 (1‐4) | 4 (2‐14) | 0,11 | 1 (0‐3) | 4 (1‐5) | 0,06 | 0,38 | |
| GranMelanos | 1,4 (1,0‐2,0) | 1,5 (1,0‐2,3) | 0,11 | 1,5 (1,0‐2,0) | 1,5 (1,0‐2,0) | 0,80 | 0,98 | |
MelBasal, percentual de melanina na camada basal da epiderme; MelDS, percentual de melanina na derme superior (×100); GranMelanoss, escore de granulação dos melanossomas da epiderme (1+, granulação fina; 2+, granulação moderada; 3+, granulação grosseira) – média de 4 campos.
Quando ajustado para o fototipo, a contagem de dendritos aumentou (68,8%) apenas após irradiação com UVB em ambas as topografias (tabela 1). Houve aumento no escore de granulação da melanina (melanossomas mais grosseiros) apenas após a irradiação com UVA e apenas na pele com melasma (p = 0,05). Houve também aumento do percentual de melanina na derme superior na pele adjacente após irradiação com UVB e no melasma após irradiação com UVA (p ≤ 0,05).
DiscussãoHouve efetiva melanogênese epidérmica nos modelos de pele (ex vivo) submetidos à UVB, UVA e LV, sem diferença quantitativa entre as topografias (melasma facial e pele normal adjacente), subsidiou a importância da fotoproteção de amplo espectro no tratamento de dermatoses pigmentares, como o melasma.16
As doses de radiação testadas, apesar de independentes, equivaleram a 6‐12 minutos de exposição solar ao meio‐dia, no verão, no interior do Brasil (latitude: 22°53’09”S; longitude: 48°26’42”W; altitude: 804 m), em dia sem nuvens, medida em 9/12/2018 pelos pesquisadores. Entretanto, os níveis de UVA e LV solares alcançam um platô de energia com duração entre 9 horas até as 18 horas, enquanto o UVB apresenta seu pico entre as 11 horas e as 15 horas, tanto no verão quanto no inverno. Isso pode justificar o relato de pioria do melasma após breves exposições desprotegidas fora do horário de pico de UVB, ou mesmo após longas exposições com fotoprotetor (p.ex., congestionamento no trânsito), visto que não há completo bloqueio das radiações solares pelos filtros solares.17 Em tempo, as radiações UVB, UVA e LV medidas em ambientes fechados (p.ex., telas de celular e computadores, lâmpadas fluorescentes) são desprezíveis para efeitos de melanogênese (dados não mostrados).
A LV tem amplo espectro de comprimentos de onda (400‐700nm) que não atuam de maneira homogênea na pigmentação. Um estudo feito na França testou o espectro da luz azul‐violeta (400‐500nm) em comparação com o espectro da luz vermelha (620‐750nm) e não houve pigmentação induzida pela segunda, o que justificou a escolha da faixa azul violeta para este estudo.18
Apenas filtros solares com cor apresentam proteção efetiva contra LV e, em sua maioria, apresentam também melhor desempenho na proteção UVA. Em levantamento brasileiro com 41 filtros solares opacos, 63% bloquearam > 99,9% de UVA e 63% bloquearam > 99,9% da transmitância da luz azul‐violeta. Entretanto, tal bloqueio não foi coincidente, já que 31% dos filtros opacos que bloquearam > 99,9% da LV não tiveram o mesmo desempenho quanto ao UVA.17 Em tempo, este estudo é o primeiro a evidenciar o papel da LV na melanogênese de pacientes com melasma facial.
Não ocorreu melanogênese diferencial entre a pele com melasma e normal adjacente nas doses testadas, o que não exclui a possibilidade de que a pele com melasma seja sensível a doses mais baixas de irradiação ou responda diferentemente a exposições repetidas. A própria maior pigmentação basal do melasma também pode significar um status de resistência à melanogênese induzida pela exposição crônica à radiação UV e LV. Além disso, há maior retenção epidérmica da melanina no melasma e sua melanogênese depende de diversas outras alterações dérmicas que favorecem a manutenção da pigmentação, em detrimento da indução melanogênica pela radiação UV e LV.4
A melanogênese ocorre de maneira desigual, depende do tipo e da dose de radiação. O UVB causa eritema que persiste por dias a semanas (depende do fototipo) e pigmentação que evolui para bronzeamento. O UVA provoca eritema em 4 horas e pigmentação imediata que evolui com bronzeamento duradouro. Na LV, o eritema é menos proeminente, pode ocorrer precocemente (2 horas) e a pigmentação é sustentada com evolução para bronzeamento, porém apenas nos fototipos altos.19–21
Toda resposta melanogênica acontece de maneira dose‐dependente. No entanto, é indispensável considerar os fototipos na análise da atuação das diferentes radiações, já que a melanogênese atua de modo diferente nos fototipos mais altos (III‐V), provoca maior pigmentação com evolução para bronzeamento de modo dose‐dependente, diferentemente dos fototipos mais baixos (I‐II), em que a irradiação promove menor estímulo. Em estudo experimental, UVA e LV não induziram melanogênese em pacientes com fototipo II.11,22
A melanôgenese humana é um processo complexo em que diferentes interações ocorrem de maneira organizada para a proteção das estruturas cutâneas, além de regulação de ciclos essenciais para a sobrevivência do indivíduo, como o ciclo circadiano. Os melanócitos compõem uma rede com uma leitura própria da luz ambiental que responde de acordo com os objetivos supracitados.23
Houve diferentes características na resposta melanogênica entre as topografias e entre as radiações. A formação de dendritos ocorre na fase G2 do crescimento dos melanócitos e representa um importante sinal de resposta melanogênica, em nosso caso induzida principalmente pela irradiação de maior potencial mutagênico (UVB). Apesar de a melanogênese ser percebida de modo semelhante em ambas as topografias, a formação de dendritos pode significar maior persistência do fenômeno e maior eficiência na transferência de melanossomas na epiderme.11
A pele com melasma também se caracteriza pela presença de melanossomas mais maduros, equivalentes ao que ocorre em populações mais pigmentadas. Neste experimento, a irradiação UVA promoveu granulação mais evidente do que as demais radiações testadas, exclusivamente na pele com melasma, evidenciou que a melanogênese do melasma ocorra de modo mais intenso e assemelhe‐se aos fenótipos mais pigmentados. De fato, a miscigenação africana foi associada ao maior risco de melasma em nossa população e genes ancestrais relacionados à melanogênese podem justificar a resposta pigmentar diferenciada entre as topografias.7
O papel da melanina dérmica permanece sem definição clara no melasma; uma das hipóteses é que a disfunção arquitetural da membrana basal e a autofagia dos melanócitos da derme possam ocasionar a presença dos melanófagos dérmicos, semelhantemente ao ocorrido no fotoenvelhecimento.24,25 Neste estudo, UVA e UVB promoveram maior taxa de melanina na derme superior; entretanto, tal densidade é cerca de 100 vezes menor do que a epidérmica em ambas as topografias, o que deve contribuir pouco para o fenótipo clínico, mas pode sinalizar alterações subjacentes na derme superior, zona de membrana basal e camada basal.
Finalmente, apesar do papel fundamental da radiação solar no agravamento do melasma, não foram evidenciadas expressões diferenciais de p53 entre a pele com melasma e normal adjacente, sugeriu‐se que a manutenção da melanogênese possa se dever a alterações subjacentes da derme superior e da epiderme, que induzem a hiperfunção melanocítica.4 Ademais, o uso exclusivo de filtro solar, apesar de efeito preventivo, não é suficiente para a completa remissão do quadro, o que significa a necessidade de contínuo estudo fisiopatológico em busca de tratamentos que levem à reversão de todo o processo.9,26
O presente estudo promoveu uma análise preliminar dos efeitos independentes das radiações UVB, UVA e LV. Novas investigações devem ser conduzidas a fim de elucidar o efeito de combinações e dosagens de irradiações que espelhem as condições ambientais. A interação entre UVA e LV ainda é desconhecida; acredita‐se que interajam no mesmo precursor de melanina durante a melanogênese. Essa associação provavelmente resulta em um comportamento mais evidente da melanogênese em situações naturais, nas quais LV e UVA expressam‐se conjuntamente.20
Este estudo apresenta limitações inerentes à técnica com modelo ex vivo, pode sofrer alterações quanto às diferentes condições de coleta e armazenamento. Entretanto, não impediu a identificação de resposta melanogênica. Outra limitação pode ser apontada pelo fato de as irradiações nos modelos de pele ex vivo ocorrerem com comprimentos de onda independentes (UVB, UVA e LV), o que não acontece na exposição ambiental. Além dos fatores apresentados, os modelos ex vivo estão dissociados do organismo, limitam a interação entre os sistemas hormonal, neural e vasomotor.
Novas experimentações devem considerar modelos de irradiações repetidas de baixa intensidade, assim como associadas entre si, a fim de reproduzir a exposição cotidiana dos pacientes. Além disso, pode‐se testar a inclusão de ativos como ácido tranexâmico e antioxidantes na prevenção da melanogênese no melasma.
ConclusãoHouve resposta melanogênica epidérmica tanto na pele com melasma quanto na pele normal adjacente induzida por UVB, UVA ou LV. Os padrões morfológicos relacionados à fotobiologia da melanogênese sugerem que diferentes radiações promovam respostas individualizadas na pele com melasma.
Suporte financeiroCNPq (Pibic no.148501/2018‐4); Funaderm (001/2019).
Contribuição dos autoresGiovana Piteri Alcântara: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Ana Cláudia Cavalcante Espósito: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Thainá Oliveira Felicio Olivatti: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Melissa Mari Yoshida: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Hélio Amante Miot: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Alcantara GP, Esposito ACC, Olivatti TOF, Yoshida MM, Miot HA. Evaluation of ex vivo melanogenic response to UVB, UVA, and visible light in facial melasma and unaffected adjacent skin. An Bras Dermatol. 2020;95:684–90.
Trabalho realizado no Departamento de Dermatologia e Radioterapia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.