A cicatriz hipertrófica (CH), alteração fibroproliferativa que corresponde à cicatrização aberrante de feridas após lesões de pele como queimaduras, lacerações e cirurgias, é caracterizada pela proliferação invasiva de fibroblastos e acúmulo excessivo de matriz extracelular (MEC). A desregulação da autofagia é a base fisiopatológica da formação da CH. Anteriormente, descobriu‐se que a angiopoietina‐2 (ANGPT2) era superexpressa em fibroblastos de CH (FCH) em comparação com fibroblastos normais da pele. Entretanto, ainda não está claro se a ANGPT2 participa do processo de formação de CH, bem como os potenciais mecanismos moleculares.
ObjetivoO presente estudo mostrou o papel da ANGPT2 e da autofagia mediada por ANGPT2 durante o desenvolvimento da CH.
MétodosRT‐qPCR foi usada para detectar a expressão da ANGPT2 em tecidos de CH e FCH. Os FCH foram transfectados com sh‐ANGPT2 para reduzir a expressão da ANGPT2 e depois tratados com MHT1485, o agonista de mTOR. Os efeitos de sh‐ANGPT2 ou MHT1485 na proliferação, migração, autofagia e acúmulo de MEC de FCH foram avaliados por ensaio CCK‐8, ensaio Transwell e Western blotting. A expressão de moléculas relacionadas à via PI3K/Akt/mTOR (p‐PI3K, p‐Akt e p‐mTOR) foi avaliada por Western blotting.
ResultadosA expressão de ANGPT2 esteve acentuadamente aumentada em tecidos de CH e FCH. O knockdown de ANGPT2 diminuiu a expressão de p‐PI3K, p‐Akt e p‐mTOR. O knockdown de ANGPT2 ativou a autofagia e inibiu a proliferação, a migração e o acúmulo da MEC de FCH. Além disso, o tratamento de MHT1485, o agonista mTOR, em FCH com regulação negativa de ANGPT2, reverteu parcialmente a influência do knockdown de ANGPT2 em FCH.
Limitações do estudoO estudo necessita de modelos animais in vivo mais estáveis de CH para investigar os efeitos da ANGPT2 na formação da CH.
ConclusõesA regulação negativa da ANGPT2 inibe o crescimento, a migração e o acúmulo de MEC de FCH por meio da ativação de autofagia pela supressão da via PI3K/Akt/mTOR. O presente estudo indica novo alvo terapêutico potencial para CH.
A cicatriz hipertrófica (CH), alteração fibroproliferativa que corresponde a uma cicatrização aberrante de feridas após lesões na pele, como queimaduras, lacerações e cirurgia, é caracterizada pelo crescimento invasivo de fibroblastos e acúmulo excessivo de matriz extracelular (MEC).1 A destruição da estrutura do tecido da pele pode levar a vários graus de disfunção de tecidos ou órgãos, e até mesmo incapacidade, fazendo com que a CH se torne problema de saúde social cada vez maior.2 De acordo com as estatísticas, a incidência de cicatrizes após a cirurgia em indivíduos chineses é de 70%, e a incidência de cicatrizes em pacientes queimados chega a 90%.3 Atualmente, a terapia da CH inclui ressecção cirúrgica, tratamento a laser e cobertura com gel de silicone.4 Entretanto, em decorrência de diferenças individuais, os resultados permanecem insatisfatórios.5 Portanto, é imperativo identificar os mecanismos moleculares subjacentes à formação de CH para o desenvolvimento de novas estratégias terapêuticas para o tratamento das mesmas.
A autofagia é processo fundamental para a renovação de substâncias intracelulares em eucariontes, durante o qual as organelas ou proteínas danificadas são envolvidas por vesículas autofágicas e, em seguida, enviadas para vacúolos ou lisossomos para reciclagem e degradação.6 A autofagia é uma resposta celular para manter a homeostase da estrutura e a função do tecido7 e desempenha papel crucial na patogênese de inúmeras doenças.8 Além disso, foi relatado que a autofagia está fortemente associada à sobrevivência, diferenciação e manutenção de fibroblastos durante o processo de cicatrização de feridas, o que indica que a desregulação da autofagia é a base fisiopatológica da formação de CH.9,10
A angiopoietina‐2 (ANGPT2), como fator de crescimento, pertence à via angiopoietina/Tie.11 É uma proteína de 496 aminoácidos com domínio semelhante ao fibrinogênio no terminal COOH, domínio espiralado no terminal NH2 e peptídeo de sinal de secreção.12 A ANGPT2 foi identificada como mediadora significativa de fibrose renal e autofagia na nefropatia diabética, cujo knockdown aumentou o nível de autofagia e atenuou a fibrose renal por meio da ativação da via MEK/ERK/Nrf‐1.13 Em estudo anterior, a ANGPT2 foi superexpressa (fold change> 20) em fibroblastos derivados de tecidos de CH em comparação com fibroblastos de tecidos normais da pele.14 Entretanto, ainda não está claro se a ANGPT2 participa da autofagia durante a formação da CH, bem como os potenciais mecanismos moleculares. Além disso, a ANGPT2 demonstrou regular a via de sinalização fosfoinositida 3‐quinase (PI3K)/Akt.15 A via PI3K/Akt é importante modulador upstream da quinase alvo da rapamicina em mamíferos (mTOR), um complexo de dois componentes mTOR, mTORC1 e mTORC2, com mTORC1 sendo importante regulador negativo da autofagia.16 Portanto, a via PI3K/Akt/mTOR foi identificada como intimamente associada à autofagia durante o desenvolvimento de muitas doenças humanas.17 O presente estudo objetiva descobrir se a ANGPT2 regula a autofagia durante a formação de CH através da via PI3K/Ak/mTOR.
No presente estudo, primeiramente foi detectada a expressão de ANGPT2 em tecidos de CH e fibroblastos de cicatriz hipertrófica (FCH) em comparação com tecidos normais e fibroblastos de pele normal. Autofagia, crescimento e migração de FCH e acúmulo de MEC foram avaliados após a regulação negativa de ANGPT2 para investigar o papel da ANGPT2 na formação de CH, e o mecanismo regulatório detalhado também foi explorado posteriormente. Os achados do presente estudo podem indicar novo alvo terapêutico potencial para CH.
Materiais e métodosColeta de tecidosTecidos de CH foram obtidos 1, 3, 6 e 12 meses após queimadura profunda de segundo e terceiro graus, bem como tecidos de pele normal adjacente de 40 pacientes adultos que foram diagnosticados com CH por exames anatomopatológicos de rotina e que foram submetidos à excisão cirúrgica no General Hospital of Central Theater Command of People's Liberation Army. Todos os pacientes (faixa etária, 23 a 59 anos; proporção de gênero, 1:1) eram asiáticos com cor da pele amarela. Entre os 40 casos, havia 16 casos de escaldadura hidrotérmica, 13 casos de queimadura por chama, oito casos de escaldadura por vapor e três casos de lesão por queimadura elétrica. Os casos envolviam várias partes do corpo, incluindo membros superiores (n=15), membros inferiores (n=12), tórax (n=8) e abdome (n=5). Antes da excisão dos tecidos de CH, a pele foi higienizada com peróxido de hidrogênio a 3% e, em seguida, depilada com lâmina descartável (BIC® Twin Lady Sensitiv, Société BIC, França) e espuma de barbear. Durante a cirurgia, os tecidos de CH foram completamente excisados e os tecidos de pele normal foram obtidos após essa excisão. Todos os tecidos foram imediatamente congelados em nitrogênio líquido e armazenados a −80°C para posterior preparação de RNA total e lisados de proteína total.
Pacientes com CH identificadas por médicos foram incluídos neste estudo. Nenhum paciente recebeu qualquer tratamento local com laser, medicamento ou outro tratamento da cicatriz, bem como qualquer medicação hormonal, nos três meses anteriores à cirurgia. Pacientes com quaisquer outras doenças infecciosas, imunológicas ou de pele foram excluídos. Antes da cirurgia, todos os pacientes foram informados sobre o objetivo e os procedimentos do estudo e concordaram em oferecer seus tecidos excisados. O consentimento informado por escrito foi obtido de todos os participantes. Todos os protocolos desse estudo foram aprovados pelo Comitê de Ética do General Hospital of Central Theater Command of People's Liberation Army.
Cultura de célulasFCH e fibroblastos normais adquiridos da American Type Culture Collection (ATCC, Manassas, VA, EUA) foram incubados em meio de Eagle Dulbecco modificado (DMEM, Gibco, Carlsbad, CA, EUA) contendo 10% de soro fetal bovino (FBS, Gibco). Todas as células foram mantidas em atmosfera umidificada com 5% de CO2 a 37°C.
Transfecção celularOs FCH foram semeados em placas de seis poços e incubados a 37°C até 80% de confluência antes da transfecção celular. O RNA hairpin curto (shRNA) direcionado contra ANGPT2 (sh‐ANGPT2) e um shRNA controle negativo scramble (sh‐NC) foram sintetizados pela GenePharma (Xangai, China). Em seguida, eles foram transfectados em FCH usando lipofectamine 3000 (Invitrogen). Vinte e quatro horas após a transfecção, sua eficiência foi avaliada por RT‐qPCR.
Reação em cadeia da polimerase via transcriptase reversa quantitativa (qRT‐PCR).O RNA total foi extraído de tecidos de CH e FCH usando o reagente TRIzol (Invitrogen). Em resumo, 500 ng de RNA total foram transcritos de forma reversa em cDNA usando um kit de transcrição reversa de cDNA (Takara, Japão). A amplificação do cDNA foi realizada com um kit SYBR Green PCR (Takara) no sistema ABI 7500 (Applied Biosystems, Foster, CA). Gliceraldeído‐3‐fosfato desidrogenase (GAPDH) serviu como referência interna para normalizar a expressão dos genes alvo. Os níveis de expressão do gene alvo foram quantificados usando o método 2‐ΔΔCt. As sequências de primers para PCR foram as seguintes: GAPDH forward, 5’‐TCATTTCCTGGTATGACAACGA‐3’ e reverse, 5’‐GTCTTACTCCTTGGAGGCC‐3’; ANGPT2 forward, 5’‐CAATTATTCAGCGACGTGAG‐3’ e reverse, 5’‐AAGGGTTACCAAATCCCAC‐3’.
Western blottingOs níveis de proteína de ANGPT2 em tecidos de CH e FCH, bem como os níveis de proteína dos marcadores da via PI3K/AKT/mTOR (PI3K, fosfo‐PI3K p‐PI3K, Akt, fosfo‐Akt [p‐Akt], mTOR, fosfo‐mTOR [p‐Mtor]), marcadores de migração celular (matriz metaloproteinases 2 [MMP2, MMP9]), marcadores de MEC (actina alfa de músculo liso [α‐SMA], colágeno tipo 1 [Col 1 e Col 3]) e marcadores de autofagia (LC3B, P62, Beclin‐1 e proteína 5 relacionada à autofagia [ATG5]) em FCH foram medidos utilizando‐se Western blotting. A proteína total foi extraída de tecidos de CH ou FCH usando tampão de ensaio de radioimunoprecipitação (Beyotime) contendo inibidores de protease (Beyotime). A concentração de proteínas foi determinada usando um kit de ensaio de proteína de ácido bicinconínico (Beyotime). Em seguida, quantidades iguais de proteínas extraídas foram submetidas à eletroforese em gel de poliacrilamida‐dodecil sulfato de sódio (SDS‐PAGE) e depois transferidas para uma membrana de PVDF (Millipore, Bedford, MA, EUA). A membrana foi bloqueada com leite desnatado a 5% por 1 hora, seguido de incubação com anticorpo primário contra ANGPT2 (1:1000, ab199133), PI3K (1:1000, ab191606), p‐PI3K (1:1000, ab138364), Akt (1:2000, ab32505), p‐Akt (1:1000, ab38449), mTOR (1:10000, ab134903), p‐mTOR (1:1000, ab109268), MMP2 (1:1000, ab92536), MMP9 (1:1000, ab76003), Col 1 (1:1000, ab275746), Col 3 (1:5000, ab7778), α‐SMA (1:10000, ab124964), LC3B (1:2000, ab192890), P62 (1:1000, ab155686), Beclin‐1 (1:2000, ab207612), ATG5 (1:1000, ab108327) and GAPDH (1:10000, ab181602) a 4°C por uma noite, todos adquiridos de Abcam (Cambridge, Reino Unido). No dia seguinte, a membrana foi lavada três vezes com TBST e depois incubada com anticorpos secundários conjugados com HRP à temperatura ambiente durante 2 horas. As bandas de proteína foram detectadas utilizando‐se um kit de detecção ECL (Thermo Fisher Scientific).
Ensaio do kit‐8 de contagem de células (CCK‐8)O ensaio CCK‐8 foi empregado para avaliar a capacidade de proliferação celular. Após 48 horas de transfecção com sh‐NC ou sh‐ANGPT2, os FCH foram semeados em placas de 96 poços (5×103 células/poço). Vinte e quatro horas depois, 10μL de solução de CCK‐8 (Sigma‐Aldrich) foram adicionados a cada poço. Após 2 horas de incubação, a proliferação de FCH foi avaliada medindo‐se a absorbância em diferentes momentos (24, 48 e 72 horas) utilizando um leitor de microplacas a 450nm
Ensaio de migração TranswellA câmara Transwell (8μm de diâmetro, Corning) foi usada para medir a capacidade de migração celular. A câmara inferior foi preenchida com 500μL de meio FBS a 20%. Após 48 horas de transfecção, os FCH foram colhidos, lavados com PBS e ressuspensos em DMEM sem FBS. Em seguida, 200μL de suspensão de células (1 × 105 células) foram colocados na câmara superior e depois cultivados por 24 horas a 37°C. As células que não migraram foram removidas cuidadosamente com um cotonete. As células migratórias foram coradas com cristal violeta a 0,5% após fixação com metanol a 100% e observadas em microscópio invertido.
Análise estatísticaOs dados de pelo menos três experimentos independentes são expressos como média±desvio padrão. O software SPSS 20.0 (IBM, Chicago, IL, EUA) foi utilizado para análise estatística. A análise estatística dos dados pelo teste de normalidade de Shapiro‐Wilk mostrou que todos os dados tinham uma distribuição normal. Portanto, as comparações estatísticas contendo dois ou mais grupos foram realizadas por meio do teste t de Student ou análise de variância (ANOVA) unidirecional seguido pelo teste post‐hoc de Tukey. O valor de p <0,05 foi considerado como estatisticamente significativo.
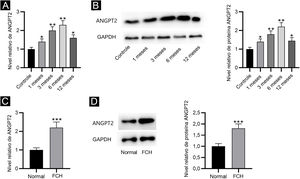
ResultadosA ANGPT2 é regulada positivamente em tecidos de CH e FCHPrimeiro, os resultados de RT‐qPCR e Western blotting revelaram que a expressão e os níveis de proteína da ANGPT2 estavam gradualmente elevados nos tecidos de CH em um, três e seis meses após a queimadura e foram parcialmente recuperados em 12 meses (fig. 1A‐B). Além disso, a ANGPT2 também apresentou expressão e níveis de proteína notavelmente regulados positivamente em FCH versus fibroblastos normais (fig. 1C‐D). Portanto, a ANGPT2 é regulada positivamente em tecidos de CH e FCH.
Expressão de ANGPT2 em tecidos de CH e FCH. (A‐B) A expressão de ANGPT2 em tecidos de CH versus tecidos normais da pele foi avaliada por RT‐qPCR e Western blotting. (C‐D) A expressão de ANGPT2 em FCH em comparação com fibroblastos normais foi avaliada por RT‐qPCR e Western blotting. *p <0,05, **p <0,01, ***p <0,001.
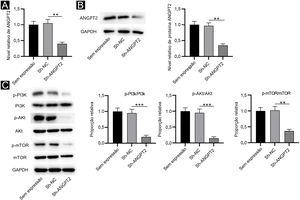
RT‐qPCR e Western blotting mostraram que a expressão de ANGPT2 estava significativamente reduzida em FCH transfectados com sh‐ANGPT2 versus grupo sh‐NC (fig. 2A‐B). O knockdown da ANGPT2 reduziu drasticamente os níveis de proteína de p‐PI3K, p‐Akt e p‐mTOR em FCH versus o grupo sh‐NC (fig. 2C). Esses dados indicaram que a regulação negativa de ANGPT2 inativa a via PI3K/Akt/mTOR em FCH.
Efeitos do knockdown de ANGPT2 na via PI3K/Akt/mTOR em FCH. (A‐B) A expressão da ANGPT2 em FCH transfectados com sh‐ANGPT2 ou sh‐NC foi medida por RT‐qPCR e Western blotting. (C) Os níveis de proteínas relacionadas à via PI3K/Akt/mTOR em FCH após a regulação negativa de ANGPT2 foram medidos por Western blotting. **p <0,01, ***p <0,001.
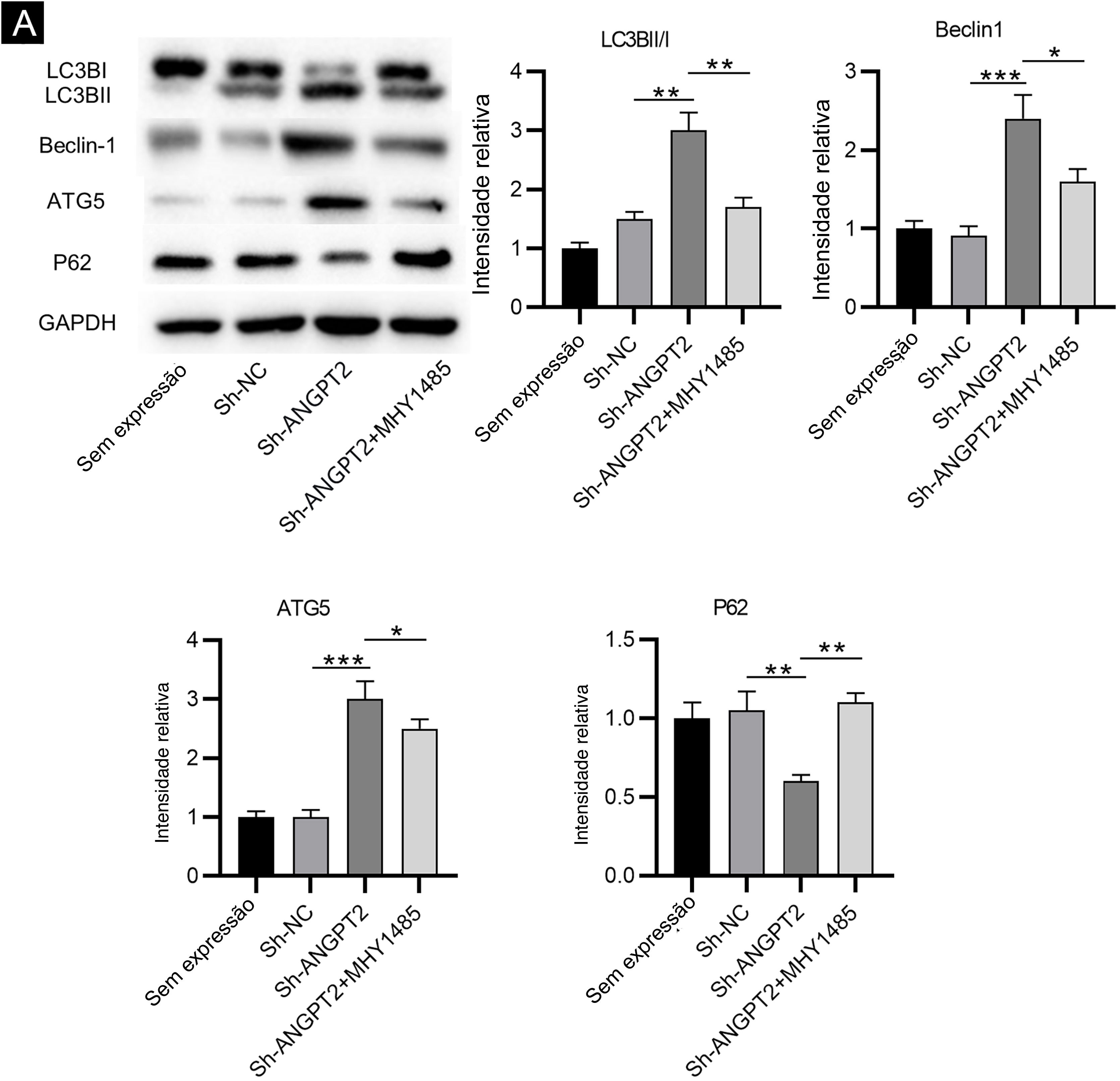
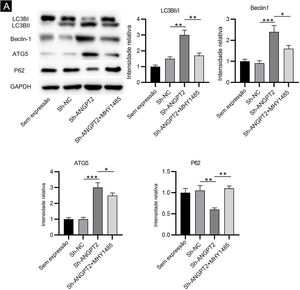
Como mostrado por Western blotting, os níveis de proteína de LC3B І e P62 estavam acentuadamente reduzidos, enquanto os níveis das proteínas de LC3B II, Beclin‐1 e ATG5 estavam acentuadamente elevados em FCH após a regulação negativa de ANGPT2. Observou‐se que a proporção de LC3B I e LC3B II estava obviamente aumentada após o knockdown de ANGPT2 (fig. 3A). Além disso, também foi observado que o tratamento com MHY1485, um ativador de mTOR, reverteu a influência da regulação negativa de ANGPT2 nos níveis de proteína dos marcadores de autofagia acima mencionados em FCH (fig. 3A‐E). Portanto, concluímos que a inibição de ANGPT2 ativa a autofagia por meio da repressão da via PI3K/Akt/mTOR em FCH.
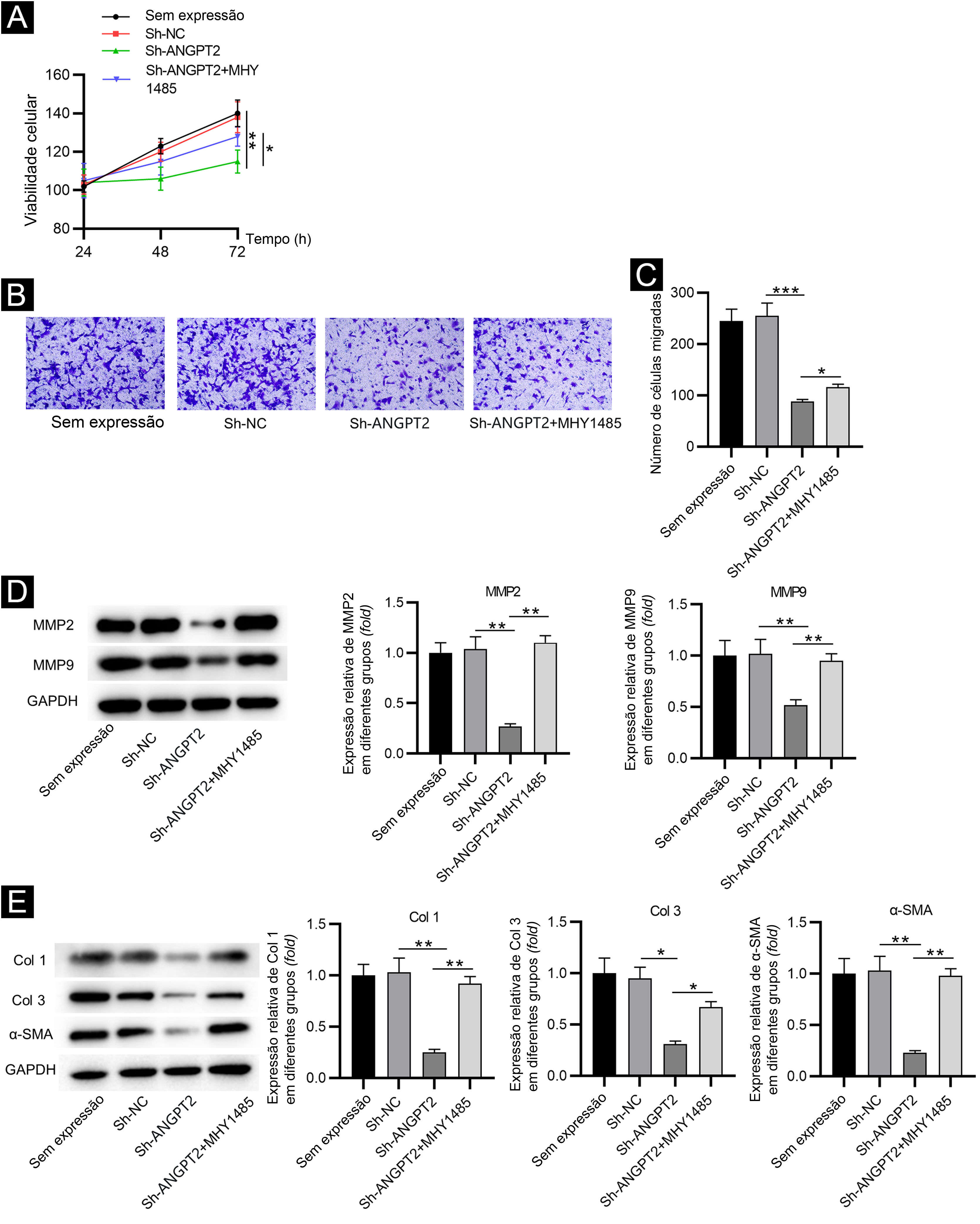
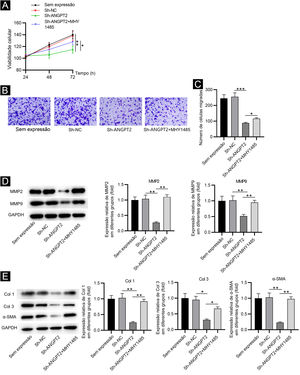
A inibição de ANGPT2 melhora a disfunção celular por meio da supressão da via PI3K/Akt/mTORO ensaio CCK‐8 demonstrou que a proliferação de FCH foi inibida após a regulação negativa de ANGPT2, enquanto o tratamento com MHY1485 reverteu parcialmente essa alteração (fig. 4A). O knockdown de ANGPT2 também reprimiu a migração de FCH, que foi parcialmente restaurada após o tratamento com MHY1485 (fig. 4B‐C). Os níveis de MMP2 e MMP9 foram reduzidos após a regulação negativa de ANGPT2, e foram restaurados após o tratamento subsequente com MHY1485 (fig. 4D). Além disso, uma diminuição significativa nos níveis das proteínas α‐SMA, Col 1 e Col 3 foi observada em FCH transfectados com sh‐ANGPT2. Entretanto, a adição de MHY1485 atenuou a influência inibitória do knockdown de ANGPT2 nos níveis de α‐SMA, Col 1 e Col 3 (fig. 4E). Em conclusão, o knockdown de ANGPT2 alivia a proliferação, a migração e o acúmulo de MEC anormais em FCH durante a formação de CH por meio da supressão da via PI3K/Akt/mTOR.
Efeitos do knockdown de ANGPT2 sobre a proliferação e migração de FCH, bem como no acúmulo de MEC. (A) O ensaio CCK‐8 foi realizado para avaliar a proliferação de FCH nos grupos Sem expressão, sh‐NC, sh‐ANGPT2 e sh‐ANGPT2+MHY1485. (B‐C) O ensaio Transwell foi realizado para avaliar a migração de FCH nos quatro grupos acima. (D) Os níveis de proteínas relacionadas à migração nos quatro grupos acima foram medidos por Western blotting. (E) Western blotting foi realizado para avaliar a expressão de proteínas relacionadas à MEC nos quatro grupos acima. *p <0,05, **p <0,01, ***p <0,001.
A CH é uma complicação prevalente durante o processo de cicatrização de feridas, que traz grande desconforto aos pacientes.18 A terapia atual para CH, incluindo ressecção cirúrgica, terapia a laser, terapia com malhas compressivas e o uso de medicamentos para melhorar a aparência das cicatrizes, como gel de silicone, geralmente apresenta limitações e o resultado não é satisfatório.19 Desse modo, o presente estudo pretende explorar os mecanismos moleculares subjacentes ao processo de formação de CH, descobrindo assim potenciais alvos para o tratamento das mesmas. O presente estudo demonstrou que a ANGPT2, que estava regulada positivamente no tecido de CH e FCH, ativou a autofagia por meio da inibição da via PI3K/Akt/mTOR. Além disso, o knockdown de ANGPT2 atenuou o crescimento excessivo, a migração e o acúmulo de MEC por meio da inibição da via PI3K/Akt/mTOR, o que atenuou a formação de CH.
A formação de CH é causada principalmente pela proliferação e migração aberrantes de FCH, bem como deposição excessiva de MEC.20 Anteriormente, muitos estudos relataram que a formação de CH poderia ser atenuada pela supressão do crescimento anormal de FCH e deposição excessiva de MEC. Por exemplo, miR‐519d reduz a proliferação e induz a apoptose de FCH e reprime a expressão de genes relacionados à MEC, inibindo assim a formação de CH.21 A regulação negativa de p75NTR suprime o crescimento, a migração e o acúmulo de MEC de FCH, atenuando assim a formação de CH.22 A ANGPT2 é uma proteína secretada e um membro da família da angiopoietina, sendo fator‐chave representativo para angiogênese e remodelação vascular.23 A angiogênese tem papel crucial no processo de cicatrização de feridas, e relatos demonstram que cicatrizes hipertróficas contêm mais microvasos do que a derme normal.24 Até agora, a terapia antiangiogênica foi confirmada como estratégia eficaz para a intervenção precoce em CH e foi utilizada para atenuar a formação de CH.25 A ANGPT2 foi superexpressa de maneira significativa em fibroblastos derivados de tecidos de CH em comparação com fibroblastos de tecidos normais da pele em estudo anterior,14 o que sugere que a mesma pode participar do processo de formação de CH. No presente estudo, primeiro verificou‐se que a expressão de ANGPT2 era maior em tecidos de CH e FCH do que em tecidos de pele normal e fibroblastos de pele normal. Então a ANGPT2 foi regulada negativamente em FCH, e verificou‐se que a proliferação e migração anormais foram suprimidas. Foi relatado que as MMPs desempenham papéis significativos em vários estágios do processo de cicatrização de feridas, entre as quais MMP2 e MMP9 que estão intimamente relacionadas à migração de fibroblastos.26 Utilizando Western blotting, verificou‐se também que os níveis de MMP2 e MMP9 em FCH estavam reduzidos após o knockdown de ANGPT2. Além disso, como sabemos, a deposição excessiva de MEC resultará na fibrose do órgão, incluindo a pele, o maior órgão do corpo humano.27 O colágeno é o componente mais importante da MEC.28 Também foi demonstrado que a expressão de α‐SMA aumenta à medida que o grau de fibrose do órgão aumenta.29 Demonstrou‐se que Col 1, Col 3 e α‐SMA estão visivelmente aumentadas em CH e tem participação vital durante a formação do ambiente de MEC fibrótica.30 Assim, foram detectados os níveis de α‐SMA, Col 1 e Col 3 em FCH após a regulação negativa de ANGPT2 utilizando Western blotting, o que indicou que o knockdown de ANGPT2 reduziu os níveis das proteínas α‐SMA, Col 1 e Col 3. Portanto, verificou‐se que a inibição de ANGPT2 suprime o crescimento, a migração e o acúmulo de MEC em FCH, o que atenua o desenvolvimento de CH.
Autofagia refere‐se ao processo pelo qual a membrana de dupla camada liberada da zona de fixação no ribossomo do retículo endoplasmático rugoso envolve parte do citoplasma e as organelas e proteínas que precisam de degradação na célula para formar autofagossomos.31 Como processo fisiológico fortemente modulado, a autofagia é importante para o desenvolvimento, a diferenciação e a manutenção celular.32 Foi relatado que a ativação da autofagia induz a supressão da proliferação, a migração celular e o acúmulo de MEC.33,34 Em estudo anterior, uma capacidade autofágica reduzida dos fibroblastos foi associada à patogênese da CH.35 Então, o presente estudo também investigou a influência do knockdown da ANGPT2 na autofagia de FCH. A ATG5, proteína estrutural composta por uma região de feixe α‐helicoidal (HBR, helical bundle region) e dois domínios de dobra semelhante à ubiquitina (UFDs, ubiquitin‐like‐fold domains), faz parte do complexo ATG12‐ATG5 envolvido na formação ou alongamento de autofagossomos, agindo como enzima semelhante a E3 na lipidação de LC3.36 Durante o processo de autofagia, LC3I é acoplada com fosfatidiletanolamina (PE) na presença de ATG5/ATG12 para formar LC3II, localizada nas membranas interna e externa da autofagia. 37 A presença de LC3 II é considerada símbolo da formação do autofagossomo.38 A p62 é uma proteína adaptadora multifuncional que geralmente é selecionada como substrato da autofagia.39 Na autofagia intacta, p62 tem uma região de interação curta com LC3 que promove interação direta com LC3 e faz com que a p62 seja especificamente degradada pela autofagia.40 O nível de p62 tem sido utilizado como marcador para inibição de autofagia ou defeitos na degradação autofágica.41 Beclin‐1, como proteína de autofagia com autofagossomo maduro em mamíferos, também é um fator importante na regulação da autofagia.42 Em estudos anteriores, a alteração nos níveis de LC3B I, LC3B II, p62, ATG5 e Beclin‐1 foi avaliada para investigar a autofagia.43–45 No presente estudo, os níveis dessas proteínas associadas à autofagia em FCH também foram avaliados após a regulação negativa de ANGPT2. Descobriu‐se que o knockdown de ANGPT2 reduziu os níveis de LC3B I e P62 e aumentou os níveis de LC3B II, ATG5 e Beclin‐1, o que demonstrou a ativação da autofagia. Portanto, os autores concluíram que a influência inibitória da ANGPT2 no crescimento, migração de FCH e acúmulo de MEC foi alcançada por meio da ativação da autofagia.
Muitas vias estão envolvidas na autofagia, entre as quais a via PI3K/Akt/mTOR tem sido amplamente investigada.46 Foi relatado em estudos anteriores que durante o desenvolvimento de múltiplas doenças, a autofagia celular é ativada por meio da supressão da via PI3K/Akt/mTOR. Por exemplo, PSORI‐CM02 induz a autofagia por meio da inibição da via PI3K/Akt/mTOR, aliviando assim o desenvolvimento da psoríase, doença inflamatória da pele.47 O sulfeto de hidrogênio exógeno restringe o desenvolvimento do melanoma da pele humana, facilitando a autofagia nas células de melanoma por meio da repressão da via PI3K/AKT/mTOR.48 Além disso, durante a formação de CH, foi relatado que o silenciamento de p75NTR ativa a autofagia inibindo a via PI3K/Akt/mTOR.22 Portanto, foi avaliado se o knockdown de ANGPT2 exerce efeitos sobre a autofagia durante o processo de formação de CH por meio da mediação da via PI3K/Akt/mTOR. Inicialmente, os níveis de proteína de p‐PI3K, p‐Akt e p‐mTOR foram detectados em FCH, que mostraram uma redução significativa após a regulação negativa da ANGPT. Isso sugeriu que a via PI3K/Akt/mTOR foi restringida pela regulação negativa da ANGPT. Posteriormente, para confirmar o mecanismo regulatório da ANGPT2, o agonista de mTOR MHY1485 foi usado para ativar essa via. Foi observado que o tratamento com MHY1485 reduziu a atividade da autofagia em FCH com regulação negativa de ANGPT2 versus células somente com regulação negativa da ANGPT2. De maneira similar, a inibição da regulação negativa de ANGPT2 no crescimento, migração e acúmulo de MEC de FCH foi parcialmente restaurada após o tratamento com MHY1485. Coletivamente, a regulação negativa de ANGPT2 reprimiu o crescimento, migração e acúmulo de MEC de FCH pela ativação da autofagia através da inibição da via PI3K/Akt/mTOR.
ConclusãoO presente estudo demonstrou pela primeira vez que a inibição de ANGPT2 ativou a autofagia por meio da supressão da via PI3K/Akt/mTOR. Além disso, o knockdown da ANGPT2 inibiu ainda mais a proliferação, migração e acúmulo de MEC em FCH por meio do mecanismo mencionado acima. Esses resultados indicam que a ANGPT2 pode representar um novo alvo potencial para atenuar a formação de CH.
Suporte financeiroEsse estudo recebeu suporte financeiro da Natural Science Foundation da Província de Hubei (n° 2020CFB210).
Contribuição dos autoresHongxin Cheng: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Kai Xu: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Chao Sun: Obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Si Gui: Coleta, análise e interpretação dos dados; Revisão crítica da literatura; Aprovação da versão final do manuscrito.
Juanjuan Wu: Obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Song Wang: Participação efetiva na orientação da pesquisa; obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem a todos os membros do laboratório envolvidos neste estudo.
Como citar este artigo: Cheng H, Xu K, Sun C, Gui S, Wu J, Wang S. Inhibition of ANGPT2 activates autophagy during hypertrophic scar formation via PI3K/AKT/mTOR pathway. An Bras Dermatol. 2023;98:26–35.
Trabalho realizado no Departamento de Queimaduras e Cirurgia Plástica, General Hospital of Central Theater Command of People's Liberation Army, Wuhan, China.