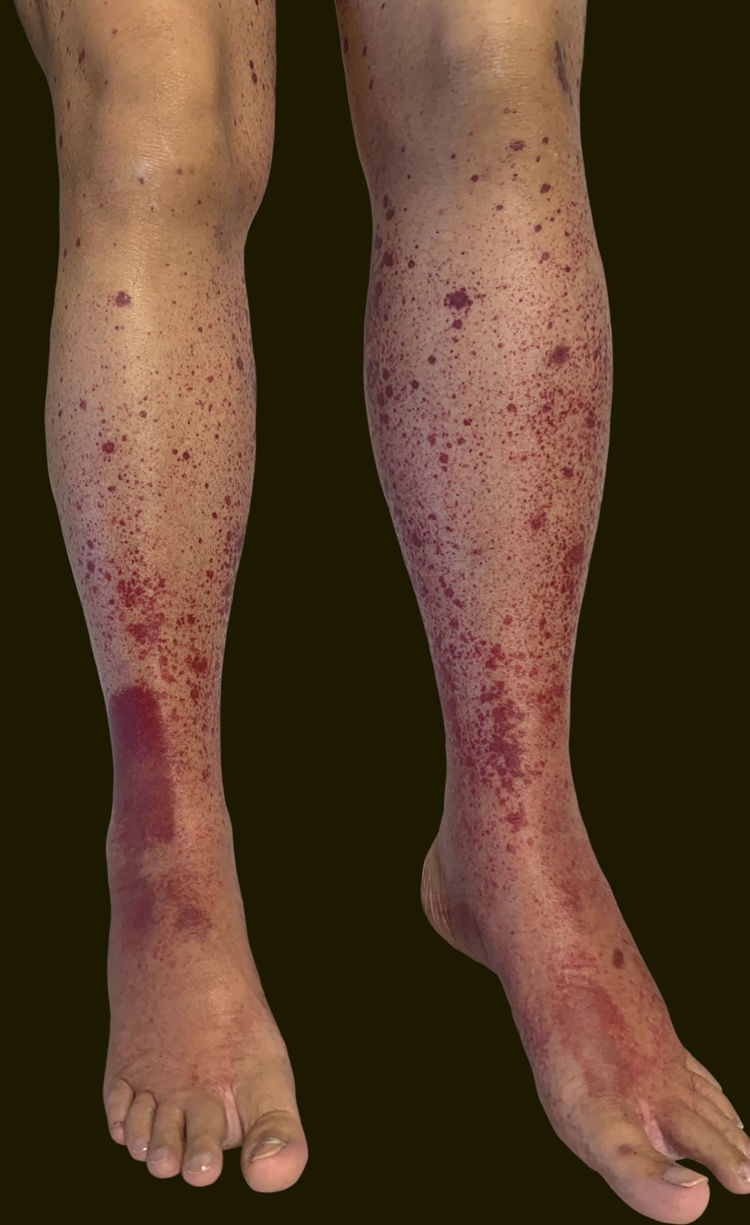
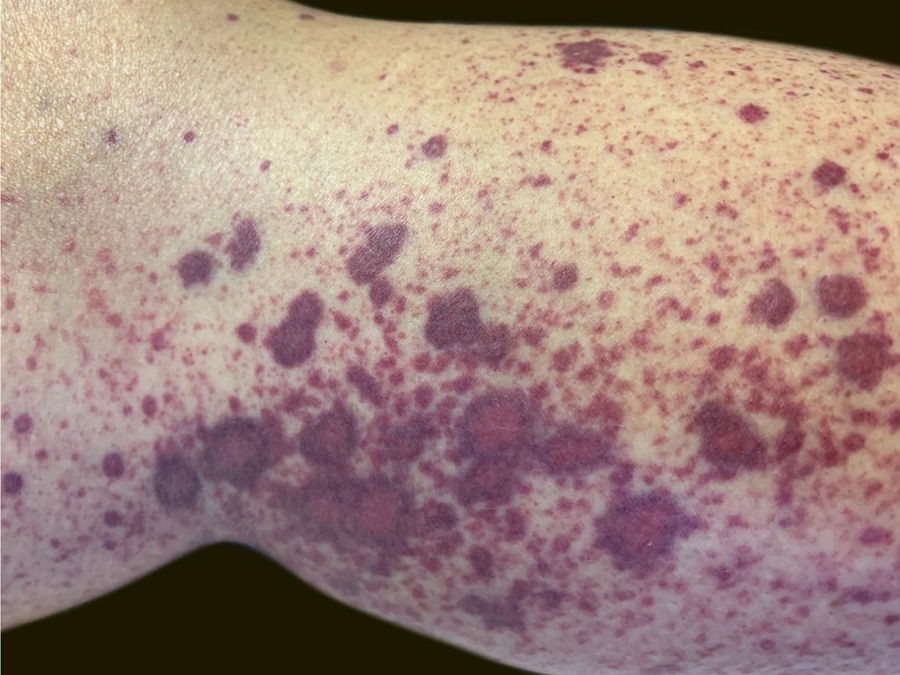
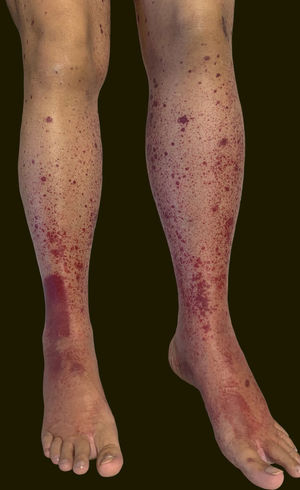
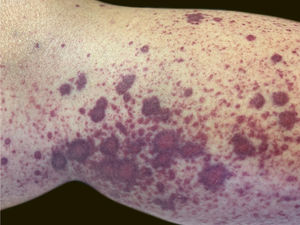
Uma paciente de 60 anos de idade, com histórico de hepatopatia crônica, hipertensão portal, policitemia vera, hipotireoidismo e diabetes mellitus tipo 2, apresentou‐se no setor de emergência do Hospital Universitário Polydoro Ernani de São Thiago referindo aparecimento de lesões purpúricas dolorosas nos membros inferiores três dias antes. Negava febre, calafrios, artralgia ou trauma. Negava uso de medicamentos novos. Relatava administração da segunda dose de vacina para COVID‐19 (Oxford‐AstraZeneca) havia cerca de 11 dias. Negava quadro semelhante prévio. Ao exame físico, apresentava lesões purpúricas e pápulas palpáveis, sem desaparecimento à digitopressão (figs. 1 e 2).
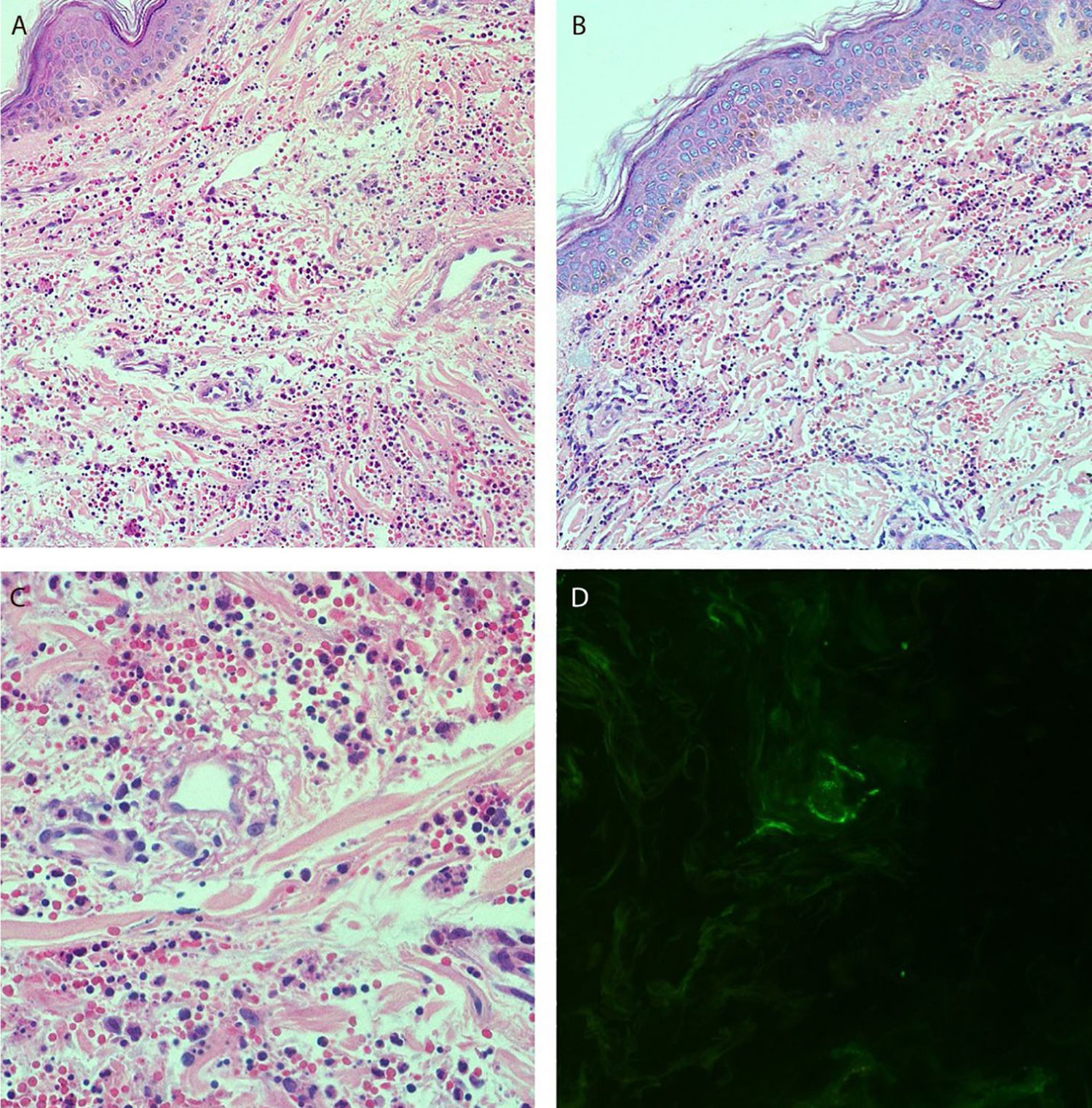
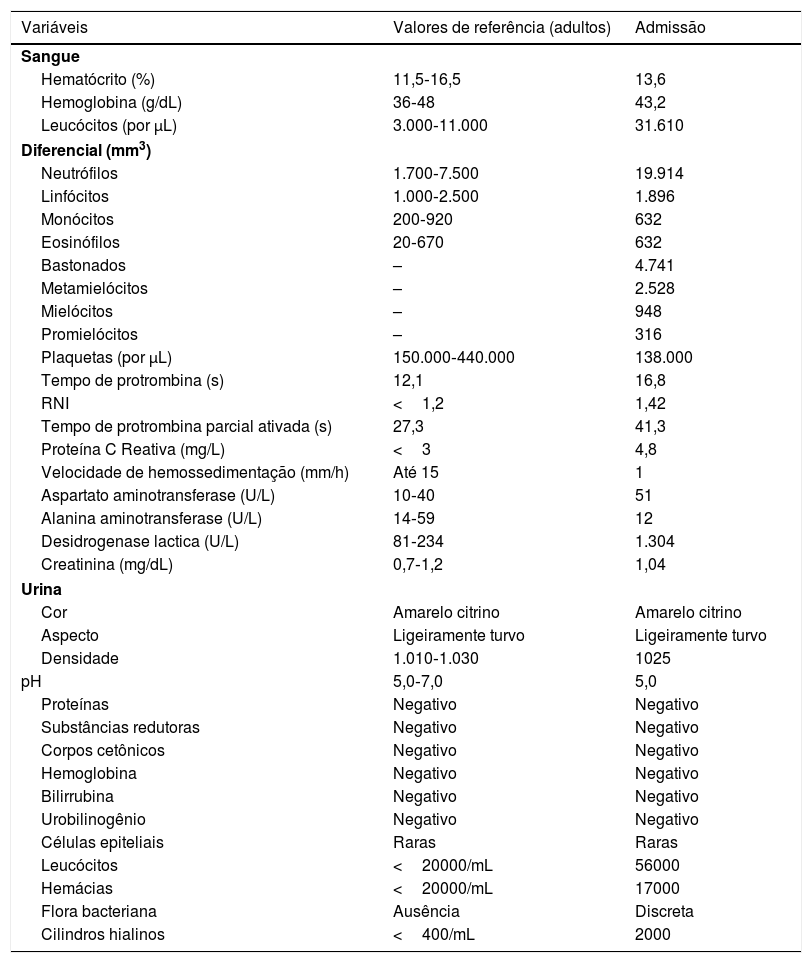
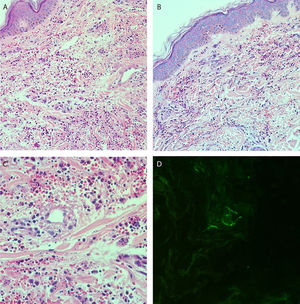
Relatava uso diário de propranolol, metformina e levotiroxina. Descrevia estabilidade do quadro de policitemia vera desde dezembro de 2015. Foi submetida à biópsia de pele por meio de dois punchs dos membros inferiores para análise histopatológica e imunofluorescência (IF). Iniciou‐se prednisona (1 mg/kg/dia) uma vez ao dia. O exame histopatológico evidenciou infiltrado inflamatório misto com neutrófilos com leucocitoclasia predominantemente perivasculares associado a hemácias extravasadas (fig. 3 A‐C). A IF revelou depósito de IgA e IgM nas paredes dos vasos pós‐capilares (fig. 3D). O quadro histológico era compatível com vasculite leucocitoclástica. A paciente negava sintomas ou quadro prévio de COVID‐19. Foi sugerida a possibilidade de crioglobulinemia; pesquisou‐se crioglobulinas séricas, as quais resultaram negativas. A paciente apresentou elevação de proteína C reativa e leucocitose com desvio. O restante do hemograma, função hepática, coagulograma e parcial de urina estavam dentro da normalidade ou compatíveis com comorbidades (tabela 1). Após três dias de internação, a paciente evoluiu com melhora das lesões nos membros inferiores e sintomas dolorosos. Após sete dias de prednisona na dose de 60mg, iniciou‐se redução progressiva, e a paciente teve alta hospitalar com prednisona 40 mg/dia.
(A e B), Exame histopatológico da pele evidenciando intenso infiltrado inflamatório difuso na derme (Hematoxilina & eosina, 100×). (C), Vasos pós‐capilares da derme permeados por neutrófilos com leucocitoclasia. Presença de sinais de dano endotelial com depósitos murais e intersticiais de fibrina, além de hemácias extravasadas (Hematoxilina & eosina, 400×). (D), Exame de imunofluorescência evidenciando depósitos granulares de IgA e IgM na parede dos vasos pós‐capilares.
Exames laboratoriaisa
| Variáveis | Valores de referência (adultos) | Admissão |
|---|---|---|
| Sangue | ||
| Hematócrito (%) | 11,5‐16,5 | 13,6 |
| Hemoglobina (g/dL) | 36‐48 | 43,2 |
| Leucócitos (por μL) | 3.000‐11.000 | 31.610 |
| Diferencial (mm3) | ||
| Neutrófilos | 1.700‐7.500 | 19.914 |
| Linfócitos | 1.000‐2.500 | 1.896 |
| Monócitos | 200‐920 | 632 |
| Eosinófilos | 20‐670 | 632 |
| Bastonados | – | 4.741 |
| Metamielócitos | – | 2.528 |
| Mielócitos | – | 948 |
| Promielócitos | – | 316 |
| Plaquetas (por μL) | 150.000‐440.000 | 138.000 |
| Tempo de protrombina (s) | 12,1 | 16,8 |
| RNI | <1,2 | 1,42 |
| Tempo de protrombina parcial ativada (s) | 27,3 | 41,3 |
| Proteína C Reativa (mg/L) | <3 | 4,8 |
| Velocidade de hemossedimentação (mm/h) | Até 15 | 1 |
| Aspartato aminotransferase (U/L) | 10‐40 | 51 |
| Alanina aminotransferase (U/L) | 14‐59 | 12 |
| Desidrogenase lactica (U/L) | 81‐234 | 1.304 |
| Creatinina (mg/dL) | 0,7‐1,2 | 1,04 |
| Urina | ||
| Cor | Amarelo citrino | Amarelo citrino |
| Aspecto | Ligeiramente turvo | Ligeiramente turvo |
| Densidade | 1.010‐1.030 | 1025 |
| pH | 5,0‐7,0 | 5,0 |
| Proteínas | Negativo | Negativo |
| Substâncias redutoras | Negativo | Negativo |
| Corpos cetônicos | Negativo | Negativo |
| Hemoglobina | Negativo | Negativo |
| Bilirrubina | Negativo | Negativo |
| Urobilinogênio | Negativo | Negativo |
| Células epiteliais | Raras | Raras |
| Leucócitos | <20000/mL | 56000 |
| Hemácias | <20000/mL | 17000 |
| Flora bacteriana | Ausência | Discreta |
| Cilindros hialinos | <400/mL | 2000 |
Os valores de referência são afetados por muitas variáveis, incluindo a população de pacientes e os métodos laboratoriais usados. Os intervalos usados são para adultos do sexo feminino que não estão grávidas e não têm condições médicas que possam afetar os resultados. Eles podem, portanto, não ser apropriados para todos os pacientes
A imunização é recurso de elevada importância no combate a pandemias, principalmente na atual, causada pelo coronavírus. Entretanto, possíveis efeitos colaterais ainda não foram totalmente descritos. Como retratados por Cohen et al. (2021) e Bostan et al. (2021), há relatos na literatura que apontam quadros de vasculite leucocitoclástica após a aplicação de vacina de ácido ribonucleico mensageiro (RNAm) de COVID‐19, como é o caso da vacina produzida pelas farmacêuticas Moderna e Pfizer.1,2 Contudo, temos poucos relatos na literatura sobre esses achados em vacinas de vetores virais, como o imunizante produzido pela Oxford‐AstraZeneca. Em razão das múltiplas comorbidades de nossa paciente, iniciou‐se o quadro investigativo com a hipótese principal de exacerbação de alguma das doenças prévias. Por isso, a importância de ponderar possíveis reações à vacina no diagnóstico diferencial.
É incerto se a vacinação para a COVID‐19 pode reativar ou ser o gatilho para doenças autoimunes.1‐4 A vasculite leucocitoclástica tem sido descrita em um conjunto de infecções e após a administração de algumas vacinas, como pneumocócica, influenza, rotavírus, hepatite A e B e HPV.3,4 Já se sabe que o SARS‐CoV‐2 pode provocar a hiperativação do sistema imunitário por reatividade cruzada e mimetismo molecular,5 e é possível que, após a administração da segunda dose da vacina, imunocomplexos formados por antígenos da vacina e anticorpos nativos tenham instaurado o processo de vasculite.4 A associação temporal entre a vacina para COVID‐19 e o desenvolvimento do quadro cutâneo é significativa. Esse relato sugere a possibilidade de que a vacina para COVID‐19 tenha o potencial de induzir fatores para vasculite leucocitoclástica.
Suporte financeiroNenhum.
Contribuição dos autoresMatheus Fritzen: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Gabriella Di Giunta Funchal: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Mariana Oliveira Luiz: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Giovanna Steffenello Durigon: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Fritzen M, Funchal GG, Luiz MO, Durigon GS. Leukocytoclastic vasculitis after exposure to COVID‐19 vaccine. An Bras Dermatol. 2022;97:118–21.
Trabalho realizado no Hospital Universitário Polydoro Ernani de São Thiago, Universidade Federal de Santa Catarina, Florianópolis, SC, Brasil.