O angioedema hereditário pode ser causado por deficiência e/ou disfunção do inibidor de C1 (C1‐INH; AEH‐1/2) ou pode ocorrer em pacientes com C1‐INH normal (AEH nC1‐INH).
MétodosO registro Icatibant Outcome Survey (IOS; NCT01034969) monitora a segurança e a eficácia do icatibanto no tratamento do angioedema agudo.
ObjetivoApresentar achados de pacientes brasileiros com AEH‐1/2 e AEH nC1‐INH participantes do IOS.
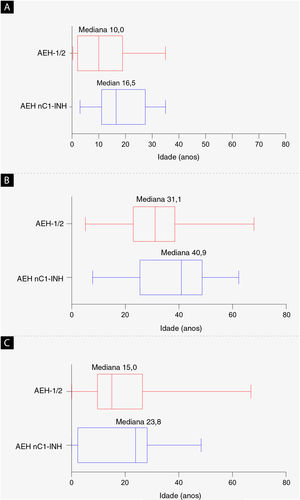
ResultadosForam incluídos 42 pacientes (AEH‐1/2, n=26; AEH nC1‐INH, n=16). A idade mediana no início dos sintomas foi significativamente menor com AEH‐1/2 vs. AEH nC1‐INH (10,0 vs. 16,5 anos, respectivamente; p=0,0105), enquanto a mediana da idade no diagnóstico (31,1 vs. 40,9 anos; p=0,1276) e a mediana do tempo entre o início dos sintomas e o diagnóstico (15,0 vs. 23,8 anos; p=0,6680) foram numericamente menores vs. AEH nC1‐INH, respectivamente. Uma dose de icatibanto foi utilizada para > 95% das crises de AEH. A mediana dos desfechos (intervalo) de tempo‐até‐o‐evento foram menores para pacientes com AEH nC1‐INH vs. AEH‐1/2, incluindo o tempo até a primeira administração (0,5 [0–96,0] vs. 1,0 [0–94,0] hora, respectivamente), tempo desde a primeira administração até a resolução completa (1,0 [0–88,0] vs. 5,5 [0–96,0] horas, respectivamente) e duração total da crise (7,0 [0,3–99,0] vs. 18,5 [0,1–100,0] horas, respectivamente). O tempo médio (DP) desde o início da crise até a resolução foi significativamente menor em pacientes com AEH nC1‐INH vs. AEH‐1/2 (9,8 [18,7] vs. 19,6 [24,0] horas, respectivamente; p=0,0174). Foram relatados 83 eventos adversos (EAs) em 42 pacientes; a maioria foi leve (66,3%) ou moderada (13,3%) e não grave (75,9%). O EA mais comum relacionado ao icatibanto foi eritema no local da injeção (AEH‐1/2, 34,6%; AEH nC1‐INH, 18,8%).
Limitações do estudoEste foi um estudo observacional que não tinha um comparador de tratamento e baseou‐se nas recordações dos pacientes.
ConclusõesOs achados demonstram eficácia e tolerabilidade do icatibanto em pacientes brasileiros com AEH.
O angioedema hereditário (AEH) é doença genética rara associada a episódios de edemas dolorosos que afetam os tecidos subcutâneos e/ou submucosos. As crises geralmente afetam a região da cabeça e pescoço, as extremidades e o abdômen. O edema laríngeo pode ser potencialmente fatal em virtude do risco de asfixia.1,2
As crises de AEH recorrem com frequência e gravidade imprevisíveis, afetando a vida pessoal e profissional dos pacientes e impondo uma pesada carga física e emocional aos pacientes, familiares e cuidadores.3–5 Episódios de edema dolorosos e potencialmente debilitantes podem afetar negativamente a produtividade do trabalho dos pacientes, dificultar a realização de metas educacionais e levar à ansiedade sobre crises futuras, mesmo durante períodos sem crise.5,6 De acordo com as diretrizes internacionais de manejo do AEH, o tratamento oportuno de crises agudas e a prevenção eficaz de crises futuras são aspectos integrais do cuidado para pacientes com AEH.7,8 O objetivo final é reduzir a frequência, a duração e a gravidade das crises, minimizando assim a carga da doença e ajudando a normalizar a vida diária dos pacientes.3,8
O AEH tipo 1 (em virtude dos baixos níveis e função do inibidor de C1 [C1‐INH]) ou tipo 2 (em razão da presença de C1‐INH disfuncional) é causado principalmente por mutações em SERPING1, o gene que codifica o inibidor de C1 (C1‐INH).7,9 C1‐INH é uma protease serina que desempenha papel fundamental na atividade de down‐regulação em várias cascatas de sinalização, incluindo a via do complemento, sistema de contato (por meio da cascata calicreína‐cinina), via de coagulação e fibrinólise.10 Dentro da cascata de calicreína‐cinina, o C1‐INH é um inibidor essencial do fator XIIa e da calicreína plasmática, que são proteases plasmáticas‐chave envolvidas na produção de bradicinina, um potente vasodilatador.9,10 A ausência de função suficiente de C1‐INH leva à ativação descontrolada da via calicreína‐cinina e à superprodução de bradicinina, a causa subjacente de edema e inchaço em pacientes com AEH tipo 1 ou 2 (AEH‐1/2).9,11,12
A presença de AEH em pacientes com níveis e função normais de C1‐INH (AEH NC1‐INH) também está sendo cada vez mais identificada; as vias patogenéticas ainda não foram totalmente elucidadas. Várias mutações em outros genes além de SERPING1 foram relatadas até o momento (por exemplo, FXII, cadeia pesada de cininogênio‐1, plasminogênio, angiopoietina‐1), e achados recentes sugerem que a presença de uma variante de ganho de função de mioferlina pode up‐regular a sinalização mediada pelo fator de crescimento endotelial vascular, levando a permeabilidade vascular excessiva. No entanto, a mutação subjacente geralmente permanece desconhecida.12,13 Como acredita‐se que a bradicinina desempenhe papel importante na patogênese das manifestações clínicas do AEH NC1‐INH,11,12,14 terapias que interferem na produção de bradicinina ou em atividades biológicas mediadas pela bradicinina podem, em princípio, também ser eficazes em pacientes com essas formas de AEH.11 Nenhum ensaio clínico controlado foi realizado até o momento nesse cenário; entretanto, evidências de relatos de casos ou estudos observacionais mostram achados encorajadores em alguns pacientes, incluindo aqueles tratados com icatibanto para crises agudas de AEH.15–17 Permanece uma necessidade urgente, ainda não atendida, de avaliação adicional das opções de tratamento nessa população de pacientes.
O Icatibant Outcome Survey (IOS; NCT01034969) é um estudo de registro pós‐comercialização, observacional multicêntrico, internacional e em andamento, que monitora a segurança e a eficácia do icatibanto, um antagonista do receptor B2 da bradicinina, usado no tratamento agudo de crises de angioedema. O IOS foi iniciado (pela Shire, uma empresa Takeda) em 2009, e desde 30 de setembro de 2019 inscreveu 1.491 pacientes de 13 países, incluindo 10 países europeus, além de Austrália, Brasil e Israel.
A caracterização formal do AEH no Brasil teve início em 2006, com a criação do registro brasileiro de AEH pela Rede Brasileira de Diagnóstico, Manejo e Tratamento de AEH; o conhecimento sobre a população brasileira de pacientes com AEH continua a crescer.18 A prevalência estimada de AEH no Brasil é de 4.220 pacientes (com base em uma estimativa de 211 milhões de pessoas no Brasil em 2020 e uma prevalência mundial presumida de AEH de ∼1:50.000).7,19 As características clínicas e mutações genéticas em pacientes brasileiros com AEH estão sendo cada vez mais relatados, incluindo achados em pacientes com AEH‐1/220–22 e naqueles com AEH NC1‐INH.16,23–25 Estudos avaliando a qualidade de vida em pacientes brasileiros com AEH demonstram uma carga pesada da doença nessa população.26,27 A maioria dos pacientes relatou medo contínuo de crises potencialmente fatais e demonstrou comprometimento físico e emocional; o impacto negativo foi particularmente observado no que diz respeito à vitalidade e função social.
A presente análise relata achados de pacientes brasileiros (recrutados no Brasil) que foram inscritos no IOS até 30 de setembro de 2019, incluindo dados demográficos, características clínicas e resultados de tratamento em pacientes com AEH‐1/2 e aqueles com AEH NC1‐INH.
MétodosPacientes e resultadosO IOS está em conformidade com os regulamentos e melhores práticas globais e locais relevantes e segue os princípios da Declaração de Helsinque e as Diretrizes da International Conference on Harmonisation – Good Clinical Practice. A aprovação foi concedida pelas autoridades de saúde e comitês de ética locais. O consentimento informado por escrito foi fornecido por todos os pacientes (ou seu representante legalmente autorizado).
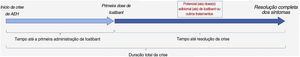
O registro IOS está aberto a todos os pacientes com AEH que receberam pelo menos uma dose de icatibanto. É digno de nota o fato de que, diferentemente de outros países do IOS, os pacientes no Brasil precisavam ter idade ≥ 18 para participar (embora o icatibanto agora seja aprovado para uso em pacientes com idade < 18 no Brasil). De acordo com as descrições publicadas anteriormente do desenho de estudo do IOS,28 os dados demográficos dos pacientes, suas características clínicas e histórico de crises de AEH (incluindo local, frequência, gravidade, duração, resultados do tratamento e tolerabilidade) foram coletados na inscrição, e as informações relacionadas às crises de AEH foram registradas em visitas regulares de seguimento (de preferência a cada seis meses). Os resultados tempo‐até‐o‐evento relacionados ao tratamento avaliados foram o tempo até a primeira administração de icatibanto (duração entre o início da crise e a primeira administração de icatibanto); tempo para resolução completa (duração entre a primeira administração de icatibanto e resolução completa de todos os sintomas) e duração total da crise (tempo entre o início da crise e a resolução completa de todos os sintomas; fig. 1).
Resultados da eficácia do tempo‐até‐o‐evento relacionados ao tratamento. Adaptada de: Maurer M et al., 28. AEH, angioedema hereditário.
Eventos adversos (EAs) foram categorizados de acordo com o Dicionário Médico para Classificação de Órgãos do Sistema de Atividades Regulatórias e Termos Preferenciais. Os EAs ocorridos antes da inscrição foram registrados na entrada do paciente no IOS como parte do seu histórico médico, enquanto os EAs ocorridos após a inscrição no IOS foram relatados durante as visitas de seguimento. Embora o uso off‐label tenha sido documentado no registro do IOS como parte das informações de segurança a serem relatadas de acordo com as normas regulatórias, tais eventos não foram considerados clinicamente significativos e, como tal, foram analisados separadamente da presente análise de segurança dos EAs.
Análise estatísticaTodas as análises estatísticas foram realizadas com o software SAS® versão 9.4 (SAS Institute, Cary, NC, Estados Unidos). As medidas quantitativas dos resultados foram relatadas como número de observações, média (desvio padrão [DP]) ou mediana, primeiro quartil (25° percentil), terceiro quartil (75° percentil), valores mínimos e máximos. As diferenças estatísticas nas características basais entre pacientes com AEH‐1/2 e pacientes com AEH nC1‐INH foram avaliadas usando o teste de Wilcoxon ou o teste Qui‐Quadrado. As avaliações dos resultados do tempo‐até‐o‐tratamento foram realizadas usando um modelo misto para medidas repetidas com dados transformados em log10. As comparações de gravidade (leve, moderada vs. grave, muito grave) foram realizadas utilizando um modelo misto linear generalizado de medidas repetidas. Dada a natureza observacional deste registro, todas as análises foram consideradas exploratórias e os valores de p foram interpretados de maneira descritiva.
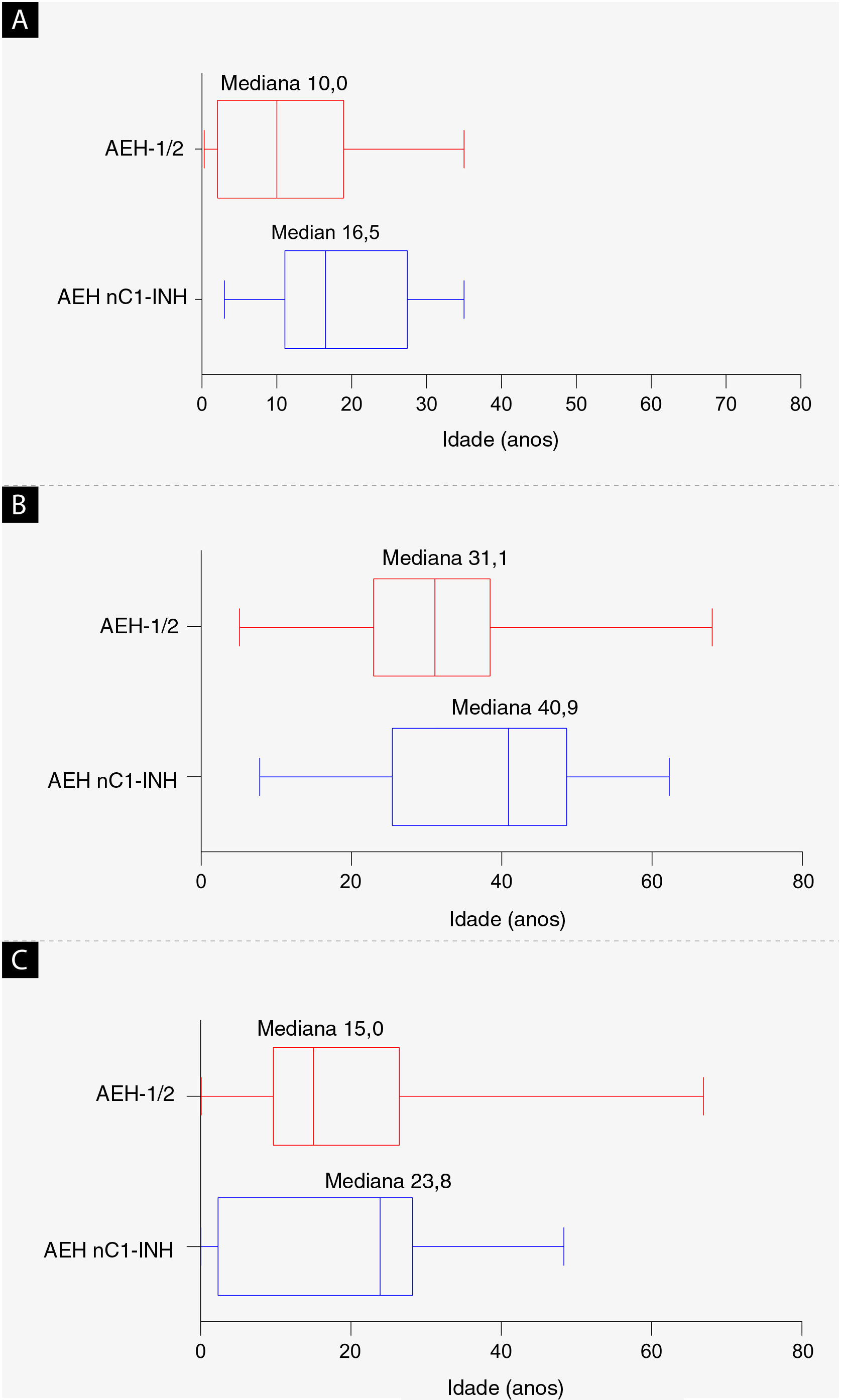
ResultadosCaracterísticas basaisEm 30 de setembro de 2019, um total de 42 pacientes do Brasil estavam inscritos no registro IOS, representando 2,8% do total de inscrições de pacientes (AEH‐1/2, n = 26; AEH nC1‐INH, n = 16). As características demográficas e clínicas estão apresentadas na tabela 1 e na figura 2. A maioria dos pacientes era do sexo feminino (AEH‐1/2, 84,6%; AEH nC1‐INH, 100%). A maioria relatou história familiar positiva (AEH‐1/2, 80,8%; AEH nC1‐INH, 93,8%). A mediana da idade no início dos sintomas foi significativamente menor em pacientes com AEH‐1/2 em relação àqueles com AEH nC1‐INH (10,0 vs. 16,5 anos; p = 0,0105). A mediana da idade ao diagnóstico (31,1 vs. 40,9 anos; p = 0,1276) e a mediana do tempo entre o início dos sintomas e o diagnóstico (15,0 vs. 23,8 anos; p = 0,6680) foram numericamente menores em pacientes com AEH‐1/2 do que naqueles com AEH nC1‐INH, respectivamente, mas as diferenças não foram estatisticamente significativas. No momento do corte dos dados, as informações coletadas sobre a presença ou ausência de mutações genéticas específicas em pacientes com AEH nC1‐INH estavam incompletas; assim, os resultados dessa análise não são apresentados.
Características basais
| Característica | AEH‐1/2(n = 26) | AEH nC1‐INH (n = 16) | Geral(n = 42) |
|---|---|---|---|
| Sexo | |||
| n (SI) | 26 (0) | 16 (0) | 42 (0) |
| Feminino, n (%) | 22 (84,6) | 16 (100,0) | 38 (90,5) |
| Masculino, n (%) | 4 (15,4) | 0 | 4 (9,5) |
| Idade no início dos sintomas de AEH (anos) | |||
| n (SI) | 23 (3) | 16 (0) | 39 (3) |
| Média (DP)a | 10,5 (9,4) | 18,9 (10,1) | 14,0 (10,4) |
| Mediana (variação) | 10,0 (0,3–35,0) | 16,5 (3,0–35,0) | 14,0 (0,3–35,0) |
| Idade no diagnóstico de AEH (anos) | |||
| n (SI) | 25 (1) | 16 (0) | 41 (1) |
| Média (DP)b | 31,6 (16,2) | 37,6 (15,8) | 33,9 (16,1) |
| Mediana (variação) | 31,1 (5,1–68,0) | 40,9 (7,8–62,3) | 33,8 (5,1–68,0) |
| Tempo entre o início dos sintomas de AEH e o diagnóstico (anos) | |||
| n (SI) | 22 (4) | 16 (0) | 38 (4) |
| Média (DP)c | 18,8 (17,8) | 18,8 (15,9) | 18,8 (16,8) |
| Mediana (variação) | 15,0 (0–66,9) | 23,8 (0–48,3) | 16,1 (0–66,9) |
| História familiar de AEH | |||
| n (SI) | 24 (2) | 16 (0) | 40 (2) |
| Sim, n (%)d | 21 (87,5) | 15 (93,8) | 36 (90,0) |
| Não, n (%)d | 3 (12,5) | 1 (6,3) | 4 (10,0) |
| Idade na inclusão do IOS (anos) | |||
| n (SI) | 26 (0) | 16 (0) | 42 (0) |
| Média (DP) | 41,9 (13,0) | 42,1 (13,8) | 42,0 (13,2) |
| Mediana (variação) | 39,8 (19,0–0,7) | 42,9 (18,3–64,3) | 41,9 (18,3–70,7) |
AEH, angioedema hereditário; AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1; IOS, Icatibant Outcome Survey; DP, desvio padrão; SI, sem informações.
Dados demográficos basais. (a) Mediana da idade no início dos sintomas de angioedema hereditário (p = 0,0105). (b) Mediana da idade no diagnóstico (p = 0,1276). (c) Mediana do tempo desde o início dos sintomas até o diagnóstico (diferença entre a idade dos primeiros sintomas e a idade de diagnóstico; p = 0,6680). As bordas esquerda e direita das caixas representam os percentis 25 e 75, respectivamente; os whiskers da caixa denotam os valores mínimos e máximos registrados. AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1.
Um total de 165 crises tratadas com icatibanto foi relatado em 18 pacientes com AEH‐1/2, e 63 crises tratadas com icatibanto foram relatadas em 10 pacientes com AEH nC1‐INH. Uma administração de icatibanto foi usada para a maioria das crises (95,7% em pacientes com AEH‐1/2; 96,7% naqueles com AEH nC1‐INH), conforme tabela 2. É digno de nota que a terapia de resgate concomitante com outros agentes além do icatibanto para o tratamento de crises de AEH foi utilizada por alguns pacientes (tabela 3). Medicamentos de resgate concomitantes podem ter sido utilizados para ajudar a aliviar os sintomas da crise, em vez de tratá‐la. Por exemplo, analgésicos e antieméticos podem ter sido usados para tratar a dor, náuseas e vômitos que podem acompanhar crises abdominais, e fluidos podem ter sido administrados como cuidados de suporte para a mesma crise. Em alguns casos, os pacientes utilizaram vários medicamentos de resgate, mas não necessariamente para a mesma crise. Os agentes utilizados para crises específicas não foram registrados.
Frequência de crises e administrações de icatibanto
| AEH‐1/2 | AEH nC1‐INH | |
|---|---|---|
| Número de pacientes com ≥ 1 crise de AEH tratados com icatibanto | 18 | 10 |
| Número de crises por paciente | ||
| Média (DP) | 9,2 (9,7) | 6,3 (4,5) |
| Mediana (Q1, Q3) | 5,5 (1,0, 18,0) | 6,0 (5,0, 8,0) |
| Variação | 1–29 | 1–17 |
| Porcentagem de crises necessitando de 1, 2 ou 4 administrações de icatibanto (%)a | ||
| 1 | 95,7 | 96,7 |
| 2 | 4,3 | 1,7 |
| 4 | 0 | 1,7 |
AEH, angioedema hereditário; AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1; Q, quartil; DP, desvio padrão.
Uso de medicamentos além do icatibanto para crises de AEH tratadas durante o período de seguimento
| Medicamento, n (%) | AEH‐1/2 (n = 164 [SI = 1]) | AEH nC1‐INH(n = 63) | Total(n = 227) |
|---|---|---|---|
| Analgésicos | 7 (4,3) | 5 (7,9) | 12 (5,3) |
| Antieméticos | 5 (3,0) | 0 | 5 (2,2) |
| Antifibrinolíticos | 15 (9,1) | 31 (49,2) | 46 (20,3) |
| Anti‐histamínicos | 3 (1,8) | 1 (1,6) | 4 (1,8) |
| Andrógenos atenuados | 5 (3,0) | 0 | 5 (2,2) |
| Concentrado de C1‐INH | 15 (9,1) | 0 | 15 (6,6) |
| Fluidos | 1 (0,6) | 0 | 1 (0,4) |
| Plasma fresco congelado | 1 (0,6) | 0 | 1 (0,4) |
| Outros | 5 (3,0) | 1 (1,6) | 6 (2,6) |
| Inibidores da bomba de prótons | 1 (0,6) | 0 | 1 (0,4) |
| Antiespasmódicos | 4 (2,4) | 3 (4,8) | 7 (3,1) |
C1‐INH, inibidor de C1; AEH, angioedema hereditário; AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1; SI, sem informações.
Ao longo de uma média (DP) de 4,5 (1,66) anos de seguimento (desde a entrada no IOS até a data da extração de dados ou descontinuação) para pacientes com AEH‐1/2, e uma média (DP) de 4,3 (1,42) anos de seguimento para pacientes com AEH nC1‐INH, o número máximo de crises relatadas por paciente foi maior em pacientes com AEH‐1/2 (29 crises) do que naqueles com AEH nC1‐INH (17 crises; tabela 2).
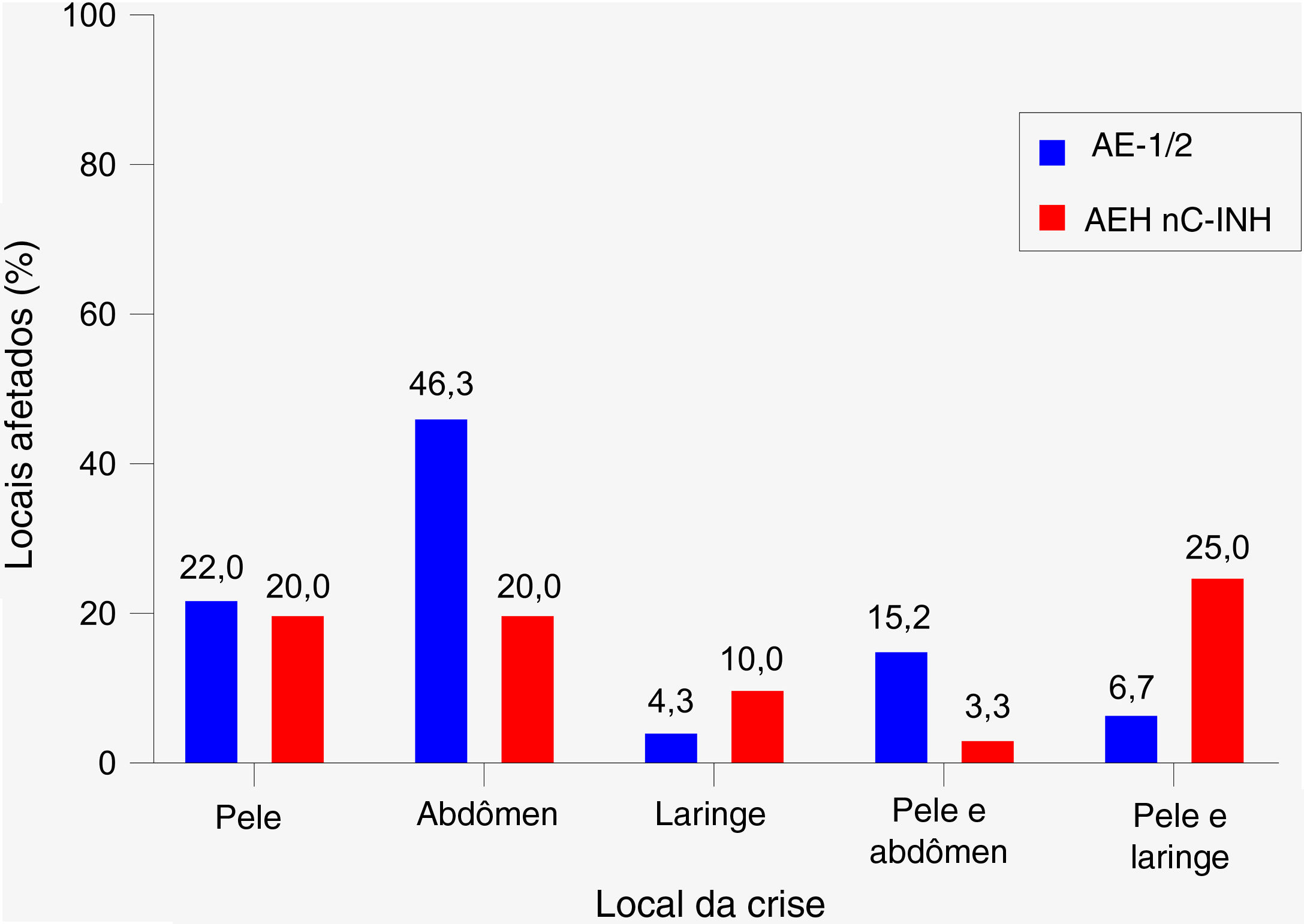
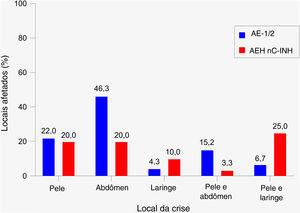
Local e gravidade das crisesEm pacientes com AEH‐1/2, a maioria das crises (72,6%) afetou um único local – mais comumente o abdômen (46,3%), seguido pela pele (22,0%; fig. 3). A combinação de locais mais comuns envolveu pele e abdômen (15,2%). Em pacientes com AEH nC1‐INH, as crises tinham a mesma probabilidade de afetar um único local ou vários locais (50% cada). A pele e o abdômen foram os locais mais acometidos (20% cada). A combinação de sítios mais comum envolveu pele e laringe (25,0%).
Local mais comum de crises de angioedema hereditário. AEH‐1/2, n = 164 crises (um faltando); AEH nC1‐INH, n = 60 crises (três faltando). Apenas os locais únicos e combinações de locais mais comuns são mostrados; assim, os percentuais não totalizam 100%. As crises que afetam a pele referem‐se aos seguintes locais: braços, pavilhões auriculares, pálpebras, face, pés, genitais, mãos, pernas, lábios, nariz, tronco, outros, desconhecidos. Crises abdominais referem‐se especificamente a crises que afetam a mucosa gastrintestinal. AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1.
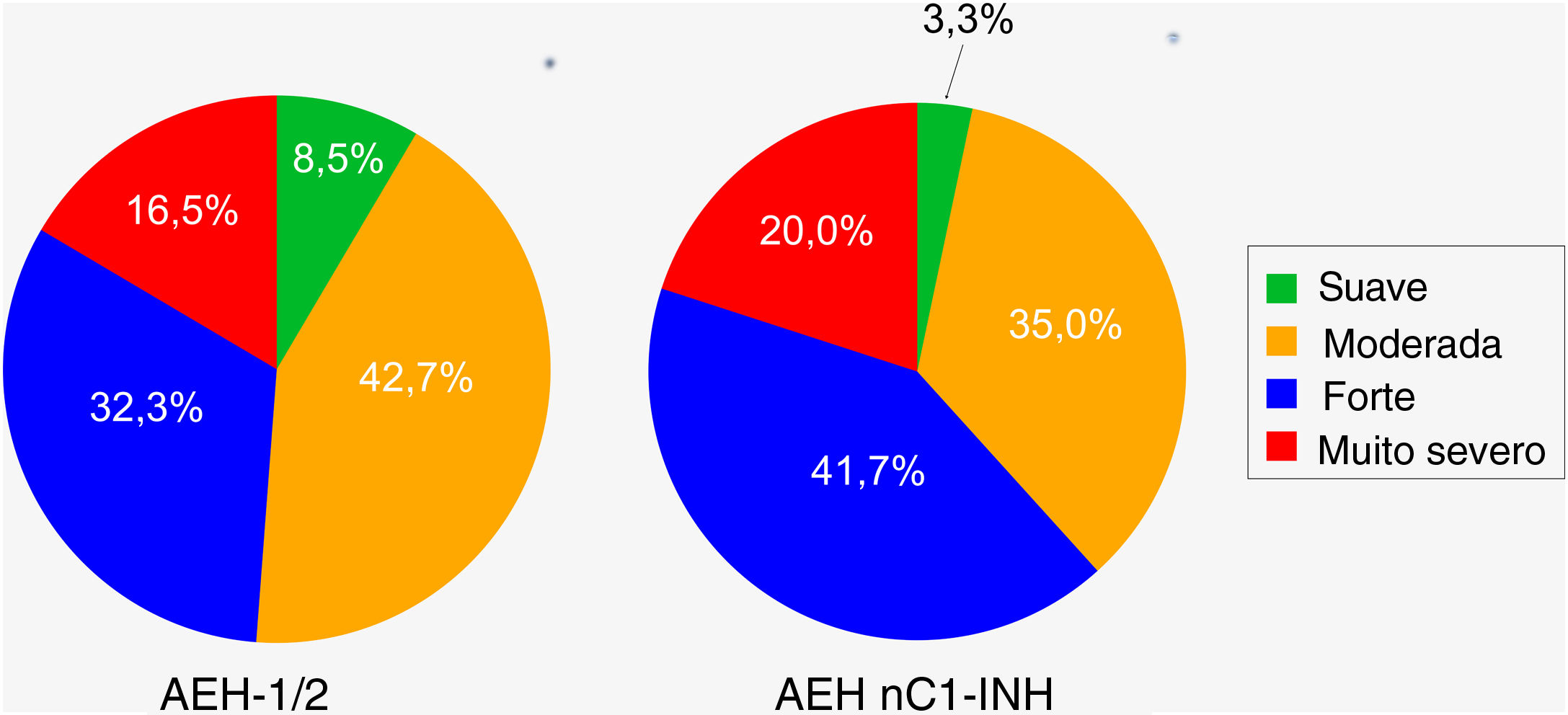
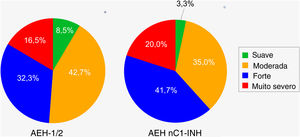
Os pacientes com AEH nC1‐INH eram mais propensos do que aqueles com AEH‐1/2 a apresentar crises graves ou muito graves antes do tratamento (61,7% vs. 48,8%, respectivamente). Entretanto, essa diferença (grave vs. muito grave) não foi significativa (p = 0,8906), assim como a diferença na ocorrência de crises leves/moderadas vs. graves/muito graves (p = 0,1038; fig. 4).
Gravidade das crises de angioedema hereditário antes do tratamento. AEH‐1/2, n = 164 crises (falta uma); AEH nC1‐INH, n = 60 crises (faltam três). A gravidade da crise foi avaliada com base nas seguintes descrições: Leve: interferência leve nas atividades diárias; Moderada: interferência moderada nas atividades diárias e sem necessidade de outras contramedidas; Grave: interferência grave nas atividades diárias e com ou sem outras contramedidas; Muito grave: interferência muito grave nas atividades diárias e outras contramedidas necessárias. A diferença entre os dois grupos de pacientes na ocorrência de crises leves/moderadas versus graves/muito graves não foi significativa (p = 0,1038). AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1.
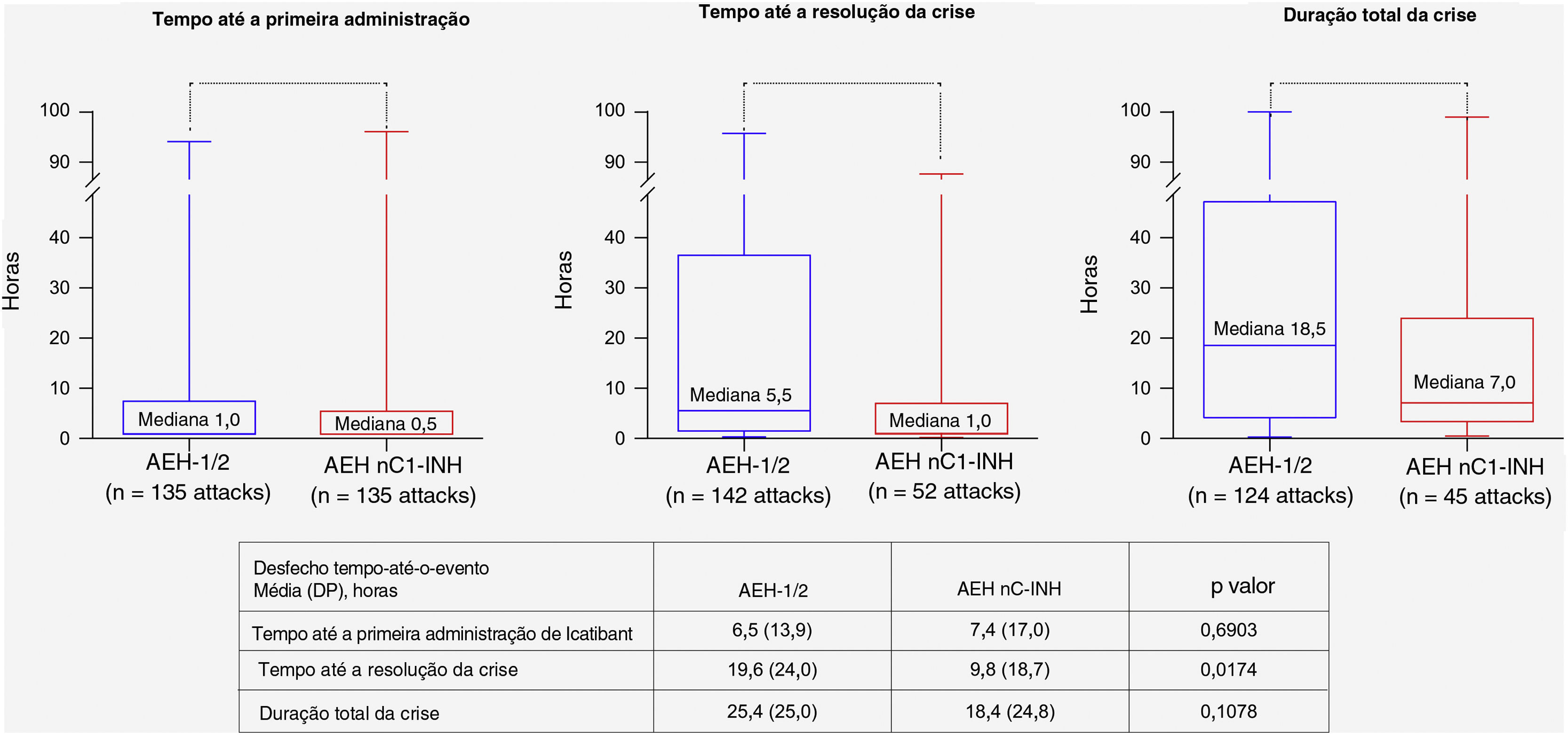
Os dados dos resultados do tratamento estavam disponíveis para até 142 crises em 17 pacientes com AEH‐1/2 e para até 52 crises em oito pacientes com AEH nC1‐INH. Todas as medianas (variação) dos resultados de tempo‐até‐o‐evento foram menores para pacientes com AEH nC1‐INH (fig. 5), incluindo o tempo desde o início da crise até a primeira administração de icatibanto (AEH nC1‐INH, n = 47 crises, 0,5 [0‐96,0] horas; AEH‐1/2, n = 135 crises, 1,0 [0‐94,0] horas); tempo desde a primeira administração de icatibanto até a resolução completa dos sintomas (AEH nC1‐INH, n = 52 crises, 1,0 [0–88,0] horas; AEH‐1/2, n = 142 crises, 5,5 [0–96,0] horas); e duração total da crise (AEH nC1‐INH, n = 45 crises, 7,0 [0,3–99,0] horas; AEH‐1/2, n = 124 crises, 18,5 [0,1–100,0] horas). É importante notar que a média de tempo (DP) desde o início da crise até a resolução foi significativamente menor para pacientes com AEH nC1‐INH vs. AEH‐1/2 (9,8 [18,7] horas vs. 19,6 [24,0] horas; p = 0,0174; fig. 5).
Resultados de tempo para o evento. As bordas inferior e superior das caixas representam os percentis 25 e 75, respectivamente; os whiskers das caixas denotam os valores mínimos e máximos registrados. AEH‐1/2, angioedema hereditário tipo 1 ou 2; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1; DP, desvio padrão.
Foram relatados 83 eventos em 42 pacientes, a maioria classificado como leve (66,3%) ou moderado (13,3%) em gravidade e não grave (75,9%). Nenhum dos eventos foi potencialmente fatal ou fatal. Um total de 44 EAs foram relatados em 16 pacientes como possivelmente (quatro eventos) ou provavelmente (40 eventos) relacionados ao uso de icatibanto. O EA mais comum relacionado ao icatibanto foi o eritema no local da injeção, afetando 34,6% dos pacientes com AEH‐1/2 e 18,8% daqueles com AEH nC1‐INH (tabela 4). Nenhum evento inesperado ou novos sinais relacionados à segurança foram detectados.
Eventos adversos considerados como possivelmente ou provavelmente relacionados ao uso de icatibanto (por termo preferencial)a
| EA, n (%) | AEH‐1/2 | AEH nC1‐INH | ||
|---|---|---|---|---|
| Pacientes(n = 26) | Eventos(n = 58) | Pacientes(n = 16) | Eventos(n = 25) | |
| Reação no local da injeção | ||||
| Eritemab | 9 (34,6) | 18 (31,0) | 3 (18,8) | 6 (24,0) |
| Dor no local de aplicação | 2 (7,7) | 3 (5,2) | 1 (6,3) | 1 (4) |
| Hematoma | – | – | 1 (6,3) | 1 (4) |
| Hemorragia | 1 (3,8) | 1 (1,7) | – | – |
| Hiperemia | 3 (11,5) | 4 (6,9) | – | – |
| Edema localizado | 1 (3,8) | 1 (1,7) | 2 (12,5) | 2 (8) |
| Dor | 3 (11,5) | 3 (5,2) | 1 (6,3) | 1 (4) |
| Náusea | 1 (3,8) | 1 (1,7) | – | – |
| Edema | 1 (3,8) | 1 (1,7) | – | – |
| Angioedemac | 1 (3,8) | 1 (1,7) | – | – |
EA, evento adverso; AEH‐1/2, angioedema hereditário com deficiência e/ou disfunção do inibidor de C1; AEH nC1‐INH, angioedema hereditário com níveis e função normais do inibidor de C1.
Os achados da análise atual fornecem uma representação valiosa no mundo real em relação ao uso de icatibanto no tratamento de pacientes com AEH‐1/2 e AEH nC1‐INH no Brasil. Embora apenas um local no Brasil tenha participado, um número substancial de pacientes foi incluído.
As características basais e as características clínicas de pacientes com AEH nC1‐INH foram geralmente consistentes com achados publicados anteriormente de coortes de pacientes franceses e brasileiros com AEH nC1‐INH,16,23,29,30 e os achados em pacientes com AEH‐1/2 foram consistentes com características publicadas anteriormente em coortes brasileiras de pacientes com AEH‐1/2.18,21,22 Em comparação com pacientes com AEH‐1/2, os pacientes com AEH nC1‐INH tinham uma mediana de idade maior no início dos sintomas, uma idade avançada ao diagnóstico e tempo prolongado entre o início dos sintomas e o diagnóstico. Ao longo de um período de seguimento semelhante para os dois grupos de pacientes, os pacientes com AEH nC1‐INH tiveram menos crises de AEH do que aqueles com AEH‐1/2. Esse achado é consistente com uma probabilidade maior de intervalos livres de doença descritos anteriormente em pacientes com AEH nC1‐INH.31
Na presente análise, a localização das crises em pacientes com AEH‐1/2 (mais comumente afetando o abdômen ou a pele) foi comparável àquelas relatadas anteriormente em outras coortes brasileiras de pacientes com AEH‐1/2.18,22 Pacientes com AEH nC1‐INH eram mais propensos a sofrer crises laríngeas e menos propensos a sofrer crises abdominais do que os com AEH‐1/2, consistente com relatos anteriores.31,32 Deve‐se notar, no entanto, que vários achados relatados recentemente demonstram a ocorrência de crises abdominais em > 50% dos pacientes com AEH nC1‐INH, especialmente na presença de mutações FXII.16,23,29 Os achados do presente estudo mostraram ainda que, independentemente do tipo de AEH, a maioria das crises foi efetivamente tratada com uma administração de icatibanto, como relatado anteriormente em pacientes franceses com AEH‐1/2, bem como naqueles com AEH nC1‐INH incluídos no IOS.29
Os achados positivos desta análise de pacientes brasileiros do IOS baseiam‐se na eficácia e segurança a longo prazo do icatibanto, demonstrada em mais de 10 anos de experiência com 1.052 pacientes com AEH‐1/2 no registro do IOS em março de 2019.33 Naquela análise, com base em dados de 5.253 crises tratadas, a resolução completa dos sintomas relacionados à crise ocorreu em uma média de 6 horas após a administração da primeira dose de icatibanto. A duração média total da crise foi de 9 horas. De 618 pacientes com AEH‐1/2 expostos ao icatibanto durante o período de seguimento, 24 relataram um total de 75 EAs que foram considerados possivelmente ou provavelmente relacionados ao uso de icatibanto. Os EAs mais frequentes relacionados ao icatibanto foram eritema no local da injeção (29,3%) e astenia (9,3%).
Estudos não controlados mostraram resultados encorajadores do tratamento com icatibanto em pacientes com AEH nC1‐INH, incluindo relatos de casos e análises retrospectivas.15,17,30,34,35 De fato, o icatibanto está entre as opções de tratamento recomendadas pelas atuais diretrizes internacionais/canadenses para o manejo de AEH no tratamento de crises agudas de AEH em pacientes com AEH nC1‐INH (com base no nível de evidência de consenso).8 Os resultados da análise atual de pacientes brasileiros do IOS enfatizam ainda mais os benefícios do icatibanto em pacientes com AEH nC1‐INH. Os achados mostraram uma tendência favorável para efeitos mais rápidos do que em pacientes com AEH‐1/2, incluindo mediana de tempo mais curta para atingir a resolução e duração mediana total de crise mais curta, embora a única diferença estatisticamente significativa entre os dois grupos de pacientes nessa coorte tenha sido a média de tempo desde a primeira administração de icatibanto até a resolução completa dos sintomas. É importante notar que o menor tempo médio desde o início da crise até a primeira administração de icatibanto para pacientes com AEH nC1‐INH pode ter contribuído para os melhores resultados de tempo‐até‐o‐evento em comparação com pacientes com AEH‐1/2, de acordo com os dados do IOS publicados anteriormente, mostrando que a administração precoce de icatibanto resulta em resolução mais rápida das crises de AEH.28
O perfil de segurança do icatibanto na análise atual foi comparável entre pacientes com AEH‐1/2 e aqueles com AEH nC1‐INH; as reações relacionadas ao local da injeção foram os EAs mais frequentemente relatados. Os achados são consistentes com o perfil de segurança do icatibanto relatado em estudos controlados‐chave em pacientes com AEH‐1/2,36,37 bem como em outras análises pós‐comercialização em pacientes do IOS e pacientes tratados com icatibanto com AEH nC1‐INH em estudos não controlados.29,34,38
Várias limitações são inerentes a um desenho de estudo observacional, incluindo a falta de comparador de tratamento e dependência da memória do paciente, potencialmente levando a subnotificação de crises mais leves ou relato incompleto de sintomas. Além disso, todas as análises foram post hoc, e a amostra não tinha poder para mostrar as diferenças; dessa maneira, os resultados das comparações entre os dois grupos de pacientes devem ser interpretados com cautela. Entretanto, apesar dessas limitações inerentes, registros como o IOS são ferramentas úteis para obter informações sobre o AEH além das configurações de ensaios clínicos controlados e para avaliar a eficácia e a segurança do icatibanto por longos períodos de tempo.
Vale ressaltar que o icatibanto foi lançado no Brasil em 2009 e é aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa), porém não foi introduzido no protocolo oficial do Ministério da Saúde do Brasil. Desse modo, não há financiamento do governo atualmente para o seu uso; portanto, o acesso do paciente a essa terapia continua sendo um desafio. Espera‐se que o relato contínuo dos achados de eficácia e segurança do icatibanto, como os feitos aqui, ajude a melhorar a acessibilidade a essa medicação para o tratamento de AEH no Brasil.
ConclusõesA caracterização de várias formas de AEH em todo o mundo continua a crescer, abrindo caminho para uma melhor compreensão das mutações genéticas subjacentes, dados demográficos dos pacientes e resultados do tratamento em várias populações de pacientes com AEH. A presente análise fornece suporte para a eficácia, segurança e tolerabilidade do icatibanto em pacientes brasileiros com AEH.
Suporte financeiroAnete S. Grumach é bolsista de produtividade CNPq. (309824/2021‐4).
Esta pesquisa foi patrocinada pela Shire Human Genetic Therapies, Inc., uma empresa Takeda.
Contribuição dos autoresAnete S. Grumach: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Marina T. Henriques: Obtenção, análise e/ou interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Maine L. D. Bardou: Obtenção, análise e/ou interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Daniele A. Pontarolli: Obtenção, análise e/ou interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Jaco Botha: Obtenção, análise e/ou interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Mariangela Correa: Obtenção, análise e/ou interpretação dos dados; elaboração e redação do manuscrito e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesAnete S. Grumach foi palestrante ou consultora da BioCryst, Biotest, CSL Behring e Takeda. Marina T. Henriques, Maine L. D. Bardou e Daniele A. Pontarolli não têm conflito de interesses a declarar. J. Botha é funcionário e possui opções de compra de ações/ações da Takeda. M. Correa era funcionária e possuía opções de compra de ações/ações da Takeda no momento desta análise.
Sob a direção dos autores, Sophia Shumyatsky, PharmD, CMPP, funcionária da Excel Medical Affairs, forneceu assistência na redação deste manuscrito. A assistência editorial na formatação, revisão, edição e verificação de fatos também foi fornecida pela Excel Medical Affairs. A Takeda Development Center Americas, Inc. financiou a Excel Medical Affairs para apoio na redação e edição deste manuscrito. A interpretação dos dados foi feita pelos autores de maneira independente. O papel dos funcionários da Takeda no projeto do estudo e coleta, análise e interpretação dos dados e na redação do manuscrito são especificados na seção de contribuição dos autores. Agradecemos a todos os investigadores do IOS por suas contribuições ao registro do IOS.
Como citar este artigo: Grumach AS, Henriques MT, Bardou MLD, Pontarolli DA, Botha J, Correa M. Icatibant use in Brazilian patients with hereditary angioedema (HAE) type 1 or 2 and HAE with normal C1‐INH levels: findings from the Icatibant Outcome Survey Registry Study. An Bras Dermatol. 2022;97:448–57.
Trabalho realizado na Imunologia Clínica, Faculdade de Medicina, Centro Universitário Saúde ABC, Santo André, SP, Brasil.