O maior pH da pele na dermatite atópica prejudica a barreira epidérmica. Um hidratante compatível com o pH fisiológico pode melhorar a dermatite atópica.
ObjetivoDeterminar o efeito de um hidratante com pH fisiologicamente compatível na dermatite atópica.
MétodosFoi feito um ensaio clínico hemicorporal randomizado, duplo cego, controlado, envolvendo pacientes com dermatite atópica estável. Um hidratante com pH modificado e um hidratante padrão foram aplicados em metade do corpo por seis semanas.
ResultadosO estudo incluiu seis (16,7%) homens e 30 (83,3%) mulheres. Com o uso de um hidratante com pH modificado, as reduções do pH da pele da semana 0, semana 2 e 6 foram significativas nos antebraços (5,315 [0,98], 4,85 [0,54], 5,04 [0,78]; p=0,02) e abdome (5,25 [1,01], 4,82 [0,64], 5,01 [0,59]; p=0,00), mas não nas regiões pré‐tibiais (5,01 [0,80], 4,76 [0,49], 4,85 [0,79]; p=0,09). A perda transepidérmica de água (PTEA) diminuiu nos antebraços (4,60 [2,55], 3,70 [3,10], 3,00 [3,55]; p=0,00) e no abdome (3,90 [2,90], 2,40 [3,45], 2,70 [(2,25]; p=0,046). O SCORAD melhorou de 14,1±12,75 para 10,5±13,25 para 7±12,25 (p=0,00). No grupo hidratante convencional, as reduções de pH foram significativas nos antebraços (5,29 [0,94], 4,84 [0,55], 5,02 [0,70], p=0,00) e no abdome (5,25 [1,09], 4,91 [0,63], 5,12 [0,66]; p=0,00). Observou‐se PTEA no antebraço (4,80 [2,95], 4,10 [2,15]; 4,60 [3,40], p=0,67), canelas (3,80 [1,40], 3,50 [2,35], 4,00 [2,50]; p=0,91) e abdome (3,70 [2,45], 4,10 [3,60], 3,40 [2,95]; p=0,80). O SCORAD melhorou de 14,2±9,1 para 10,9±10,65 para 10,5±11 (p=0,00). Foi observada redução no pH com os dois hidratantes, enquanto a PTEA melhorou significativamente com o hidratante com pH modificado. O hidratante com pH modificado resultou em melhorias maiores de pH, PTEA e SCORAD; no entanto, as diferenças não foram significativas em relação ao hidratante convencional.
Limitação do estudoA hidratação da pele não foi avaliada.
ConclusãoA hidratação é benéfica para a dermatite atópica e o uso de hidratantes de pH fisiologicamente compatível é promissor.
A dermatite atópica (DA) é uma doença inflamatória da pele com recidiva crônica e prevalência crescente, afetando 0,2% a 24,6% das crianças em todo o mundo.1 Na Malásia, a prevalência de DA foi estimada em 12,6%, com um aumento de 0,49% ao ano.1 A fisiopatologia da DA envolve interações complexas entre fatores genéticos, o sistema imunológico e o meio ambiente. A elevação do pH da pele é um componente patológico importante que causa aumento da atividade das proteases e inibição da síntese das lamelas lipídicas, e leva à quebra da barreira epidérmica.2 O pH da pele de adultos e adolescentes normais varia entre 4 e 5.3 Pacientes com DA apresentam um pH maior tanto na pele lesional quanto na não lesional em comparação com a população saudável.3
O pH ácido fisiológico da pele desempenha um papel importante na preservação da integridade da barreira epidérmica, mas ainda não foi aplicado adequadamente como o conceito central no manejo da DA. Em modelos murinos, a acidificação da pele melhorou a integridade epidérmica e perda transepidérmica de água (PTEA), acelerou a recuperação da barreira4 e preveniu DA.2,5,6 Ela impediu o surgimento de DA induzida por oxazolona, reduziu a inflamação dominante em Th2, normalizou a expressão de peptídeos antimicrobianos e inibiu a geração de citocinas.5 A função de barreira e permeabilidade da pele em camundongos normais melhorou com o aumento das atividades de β‐glucocerebrosidase e esfingomielinase e redução na degradação de desmogleinas dependente de serina protease.4 A aplicação do conceito de acidificação da pele murina na restauração da acidez fisiológica da pele na DA e seu efeito na gravidade da doença ainda precisa ser mais investigado.
O presente estudo teve como objetivo determinar o efeito do hidratante com pH 4,5 na restauração da barreira epidérmica na DA. Um hidratante com pH mais compatível com o pH fisiológico pode melhorar o pH da pele na DA e, subsequentemente, a gravidade da doença.
MétodosFoi feito um estudo hemicorporal, randomizado, controlado, duplo‐cego, que comparou um hidratante com pH modificado e um hidratante comercial convencional. Os critérios de inclusão foram pacientes entre 12 e 65 anos diagnosticados com DA de acordo com os critérios de Hanifin & Radjka7 e com doença leve a moderada estável por um mês antes do recrutamento. Os critérios de exclusão foram infecções recorrentes,> 1% da superfície corporal com erosões cutâneas, reação alérgica ou irritante conhecida a creme aquoso, glicerina, metilparabeno ou propilparabeno, mudança no regime de tratamento quatro semanas antes do recrutamento, gravidez e aleitamento.
A randomização de meio corpo foi feita com envelopes opacos, selados e numerados sequencialmente. Os investigadores e pacientes permaneceram cegos durante o estudo. Os pacientes foram instruídos a aplicar um hidratante em um lado do corpo, do pescoço para baixo, e outro hidratante no outro lado, duas vezes por dia durante seis semanas. Todos os outros tratamentos tópicos e orais que os pacientes usavam antes da inscrição no estudo, exceto os hidratantes, foram mantidos.
As medições do pH da pele e PTEA foram feitas no início do estudo (semana 0), na semana 2 e na semana 6, em seis locais pré‐determinados: antebraços bilateralmente, lado direito e esquerdo do abdome e regiões pré‐tibiais anteriores bilateralmente. Os pacientes descansaram por pelo menos 20 minutos a 22°C em umidade relativa de 55% a 60%. As medições foram feitas pelo menos 5 horas após a aplicação do hidratante e qualquer outro tratamento tópico. O pH da pele foi avaliado com Hanna Instruments H199181. A PTEA foi avaliada com Tewameter TM300. Foram feitas três leituras por avaliação e uma média foi obtida. Foi usado o escore objetivo modificado de DA (SCORAD) para determinar a gravidade da doença. O componente A foi duplicado no cálculo da pontuação final. A avaliação de prurido e insônia no componente C foi excluída, pois era difícil diferenciar a gravidade do prurido em cada lado do corpo e impossível determinar o efeito dos sintomas de metade do corpo para explicar a insônia. O SCORAD objetivo modificado foi calculado como 2 (A/5) + 7B/2. Escores <15 foram considerados leves, 15 a 40, moderados e> 40, acentuados.8 O prurido foi avaliado com uma escala visual analógica (EVA) de 0 a 10 (0 representou nenhum prurido e 10, prurido máximo). O Questionário do Índice de Qualidade de Vida em Dermatologia (Dermatology Life Quality Index Questionnaire [DLQI])9 foi usado para determinar o efeito da doença na qualidade de vida dos pacientes. SCORAD, escore de prurido e DLQI foram determinados no início do estudo (semana 0), na semana 2 e na semana 6.
O hidratante comercial padrão usado foi o creme aquoso fabricado pela KCK Pharmaceutical Industries Sdn Bhd. Os ingredientes incluem 9% de cera emulsificante, 6% de parafina líquida, 15% de parafina branca, 0,15% de metilparabeno e 0,08% de propilparabeno. O creme tem um pH de 7,32–7,58 medido pelo medidor de pH LAQUA da HORIBA Scientific. O pH desse hidratante foi modificado com a adição de ácido cítrico a 5% para atingir o pH desejado de 4,5. O ácido cítrico foi escolhido por ser amplamente disponível. O ácido cítrico é um pequeno componente dos fatores hidratantes naturais e sua aplicação tópica demonstrou ser benéfica na ictiose, no aumento da espessura da epiderme e no aumento de glicosaminoglicanos na derme.10,11 O hidratante com pH modificado permaneceu estável por 3 meses à temperatura ambiente, sem alterações de cor, cheiro, textura, consistência e pH. Tanto creme hidratante comercial convencional e o creme com pH modificado tinham cor, cheiro, textura e consistência semelhantes. O estudo foi aprovado pelo Comitê de Ética em Pesquisa, código de pesquisa da Universidade Nacional da Malásia FF‐2018‐058. Com base nos resultados de Danby et al., o tamanho da amostra foi calculado com tamanho de efeito de 0,2 e desvio‐padrão do resultado de 0,18.12 O nível alfa bicaudal foi fixado em 0,05, nível beta em 0,2. Com a fórmula (1/q1 + 1/q0) (Zα + Zβ)2/(E/S)2, o tamanho da amostra foi calculado em 36, considerou‐se uma taxa de abandono de 20%.13 O software estatístico SPSS foi usado para as análises estatísticas. Onde havia mais de duas variáveis comparadas, os valores de p foram obtidos pelo teste de Friedman. O teste de Wilcoxon foi usado para determinar as alterações entre semana 0, a semana 2 e a semana 6. O teste de Mann‐Whitney foi usado para analisar as diferenças entre os grupos hidratante convencional e hidratante com pH modificado. Valores‐p <0,05 foram considerados estatisticamente significativos.
ResultadosParticiparam do estudo 36 pacientes com DA, dos quais 30 eram do sexo feminino e seis do masculino. A idade variou de 12 a 64 anos, enquanto a mediana foi de 24,5 (28,7) anos. Havia 20 (55,6%) malaios, nove (25%) chineses, cinco (13,9%) indianos e dois (5,5%) de outras etnias. Dos pacientes, 21 (58,3%) apresentaram rinite ou sinusite alérgica, 12 (33,3%) apresentaram conjuntivite alérgica e alergia alimentar, respectivamente, e 29 (80,6%) apresentaram teste de alergia positivo. Trinta (83,3%) pacientes usavam hidratantes; 31 (86,1%), esteroides tópicos e 15 (41,7%), anti‐histamínicos. Os tipos de hidratantes usados pelos pacientes foram: creme aquoso (13; 36,1%), creme aquoso com glicerina (12; 33,3%), parafina (3; 8,3%) e outros (2; 5,6%; um paciente usava hidratante à base de aveia e um, à base de ureia); seis pacientes (16,7%) não usavam hidratante. As avaliações de intensidade da doença na semana 0 indicaram um valor médio modificado do SCORAD de 14,3 (10,7); a área de superfície corporal (ASC) foi de 1,0 (1,5), o escore de prurido foi de 4 (3) e o DLQI foi de 7,5 (5,75). A tabela 1 apresenta as características da população do estudo.
Características da população
| Características | n (%) ou mediana (IIQ) |
|---|---|
| Idade (anos) | 24,5 (28,7) |
| Sexo | |
| Masculino | 6 (16,7%) |
| Feminino | 30 (83,3%) |
| Etnia | |
| Malaio | 20 (55,6%) |
| Chinês | 9 (25%) |
| Indiano | 5 (13,9%) |
| Outros | 2 (5,5%) |
| Comorbidades | |
| Rinite alérgica/Sinusite | 21 (58,3%) |
| Asma brônquica | 9 (25%) |
| Urticária/Angioedema | 11 (30,5%) |
| Conjuntivite alérgica | 12 (33,3%) |
| Alergia alimentar | 12 (33,3%) |
| Alergia a medicamentos | 5 (13,9%) |
| Teste de punctura/teste de contato/IgE sérica | 29 (80,6%) |
| Tratamento | |
| Hidratante | 30 (83,3%) |
| Esteroides tópicos | 31 (86,1%) |
| Imunossupressor sistêmico | 0 (0%) |
| Anti‐histamínico | 15 (41,7%) |
| Tipo de hidratante | |
| Creme aquoso | 13 (36,1%) |
| Creme aquoso com glicerina | 12 (33,3%) |
| Parafina | 3 (8,3%) |
| Outros | 2 (5,6%) |
| Sem hidratante | 6 (16,7%) |
| Intensidade da doença | |
| SCORAD objetivo modificado | 14,3 (10,7) |
| BSA | 1,0 (1,5) |
| DLQI | 7,5 (5,75) |
| Grau de prurido | 4 (3) |
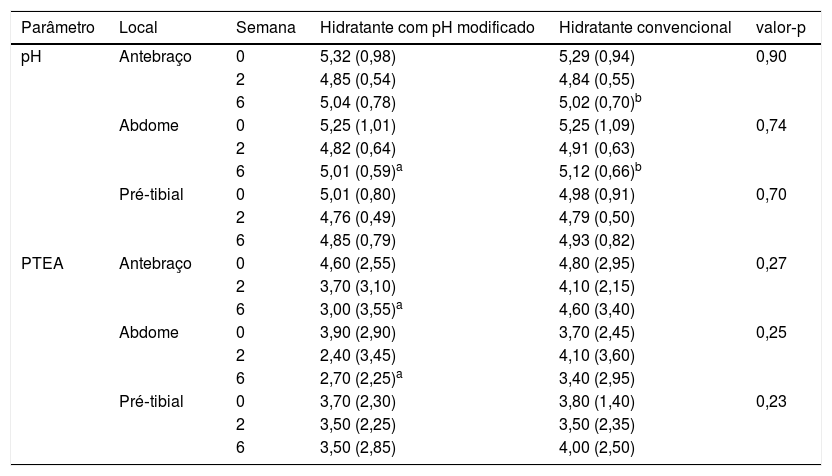
O pH da pele diminuiu da semana 0 para a semana 6 em todos os locais; uma redução maior foi observada na semana 2. Os valores aumentaram ligeiramente da semana 2 para a semana 6, mas permaneceram abaixo dos valores iniciais (tabela 2). As reduções de pH da semana 0 à semana 6 foram significativas nos antebraços (5,315 [0,98] na semana 0, 4,85 [0,54] na semana 2, 5,04 [0,78] na semana 6; p=0,024) e no abdome (5,25 [1,01] na semana 0, 4,82 [0,64] na semana 2, 5,01 [0,59] na semana 6; p=0,000), mas não nas regiões pré‐tibiais (5,01 [0,80] na semana 0, 4,76 [0,49] na semana 2, 4,85 [0,79] na semana 6; p=0,088). A PTEA diminuiu da semana 0 para a semana 6 em todos os locais. Nos antebraços, a PTEA diminuiu significativamente de 4,60 (2,55) na semana 0 para 3,70 (3,10) na semana 2 e 3,00 (3,55) na semana 6, com p=0,00 (tabela 2). No abdome, a PTEA diminuiu de 3,90 (2,90) na semana 0 para 2,40 (3,45) na semana 2, mas aumentou ligeiramente para 2,70 (2,25) na semana 6, com p=0,05. As alterações observadas nas regiões pré‐tibiais não foram significativas: a PTEA na semana 0 foi de 3,70 (2,30), 3,50 (2,25) na semana 2 e 3,50 (2,85) na semana 6, com p=0,10. A tabela 2 apresenta as alterações no pH da pele e na PTEA nos locais de aplicação do hidratante com pH modificado. O SCORAD melhorou significativamente: a mediana foi de 14,1 (12,75) na semana 0, 10,5 (13,25) na semana 2 e 7 (12,65) na semana 6, p=0,00 (tabela 3).
Valores de pH e PTEA nas semanas 0, 2 e 6 nos locais de aplicação de hidratantes com pH modificado e hidratantes convencionais
| Parâmetro | Local | Semana | Hidratante com pH modificado | Hidratante convencional | valor‐p |
|---|---|---|---|---|---|
| pH | Antebraço | 0 | 5,32 (0,98) | 5,29 (0,94) | 0,90 |
| 2 | 4,85 (0,54) | 4,84 (0,55) | |||
| 6 | 5,04 (0,78) | 5,02 (0,70)b | |||
| Abdome | 0 | 5,25 (1,01) | 5,25 (1,09) | 0,74 | |
| 2 | 4,82 (0,64) | 4,91 (0,63) | |||
| 6 | 5,01 (0,59)a | 5,12 (0,66)b | |||
| Pré‐tibial | 0 | 5,01 (0,80) | 4,98 (0,91) | 0,70 | |
| 2 | 4,76 (0,49) | 4,79 (0,50) | |||
| 6 | 4,85 (0,79) | 4,93 (0,82) | |||
| PTEA | Antebraço | 0 | 4,60 (2,55) | 4,80 (2,95) | 0,27 |
| 2 | 3,70 (3,10) | 4,10 (2,15) | |||
| 6 | 3,00 (3,55)a | 4,60 (3,40) | |||
| Abdome | 0 | 3,90 (2,90) | 3,70 (2,45) | 0,25 | |
| 2 | 2,40 (3,45) | 4,10 (3,60) | |||
| 6 | 2,70 (2,25)a | 3,40 (2,95) | |||
| Pré‐tibial | 0 | 3,70 (2,30) | 3,80 (1,40) | 0,23 | |
| 2 | 3,50 (2,25) | 3,50 (2,35) | |||
| 6 | 3,50 (2,85) | 4,00 (2,50) |
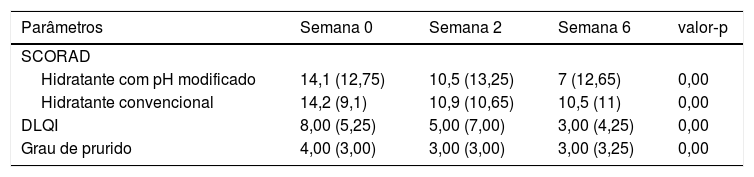
Efeito do hidratante convencional vs. hidratante com pH modificado na intensidade da doença (SCORAD), DLQI e grau de prurido
| Parâmetros | Semana 0 | Semana 2 | Semana 6 | valor‐p |
|---|---|---|---|---|
| SCORAD | ||||
| Hidratante com pH modificado | 14,1 (12,75) | 10,5 (13,25) | 7 (12,65) | 0,00 |
| Hidratante convencional | 14,2 (9,1) | 10,9 (10,65) | 10,5 (11) | 0,00 |
| DLQI | 8,00 (5,25) | 5,00 (7,00) | 3,00 (4,25) | 0,00 |
| Grau de prurido | 4,00 (3,00) | 3,00 (3,00) | 3,00 (3,25) | 0,00 |
Um padrão semelhante de redução no pH da pele da semana 0 à semana 6 com maior redução na semana 2 foi observado nos locais de aplicação do hidratante convencional (tabela 2). A redução do pH foi significativa no antebraço (5,29 [0,94] na semana 0; 4,84 [0,55] na semana 2 e 5,02 [0,70] na semana 6; p=0,00) e no abdome (5,25 [1,09] na semana 0, 4,91 [0,63] na semana 2, 5,12 [0,66] na semana 6; p=0,00). As alterações de pH na região pré‐tibial não foram significativas: 4,98 (0,91) na semana 0, 4,79 (0,50) na semana 2 e 4,93 (0,82) na semana 6, com p=0,432. A PTEA nos antebraços e regiões pré‐tibiais apresentou discretas reduções não significativas na semana 2, seguidas de um incremento na semana 6 (tabela 2). A PTEA no antebraço foi de 4,80 (2,95) na semana 0, 4,10 (2,15) na semana 2 e 4,60 (3,40) na semana 6, com p=0,67. Nas regiões pré‐tibiais, a PTEA foi de 3,80 (1,40) na semana 0, 3,50 (2,35) na semana 2 e 4,00 (2,50) na semana 6, com p=0,913. A PTEA aumentou transitoriamente e posteriormente diminuiu para valores abaixo dos iniciais no abdome: 3,70 (2,45) na semana 0, 4,10 (3,60) na semana 2 e 3,40 (2,95) na semana 6, com p=0,80. A tabela 2 apresenta as alterações no pH da pele e na PTEA nos locais de aplicação do hidratante convencional. O SCORAD melhorou significativamente: a mediana foi de 14,2 (9,1) na semana 0, 10,9 (10,65) na semana 2 e 10,5 (11) na semana 6, com p=0,00 (tabela 3).
Hidratante com pH modificado vs. hidratante convencionalObservou‐se maior redução do pH no abdome e na região pré‐tibial com o uso de hidratante com pH modificado (tabela 2). Os valores de PTEA foram menores no antebraço e no abdome com o uso de hidratante com pH modificado (tabela 2). O SCORAD foi menor nos locais de hidratante com pH modificado nas semanas 2 e 6 (tabela 3). No entanto, não foram observadas diferenças estatisticamente significativas nos valores de pH, PTEA e SCORAD entre os locais de hidratante convencional e hidratante com pH modificado. A melhoria no SCORAD foi refletida em uma redução significativa no escore de prurido e no DLQI (tabela 3).
Um paciente desenvolveu eritema ipsilateral que demandou uso de corticosteroide tópico, provavelmente devido a uma reação ao hidratante com pH modificado. Dois pacientes desenvolveram exacerbações leves, simétricas e bilaterais. Outro efeito colateral relatado foi hipertricose (n=2) nas duas pernas após a conclusão do estudo. Outro paciente relatou leve sensação de formigamento na aplicação de hidratante com pH modificado, que desapareceu após duas semanas.
DiscussãoOs efeitos clínicos e biofísicos dos hidratantes na pele com DA são pouco explorados na literatura, apesar do uso extensivo de vários tipos de hidratantes no tratamento padrão da DA.14,15 Os efeitos dos óleos minerais (um ingrediente comum em hidratantes) na barreira da pele em pacientes com DA são pouco documentados. O creme aquoso foi escolhido como hidratante neste estudo, pois é o hidratante preferido pela maioria dos presentes pacientes, é econômico e é mais adaptável à modificação do pH. O creme aquoso é preferido pelos presentes pacientes por sua sensação menos oleosa, um fator importante que facilita a adesão ao tratamento no clima quente e úmido tropical da Malásia. O creme aquoso não continha lauril éter sulfato de sódio (SLS), que é provavelmente o agente mais provavelmente responsável pelos efeitos adversos relatados com o creme aquoso.16‐18 O creme aquoso com SLS causou redução da espessura do estrato córneo com aumento da PTEA após quatro semanas de aplicação regular.15,16 Foram observadas melhorias no pH e na PTEA com creme aquoso (sem SLS): na semana 6, os valores de pH foram significativamente menores do que os valores iniciais, enquanto não foram observadas alterações significativas na PTEA. Isso sugere que o uso de SLS em vez de creme aquoso deve ser proibido em produtos destinados a serem enxaguados ou não, mas são necessárias mais evidências confirmatórias.
Os presentes resultados demonstraram que o pH da pele, a PTEA e a intensidade da AD melhoraram com a aplicação de hidratante, independentemente do pH do hidratante usado. Foi demonstrado que a inclusão de hidratantes no tratamento da DA melhorou a intensidade da doença, reduziu os surtos e diminuiu a necessidade de corticosteroide tópico em comparação com nenhum hidratante.15 Esses efeitos foram observados com vários tipos de hidratantes.15 A relação entre a melhoria clínica da DA e parâmetros biofísicos como pH, PTEA e hidratação ainda não é clara, pois esses parâmetros não são avaliados na maioria dos estudos de hidratantes.14 A redução nos graus de intensidade clínica parecia ser acompanhada por melhoria na hidratação da pele, sem alteração na PTEA.14 Ainda faltam dados sobre o efeito dos hidratantes no pH da pele. O efeito de um hidratante com pH 4,92 (creme Diprobase®) foi comparado com creme aquoso (com SLS) e outro hidratante com pH 7,13 (gel DoublebaseTM) em pacientes com DA quiescente.12 O pH e a hidratação da pele aumentaram enquanto a PTEA diminuiu transitoriamente após uma única aplicação dos três hidratantes. O pH aumentou significativamente com o gel DoublebaseTM e o creme Diprobase® após 28 dias de uso repetido; não foram observadas alterações na PTEA, mas a hidratação foi melhor com o gel DoublebaseTM. O pH dos hidratantes não pareceu afetar o pH da pele e a PTEA de maneira diferente. A diferença na hidratação pode ser atribuída ao componente umectante do gel DoublebaseTM, pois os outros hidratantes contêm apenas agentes oclusivos. Foi demonstrado que curativos oclusivos melhoram a hidratação da pele, mas causam aumento do pH e PTEA.19,20 O uso prolongado de hidratantes oclusivos com parafina pode resultar no mesmo efeito. As alterações de pH da superfície que resultam da aplicação do hidratante são provavelmente inadequadas para superar os efeitos dos mecanismos de proteção intrínseca da pele. Além disso, o uso concomitante de produtos de limpeza da pele e esteroides tópicos de formulação mais alcalina pode ter superado o efeito do hidratante.
Embora as alterações de pH com os dois hidratantes fossem comparáveis, foi observada uma melhoria significativa da PTEA nos locais de hidratante com pH modificado, o que não foi observado nos locais de hidratante convencional. O uso da maioria dos hidratantes normalmente não é suficiente para causar uma redução da PTEA, independentemente de sua formulação.12,14 A redução da PTEA é observada com intervenções farmacológicas tópicas, como corticosteroide e inibidor de calcineurina.21 O benefício do hidratante com pH fisiologicamente compatível pode ser devido ao seu efeito na PTEA, e não no pH da superfície da pele. A acidificação da pele na AD inibe a atividade das serina‐proteases sensíveis ao pH, responsáveis pela descamação acelerada e pelo aumento da síntese de lipídios para a formação da matriz lamelar extracelular;2 ambos são componentes‐chave da barreira de permeabilidade representada pela PTEA. Para investigar esse aspecto mais a fundo, faz‐se necessária a avaliação dos compostos do estrato córneo.
Ambos os hidratantes foram bem tolerados; foram observados efeitos adversos leves e transitórios. Todos os pacientes já haviam usado creme aquoso sem apresentar efeitos adversos.
As limitações deste estudo incluem a ausência de um período de descontinuação do hidratante dos pacientes antes do início do hidratante do estudo. O pH inicial foi obtido pelo menos 5 horas após a última aplicação do hidratante de rotina dos pacientes. No entanto, a maioria dos pacientes ou não usava hidratante, ou usava creme aquoso ou creme aquoso em combinação com glicerina. Além disso, a lavagem não foi feita para evitar exacerbação da doença. A hidratação da pele não foi medida; portanto, este estudo foi incapaz de mostrar a relação entre hidratação e pH. A deficiência ou não de filagrina dos participantes do estudo não foi determinada; isso pode afetar a interpretação dos presentes resultados.
ConclusãoTanto o creme aquoso convencional quanto o creme aquoso com pH modificado melhoraram o pH da pele. Não foram observadas diferenças significativas nos valores de pH e PTEA entre os dois hidratantes. A redução do pH foi observada com os dois hidratantes. Observou‐se melhoria significativa da PTEA com o hidratante com pH modificado, o que não foi observado com o hidratante convencional. A aplicação de ambos os hidratantes resultou na melhoria da DA. O uso de hidratante com pH fisiológico é útil como um complemento no tratamento da DA.
Suporte financeiroBolsa de pesquisa fundamental da University Kebangsaan Malaysia.
Contribuição dos autoresGoh Siew Wen: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Adawiyah Jamil: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Nazarudin Safian: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Norazirah Md Nor: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Norliza Muhammad: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Nur Liyana Saharudin: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
A Julianah Ramli e Nur Arifah Muhd Rafiee por coordenarem o cronograma de visitas dos pacientes.
Como citar este artigo: Goh SW, Jamil A, Safian N, Md Nor N, Muhammad N, Saharudin NL. A randomized half‐body, double blind, controlled trial on the effects of a pH‐modified moisturizer vs. standard moisturizer in mild to moderate atopic dermatitis. An Bras Dermatol. 2020;95:320–5.
Trabalho realizado na Unidade de Dermatologia, Departamento de Medicina, Centro Médico da Universidade Kebangsaan Malaysia, Kuala Lumpur, Malásia.