Embora não totalmente compreendido, o estresse oxidativo tem sido associado à patogênese de diferentes doenças autoimunes, como a esclerose sistêmica. A evidência acumulada indica que o estresse oxidativo pode induzir danos no DNA mitocondrial (mtDNA) e variações no número de cópias do mtDNA (mtDNAcn).
ObjetivoExplorar o mtDNAcn e subprodutos de danos oxidativos ao DNA no sangue periférico de pacientes com esclerose sistêmica e em controles saudáveis.
MétodosO estudo incluiu 46 pacientes com esclerose sistêmica e 49 indivíduos saudáveis. PCR quantitativa em tempo real foi usada para mensurar o mtDNAcn relativo e o dano oxidativo (purinas oxidadas) de cada amostra.
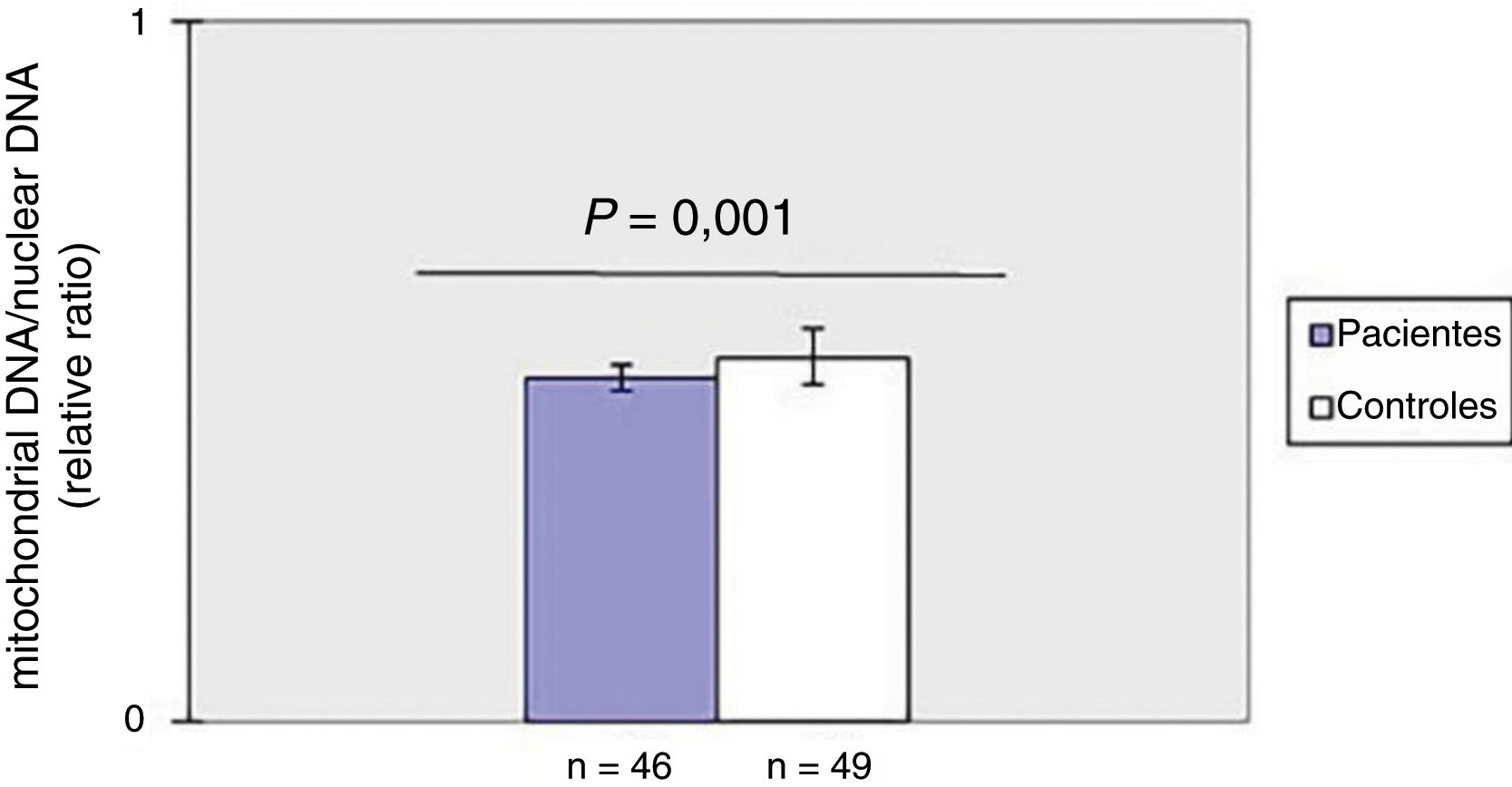
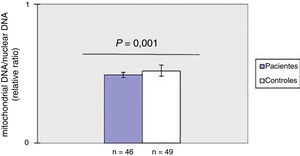
ResultadosO mtDNAcn médio foi menor em pacientes com esclerose sistêmica do que nos controles, enquanto o grau de dano ao mtDNA foi significativamente maior nos doentes em comparação com os controles. Além disso, observou‐se correlação negativa entre o mtDNAcn e o dano oxidativo ao DNA.
Limitações do estudoA falta de análise e quantificação simultânea de marcadores de dano oxidativo ao DNA no soro ou na urina de pacientes com esclerose sistêmica e em controles saudáveis.
ConclusãoEsses dados sugerem que a alteração no mtDNAcn e o aumento do dano oxidativo ao DNA podem estar envolvidos na patogênese da esclerose sistêmica.
A esclerose sistêmica (ES) é doença crônica rara do tecido conjuntivo caracterizada por vasculopatia e fibrose na pele e em vários órgãos internos.1,2 Sua causa exata é desconhecida, mas sua ocorrência pode ser influenciada por uma interação complexa de fatores genéticos, epigenéticos e ambientais.3 Recentemente, grande atenção tem sido dedicada ao papel do estresse oxidativo na patogênese da ES. Acredita‐se que ele esteja envolvido nos processos fisiopatológicos de aumento da síntese e acúmulo de matriz extracelular, ativação imune anormal e dano endotelial vascular, as três principais características da ES.4,5
O aumento do estresse oxidativo reflete um desequilíbrio entre a homeostase pró‐oxidante/antioxidante e leva a níveis aumentados de espécies reativas de oxigênio (ERO) tóxicas. Existem duas vias principais de geração de ERO: endógena e exógena. As mitocôndrias são a principal fonte endógena de ERO. Elas têm seu próprio genoma (DNA mitocondrial [mtDNA]) e são organelas indispensáveis para a fisiologia celular normal. O mtDNA é multicópias e sua abundância é regulada de forma específica em cada tipo de tecido. O mtDNAcn flutua em resposta ao ambiente fisiológico ao redor da célula; em condições fisiológicas, permanece relativamente estável dentro das células.6 Em circunstâncias patológicas, o mtDNAcn pode variar, depende de diferentes fatores, inclusive o equilíbrio redox celular alterado. O mtDNA também é propenso a danos por estresse oxidativo devido à sua alta exposição aos EROs produzidos pelas mitocôndrias.7
Os produtos de oxidação da guanina são importantes indicadores de dano oxidativo ao DNA. Esses marcadores químicos podem ser removidos por Fpg (DNA‐formamidopirimidina glicosilase), uma enzima de reparo por excisão de base que libera lesões de purina, tanto do DNA nuclear quanto do mtDNA.7,8 A clivagem por Fpg do DNA oxidativamente danificado pode reduzir a amplificação do DNA alvo digerido pela enzima Taq DNA polimerase.9 Portanto, esse método tem sido amplamente usado como uma medida de dano oxidativo ao DNA. Os objetivos do presente estudo foram determinar se a variação do mtDNAcn e seu índice de dano oxidativo (mtDNA [ΔCT]) podem ser detectados em pacientes com ES.
MétodosO estudo foi aprovado pelo Comitê de Ética da Universidade de Ciências Médicas e foi feito de acordo com os princípios de ética da Declaração de Helsinque. Todos os participantes concordaram voluntariamente em participar do estudo e assinaram o termo de consentimento livre e esclarecido.
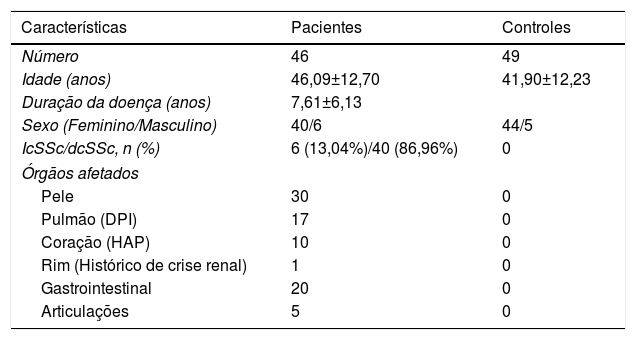
População do estudoO estudo incluiu 46 pacientes com ES e 49 indivíduos saudáveis pareados por idade e sexo, sem histórico de esclerodermia ou outras doenças crônicas e autoimunes. Os pacientes com ES foram diagnosticados de acordo com os critérios do Colégio Americano de Reumatologia (ACR)/Liga Europeia Contra Reumatismo (EULAR) de 2013.10,11 Entre os pacientes incluídos, seis (13,04%) apresentavam forma limitada de ES e 40 (86,96%) ES difusa. Doze (26,09%) apresentavam doença pulmonar intersticial (DPI), três (6,52%) hipertensão arterial pulmonar (HAP) e três (6,52%) DPI e HAP. A idade média dos pacientes com ES (seis homens, 40 mulheres) e os controles (cinco homens, 44 mulheres) foi de 46,09 e 41,90 anos, respectivamente. A duração média da doença foi de 7,61±6,13 anos, com variação de um a 40 anos. Trinta e oito pacientes com ES difusa e seis pacientes com ES cutânea limitada haviam recebido tratamento com esteroides e/ou imunossupressores antes da amostragem. A dose e a duração do tratamento foram diferentes, dependeram da gravidade das lesões e dos órgãos afetados. Nenhum dos pacientes apresentava doenças inflamatórias/autoimunes além da ES e todos estavam inativos no momento da visita. A tabela 1 apresenta as características demográficas e clínicas dos pacientes com ES e controles.
Características demográficas e clínicas de pacientes com esclerose sistêmica e controles saudáveis
| Características | Pacientes | Controles |
|---|---|---|
| Número | 46 | 49 |
| Idade (anos) | 46,09±12,70 | 41,90±12,23 |
| Duração da doença (anos) | 7,61±6,13 | |
| Sexo (Feminino/Masculino) | 40/6 | 44/5 |
| IcSSc/dcSSc, n (%) | 6 (13,04%)/40 (86,96%) | 0 |
| Órgãos afetados | ||
| Pele | 30 | 0 |
| Pulmão (DPI) | 17 | 0 |
| Coração (HAP) | 10 | 0 |
| Rim (Histórico de crise renal) | 1 | 0 |
| Gastrointestinal | 20 | 0 |
| Articulações | 5 | 0 |
| Tratamento | ||
|---|---|---|
| Tipo de doença | Medicamento | Número de pacientes |
| Esclerose sistêmica cutânea limitada | Metotrexato | 4 |
| Azatioprina | 1 | |
| Micofenolato | 1 | |
| Esclerose sistêmica difusa | Metotrexato | 6 |
| Azatioprina | 10 | |
| Micofenolato | 14 | |
| Prednisolona | 1 | |
| Azatioprina+prednisolona | 7 | |
| Nenhum | 2 | |
As amostras de sangue foram coletadas em tubos de 5mL com ácido etileno diamino tetraacético (EDTA). O DNA do sangue total foi extraído com o kit de isolamento de DNA (GeneAll – Seul, Coreia), de acordo com as instruções do fabricante.
A concentração e purificação do DNA extraído foram medidas com eletroforese em gel de agarose (1,5%) e espectrofotometria com NanoDrop 2000c (Thermo Fisher Scientific, EUA). Todas as amostras de DNA foram armazenadas a ‐20°C até o uso.
Preparação do modelo de DNAPara a detecção de dano oxidativo, 100 ng de DNA da amostra (2μL de solução‐padrão) foram incubados por 1h a 37°C em 10μL de mistura de reagente com uma unidade de enzima FPG (New England BioLabs – Massachusetts, EUA), 10mM Bis Tris Propano‐HCl, 10mM MgCl2, 1mM DTT e 0,1mg/mL de albumina de soro bovino. Para a detecção do mtDNAcn, o DNA da amostra foi preparado de maneira semelhante, mas sem FPG.
Determinação quantitativa do número de cópias do mtDNAAs reações para o ensaio quantitativo de reação em cadeia de polimerase em tempo real (qPCR) foram feitas com o kit SYBR Premix EX Taq II (Takara – Japão) e com um aparelho Rotor‐Gene 6000 (Corbett Life Science – Austrália). A PCR foi feita em 42 ciclos, com uma desnaturação inicial de 1min a 95°C no primeiro ciclo. Todos os ciclos subsequentes consistiram em desnaturação a 95°C por 4s, emparelhamento a 62°C por 30s e extensão a 72°C por 15s, bem como uma etapa final de extensão a 72°C por 15s.
As reações de PCR foram feitas em um volume total de 10μL com 1μL de DNA genômico, 0,5μL de cada iniciador, 5μL de SYBR Premix e 3μL de água destilada.
Para quantificação de mtDNA, foi usado um conjunto de iniciadores direcionados à subunidade NADH desidrogenase tipo 2 codificada mitocondrialmente (ND2). Para quantificação nuclear de DNA, um conjunto de iniciadores direcionados ao gene da β‐actina foi selecionado. Todos os iniciadores foram comprados na Gene Fanavaran Company (Teerã, Irã) e suas sequências exatas foram descritas anteriormente.12 A proporção de mtDNA para DNA nuclear em cada amostra foi calculada como uma estimativa para o número de mtDNA.
Determinação quantitativa do dano ao mtDNAO conteúdo de produtos de oxidação de guanina foi determinado pela técnica baseada em qPCR. O nível de dano oxidativo no DNA mitocondrial é indicado por um aumento dos nucleotídeos de purina oxidados, inclusive 8‐OHdG. A digestão com FPG foi usada para a detecção de produtos do dano oxidativo no DNA. Os níveis de dano oxidativo ao mtDNA foram apresentados como ΔCt, que é a diferença entre os valores do ciclo limiar (Ct) entre as amostras tratadas com enzima e as não tratadas com enzima (Ct‐T e Ct‐N, respectivamente). Valores mais elevados de ΔCt indicam níveis mais altos de estresse oxidativo nas mitocôndrias.
Análise estatísticaOs dados distribuídos normalmente e não normalmente foram analisados pelo teste t para amostras independentes e pelo teste U de Mann‐Whitney, respectivamente. Os níveis de dependência linear entre duas variáveis foram calculados pelo coeficiente de correlação de Pearson. Esse teste é adequado para variáveis contínuas normais; valores‐p inferiores a 0,05 foram considerados estatisticamente significativos. Os resultados experimentais foram apresentados como média±desvio‐padrão. O software SPSS (v11.0; SPSS, Inc. Chicago, IL, EUA) foi usado para as operações estatísticas e interpretação dos resultados do estudo.
ResultadosDiminuição do mtDNAcn no sangue periférico em pacientes com ESComo mostrado na figura 1, o mtDNAcn do sangue periférico diminuiu significativamente (p=0,001) no grupo de pacientes (0,49±0,02) em comparação com o grupo controle (0,52±0,04). Não foi observada associação entre mtDNAcn e idade, sexo e duração da doença. Além disso, não houve diferença significativa no mtDNAcn entre os pacientes com doença limitada e difusa (p>0,05).
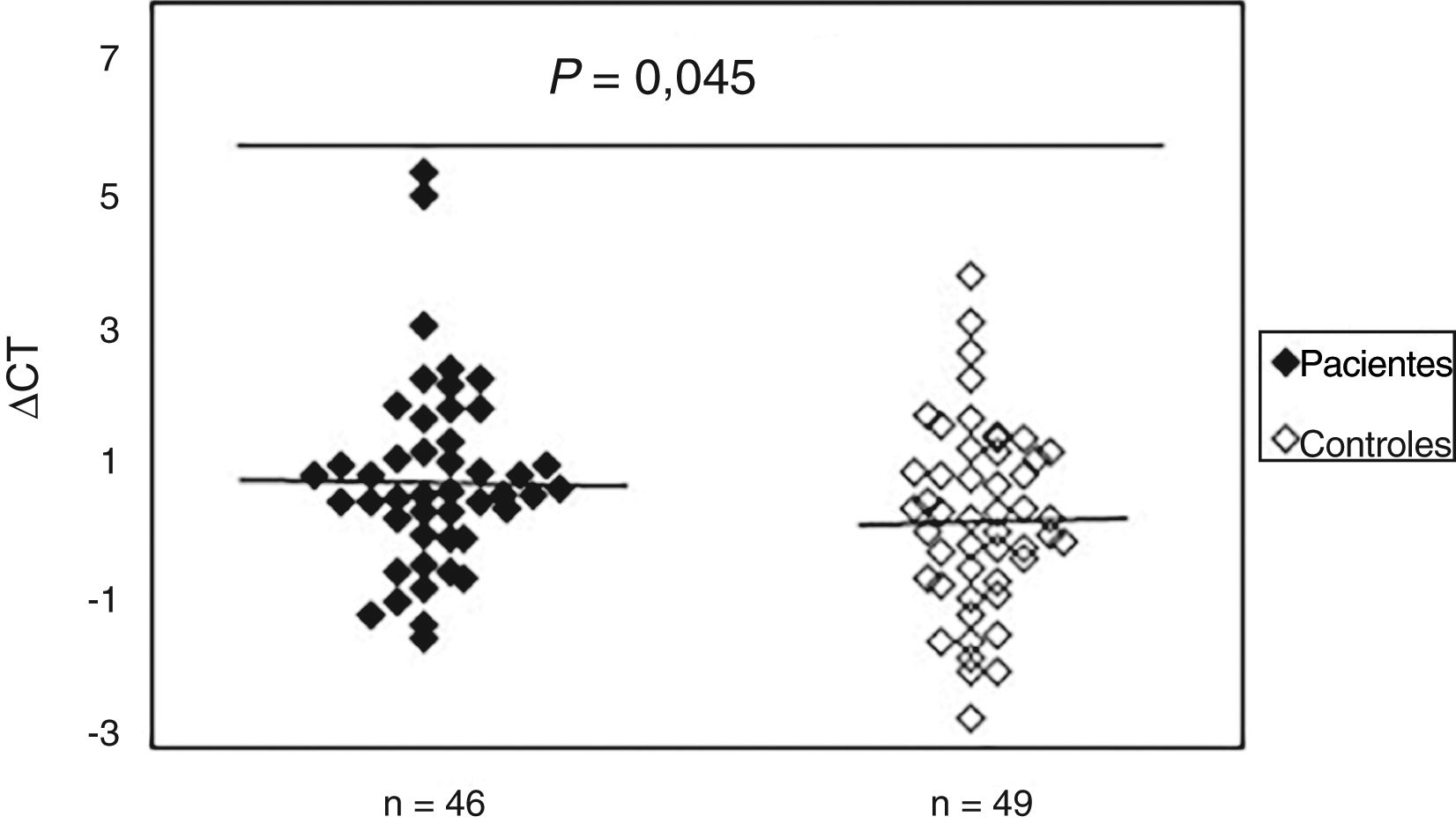
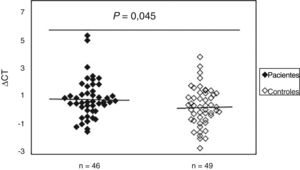
Aumento do dano oxidativo ao DNA em pacientes com ESPara avaliar a existência de dano oxidativo, a presença de bases de purinas oxidadas (principalmente 8‐oxodGuo), que são locais sensíveis à FPG, foi determinada no DNA de amostras de sangue periférico de pacientes com ES e controles normais. Os resultados indicaram (fig. 2) que o valor médio do dano oxidativo ao DNA em pacientes (0,99±1,40) aumentou significativamente (p=0,045) em comparação ao grupo controle (0,42±1,37). Além disso, não foi observada associação entre dano oxidativo ao DNA e idade, sexo e duração da doença. A análise estatística também não indicou diferenças significativas entre os pacientes com ES limitada e difusa em termos de dano oxidativo ao DNA (p>0,05). Curiosamente, observou‐se uma correlação negativa entre o mtDNAcn e o dano oxidativo ao DNA (r=‐0,392, p=0,007).
Aumento do dano ao DNAmt em pacientes com esclerose sistêmica em comparação aos controles normais. O Ct é a diferença entre o valor de Ct da amostra de DNA tratada com FPG e o valor de Ct da amostra de DNA sem tratamento com FPG. Observe que um valor mais alto de Ct corresponde a níveis comparativamente mais altos desses danos oxidativos.
Há um consenso geral de que a ES é doença autoimune e que a complexidade de sua imunopatogênese é similar à de outras doenças autoimunes.13 Sua etiologia exata não é clara. No entanto, estudos recentes apontam a importância da influência do estresse oxidativo nos processos da doença. Por exemplo, Bourji et al. mostraram que peles fibróticas e não fibróticas de pacientes com ES apresentam níveis mais altos de ERO do que as de controles saudáveis. Eles também observaram que pacientes com ES apresentavam níveis mais baixos de vitamina C (que tem poderosa atividade antioxidante) do que os controles saudáveis.14 O aumento da produção de ERO por fibroblastos, células endoteliais e células T, os principais agentes celulares na patogênese da ES, é outra evidência que associa o estresse oxidativo aos principais eventos da doença, como fibrose e dano vascular.15
Existem muitas vias distintas para a geração de ERO. As mitocôndrias são as principais fontes de ERO e, ao mesmo tempo, os principais alvos de seus efeitos desfavoráveis. A maior parte das ERO mitocondriais decorre da cadeia de transporte de elétrons, como subproduto do processo de respiração aeróbica.16 As ERO agem como uma faca de dois gumes, porque sua geração descontrolada promove estresse oxidativo que causa lesões graves em tipos básicos de macromoléculas biológicas, inclusive DNA, proteínas, carboidratos e lipídios. Por outro lado, a ERO pode participar de vários processos biológicos em células normais, inclusive vias de sinalização celular e respostas imunes contra patógenos ou substâncias estranhas.17
Nos últimos anos, vários estudos examinaram o impacto da variação quantitativa e qualitativa do mtDNAcn em doenças humanas e demonstraram alterações notáveis no mtDNAcn em várias doenças.12,18 O mtDNAcn pode ser modificado pelo estresse oxidativo. Além disso, o aumento da produção de ERO pode causar danos oxidativos aos componentes celulares, inclusive o DNA.6 Portanto, a avaliação do mtDNAcn e de seu índice de dano oxidativo melhorará o entendimento sobre a patogênese de doenças relacionadas ao estresse oxidativo, como a ES.
Os resultados do presente estudo indicaram que o valor médio do mtDNAcn foi significativamente menor do que o observado em controles normais. Tanto quanto é do conhecimento dos autores, este é o primeiro relato que mediu as alterações do mtDNAcn no sangue periférico de pacientes com ES. Atualmente, existem poucas informações sobre a relação entre alterações bioquímicas, estruturais e funcionais nas mitocôndrias e ES.
Um relato de Feldmann et al. indicou a presença de mitocôndrias gigantes nos hepatócitos de pacientes com esclerodermia sistêmica. Entretanto, esses autores não forneceram explicação sobre o(s) mecanismo(s) por trás desse evento celular.19 Alguns pesquisadores também relataram a presença de anticorpos antimitocôndrias (AMAs) nos soros de pacientes com ES. Esses anticorpos são encontrados em até 25% dos pacientes20 e atuam contra componentes da multienzima piruvato desidrogenase complexa (PDHC),21 que está localizada na matriz mitocondrial interna e produz substratos reduzidos para a cadeia de transporte de elétrons.22 Os AMAs são considerados um marcador sérico de doenças autoimunes, como a cirrose biliar primária (CBP).23 A motivação clínica por trás da avaliação dos AMAs em pacientes com ES foi a observação de que uma grande proporção desses pacientes apresentava uma condição autoimune coexistente, inclusive CBP.24
Vários outros autoanticorpos, inclusive anticorpos anticentrômero (ACA), anti‐topoisomerase (ATA) e anti‐RNA polimerase III (anti‐RNAP), foram descritos em pacientes com ES como possíveis bons biomarcadores para várias manifestações clínicas e prognósticas em subconjuntos de ES.25
Existem também algumas evidências de associação positiva entre esses anticorpos e AMA. Por exemplo, Wielose et al. concluíram que a prevalência de ACAs é significativamente maior em pacientes com ES que apresentam títulos positivos de AMA do que naqueles com títulos negativos de AMA.26 Este estudo também apontou uma forte associação entre AMAs e ACAs em pacientes com ES cutânea limitada, o que é consistente com relatos anteriores.27
Esses achados sugerem indiretamente que as mitocôndrias podem estar envolvidas na ES, além de sugerir um possível papel para o estresse oxidativo. Essa hipótese é reforçada por outras observações. Por exemplo, a análise do fluido obtido na lavagem broncoalveolar (LBA) de pacientes com ES e fibrose pulmonar (SScFib+) indicou significativa suprarregulação da topoisomerase 1 do DNA mitocondrial (mtDNA TOP1),28 uma enzima que tem papel funcional na manutenção e na topologia do mtDNA.29 Além disso, foi observada infrarregulação da glutationa S‐transferase P (GSTP) e superóxido dismutase (SOD) no LBA de pacientes com SScFib+.28 É importante mencionar que SOD e GSTP são dois componentes do sistema de defesa antioxidante que protege as células e os tecidos contra oxidantes, especialmente no pulmão.30,31
Os produtos de danos oxidativos em bases de DNA também servem como marcadores de estresse oxidativo; entre as quatro bases nitrogenadas no DNA, a guanina é a base de ácido nucleico mais facilmente oxidável. Portanto, a guanina é alvo primário de modificação oxidativa32 e a medição de espécies de guanina oxidada pode ser uma ferramenta útil para avaliar os danos ao DNA induzidos pelo estresse oxidativo nos compartimentos nuclear e mitocondrial.
No presente estudo, o teste qPCR foi usado para avaliar a oxidação da base de DNA nas células sanguíneas periféricas de pacientes com ES e controles saudáveis.
Os resultados indicaram diferença estatisticamente significativa entre os grupos analisados em relação ao dano oxidativo do mtDNA. Além disso, uma correlação negativa significativa foi observada entre o mtDNAcn e o grau de mtDNA oxidativo (r=‐0,392, p=0,007).
Esses resultados são similares aos de estudos anteriores que relataram aumento do estresse oxidativo e danos ao DNA em fibroblastos obtidos de pacientes com ES (esclerodermia).33,34
Embora o mecanismo molecular exato do dano ao DNA ainda não tenha sido elucidado, aparentemente os autoanticorpos derivados de pacientes com ES podem estimular várias vias de sinalização intracelular (como as vias Wnt e Ras) que podem ser influenciadas pelos ERO e também podem ter impacto na produção de ERO. Nesse cenário, alterações descontroladas na produção de ERO e na transdução de sinal podem resultar em acúmulo de danos ao DNA, ativação de genes dependentes de ERO e alta suscetibilidade à apoptose. Acredita‐se que esses eventos participem da formação de fibrose tecidual como consequência da apoptose e da deposição de colágeno.35
ConclusãoO presente estudo avaliou os danos ao mtDNAcn e ao mtDNA com um ensaio quantitativo baseado em PCR. Os presentes resultados indicam que pacientes com ES apresentavam redução no mtDNAcn e aumento no dano mitocondrial, o que é consistente com a disfunção mitocondrial. Além de experimentos tradicionais para desvendar a fisiopatologia da ES, estudos futuros são necessários para confirmar os presentes achados.
Suporte financeiroUniversidade de Ciências Médicas de Teerã (contrato n° 24.743).
Contribuição dos autoresShafieh Movassaghi: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Sara Jafari: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Kowsar Falahati: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados.
Mitra Ataei: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados.
Mohammad Hossein Sanati: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Zohreh Jadali: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Movassaghi S, Jafari S, Falahati K, Ataei M, Sanati MH, Jadali Z. Quantification of mitochondrial DNA damage and copy number in circulating blood of patients with systemic sclerosis by a qPCR‐based assay. An Bras Dermatol. 2020;95:314–9.
Trabalho realizado no Tehran University of Medical Sciences, Teerã, Irã.