Embora os nevos displásicos (NDs) apresentem grau de desorganização citoarquitetural, geralmente não é difícil distingui‐los do melanoma cutâneo (MC). No entanto, em alguns casos, essa distinção pode ser difícil.1 Pacientes com numerosos NDs2 e aqueles com NDs com atipia de alto grau (NDAG)3 são mais propensos a desenvolver MC. Esses pacientes precisam de seguimento cuidadoso, e qualquer lesão com alterações deve ser excisada para descartar malignidade, anteriormente diagnosticada erroneamente como nevo displásico. Um dos achados microscópicos evidentes dos NDs é a fibroplasia da derme papilar.4 O PRAME (PReferentially expressed Antigen in MElanoma) é antígeno associado à maioria dos melanomas cutâneos e uveais primários e metastáticos, com exceção dos melanomas desmoplásicos.5 Foram estudadas a densidade e a textura do colágeno subjacente aos NDs excisado de 15 pacientes com síndrome do nevo displásico (SND), no período de 1994 a 2019, e a expressão de PRAME em suas células.
MétodosA aprovação do Comitê de Ética em Pesquisa foi obtida (n° 3.548.935). Os pacientes eram acompanhados regularmente no Ambulatório de Dermatologia. Dos nevos excisados desses pacientes durante o período estudado, 56 foram diagnosticados histopatologicamente como ND juncional e tinham tecido emblocado suficiente para cortes adicionais. Os nevos foram diagnosticados com grau/desorganização de citoarquitetura baixo/moderado (n=32, NDBG) ou moderado/grave (n=24, NDAG; fig. 1 A‐D). Cada espécime foi estudado de duas maneiras: 1) por coloração com vermelho de picrosirius e observação sob luz polarizada em imagens digitalizadas (fig. 2), para avaliar a densidade e a textura do colágeno sob o nevo, utilizando o software ImageJ (http:// rsb.info.nih.gov/ij) para medir o contraste da matriz de co‐ocorrência de nível de cinza, segundo momento angular, entropia e anisotropia, e 2) por métodos imuno‐histoquímicos convencionais, para expressão do PRAME (Mab EPR20330; Abcam, #219650), de acordo com o método de Googe et al.5 SAS System for Windows foi o software utilizado para a análise estatística.
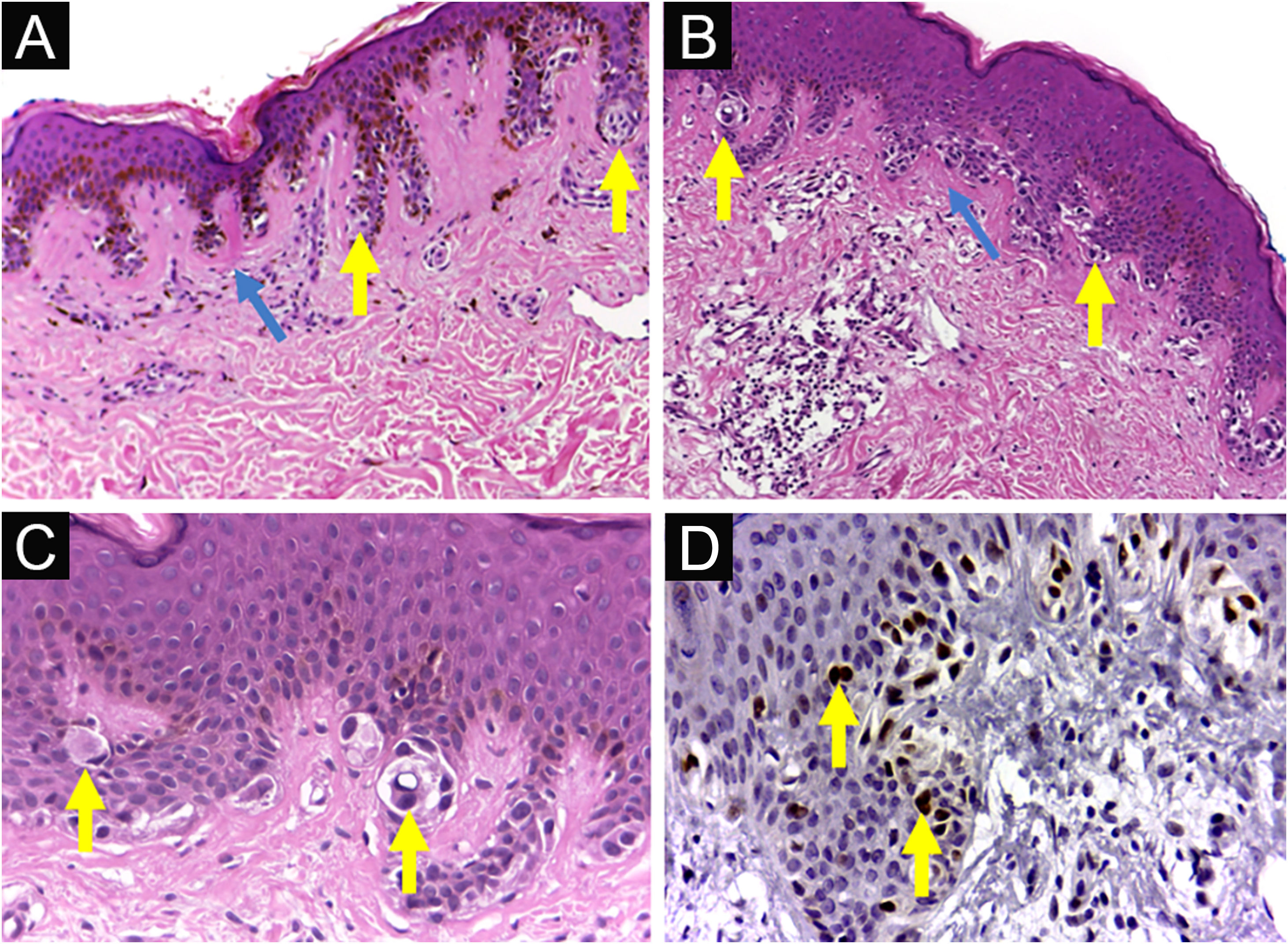
Síndrome do nevo displásico. (A) Nevo displásico clássico (NDC): hiperplasia epidérmica regular, pequenos aglomerados de melanócitos na junção dermoepidérmica (setas amarelas) e fibroplasia da derme papilar (seta azul). (B, C) ND com atipia histológica de alto grau (NDAG): hiperplasia epidérmica irregular, agregados de melanócitos de volumes variados, em distribuição variada e com atipia citológica multifocal moderada a acentuada (setas amarelas) e fibroplasia da derme papilar (seta azul). (D) ND com atipia histológica de alto grau (NDAG): imunoexpressão nuclear do antígeno PRAME nos melanócitos presentes na junção dermoepidérmica. (A‐C) Hematoxilina & eosina; (D) imuno‐histoquímica; Aumento original 100×(A, B) e 400×(C, D).
Nove dos 15 pacientes eram do sexo feminino, oito tinham história prévia de MC em algum momento da vida, 51/56 NDs foram diagnosticados até os 40 anos de idade e nenhuma lesão apresentou recorrência após a excisão. O colágeno sob o ND de pacientes com histórico pessoal de MC apresentou valores de densidade óptica significativamente maiores (p=0,0259) em relação àqueles sem esse precedente, denotando textura mais compacta. O NDAG (n=24/56) apresentou valores significativamente menores de contraste (p=0,0140) e entropia (p=0,0353) em relação ao NDBG, refletindo maior organização do colágeno. Esses resultados confirmam a maior predisposição desses pacientes com SND ao MC. Como Babacan et al. encontraram por meio de métodos histoquímicos,6 parece que a modulação da matriz extracelular evolui em paralelo com a desorganização citoarquitetural. O PRAME não estava superexpresso em NDs de pacientes com SND. A coloração nuclear do PRAME de melanócitos de NDs foi categorizada como ausente em 51 NDs e focalmente presente5 em cinco lesões NDAG (fig. 2). Googe et. al.5 encontraram apenas imunorreatividade focal para PRAME em pouco mais de 10% dos nevos, incluindo os displásicos.
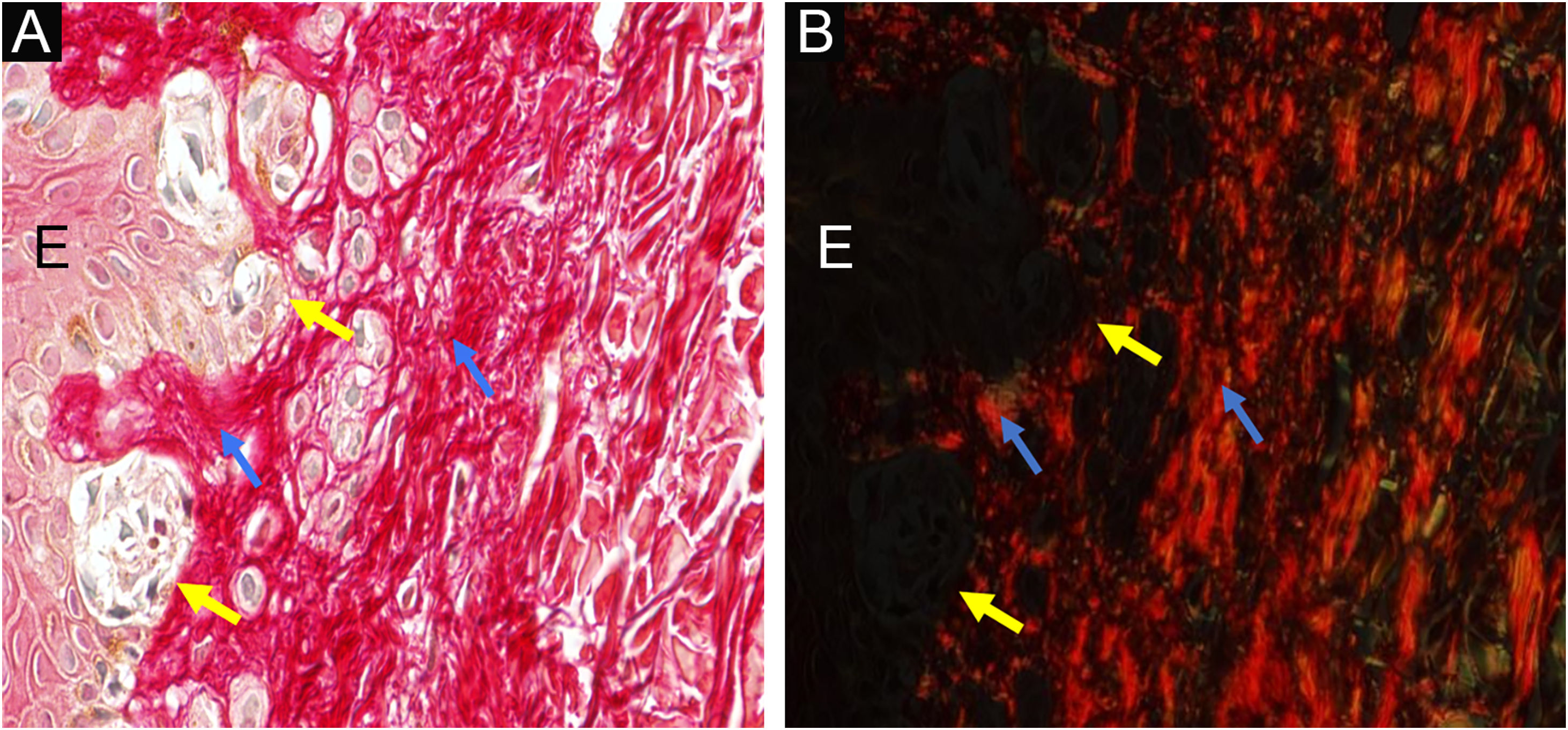
Síndrome do nevo displásico: nevo displásico clássico ‐ à esquerda, a epiderme (E) mostra agregados de melanócitos na junção dermoepidérmica (setas amarelas) e, à direita, a derme papilar sob o nevo é indicada por setas azuis. Aumento original, 400×. Vermelho de picrosirius, sem polarização (A) e sob polarização (B).
NDAG e NDs com textura compacta subjacente parecem ser marcadores de pacientes com risco aumentado de desenvolver melanoma.
Suporte financeiroO anticorpo e demais itens utilizados para o desenvolvimento deste trabalho foram adquiridos com o auxílio da FAEPEX‐Uncamp (Fundo de Amparo ao Ensino, Pesquisa e Extensão), Bolsa n° 2015/20. Paula R. M. Costa foi bolsista do CNPq/ Pibic (Conselho Nacional de Desenvolvimento Científico e Tecnológico). Revisamos o conteúdo do manuscrito, guiados pela Sra. Diane Ellis, B.A. em educação. A bioestatística Cleide Aparecida Moreira Silva, da Comissão de Pesquisa, Divisão de Bioestatística, Faculdade de Ciências Médicas, Unicamp, prestou consultoria estatística.
Contribuição dos autoresPaula Regina Martins Costa: Concepção do estudo; obtenção dos dados; redação do manuscrito.
Gislaine Vieira‐Damiani: Análise e interpretação, revisão crítica.
Rafael Fantelli Stelini: Obtenção dos dados; orientação de pesquisa.
Leonardo Ávila Ferreira: Obtenção dos dados; orientação da pesquisa.
Maria Letícia Cintra: Obtenção dos dados; redação do manuscrito; participação efetiva na orientação da pesquisa.
Fernanda Teixeira: Obtenção dos dados; revisão crítica do manuscrito; redação do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Costa PRM, Vieira‐Damiani G, Stelini RF, Ferreira LA, Cintra ML, Teixeira F. The texture of collagen and immunoexpression of PRAME in dysplastic nevus syndrome lesions: relationship with melanoma. An Bras Dermatol. 2023;98:128–130.
Trabalho realizado no Departamento de Patologia, Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.