A psoríase é doença dermatológica inflamatória crônica caracterizada por placas descamativas brancas e placas eritematosas nitidamente demarcadas. A prevalência da psoríase varia de país para país; a doença pode ocorrer em qualquer idade, implicando que etnia, fatores ambientais e antecedentes genéticos desempenham um papel no seu aparecimento. De acordo com o World Psoriasis Day Consortium, 125 milhões de pessoas em todo o mundo e 2 a 3% da comunidade geral têm psoríase. A introdução de tratamentos biológicos revolucionou o tratamento da psoríase moderada a grave. Esses novos medicamentos, particularmente aqueles que têm como alvo a interleucina (IL)‐17 e IL‐23p19, podem ajudar a maioria dos pacientes com a doença a obter uma pele livre ou praticamente livre de lesões, com durabilidade satisfatória. No entanto, nenhum desses tratamentos modernos é totalmente curativo em sua forma atual e, de modo alarmante, uma proporção limitada, mas crescente, de pacientes com psoríase grave não está respondendo satisfatoriamente aos tratamentos atualmente disponíveis. A terapia com células‐tronco, incluindo células T reguladoras, transplante de células‐tronco hematopoiéticas e células estromais mesenquimais, tem sido utilizada em pacientes com psoríase recalcitrante. Esta revisão discute os tratamentos com células‐tronco disponíveis para a psoríase.
A psoríase é uma doença dermatológica autoimune crônica, caracterizada por placas descamativas brancas ou eritematosas, com predileção pelo couro cabeludo, genitália, região lombosacra e superfícies extensoras dos membros. A doença afeta 2 a 3% da população global – cerca de 125 milhões de indivíduos em todo o mundo. Não há prevalência de idade, mas a doença é mais comum entre os 15 e 25 anos, e pode levar à artrite psoriásica. É mais comum em caucasianos do que em outros grupos étnicos, e é mais frequente em latitudes maiores. Embora a psoríase seja classificada como doença autoimune, não há evidências que envolvam autoantígenos; no entanto, há evidências de que a doença tem predisposição genética.1 Fatores genéticos e ambientais podem influenciar a idade de início da psoríase – por exemplo, a presença dos alelos do antígeno leucocitário humano (HLA, do inglês human leukocyte antigen)‐C*06 tem sido associada a idade de início mais jovem.
Vários tipos de células, incluindo ceratinócitos, células T natural killer, células dendríticas plasmocitoides e macrófagos, produzem citocinas que ativam células dendríticas mieloides nos estágios iniciais da patogênese da psoríase. Os complexos DNA‐LL37, por exemplo, induzem as células dendríticas plasmocitoides a liberar interferon‐alfa (IFN‐α), que ativa as células dendríticas mieloides que, por sua vez, liberam IL‐12 e IL‐23 após a estimulação. A IL‐12 induz células T naïve a se diferenciarem em células TH1.2 A sinalização intracelular de IL‐23 é mediada por Tyk2‐Jak2 e STAT3, o que leva à transcrição de mediadores inflamatórios críticos. Essas citocinas causam a proliferação de ceratinócitos, a liberação de moléculas de adesão endotelial e um aumento na produção de mediadores angiogênicos e infiltração de células imunes em lesões dérmicas.2
A intrincada interação entre os elementos imunológicos, naturais, genéticos e epigenéticos que sustentam a etiologia dessa doença ainda não está clara. Entretanto, o advento de medicamentos biológicos que têm como alvo as vias imunes críticas envolvidas na etiopatogenia da psoríase, como IL‐17, IL‐23 e fator de necrose tumoral (TNF), mudou o cenário terapêutico para formas graves de psoríase. Os esquemas terapêuticos que incluem esses novos agentes podem ajudar os pacientes com psoríase a reduzir a carga da doença e melhorar sua qualidade de vida. Por outro lado, esses medicamentos direcionados não são completamente curativos e apresentam limitações como eficácia diminuída ao longo do tempo, possíveis efeitos adversos graves e resposta clínica deficiente em algumas pessoas.3 Consequentemente, há um número crescente de pacientes identificados com psoríase que são refratários às terapias sistêmicas. Portanto, é urgente a necessidade de avanços de última geração no tratamento da psoríase grave e estratégias não farmacológicas.
A terapia com células‐tronco envolve o uso de células somáticas derivadas de um doador (alogênico) ou de um indivíduo afetado (autólogo) para tratar a doença subjacente. Células‐tronco hematopoiéticas (HSCs, do inglês hematopoietic stem cells), células‐tronco pluripotentes induzidas, células‐tronco mesenquimais (MSCs, do inglês mesenchymal stem cells) e células‐T reguladoras (Tregs) são exemplos de células somáticas já utilizadas ou promissoras como terapia com células‐tronco na psoríase. Distúrbios cardiovasculares, doenças do tecido conjuntivo e câncer são as três aplicações atuais da terapia com células‐tronco em todo o mundo, todas com rápida pesquisa clínica e melhora na comercialização. O transplante de células‐tronco hematopoiéticas (TCTH) atraiu a atenção em termos de “transferência” e “cura” da psoríase após pesquisas que se concentraram principalmente em doenças musculoesqueléticas, esclerose sistêmica e esclerose múltipla. No entanto, tem havido pouca pesquisa testando as hipóteses sobre a ação do TCTH na psoríase. Portanto, parece haver fundamento e incentivo para investigar o uso da terapia com células‐tronco na psoríase, particularmente em indivíduos que não responderam aos tratamentos convencionais. Esta revisão discute a epidemiologia, a patogênese, a apresentação clínica, o diagnóstico e o tratamento com células‐tronco para a psoríase.
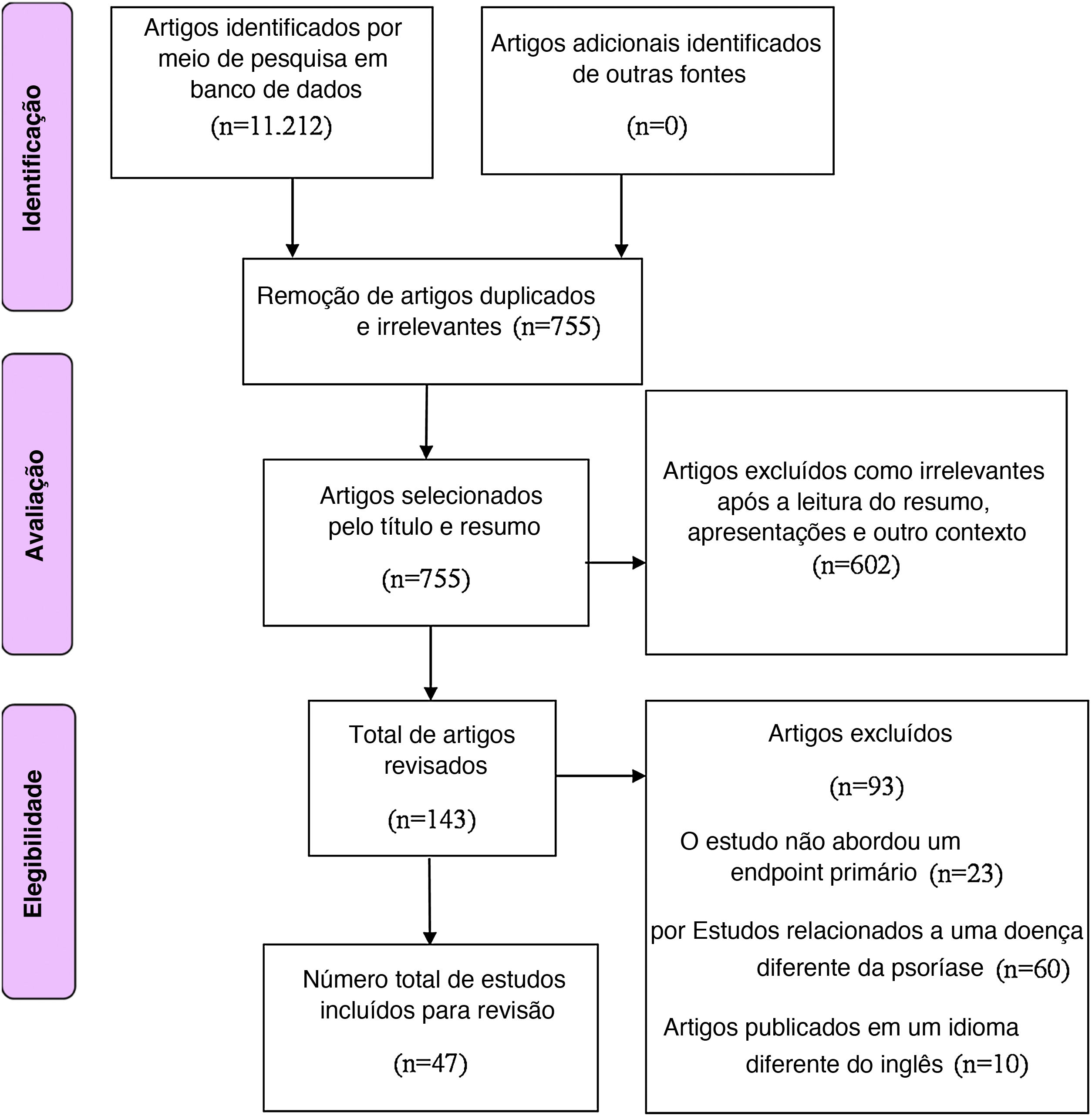
MétodoAs bases de dados PubMed, Google Scholar, MEDLINE, Scopus e Cochrane foram pesquisadas eletronicamente utilizando termos‐chave apropriados para identificar artigos sobre terapia com células‐tronco como tratamento potencial para a psoríase. Os seguintes termos foram combinados para pesquisa no MEDLINE e PubMed para identificar a literatura: Psoriasis AND “stem cell therapy” OR “regulatory T‐cells” OR “hematopoietic stem cell transplantation” OR “mesenchymal stromal cells” OR “diagnosis”) AND (“cell therapy” OR (“psoriasis” AND “treatments”) OR “stem cells” OR (“psoriasis” AND “cell‐based”). A busca inicial na literatura resultou em 11.212 artigos (fig. 1). Os artigos publicados entre janeiro de 1990 e julho de 2021 eram relatos que continham descrição da terapia com células‐tronco para psoríase e foram publicados em inglês. Não foram impostas restrições em relação ao tipo de desenho do estudo.
Terapia com células‐tronco na psoríaseCélulas T reguladorasAs Tregs regulam ou suprimem outros imunócitos ao modular suas respostas ao ambiente endógeno e antígenos, ajudando assim a evitar autoimunidade e inflamação crônica. Essas funções são realizadas por meio de citocinas inibitórias, como a IL‐10, interferência no metabolismo, modificação da maturação ou funcionamento de células dendríticas, ligação do gene 3 de ativação de linfócitos às moléculas do MHC classe II e citólise (por meio de granzima A/B e perforina).4
Muitos tratamentos para a psoríase parecem aumentar o número de Tregs e seu desempenho em pacientes com psoríase. A terapia anti‐TNF (particularmente etanercepte) aumenta as Tregs e diminui a expressão de IL‐6 e IL‐22.5 O aumento do número de Tregs pode estar associado a melhores resultados clínicos, e o infliximabe estimula um repertório de RCT mais divergente.6 Em um estudo, descobriu‐se que o bloqueio de TNF aumenta a liberação de citocinas pró‐inflamatórias e a atividade de Th17 e diminui o número de Tregs e a expressão de Foxp3, resultando no agravamento da doença.7
Vários agentes biológicos, incluindo anti‐IL‐23 (ustequinumabe específico para p40 e guselkumabe específico para p19) e anti‐IL‐17A (secuquinumabe), foram aprovados para tratar a psoríase. Existem outros agentes anti‐IL‐23 (risanquizumabe, guselkumabe, briakinumabe, tildrakizumabe) e anti‐IL17 (ixekizumabe e brodalumabe) aprovados e disponíveis no mercado.8 Anti‐IL‐17A e anti‐IL‐23 já demonstraram aumentar as células Foxp3+. Portanto, o tratamento com anti‐IL‐17 na psoríase pode restaurar um equilíbrio Th17/Treg saudável e, assim, reduzir a inflamação e atenuar a doença. Em um estudo recente de Fase I‐IIa, IL‐2 em baixa dose foi administrada a pacientes com várias doenças autoimunes. Os pacientes com psoríase apresentaram níveis de Treg aumentados e melhora nos escores de área de superfície corporal e PASI.9 Portanto, uma combinação de IL‐2 de baixa dose com um regime que restaure as funções das Tregs (p. ex., fototerapia ou sotrastaurina) é uma abordagem terapêutica promissora na psoríase.
A estabilidade e a funcionalidade da linhagem Treg dependem da programação epigenética. A histona deacetilase (HDAC‐1) é expressa nos tecidos de pessoas com psoríase. Verificou‐se que a tricostatina‐A, que inibe a proteína HDAC, desloca as Tregs para um fenótipo IL‐17.10 Esse achado sugere que os inibidores de HDAC também podem ser benéficos no tratamento da psoríase. Ao redefinir a razão Th17/Treg e diminuir o número de subconjuntos de células T inflamatórias, as terapias com base em células Treg podem ter a capacidade de interferir na patogênese da psoríase apesar de seu alto custo e riscos.11
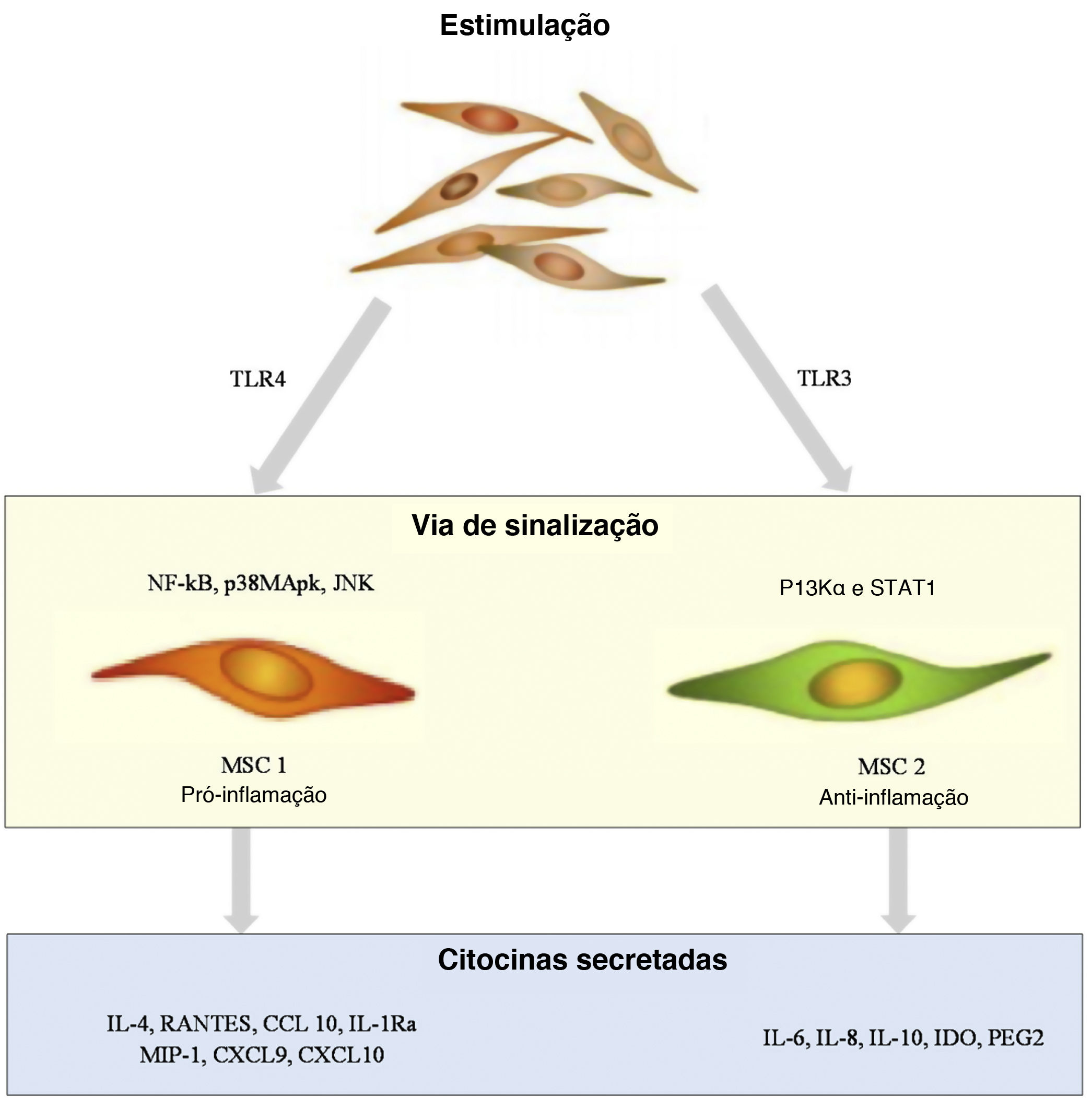
Células‐tronco mesenquimaisAs MSCs são um tipo de célula pluripotente encontrada em tecidos de origem mesenquimal e são responsáveis pela regeneração tecidual. O papel das MSCs na patogênese da psoríase é mostrado na figura 2. As MSCs são diferenciadas por indicadores de superfície específicos e sua capacidade de aderir a substratos plásticos e se desenvolver em adipócitos, osteócitos e condrócitos in vitro. As MSCs consistem em vários tipos de células; as mais conhecidas são as células‐tronco estromais derivadas da medula óssea. Outras MSCs incluem MSCs do cordão umbilical, células‐tronco derivadas do tecido adiposo e células‐tronco do líquido amniótico, encontradas na fração vascular estromal do tecido adiposo. As MSCs estão sendo estudadas não apenas por sua capacidade de regenerar células, mas também por suas propriedades imunomoduladoras, uma vez que parecem modular diretamente a liberação de citocinas derivadas de linfócitos.12 De acordo com um estudo recente, as MSCs da pele de pacientes com psoríase apresentam baixa capacidade de diferenciação, baixa função imunorreguladora e altos níveis de expressão de HLA‐I.13 Na pele psoriásica, a inibição de linfócitos parece estar prejudicada, provavelmente em virtude das MSCs dérmicas anormais, que resultam em secreção anormal de citocinas por meio do RNA circular.14 Além disso, foi demonstrado que as MSCs de placas psoriáticas estimulam o crescimento de ceratinócitos, levando ao espessamento epidérmico.15
Vários estudos relataram que as MSCs desempenham um papel significativo na determinação dos efeitos pleiotrópicos da terapia biológica em ceratinócitos e células T. De acordo com Campanati et al., os inibidores de TNF‐α afetam as MSCs cutâneas, as células com maior probabilidade de estarem envolvidas na psoríase.16 Vários estudos recentes investigaram o uso de MSCs como uma possível opção terapêutica para a psoríase (tabela 1).17–25
Estudos de células‐tronco mesenquimais como tratamento curativo para psoríase
| Número do estudo | Autor(es) | Tipo de MSCs | Tipo de estudo | Tipo de publicação |
|---|---|---|---|---|
| 1 | Owczarczyk‐Saczonek et al.17 | MSCs de medula óssea e cordão umbilical | Pré‐clínico, clínico | Revisão |
| 2 | Lee et al.18 | MSC de cordão umbilical | Pré‐clínico | Pesquisa Original |
| 3 | Kim et al.19 | MSCs derivados de tonsilas | Pré‐clínico | Pesquisa Original |
| 5 | Campanati et al.20 | MSCs dérmicos | Pré‐clínico | Pesquisa Original |
| 7 | Kim et al.21 | MSCs derivadas de células‐tronco embrionárias | Pré‐clínico | Pesquisa Original |
| 8 | Imai et al.22 | Células‐tronco do líquido amniótico | Pré‐clínico | Carta |
| 9 | Chen et al.23 | MSCs de cordão umbilical | Pré‐clínico | Pesquisa Original |
| 10 | Wang et al.24 | MSCs gengivais alogênicas | Clínico | Relato de caso |
| 11 | Chang et al.25 | MSCs derivadas da derme humana | Clínico | Artigo original |
MSCs, células‐tronco mesenquimais.
As MSCs desempenham um papel na imunidade inata e adaptativa em termos de imunomodulação. Suas atividades de aprimoramento imunológico são realizadas por meio de sinergia com células imunes, incluindo neutrófilos, células dendríticas, monócitos, células natural killer, macrófagos, células‐B e células‐T via interações célula‐a‐célula e atividade parácrina.26 Vários fatores de crescimento, quimiocinas e citocinas são encontrados no secretoma das MSCs, envoltos em vesículas extracelulares; entre esses, óxido nítrico, indoleamina‐pirrol 2,3‐dioxigenase, fibroblastos e fatores de crescimento de hepatócitos, IFN‐ɣ, prostaglandina E2, TNF‐α e fator de crescimento transformador β1.27
A maioria das evidências favoráveis ao uso de MSCs na psoríase vem de estudos de fase I ou II. Até o momento, não houve toxicidade significativa. No entanto, são necessários ensaios controlados mais extensos para determinar a eficácia e a segurança a longo prazo dessa estratégia de tratamento. Apesar do crescente volume de conhecimento e experiência com MSCs no cenário clínico, a dose celular e a constância diferem entre os estudos clínicos relatados até o momento, e o melhor regime ainda não foi identificado.
Células‐tronco hematopoiéticasOs efeitos favoráveis do TCTH em pacientes com linfoma e leucemia e outras doenças autoimunes, incluindo lúpus eritematoso sistêmico, diabetes, artrite reumatoide e esclerose múltipla, levaram a estudos de TCTH em pacientes com psoríase.28–30 Nos últimos 25 anos, a remissão prolongada da psoríase foi documentada em mais de 30 pacientes submetidos a transplante de medula óssea (TMO).31,32 Entretanto, um pequeno número de pacientes desenvolveu psoríase após receber um TMO alogênico ou uma transfusão de sangue de um doador com psoríase.31 Detalhes dos estudos que demonstraram remissão da psoríase após TCTH autólogo são mostrados na tabela 2.33–41
Estudos de remissão da psoríase após transplante de HSC
| Número do estudo | Autor(es) | Indicação | Tipo de HSCT | Remissão da psoríase |
|---|---|---|---|---|
| 1 | Kishimoto33 | Leucemia mieloide aguda | Alogênico | Dois anos de seguimento |
| 2 | Kaffenberger et al.32 | Leucemia mieloide crônica | Alogênico NST | Dois anos de seguimento |
| 3 | Kanamori et al.34 | Leucemia mieloide crônica | Alogênico BMT | Dois anos e meio de seguimento |
| 4 | Mohren et al.35 | Artrite psoriática | PBSCT | 16 meses |
| 5 | Woods and Mant29 | Anemia aplástica | Alogênico HSCT | 12 meses |
| 6 | Rossi et al.36 | Anemia aplástica aguda | Alogênico BMT | Dez anos de seguimento |
| 7 | Braiteh et al.37 | Mieloma múltiplo | Autólogo HSCT | > dois anos de seguimento |
| 8 | Held et al.38 | Sarcoma de Ewing | Transplante Autólogo de Células‐Tronco | 15 meses de seguimento |
| 9 | Mori et al.39 | Síndrome mielodisplásica | Alogênico BMT | Oito meses de seguimento |
| 10 | Chen et al.40 | Amiloidose de cadeia leve de imunoglobulina e psoríase | Autólogo HSCT | Seguimento por mais de sete anos |
| 11 | Ugur e Gediz41 | Psoríase e mieloma múltiplo | Transplante Autólogo de Células‐Tronco | 18 meses de seguimento |
TMO, transplante de medula óssea; TCTH, transplante de células‐tronco hematopoiéticas; NST, transplante de células‐tronco alogênicas não mieloablativas; TCTSP, transplante de células‐tronco de sangue periférico.
De acordo com a patogênese da psoríase, as células T podem provocar o desenvolvimento de alterações após uma transfusão de sangue, mas as células T periféricas têm um tempo de vida relativamente curto. A melhora da psoríase foi documentada em pacientes submetidos a TCTH alogênico (em vez de autólogo), sugerindo que as células‐tronco hematopoiéticas poderiam ser a causa primária da doença.31,42 Mori et al. descreveram o caso de um paciente do sexo masculino de 54 anos com história de psoríase de 10 anos, que foi tratado com um transplante alogênico de medula óssea com mieloablação anterior com bussulfano e ciclofosfamida em razão de uma síndrome mielodisplásica, que obteve remissão completa da psoríase que se manteve durante os oito meses de seguimento.39 Os autores desse relato enfatizaram a necessidade de eliminar as células autorreativas durante o TMO alogênico e o tratamento com medicação imunossupressora para manter a remissão. De maneira similar, Adkins et al. relataram o caso de uma mulher de 55 anos com psoríase refratária e leucemia mieloide crônica que recebeu um TMO alogênico e obteve remissão completa da psoríase,28 embora os medicamentos utilizados para preparar a paciente para o transplante (ciclofosfamida e bussulfano) possam ter contribuído para a rápida remissão da psoríase na paciente. Zurita et al. apresentaram os achados de um estudo que comparou os efeitos do TCTH autólogo (n=30) com a fotoquimioterapia com UVA (n=19) em pacientes com psoríase grave. Após a obtenção da medula óssea da crista ilíaca e isolamento da fração CD34+, as células autólogas foram administradas por via intravenosa em dose única.30 Os efeitos terapêuticos foram controlados por até seis meses e comparados com os efeitos da fotoquimioterapia com UVA (PUVA). A PASI 75 atingiu um nível estatisticamente significativo no grupo tratado com células‐tronco, mas nenhuma diferença significativa foi observada em comparação com os efeitos do PUVA.30
Vantagens da terapia com células‐tronco para psoríaseA descoberta da terapia com células‐tronco como uma alternativa viável de tratamento para a psoríase refratária foi acidental. Eedy et al. descreveram um homem de 35 anos que recebeu HSCs alogênicas de seu irmão não afetado para tratar uma leucemia mielomonocítica aguda e foi curado de psoríase grave e intratável. O receptor ainda estava livre da psoríase cinco anos após o transplante.43 Os mecanismos subjacentes à eficácia do TCTH alogênico na psoríase ainda são desconhecidos. Acredita‐se que os medicamentos imunossupressores e a ablação imunológica necessários para a cirurgia diminuem o número de células T autorreativas. O sistema imunológico é reconstruído com populações de células T potencialmente não reativas de doadores que não têm psoríase. Uma remissão durável da psoríase (por até 20 anos) foi relatada em pessoas que foram submetidas a TCTH alogênico em vez de TCTH autólogo.32
Em um relato contrastante, “transferência” de psoríase foi documentada em um homem de 40 anos com leucemia mieloide aguda que recebeu um TCTH singênico de seu irmão gêmeo fenotipicamente idêntico com história de 20 anos de psoríase grave e artrite psoriática.44 O irmão receptor desenvolveu psoríase intratável dez dias após o enxerto. Mesmo após uma segunda doação do mesmo doador, sua condição continuou com o início de artrite psoriásica. Esse caso sugere que a transferência adotiva pode ser utilizada para transmitir as características celulares da psoríase. Por outro lado, o TCTH autólogo não alivia totalmente a psoríase; recaídas são comuns e podem ocorrer em até dez anos após o transplante. Em um estudo, cinco dos 11 pacientes com psoríase que receberam TCTH autólogo sofreram recidiva em dois anos, e um apresentou recidiva 13 anos depois.45 No entanto, mesmo quando há recorrência da psoríase, ela segue um curso mais benigno do que antes do transplante. Os efeitos mieloablativos e linfoablativos do pré‐condicionamento e da reconstituição imune retardada após o transplante são todos fatores a serem considerados, e acredita‐se que sejam responsáveis pela remissão da psoríase após TCTH autólogo.37
Chen et al. exploraram o mecanismo de ação das MSCs de cordão umbilical para psoríase utilizando o modelo de camundongo tratado com imiquimode e infusão de MSCs de cordão umbilical humano; essas MSCs reduziram significativamente a gravidade da psoríase.46 A menor geração de IFN tipo I por células dendríticas plasmocitoides foi uma característica significante da resposta. Por fim, Wang et al. utilizaram cinco infusões de MSCs gengivais alogênicas, que têm efeitos imunomoduladores e anti‐inflamatórios, para tratar um jovem de 19 anos com psoríase grave em placas que era recalcitrante a tratamentos sistêmicos. A psoríase do paciente desapareceu após a sexta infusão, e o rapaz permanecia livre da psoríase três anos depois.24
ConclusãoA psoríase é uma doença inflamatória da pele associada a diversas comorbidades que têm impacto significativo na qualidade de vida. A aplicação de células‐tronco aumenta a esperança de desenvolver uma terapia nova, segura e eficaz para pacientes com psoríase. A terapia celular na forma de MSCs pode oferecer uma opção atraente e segura na psoríase. Apesar de mais dados ainda serem necessários, as MSCs podem ser uma terapia promissora para a psoríase.
Suporte financeiroNenhum.
Contribuição dos autoresPiyu Parth Naik: Desenho, metodologia, concepção e planejamento do estudo, revisão crítica da literatura, preparação e redação do manuscrito, redação do rascunho original, redação‐revisão e edição, aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
O autor agradece ao Dr. Parth Naik por seus esforços na compilação de informações.