A dermatite atópica é a doença cutânea inflamatória mais comum na infância e ocasiona importante impacto na qualidade de vida – principalmente as graves, ou recalcitrantes aos tratamentos. A sensibilização a alérgenos com potencial para o surgimento de dermatite alérgica de contato é um fator associado à recalcitrância da dermatite atópica. Compreender a relação entre a dermatite atópica, alérgenos e dermatite alérgica de contato é essencial para o tratamento dos pacientes. No Brasil, não há estudos sobre a sensibilização a alérgenos utilizando‐se testes de contato em crianças com dermatite atópica.
ObjetivosVerificar os principais sensibilizantes, a prevalência de dermatite de contato alérgica e o perfil epidemiológico e clínico de crianças e adolescentes com dermatite atópica.
MétodosEstudo transversal, prospectivo, em pacientes entre 4 e 18 anos de idade, com dermatite atópica recalcitrante, atendidos no Ambulatório de Dermatologia Sanitária (RS). Todos foram submetidos a testes de contato com uma bateria com alérgenos de série pediátrica.
ResultadosAs prevalências de sensibilização e de dermatite alérgica de contato nos pacientes avaliados foram de 37,07% (20/54) e 27,7% (15/54), respectivamente. Os alérgenos mais frequentes foram: sulfato de níquel (16,7%), azul disperse (5,6%) e fragrância mix I (5,6%). O níquel foi associado ao sexo feminino (p=0,019).
Limitações do estudoTamanho e seleção amostral, ausência de grupo controle.
ConclusõesUma parcela dos pacientes com dermatite atópica recalcitrante pode estar sensibilizada a diferentes alérgenos e mesmo ter desenvolvido dermatite alérgica de contato. Reconhecer esse contexto é importante na estratégia de prevenção e no manejo da doença.
A dermatite atópica (DA) e a dermatite alérgica de contato (DAC) são duas das doenças inflamatórias cutâneas mais comuns na população pediátrica com uma inter‐relação complexa.1,2
A prevalência da DA aumentou significativamente nos últimos 30 anos, afetando entre 15% e 30% das crianças nos países ocidentais.3 Da mesma maneira, a DAC é frequente tanto na população adulta quanto na pediátrica, com relatos inclusive em crianças de idades mais precoces.4,5 Estudos recentes têm mostrado uma elevação na prevalência da DAC nas crianças sintomáticas variando de 27% a 95%, 6%.5–8
Dada à disfunção da barreira cutânea que diminui a proteção contra agentes ambientais, a dermatite de contato irritativa (DCI) e a dermatite alérgica de contato (DAC) são problemas significativos entre os indivíduos com DA.5,9
Clinicamente, a DA e a DAC podem ser indistinguíveis; as reações alérgicas concomitantes foram descritas como possíveis causas de dermatite atópica recalcitrante ou resistente à terapia.1,10,11
Embora não haja diretrizes consensuais baseadas em evidências para o teste de contato (TC) em crianças, essa é uma ferramenta segura e útil para identificar a sensibilização cutânea.5,12
A maioria dos estudos sobre prevalência e características clínicas e epidemiológicas da DAC em crianças e adolescentes com DA são retrospectivos e provenientes de centros norte‐americanos e europeus.1,2,5
No Brasil, há poucos trabalhos sobre DAC na população pediátrica e todos realizaram TC utilizando a série padrão brasileira utilizada em adultos ou séries de cosméticos, até o momento não há registros de estudo que tenha utilizado série pediátrica no Brasil.7,13–15 Cabe ressaltar a importância do conhecimento dos sensibilizantes em cada país, face à variabilidade de exposições e diferenças entre regiões do mundo.
O presente estudo tem como objetivo verificar os sensibilizantes e a presença da DAC em crianças e adolescentes com DA recalcitrante, além do perfil epidemiológico e clínico dos mesmos, provindos de uma amostra sul Brasileira que foi submetida aos testes de contato com uma série pediátrica.
Materiais e métodosTrata‐se de um estudo transversal, prospectivo, com testes de contato em pacientes com dermatite atópica recalcitrantes, entre 4 a 18 anos, atendidas no Ambulatório de Dermatologia Sanitária, Porto Alegre, RS (Brasil), entre fevereiro de 2019 e março de 2020.
Esse estudo foi aprovado pelos Comitês de Ética em Pesquisa da Secretaria da Saúde do Estado do Rio Grande do Sul e da Universidade Federal de Ciências da Saúde de Porto Alegre (pareceres de números 3.091.016 e 3.084.699, respectivamente). Foram avaliados apenas os pacientes cujos responsáveis legais assinaram os termos de consentimento. A anamnese e o exame físico foram realizados na primeira consulta.
Os pacientes selecionados foram aqueles diagnosticados com dermatite atópica, seguindo os critérios de Hanifin e Radjka modificados16 e que apresentavam história de dermatite recalcitrante (ou que recorria logo após a suspensão do tratamento tópico) e, portanto, com suspeita clínica de dermatite alérgica de contato.10–12 Foram excluídos os pacientes em uso de corticosteroides ou imunomoduladores tópicos nos últimos sete dias, imunossupressores sistêmicos ou corticosteroides dentro de 30 dias, exposição à radiação ultravioleta 15 dias antes do teste, dermatite no local do teste, história de anafilaxia, distúrbios psiquiátricos ou gravidez.12
As variáveis coletadas foram: idade, sexo, idade de início e duração da dermatite, presença de outras doenças atópicas associadas e história familiar de doenças atópicas. Além dessas, foram avaliados: o fototipo da pele, a topografia da dermatite e a gravidade da DA por meio do Índice de Área e Gravidade do Eczema, o EASI: extensão por região corporal (face e pescoço, membros superiores, membros inferiores e tronco) que pode variar de 0 a 100%; intensidade de cada lesão (eritema, edema ou pápulas, escoriação e liquenificação), em uma escala de 0–3. A soma dos pontos classifica a doença em muito leve (0,1 a 1); leve (1,1 a 7); moderada (7,1 a 20); grave (21,1 a 50); ou muito grave 50,1 a 72).17
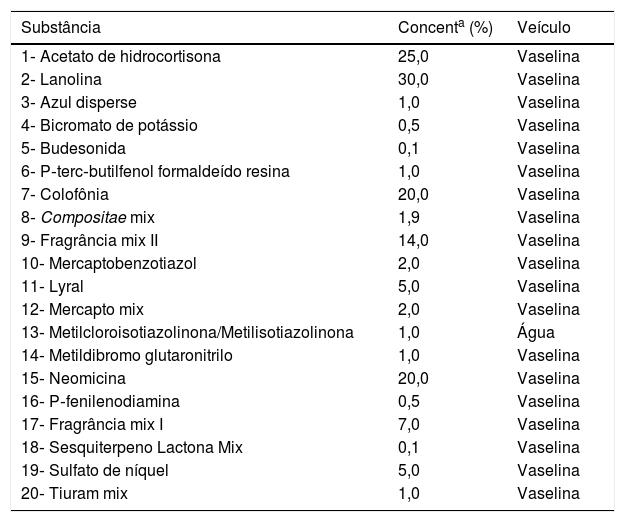
Os TC foram realizados com uma bateria pediátrica modificada, baseada no consenso da Força‐Tarefa da Dermatite Alérgica de Contato em Crianças da Academia Europeia de Alergologia e Imunologia Clínica (EAACI) sobre recomendações para o teste de contato com uma série dos principais alérgenos no grupo pediátrico.12 A bateria foi elaborada pela empresa IPI ‐ASAC Brasil® e adaptada conforme a disponibilidade dos produtos no Brasil. Essa é composta por 20 substâncias, incluindo alérgenos e misturas (tabela 1).18 Algumas substâncias estão presentes na bateria padrão brasileira,19 mas outras não existem regionalmente, como o bufexamac (anti‐inflamatório) e o pivolato de tixocortol (corticosteroide do grupo A), que foram removidos. Esse foi substituído pela hidrocortisona (mesmo grupo A). Um componente da mistura de Compositae também foi excluído por falta de matéria‐prima. Os alérgenos foram inseridos nas câmaras de 8mm em contensores Alergo Chamber (Neoflex®).
Bateria pediátrica brasileira – baseada no consenso da EAACI12,18
| Substância | Concenta (%) | Veículo |
|---|---|---|
| 1‐ Acetato de hidrocortisona | 25,0 | Vaselina |
| 2‐ Lanolina | 30,0 | Vaselina |
| 3‐ Azul disperse | 1,0 | Vaselina |
| 4‐ Bicromato de potássio | 0,5 | Vaselina |
| 5‐ Budesonida | 0,1 | Vaselina |
| 6‐ P‐terc‐butilfenol formaldeído resina | 1,0 | Vaselina |
| 7‐ Colofônia | 20,0 | Vaselina |
| 8‐ Compositae mix | 1,9 | Vaselina |
| 9‐ Fragrância mix II | 14,0 | Vaselina |
| 10‐ Mercaptobenzotiazol | 2,0 | Vaselina |
| 11‐ Lyral | 5,0 | Vaselina |
| 12‐ Mercapto mix | 2,0 | Vaselina |
| 13‐ Metilcloroisotiazolinona/Metilisotiazolinona | 1,0 | Água |
| 14‐ Metildibromo glutaronitrilo | 1,0 | Vaselina |
| 15‐ Neomicina | 20,0 | Vaselina |
| 16‐ P‐fenilenodiamina | 0,5 | Vaselina |
| 17‐ Fragrância mix I | 7,0 | Vaselina |
| 18‐ Sesquiterpeno Lactona Mix | 0,1 | Vaselina |
| 19‐ Sulfato de níquel | 5,0 | Vaselina |
| 20‐ Tiuram mix | 1,0 | Vaselina |
Os procedimentos foram realizados de acordo com as recomendações do Grupo Internacional de Dermatite de Contato (ICDRG).12 Os contensores foram aplicados no dorso dos pacientes e removidos em 48 horas. As leituras foram realizadas em 48h e em 96 horas, ambas pelos mesmos dermatologistas. Os testes com reações classificadas como +, ++ ou +++ foram considerados positivos. Somente os resultados das leituras de 96h foram incluídos na análise estatística. Foram considerados pacientes com DAC aqueles que apresentavam os testes positivos em 96 horas com alérgenos relevantes na atualidade (exposição aos alérgenos que explicasse o quadro clínico do momento). Os que não apresentavam relevância atual foram classificados como sensibilizados, mas não portadores de DAC.
A análise dos dados foi realizada por meio de software estatístico para ciências sociais (SPSS) versão 25. O teste do Qui‐Quadrado ou o teste de Fisher foram usados para variáveis categóricas. Para as variáveis contínuas, utilizou‐se o teste de Mann Whitney. Valores de p <0,05 foram considerados estatisticamente significativos.
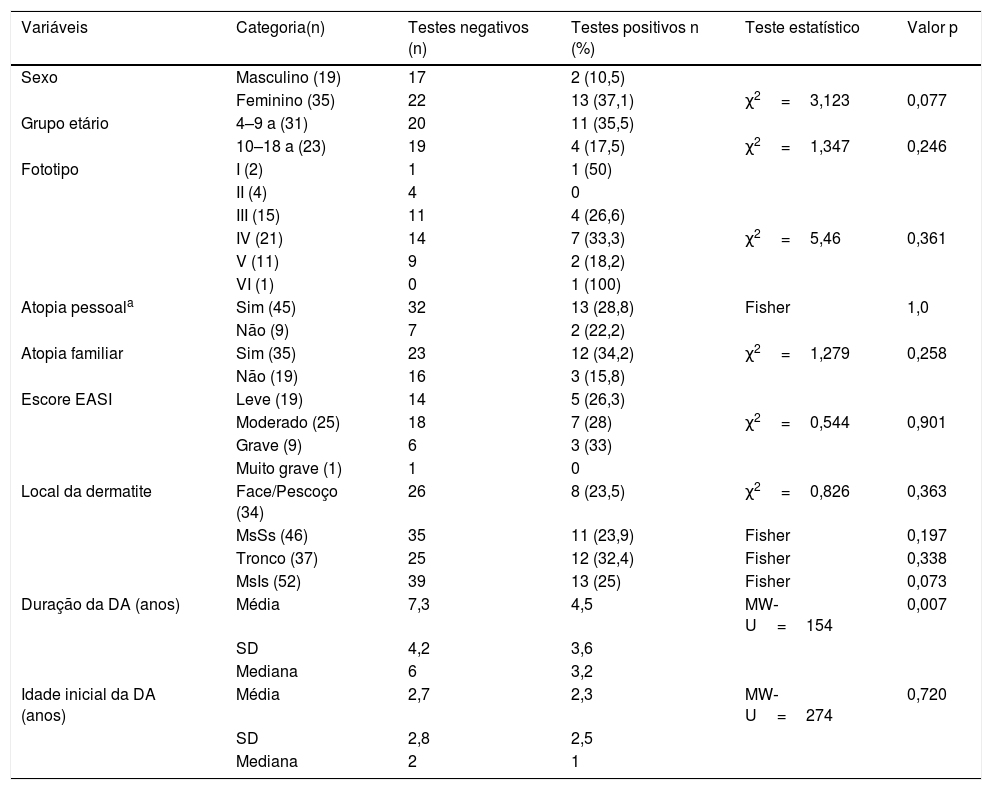
ResultadosForam avaliados 54 pacientes com DA. Utilizando a classificação da Organização Mundial da Saúde,7 a amostra foi dividida em dois grupos etários: crianças (4 a 9 anos) e adolescentes (10 a 18 anos); 31 (57,4%) eram crianças e 23 (42,6%) eram adolescentes (tabela 2). O sexo feminino predominou com 35 pacientes (64,8%), assim como os fototipos III e IV, com 15 (27,8%) e 21 (38,9%) dos pacientes, respectivamente. A média de idade de início da DA foi de 2,63 anos (DP=2,7), com mediana de 1,5 anos. A duração média da DA foi de 6,57 anos (DP=4,2) com a mediana de 5 anos.
Outras doenças atópicas estavam presentes em 45 pacientes (83,3%) e havia história familiar de atopia em 35 pacientes (64,8%).
Em relação à gravidade da DA, a maioria dos pacientes apresentava EASI leve e moderado (35,2% e 46,3%, respectivamente). Nove (16,7%) tinham doença grave e havia apenas um com DA muito grave. As áreas corporais mais acometidas foram: membros inferiores (96,3%), membros superiores (85,2%), tronco (68,5%) face e pescoço (63%). A dermatite afetava três ou mais áreas em 42 pacientes (78%).
Vinte reações positivas em 96 horas foram registradas nos 54 pacientes testados, ou seja, encontramos uma taxa de sensibilização de 37,07% (20/54). O índice de relevância foi de 75%, ou seja, em 15 pacientes a exposição atual ao sensibilizante respondia pelo quadro clínico atual. Dessa forma, a prevalência de DAC na nossa amostra foi de 27,7% (15/54) (tabelas 2 e 3).
Dermatite atópica e testes de contato: características da amostra (n=54) e associações
| Variáveis | Categoria(n) | Testes negativos (n) | Testes positivos n (%) | Teste estatístico | Valor p |
|---|---|---|---|---|---|
| Sexo | Masculino (19) | 17 | 2 (10,5) | ||
| Feminino (35) | 22 | 13 (37,1) | χ2=3,123 | 0,077 | |
| Grupo etário | 4–9 a (31) | 20 | 11 (35,5) | ||
| 10–18 a (23) | 19 | 4 (17,5) | χ2=1,347 | 0,246 | |
| Fototipo | I (2) | 1 | 1 (50) | ||
| II (4) | 4 | 0 | |||
| III (15) | 11 | 4 (26,6) | |||
| IV (21) | 14 | 7 (33,3) | χ2=5,46 | 0,361 | |
| V (11) | 9 | 2 (18,2) | |||
| VI (1) | 0 | 1 (100) | |||
| Atopia pessoala | Sim (45) | 32 | 13 (28,8) | Fisher | 1,0 |
| Não (9) | 7 | 2 (22,2) | |||
| Atopia familiar | Sim (35) | 23 | 12 (34,2) | χ2=1,279 | 0,258 |
| Não (19) | 16 | 3 (15,8) | |||
| Escore EASI | Leve (19) | 14 | 5 (26,3) | ||
| Moderado (25) | 18 | 7 (28) | χ2=0,544 | 0,901 | |
| Grave (9) | 6 | 3 (33) | |||
| Muito grave (1) | 1 | 0 | |||
| Local da dermatite | Face/Pescoço (34) | 26 | 8 (23,5) | χ2=0,826 | 0,363 |
| MsSs (46) | 35 | 11 (23,9) | Fisher | 0,197 | |
| Tronco (37) | 25 | 12 (32,4) | Fisher | 0,338 | |
| MsIs (52) | 39 | 13 (25) | Fisher | 0,073 | |
| Duração da DA (anos) | Média | 7,3 | 4,5 | MW‐U=154 | 0,007 |
| SD | 4,2 | 3,6 | |||
| Mediana | 6 | 3,2 | |||
| Idade inicial da DA (anos) | Média | 2,7 | 2,3 | MW‐U=274 | 0,720 |
| SD | 2,8 | 2,5 | |||
| Mediana | 2 | 1 |
a, anos de idade; MsSs, membros superiores; MsIs, membros inferiores; SD, desvio padrão; χ2,qui quadrado; MW‐U, Mann‐Whitney.
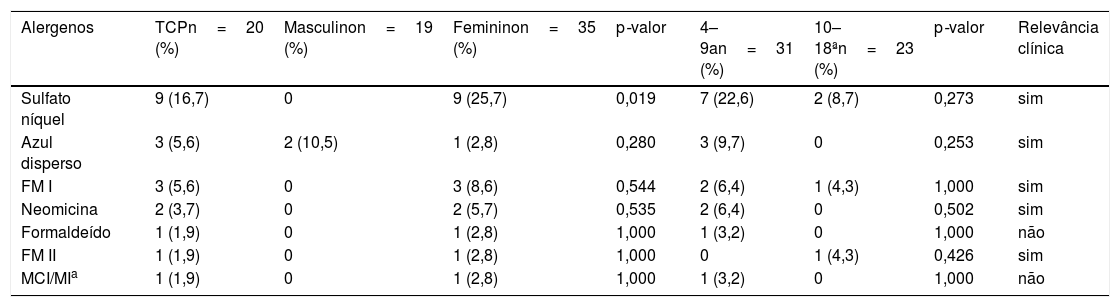
Perfil de alergenos: testes positivos em relação ao sexo e grupos etários
| Alergenos | TCPn=20 (%) | Masculinon=19 (%) | Femininon=35 (%) | p‐valor | 4–9an=31 (%) | 10–18ªn=23 (%) | p‐valor | Relevância clínica |
|---|---|---|---|---|---|---|---|---|
| Sulfato níquel | 9 (16,7) | 0 | 9 (25,7) | 0,019 | 7 (22,6) | 2 (8,7) | 0,273 | sim |
| Azul disperso | 3 (5,6) | 2 (10,5) | 1 (2,8) | 0,280 | 3 (9,7) | 0 | 0,253 | sim |
| FM I | 3 (5,6) | 0 | 3 (8,6) | 0,544 | 2 (6,4) | 1 (4,3) | 1,000 | sim |
| Neomicina | 2 (3,7) | 0 | 2 (5,7) | 0,535 | 2 (6,4) | 0 | 0,502 | sim |
| Formaldeído | 1 (1,9) | 0 | 1 (2,8) | 1,000 | 1 (3,2) | 0 | 1,000 | não |
| FM II | 1 (1,9) | 0 | 1 (2,8) | 1,000 | 0 | 1 (4,3) | 0,426 | sim |
| MCI/MIa | 1 (1,9) | 0 | 1 (2,8) | 1,000 | 1 (3,2) | 0 | 1,000 | não |
TCP, número de testes de contato positivos; a, anos de idade; FM I, fragrância mix I; FM II, fragrância mix II; MCI/MI, metilcloroisotiazolinona/metilisotiazolinona.
OBS: Demais alergenos da bateria, todos com resultados negativos: tiuram mix, colofônia, mercaptobenzotiazol, sesquiterpene lactone mix, lyral, p‐terc‐butilfenol formaldeido resina, bicromato de potássio, álcool lanolina, p‐fenilenodiamina, Compositae mix, acetato de hidrocortisona, budesonida, metildibromoglutaronitrilo.
Foi constatado que 11 das 31 crianças (35,5%) e quatro dos 23 adolescentes (17,4%) apresentaram testes positivos, porém essa diferença não alcançou significância estatística (p=0,107). Do mesmo modo, os testes estatísticos não mostraram maior sensibilização associada às seguintes variáveis: fototipo, histórico pessoal ou familiar de atopia, idade de início da DA, localização e gravidade da doença. O sexo feminino apresentou uma tendência estatística a mais testes positivos (p=0,077). Um período menor de duração da DA (média=4,5 anos; DP=3,60 [mediana 3,2 anos]) foi associado a maior frequência de testes positivos quando comparada com uma duração mais longa da DA (média=7,3 anos, DP=4,25 [mediana 6 anos]), com p=0,007 (tabela 2).
Os alérgenos com maior frequência de sensibilização foram: sulfato de níquel (16,7%), azul disperso (5,6%) e a mistura de fragrâncias I (5,6%). O perfil geral dos alérgenos é exibido na tabela (tabela 3). Nenhum alérgeno foi associado a uma faixa etária específica; porém, foi demonstrada associação entre a sensibilização ao níquel e o sexo feminino (p=0,19) (tabela 3).
A síndrome da pele excitada (“angry back syndrome”) foi detectada em uma criança. Reações irritativas apareceram em 11 pacientes (20,4%), sendo que 10 eram crianças (entre 4 e 9 anos). Fragrâncias e níquel foram as substâncias irritativas mais comuns nas crianças. Não havia adolescentes com exposição ocupacional e apenas um com 16 anos apresentou uma reação irritativa (à fragrância mix II).
DiscussãoA relação entre a DA e a DAC ainda não é totalmente compreendida.1,5,20
O Registro de Dermatite de Contato Pediátrica (PCDR) que contém os dados da maior quantidade de TC pediátrico nos EUA relatou que dentre 49% das crianças encaminhadas com DA, 42% também apresentaram DCA.2
No geral, a maioria dos autores não encontrou diferenças significativas na prevalência de DAC entre crianças e adolescentes atópicos e não atópicos.2,4,8,13,15,21–23 No entanto, muitos dos trabalhos publicados mostraram resultados controversos com relação ao assunto. As taxas de sensibilização variaram consideravelmente, assim como o delineamento dos estudos em relação ao tamanho e características da amostra, critérios diagnósticos para DA, metodologia de TC e alérgenos usados. Além disso, um viés de seleção pode ter ocorrido na maioria dos estudos porque as crianças sem DA foram mais encaminhadas para os testes devido a suspeita de DAC, enquanto aquelas com DA podem ter sido encaminhadas em virtude de recaída da DA.1 Poucos autores publicaram os resultados do TC e o perfil de crianças e adolescentes com DA.2,3,6,14,24–35
Independentemente das crianças com DA terem um risco aumentado de sensibilização em comparação às outras, a DAC pode coexistir em até 30% das crianças com DA, de acordo com publicações recentes.1,2,11
As séries utilizadas nos TC dos estudos pediátricos apresentam variações geográficas na seleção de alérgenos, mas a maioria é da América do Norte e da Europa.1,5,7 Este é o primeiro estudo brasileiro a avaliar a prevalência e o perfil da DAC em crianças e adolescentes com DA por meio dos TC com bateria pediátrica. Nessa amostra, a prevalência de DAC foi de 27,7%, coincidindo com as últimas revisões da literatura internacional, em que a prevalência variou de 20 a 44% nesse grupo.1,5,7 Outros autores brasileiros encontraram prevalência semelhante à nossa, em amostras não extensas, regionalizadas, mas utilizando os testes da bateria padrão brasileira (30 substâncias), não com uma série pediátrica.13–15
Alguns estudos encontraram uma alta taxa de testes com reações irritativas (falso‐positivas) nos pacientes com DA, provavelmente devido a um menor limiar de irritabilidade numa barreira cutânea defeituosa.5,9,14,36 Em nosso estudo também apareceram reações irritativas em 20,4% das crianças, principalmente ao níquel e a fragrâncias, na faixa etária menor. No entanto, apesar de reações falso‐positivas serem frequentes nos pacientes com DA, reações positivas fracas podem ocorrer e devem ser consideradas positivas verdadeiras, especialmente em pacientes com exacerbação da DA.20 Ademais, muitos pacientes também apresentaram reações positivas fracas relevantes, tal como um estudo pediátrico brasileiro que relatou 84,2% de TC positivos relevantes com reações de intensidade 1+.15
Em nosso estudo, 57,4% da amostra eram crianças entre 4 a 9 anos de idade e, embora não seja significativo, foram encontrados mais resultados positivos nesse grupo mais jovem. Esse achado acompanha os relatos de outros autores sobre altas taxas de sensibilização em crianças de faixas etárias menores.2,4,31 Por outo lado, como a exposição a alérgenos aumenta com a idade, mais DAC foi relatada no grupo de adolescentes em diversos estudos.7,13,15 Ainda em relação à faixa etária, são descritas diferenças significativas com alguns alérgenos.7 Um amplo estudo norte‐americano relatou que crianças menores foram mais sensibilizadas a ingredientes dos produtos de higiene pessoal, enquanto a sensibilização ao azul disperso e ao ouro foi mais comum em crianças maiores.26
Em nossa amostra, a idade de início da DA nas crianças com TC positivos não diferiu estatisticamente daquelas com TC negativos, coincidindo com os achados de Labadie et al.31 Da mesma maneira, não encontramos associação entre o fototipo e mais TC positivos (p=0,361). Poucos estudos incluíram essa variável e um sugeriu que as tendências étnicas e culturais, como body piercing, poderiam influenciar na incidência de DAC.26
Como vários estudos, também observamos maior número de pacientes do sexo feminino encaminhados (64,8%) e com maior tendência a TC positivos (p=0,077).2,13,15,21,26
Em nosso estudo, uma menor duração da DA (mediana de 3,2 anos) foi associada a mais testes positivos do que uma duração mais longa. Isso pode ser decorrente do predomínio de crianças menores referidas (57,4% com idades entre 4 a 9 anos). O maior estudo pediátrico norte‐americano também encontrou mais TC positivos naquelas com dermatite de menor duração.26
A associação entre a presença de outras doenças atópicas ou histórico familiar e maior sensibilização não foi encontrada na nossa amostra. Outros trabalhos também não relataram diferenças significativas entre atopia e os grupos etários com TC positivos.7,8,25
A maioria dos nossos pacientes apresentava lesões de DA em mais de duas regiões corporais, como no estudo de Rodrigues et al.15 Outros autores também relataram dermatite mais difusa (espalhada) dentre aquelas crianças testadas.2,7
Associações significativas foram descritas entre DA, DAC e eczema de mãos em adolescentes.1,9,35
No presente trabalho, como havia mais pacientes com DA leve a moderada, nenhuma correlação foi possível entre maior gravidade da doença e maior sensibilização alérgica. Da mesma maneira, Ozceker et al. não encontraram mais DAC nas crianças com DA grave.27 No entanto, outros autores relataram associação entre mais TC positivos e doença mais grave.3,32,34
De fato, alguns trabalhos sugeriram que o limiar de sensibilização estaria inversamente relacionado à gravidade da DA. Uma menor positividade nas reações dos TC em pacientes com DA grave poderia ser explicada pelo aumento da célula T helper 2 (Th2) em oposição ao desvio da célula T helper 1 (Th1) do sistema imune, tradicionalmente observado na DAC.9,10,30
Perfil de sensibilização aos alérgenosOs resultados dos trabalhos sobre a prevalência de DAC e a frequência dos alérgenos sensibilizantes em crianças e adolescentes com DA apresentaram variações de acordo com a amostra selecionada, o tempo de exposição, o tipo e a quantidade de substâncias testadas.5,7,37
Importante ressaltar que há diferenças na seleção de alérgenos das baterias de TC utilizadas nos estudos pediátricos mundiais,7 porém as mais aplicadas são as do grupo norte‐americano de dermatite de contato (NACDG)21 e do Registro de Dermatite de Contato Pediátrica (PCDR).26 Muitos estudos na Europa usaram séries padrão ou regionais de acordo com o Sistema Europeu de Vigilância em Alergias de Contato (ESSCA).38,39
Recentemente, baseada em uma pesquisa de consenso, a Sociedade Americana de Dermatite de Contato propôs uma série pediátrica para crianças de 6 a 18 anos.39,40
No entanto, essas baterias propostas não são direcionadas especificamente às crianças com DA. O perfil de sensibilização aos alérgenos parece ser diferente nessa população.3,5,11,23
Em nosso estudo, todos os pacientes com DA foram testados com uma bateria pediátrica, seguindo as recomendações do EAACI,12 mas adaptada à realidade brasileira (substituição de três substâncias). Os alérgenos com maiores taxas de sensibilização, em ordem de frequência, foram: sulfato de níquel, azul disperso, mistura de fragrâncias I e neomicina.
Uma recente publicação nos EUA sobre DCA em crianças ressaltou os principais alérgenos naquelas com DA: níquel, mistura de fragrâncias I, bálsamo do Peru, bacitracina, lanolina, formaldeído e neomicina.2
Teo et al., numa extensa revisão de estudos comparando DAC em indivíduos sem DA e com DA, destacaram nesses últimos os 10 alérgenos mais comuns: níquel, fragrância mix I, metilisotiazolinona (MI), cobalto, colofônia, neomicina, p‐fenilenodiamina (PPD), tiuram mix, bálsamo do Peru e metabissulfito de sódio.37 Três desses (níquel, fragrâncias e neomicina) também foram os mais frequentes em nosso estudo.
Os pacientes com DA podem ter maior risco de sensibilização devido a uma barreira defeituosa e ao uso frequente de produtos tópicos (cuidados com a pele e medicamentos).2,2,9,37 Além disso, um grande estudo multicêntrico (11 países europeus) sugeriu que as crianças com DA recalcitrante também deveriam ser testadas para metais, corantes dispersos e Compositae.38
Como constatado em várias publicações, no presente estudo, o níquel foi também o alérgeno mais sensibilizante5,14,26,28,29,31 e o mais associado ao sexo feminino (p=0,019).8,11,13,31,33 A sensibilização ao níquel tem sido relacionada ao hábito de furar orelhas (ear piercing). Brinquedos, roupas (zíperes, botões etc.) e equipamentos eletrônicos (tablets e telefones celulares) são fontes contínuas de liberação de níquel.8,11
O corante azul disperso foi o segundo alérgeno frequente em nosso estudo. Os corantes dispersos (disperse dyes), presentes em roupas de cores intensas ou brilhantes e em alguns cosméticos infantis, são potenciais alérgenos em crianças.6,12 Embora tais substâncias não façam parte da bateria padrão brasileira, sua importância em crianças com DA vem sendo mencionada em estudos recentes.22,25,26
Os emolientes são os principais produtos de cuidados com a pele usados no tratamento da DA. Dermatites de contato a fragrâncias e conservantes contidos nesses emolientes podem desempenhar um papel no agravamento da doença.1,3,11,12 As fragrâncias mix I e II foram encontradas, em ordem de frequência, como o terceiro e o quinto alérgeno, respectivamente, em nosso estudo. As fragrâncias estão entre as principais substâncias presentes em brinquedos e outros produtos perfumados voltados para crianças, mesmo naqueles rotulados como “sem fragrância” que podem conter ingredientes relacionados.26
A neomicina, o quarto alérgeno frequente em nosso estudo, é um antibiótico amplamente presente em preparações e medicamentos tópicos e há muito tempo figura entre os principais alérgenos em crianças.11,21,25
Indivíduos com DA podem ter mais sensibilização aos conservantes.37 Sensibilização à metilcloroisotiazolinona, à metilisotiazolinona e à associação MCI/MI presentes em cosméticos, produtos de limpeza e de higiene vem aumentando em estudos recentes.8,28 O formaldeído e os liberadores de formaldeído também são conservantes comuns em produtos de uso diário11 e estão entre os cinco principais alérgenos em um grande estudo pediátrico em DA.2 No entanto, em nosso estudo, somente um paciente apresentou sensibilização ao formaldeído e outro à associação MCI/MI.
Apesar de vários autores mencionarem alergia aos corticosteroides tópicos principalmente em pacientes com DA resistente ao tratamento, em nossa amostra não encontramos testes positivos aos corticosteroides menos potentes (grupo A) presentes na bateria pediátrica. Alguns estudos atribuem esse resultado negativo ao fato de aqueles pacientes com doença recalcitrante utilizarem mais os corticosteroides de maior potência (grupos B e D).10
Considerando que determinados alérgenos parecem apresentar padrões específicos conforme a idade,7,21,26 alguns autores sugerem TC com diferentes séries direcionadas às crianças e aos adolescentes:28 séries reduzidas nas crianças (pela menor superfície corporal)4,6,25,29 e séries estendidas nos adolescentes (maior exposição, inclusive ocupacional).28,40
No entanto, os autores concordam na dificuldade de designar uma série de substâncias ideal para triagem na população pediátrica e recomendam o uso de baterias regionais e personalizadas com substâncias dos produtos do paciente baseadas no histórico de exposição e na relevância clínica.5,28,39,40
O ponto forte deste estudo é ser o primeiro no Brasil (de nosso conhecimento) a realizar testes de contato em crianças com DA com empregando bateria pediátrica para avaliar a prevalência, o perfil dos sensibilizantes e da DAC nesse grupo vulnerável. As principais limitações desta pesquisa poderiam ser o tamanho amostral, a ausência de grupo controle a ser testado com a bateria padrão brasileira para comparar com outros estudos e o fato de nossos pacientes serem provenientes de um serviço de saúde pública (influências socioeconômicas na exposição a determinados alérgenos). Por ser um estudo que abre a discussão sobre o uso da série pediátrica em dermatite atópica recalcitrante, o delineamento transversal é o delineamento correspondente aos objetivos.
ConclusõesA DAC pode coexistir e desempenhar um papel no agravamento da DA. Quase 1/3 das crianças e dos adolescentes com DA de uma amostra do Sul do Brasil atendidas no sistema público de saúde foi diagnosticada com DAC, por meio dos testes de contato com bateria pediátrica. Os alérgenos mais importantes nessa população foram o sulfato de níquel, o azul disperse, as fragrâncias e a neomicina. Futuros estudos multicêntricos, com amostras maiores, grupos de controle e metodologias padronizadas são necessários.
Nosso estudo contribui para acrescentar informações sobre sensibilizantes em crianças e adolescentes com DA recalcitrante.
Suporte financeiroNenhum.
Contribuição dos autoresCristiane Almeida Soares Cattani: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Renan Rangel Bonamigo: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Kenselyn Oppermann: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Simone Perazzoli: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Nathalia Hoffmann Guarda: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Paula Baréa: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Conflito de interessesNenhum.
Gostaríamos de agradecer à empresa IPI‐ASAC Brasil pela doação da bateria pediátrica utilizada neste estudo.
Como citar este artigo: Cattani CAS, Oppermann K, Perazzoli S, Guarda NH, Baréa P, Bonamigo RR. Sensitizing agents found in children and adolescents with recalcitrant atopic dermatitis: a cross‐sectional study with a pediatric battery. An Bras Dermatol. 2022;97:307–14.