Os anestésicos locais são medicamentos essenciais para procedimentos dermatológicos. Impedem a despolarização das fibras nervosas e são divididos em duas categorias principais: tipo amida e tipo éster. Os efeitos adversos mais temidos são a toxicidade sistêmica, com repercussões no sistema nervoso central e no sistema cardiovascular, e as reações de hipersensibilidade, sendo a reação anafilática a mais grave delas. Embora potencialmente fatais, esses eventos são extremamente raros e os anestésicos locais são considerados medicamentos seguros para uso em consultório.
Os procedimentos dermatológicos feitos em consultório são frequentes e abrangem desde biópsias de pequenas lesões a procedimentos cosmiátricos e cirurgias complexas e prolongadas. Para torná‐los viáveis e bem tolerados, a anestesia local é peça fundamental em sua execução. Quando bem indicada e usada, é considerada método seguro, que permite que a grande maioria dos procedimentos seja executada fora do ambiente ambulatorial ou hospitalar.1,2 O objetivo deste trabalho foi fazer uma revisão sobre a segurança do emprego dos anestésicos locais com ênfase nos eventos adversos.
MétodosA metodologia usada para a seleção dos artigos foi baseada na técnica PICO da Medicina Baseada em Evidências, acrônimo para Paciente/População, Intervenção/Indicador, Comparação/Controle e Outcomes (Desfecho). Neste trabalho, a população são os “pacientes submetidos a procedimentos dermatológicos”, a intervenção são os “anestésicos locais” e o desfecho são os “eventos adversos”. Não foi determinado grupo para comparação.
Resultados e discussãoOs resultados desta revisão foram divididos nos seguintes subtítulos: Mecanismo de ação dos anestésicos locais, Classificação e farmacocinética, Tipos de anestésicos locais, Efeitos adversos, Técnicas para aplicação, Segurança dos anestésicos e Situações especiais.
Mecanismo de ação dos anestésicos locaisA sensação da dor depende da habilidade do sistema nervoso de transmitir os impulsos elétricos através da fibra nervosa. Essa propagação ocorre devido a diferentes concentrações de eletrólitos entre o meio intracelular, que apresenta maior concentração de potássio (K+) e menores concentrações de sódio (Na+), e o meio extracelular, em que as concentrações são invertidas. Esse gradiente iônico é mantido pela bomba de Na+ K+ ATPase (adenosina trifosfatase). Em repouso, a membrana externa do nervo apresenta carga positiva em relação ao meio interno, devido à baixa permeabilidade da membrana ao Na+ e à ação da bomba, que expulsa três íons de Na+ para cada dois íons de K+ que são internalizados.3,4
Quando há um estímulo ao nervo, a membrana torna‐se permeável ao Na+, que se acumula dentro da célula, culmina em uma despolarização. Essa mudança na permeabilidade ao Na+ causa uma alteração no potencial elétrico através da membrana e a propagação desse potencial elétrico é chamada de potencial de ação. O nervo retorna ao seu estado de repouso ao mudar novamente a permeabilidade da membrana ao Na+.3–5
Os anestésicos locais atuam na bomba de Na+ K+ ATPase, impedem o influxo de sódio e a propagação do estímulo de dor pelas fibras nervosas. Assim, a despolarização não acontece.2,5
A sensação de dor é propagada pelas fibras não mielinizadas (Fibras C), mais sensíveis aos anestésicos locais do que as mielinizadas (Fibras A e B). Isso permite que sensações como vibração e pressão sejam mantidas mesmo após a inibição completa da dor.2,5
Classificação e farmacocinéticaOs anestésicos locais são compostos por uma estrutura dividida em três partes: porção aromática (lipofílica), cadeia intermediária e grupo amina (hidrofílica).
O anel aromático confere a solubilidade lipídica à substância, quanto maior a solubilidade, maior a difusão do anestésico na membrana nervosa. Essa propriedade correlaciona‐se à potência do medicamento.
O terminal amina existe na forma terciária (lipossolúvel) e na forma quaternária (hidrossolúvel). O anestésico encontra‐se na forma quaternária durante sua aplicação. O início de ação acontece de acordo com a proporção de moléculas que se transformam na forma terciária ao entrar em contato com o pH fisiológico (7,4). A constante de ionização (pKa) do anestésico representa o pH, a metade das moléculas se encontra no estado terciário e a outra metade no estado quaternário. A maioria dos anestésicos apresenta pKa semelhante ao pH fisiológico (7,4). Quando há inflamação, o ambiente acidificado favorece a forma quaternária, reduz a proporção de anestésico capaz de penetrar nos nervos.5
A cadeia intermediária pode ser composta por éster ou por amida, responsável pela classificação dos anestésicos (tabela 1).5,6
Características dos anestésicos locais mais empregados na dermatologia
| Anestésico | Afinidade às proteínas | Início de ação | Tempo de açãosem epinefrina (min) | Tempo de açãocom epinefrina (min) |
|---|---|---|---|---|
| Tipo amida | ||||
| Lidocaína | 64 | 2–3 min | 30–120 | 60–400 |
| Mepivacaína | 77 | 3–20 min | 30–120 | 60–400 |
| Bupivacaína | 95 | 5–8 min | 120–240 | 240–480 |
| Tipo éster | ||||
| Procaína | 5,8 | 5 min | 15–30 | 30–90 |
Adaptado de Koay et al, 2012 e Park et al, 2017.5,6
Os anestésicos tipo‐amida são metabolizados pelo fígado e devem ser usados com cautela em pacientes com insuficiência hepática. Os anestésicos tipo‐éster são degradados pela pseudocolinesterase plasmática e seus metabólitos são excretados pela urina. Um de seus metabólitos, ácido para‐aminobenzoico (Para‐Aminobenzoic Acid – PABA), é responsável pelo risco de reações alérgicas a esse grupo de medicamento. Também é conhecido o potencial de reação cruzada entre os anestésicos desse grupo, distintamente do que ocorre com os anestésicos do grupo amida.3,5,6
A afinidade dos anestésicos às proteínas plasmáticas correlaciona‐se à sua afinidade pelas proteínas dos canais de sódio transmembrana. Quanto maior a afinidade, maior o tempo de ação do anestésico e maior a sua duração (tabela 1).5,6
Tipos de anestésicos locaisExistem distintos métodos para se induzir a anestesia local: tópica, infiltrativa, bloqueio de campo, bloqueio de nervo periférico e tumescente. Em todos, há anestesia regional transitória.3,5
A anestesia tópica é aquela em que a substância é aplicada diretamente na pele ou na mucosa por meio de creme, pomada, gel ou spray. Nesse caso, o agente penetra até a derme papilar e atua nos ramos nervosos terminais.3,5 Quando o pKa do anestésico se aproxima do pH da pele (5,5) e a camada córnea é fina (como em pálpebras) ou ausente (mucosas), o composto atravessa a pele com maior facilidade.7,8
A anestesia infiltrativa é obtida através da injeção do medicamento diretamente na derme ou no subcutâneo, causa inibição direta das terminações nervosas da área desejada. Quando injetado na derme, o início de ação é imediato, porém a aplicação é dolorosa. Se injetado no tecido subcutâneo, a dor tem menor intensidade, porém há risco de menor duração do efeito pela reabsorção maior da substância.3,5
O bloqueio de campo consiste na deposição de solução anestésica em torno do local desejado, de maneira circunferencial, para que sejam anestesiados os nervos superficiais ou profundos responsáveis pela inervação da região alvo. Dessa forma, é possível obter‐se anestesia com menor volume do produto e não há distorção da área a ser tratada.3,5
No bloqueio de nervo periférico, o anestésico é injetado no tronco nervoso principal. Esse método permite uma redução expressiva do volume de anestésico necessário para o procedimento e também preserva o sítio operatório de distorção. São amplamente usados em procedimentos dermatológicos de face, dáctilo e unhas. Exigem conhecimento detalhado da anatomia e experiência do profissional executante.3,5
A anestesia tumescente é semelhante à infiltrativa. No entanto, usam‐se doses mais diluídas da substância diretamente no local do procedimento. Devido à menor concentração do anestésico, é permitido usar‐se maior volume com baixo risco de toxicidade. Essa técnica é empregada em lipoaspiração, dermoabrasão e implante capilar.5,9
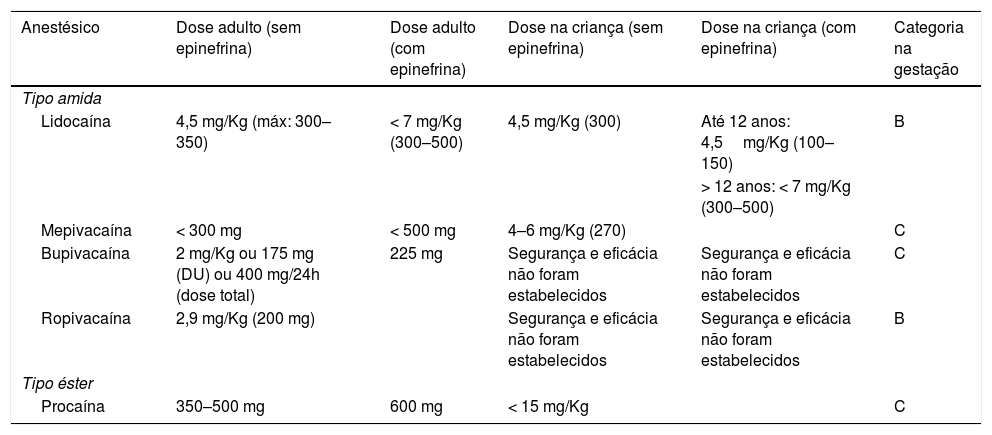
Anestésicos injetáveisLidocaínaA lidocaína é um antiarrítmico sistêmico e é, atualmente, o anestésico injetável mais usado na prática dermatológica. Seu início de ação é rápido (< 1 minuto) e sua duração é intermediária (30 a 120 minutos). A dose máxima permitida para infiltração local em adultos é de 4,5 mg/Kg/dose (máximo: 300–350 mg) sem epinefrina e de 7 mg/Kg/dose (máximo: 300–500 mg) com epinefrina. Em crianças abaixo de 12 anos, a dose máxima é de 1,5 a 2,0 mg/Kg/dose (máximo de 150 mg) sem epinefrina e de 3 a 4,5 mg/Kg/dose (máximo de 150 mg) com epinefrina. Para aquelas acima de 12 anos, as doses são semelhantes às de adultos. É classificada como categoria B na gestação e seu metabolismo hepático ocorre pelo citocromo P450 (tabelas 1 e 2).1,3,6,9
MepivacaínaA mepivacaína é um anestésico tipo amida com rápido início de ação e duração de 30 a 120 minutos. A dose máxima permitida é de 300 mg sem epinefrina e de 500 mg com epinefrina. Em crianças, a dose é de 4–6 mg/Kg/dose (máximo de 270 mg) sem epinefrina. Assim como a lidocaína, é metabolizada pelo fígado. Categoria C na gestação (tabelas 1 e 2).3,5,6,10
BupivacaínaA bupivacaína também é anestésica do grupo amida. Seu início de ação é mais lento em comparação com o da lidocaína (5 a 8 minutos) e sua duração é prolongada (2 a 4 horas). Sua segurança ainda não está bem estabelecida na população pediátrica. Em adultos, a dose máxima é de 2 mg/Kg/dose (175 mg em dose única) ou de 400 mg/24h sem epinefrina. Com epinefrina, é permitido usarem‐se até 225 mg. Para procedimentos prolongados, seu uso é benéfico. A bupivacaína tem potencial cardiotóxico e precaução é necessária em pacientes em uso de betabloqueadores ou digoxina. Categoria C na gestação (tabelas 1 e 2).3,6,10,11
EtidocaínaTambém pertencente ao grupo amida, seu início se ação ocorre entre 3 e 5 minutos, com duração de 200 minutos. A dose máxima recomendada é de 4,5 mg/Kg/dose (300 mg) sem epinefrina e de 6,5 mg/Kg/dose (400 mg) com epinefrina (tabela 1).1
PrilocaínaO anestésico do grupo amida prilocaína tem início de ação entre 5 e 6 minutos e duração intermediária, que varia de 30 a 120 minutos. Sua dose máxima permitida é de 5,7 a 8,5 mg/Kg/dose (máximo de 400 mg) sem epinefrina e de 600 mg com epinefrina. Crianças abaixo de 10 anos não devem usar doses acima de 40 mg/dose sem epinefrina. Seu metabolismo é hepático e renal. Há risco de metemoglobinemia se usadas doses superiores a 8 mg/Kg devido ao seu metabólito ortotoluidina.1,3,6
RopivacaínaA ropivacaína é anestésico tipo amida com início de ação lento (1 a 15 minutos) e longa duração (2 a 6 horas). A dose máxima permitida é de 2,9 mg/Kg/dose sem adição de epinefrina (máximo de 200 mg). Sua segurança não foi confirmada em crianças. Assim como os anestésicos do grupo, é metabolizada pelo fígado. Apresenta ação vasoconstritora. Categoria B na gestação (tabela 2).6,12
Doses preconizadas e categoria na gestação dos anestésicos locais de uso mais comum na dermatologia
| Anestésico | Dose adulto (sem epinefrina) | Dose adulto (com epinefrina) | Dose na criança (sem epinefrina) | Dose na criança (com epinefrina) | Categoria na gestação |
|---|---|---|---|---|---|
| Tipo amida | |||||
| Lidocaína | 4,5 mg/Kg (máx: 300–350) | < 7 mg/Kg (300–500) | 4,5 mg/Kg (300) | Até 12 anos: 4,5mg/Kg (100–150) | B |
| > 12 anos: < 7 mg/Kg (300–500) | |||||
| Mepivacaína | < 300 mg | < 500 mg | 4–6 mg/Kg (270) | C | |
| Bupivacaína | 2 mg/Kg ou 175 mg (DU) ou 400 mg/24h (dose total) | 225 mg | Segurança e eficácia não foram estabelecidos | Segurança e eficácia não foram estabelecidos | C |
| Ropivacaína | 2,9 mg/Kg (200 mg) | Segurança e eficácia não foram estabelecidos | Segurança e eficácia não foram estabelecidos | B | |
| Tipo éster | |||||
| Procaína | 350–500 mg | 600 mg | < 15 mg/Kg | C | |
Adaptado de Koay et al, 2012 e Park et al, 2017.5,6
Anestésico do grupo amida, apresenta rápido início de ação (2 a 4 minutos) e duração semelhante à da lidocaína (30 a 120 minutos). A dose máxima é de 7 mg/Kg/dose (350 mg) sem epinefrina e de 500 mg com epinefrina. Em crianças acima de 4 anos, a dose máxima recomendada é de 7 mg/Kg/dose. Seu metabolismo é hepático e é considerado categoria C na gestação.6
ProcaínaA procaína é anestésico tipo éster que apresenta início de ação em 5 minutos e duração curta (30 a 60 minutos). A dose máxima em adultos é de 10 mg/Kg/dose (350 a 500 mg) sem epinefrina e de 14 mg/Kg/dose (600 mg) com epinefrina. Em crianças, usam‐se até 15 mg/Kg/dose sem epinefrina. Apresenta, como outros anestésicos dessa categoria, metabolismo plasmático. Categoria C na gestação (tabelas 1 e 2).1,6
Anestésicos tópicosOs anestésicos tópicos estão disponíveis em distintas preparações e veículos. As misturas permitem que os compostos se encontrem em estado líquido e em concentrações mais elevadas, porém ainda seguras.13
LidocaínaA lidocaína é a substância mais usada em anestésicos, tanto de forma isolada quanto associada a outro componente. É do grupo amida, o que a torna menos alergênica. É classificada como categoria B na gestação, porém deve‐se ficar atento com lactantes, devido à sua excreção no leite materno.8,13
Lidocaína 4% (Dermomax®)A lidocaína em creme é o anestésico tópico mais usado no mundo, isoladamente ou associado a outras substâncias.8 No Brasil, é vendida em creme a 4%. Sua absorção sistêmica varia de acordo com o local e a extensão da área tratada. Após aplicação de 60g do creme em uma área de 400 cm2, o pico sérico atinge 0,05 a 0,16 μg/mL. Níveis tóxicos da substância (> 5 μg/mL) provocam alterações do sistema cardiovascular e do sistema nervoso central. Em crianças de até 10 Kg, a área máxima de aplicação é de 100 cm2; naquelas que pesam entre 10 e 20 Kg, a área máxima permitida é de 200 cm2. É classificado como categoria B na gestação.8,13
Lidocaína 2,5% + prilocaína 2,5% (EMLA®)Um dos anestésicos tópicos mais usados, é composto pela associação de lidocaína 2,5% e prilocaína 2,5%. A absorção sistêmica depende da duração da aplicação, da localização anatômica e da extensão da área tratada. Oclusão e aplicação prolongada aumentam a penetração da medicação. A analgesia alcança até 3 mm de profundidade após 60 minutos de aplicação e até 5 mm após 120 minutos. O uso de 60g da medicação em 400 cm2 de superfície corporal ocluída oferece baixo risco de toxicidade. Em neonatos, é permitido usar‐se até 1g do anestésico por, no máximo, uma hora. É classificada como categoria B na gestação (tabela 3).8,13
Dose e área de aplicação máximas recomendadas para o anestésico tópico eutetic mixture of local anesthetics (EMLA®)
| Idade e peso recomendados | Dose máxima total (g) | Área de aplicação máxima (cm2) | Tempo máximo de aplicação (horas) |
|---|---|---|---|
| 0–3 meses ou < 5 Kg | 1 | 10 | 1 |
| 3–12 meses e > 5 Kg | 2 | 20 | 4 |
| 1–6 anos e > 10 Kg | 10 | 100 | 4 |
| 7–12 anos e > 20 Kg | 20 | 200 | 4 |
Adaptado de Sobanko et al, 2012.8
A formulação de lidocaína 7% e tetracaína 7% em creme forma uma película na superfície cutânea, que contribui para sua absorção local. O composto penetra até 6,8 mm de profundidade na pele e deve ser aplicado com 30 minutos de antecedência ao procedimento. Reações locais incluem eritema, palidez e edema.8
EpinefrinaA epinefrina (adrenalina) é um vasoconstritor habitualmente associado aos anestésicos locais (1 a 2:100.000). Permite uma reabsorção sistêmica mais lenta do anestésico, prolonga seu efeito, reduz seu pico plasmático e promove hemostasia. Deve ser usada com cautela em pacientes tratados com β‐bloqueadores ou naqueles portadores de doenças cardiovasculares, doença vascular periférica, hipertensão grave, feocromocitoma e hipertireoidismo. Alguns estudos, no entanto, demonstraram que é segura quando usada em pequenas doses em pacientes com doenças cardíacas estáveis.1,6,14
A adição de epinefrina aos anestésicos locais também se comprovou segura em locais de vascularização terminal, como dáctilos, mãos, pés e região genital.1,15
É considerada categoria C na gestação. A propriedade alfa‐adrenérgica da epinefrina pode causar vasoconstrição no plexo sanguíneo da placenta. No entanto, é considerada segura se usada em baixas doses em grávidas, pois seu efeito vasoconstritor limita a absorção sistêmica e a sua transferência à placenta. Recomenda‐se que seu uso em gestantes seja, sempre que possível, adiado para o período pós‐parto.1,16
As concentrações usadas variam entre 1:50.000 e 1:200.000, as de 1:100.000 e 1:200.000 são as mais usadas. Nessas concentrações, apresentam efeitos semelhantes na vasoconstrição e prolongam a duração da lidocaína em cerca de 200%.1
Efeitos adversosOs anestésicos locais são considerados muito seguros quando usados corretamente. Entretanto, embora raros, alguns efeitos adversos podem ocorrer, alguns deles com repercussão sistêmica.
As reações indesejadas podem ser divididas em duas categorias: aquelas associadas à penetração da agulha na pele e aquelas associadas à solução anestésica. Entre as primeiras, destacam‐se dor, edema, equimose, infecção, hematoma, hiperalgesia e trismo muscular.5 A reações associada à solução são a toxicidade local ou sistêmica, reações alérgicas e idiossincrásicas.5
Toxicidade localA toxicidade local é atribuída ao efeito direto do anestésico no local de aplicação e está associada, em muitos casos, à técnica incorreta. São exemplos a dor, tanto pela substância quanto pela distensão do tecido no local da aplicação, o hematoma, a infecção, dilaceração de estruturas nervosas e necrose isquêmica.5,6
Toxicidade sistêmicaA toxicidade sistêmica dos anestésicos locais (LAST – local anesthetic systemic toxicity) é considerada o evento adverso mais grave e com potencial de óbito. Ocorre quando há elevação do nível plasmático do anestésico acima das doses recomendadas. Pode surgir abruptamente após aplicação direta do anestésico na circulação sanguínea de forma inadvertida, ou de maneira mais lenta, com a elevação dos níveis séricos do anestésico, após aplicação de doses excessivas ou redução do metabolismo do medicamento.1,5,17–19
Inicialmente, o paciente apresenta sinais de ativação do sistema nervoso central, que tendem a se apresentar de maneira progressiva: parestesia perioral, parestesia facial, lentificação da fala, gosto metálico, diplopia, alterações auditivas e alucinações. Hipertensão arterial e taquicardia podem estar associadas. Com a progressão, há sinais de depressão do sistema nervoso, culminam com depressão respiratória (concentração sérica de lidocaína acima de 15 μg/mL). Os efeitos cardiovasculares surgem mais tardiamente e incluem: depressão do miocárdio, prolongamento do intervalo de condução, bradicardia, hipotensão e falência cardíaca (concentração sérica de lidocaína acima de 20 μg/mL).1,5,17
Embora potencialmente grave, a toxicidade sistêmica é extremamente rara. A dose de anestésicos locais necessária para a maioria dos procedimentos dermatológicos é muito inferior à recomendada para cada anestésico: a toxicidade sistêmica está associada a doses elevadas da medicação.1
Vasques et al. publicaram uma revisão da literatura e identificaram 67 casos de toxicidade sistêmica descritos em 54 artigos entre 2010, ano da publicação do algoritmo de conduta na LAST pela Sociedade Americana de Anestesia Regional e Medicina da Dor, e 2014. Do total, oito casos surgiram após infusão contínua de anestésico local e dois ocorreram após aplicação inadvertida do anestésico em vaso por meio de cânula venosa. A técnica de aplicação foi adequada em 78% dos 50 pacientes que receberam dose única do anestésico local. Entre esses, 23% de toxicidade sistêmica surgiram após bloqueio interescaleno, 16% após bloqueio epidural e 13% após bloqueio peniano. Pacientes menores de um ano foram os mais acometidos (22%). Sete casos estavam associados a anestésicos tópicos (não injetáveis), cinco deles em crianças, quatro tinham idade de até quatro anos. Em apenas dois pacientes a toxicidade sistêmica ocorreu com dermatologistas: duas crianças evoluíram para quadro de metemoglobinemia após aplicação de EMLA®.17
O trabalho prospectivo de Starling et al. demonstrou que procedimentos dermatológicos feitos em consultório apresentam taxas muito baixas de complicações. Em dez anos de estudo nos estados da Flórida e do Alabama, Estados Unidos, não foi notificada complicação relacionada a anestésicos locais em procedimentos com dermatologistas.2
O estudo longitudinal de Alam et al. incluiu uma pesquisa com 437 cirurgiões dermatológicos nos Estados Unidos e também não mostrou casos de intoxicação pela lidocaína nos procedimentos cirúrgicos feitos por 10 dias consecutivos pelos médicos. A dose máxima do medicamento usada foi de 6,54 mL em excisões e de 15,85 mL nas reconstruções. A incidência de eventos adversos relacionados à anestesia local foi de 0,15%, em 0,13% as reações foram moderadas (tontura, sonolência e taquicardia pela epinefrina).20
Uma série de 20.021 pacientes foi analisada por Barrington e Kluger em um estudo multicêntrico da Austrália e da Nova Zelândia de janeiro de 2007 a maio de 2012. Os pacientes foram submetidos a 25.336 bloqueios de nervos periféricos, sem e com auxílio da ultrassonografia. Pacientes menores de 13 anos foram excluídos do trabalho. Houve 22 episódios de toxicidade sistêmica, resultaram em uma incidência de 0,87 por 1.000 bloqueios feitos. Apenas um paciente evoluiu para falência cardíaca após injeção intravascular direta do anestésico em procedimento de bloqueio paravertebral. O sítio de injeção, o tipo de anestésico usado, a dose por peso e o peso do paciente foram fatores preditores para a ocorrência da complicação.21
Sites et al. não identificaram caso de falência cardíaca em um trabalho prospectivo com 12.668 pacientes submetidos a anestesia regional periférica de julho de 2003 a fevereiro de 2011 em hospital dos Estados Unidos. Apenas um caso de toxicidade sistêmica ocorreu (incidência de 0,08 por 1.000).22
O tratamento da toxicidade sistêmica consiste em suspender imediatamente a aplicação do anestésico e solicitar assistência médica de urgência. Em seguida, iniciar procedimentos de suporte básico ou avançado de vida: preservação de vias aéreas e do sistema cardiovascular. O tratamento específico em casos de falência cardíaca é feito com a terapia de emulsão lipídica a 20%.5,6
Reações de hipersensibilidadeReação tipo I (mediada por IgE)Estima‐se que a prevalência da alergia mediada por IgE aos anestésicos seja menor do que 1%.6 A revisão de Bhole et al., publicada em 2012, avaliou 23 séries de casos que incluíam 2.978 pacientes, entre 1950 e 2011. Apenas 23 apresentaram verdadeira reação de hipersensibilidade do tipo I aos anestésicos tópicos.23
As reações locais são as mais comuns e incluem o surgimento de urticas ou de angioedema sem comprometimento respiratório. O tratamento consiste na administração de anti‐histamínicos e observação cautelosa do paciente.24
Os sintomas da reação de hipersensibilidade sistêmica imediata (anafilaxia) ocorrem nos primeiros 30 minutos da exposição ao anestésico e devem ser imediatamente identificados pelo médico. Em geral, dois ou mais sistemas são envolvidos ou há evidências de comprometimento respiratório ou cardiovascular. Os sintomas incluem dispneia, tosse, sibilos, hipotensão e taquicardia. O tratamento deve ser imediatamente instituído com a aplicação de vasoconstritores (epinefrina) por via intramuscular.24
Em casos de reação alérgica, pode‐se tentar o uso de anestésicos do tipo éster, devido à baixa reação cruzada entre eles e os anestésicos do grupo amida. Outras opções seriam a aplicação de difenidramina ou solução salina bacteriostática (álcool benzil 0,9% em solução salina) em biópsias ou pequenas excisões cutâneas.1
Reação tipo IV (tardia)A reação de hipersensibilidade tardia inclui a dermatite de contato alérgica. Segundo o estudo retrospectivo de To et al., que analisou 1.819 pacientes submetidos a patch teste no Canadá, a incidência chega a 2,4%. O alérgeno mais comum é a benzocaína (45%), seguido pela lidocaína (32%) e dibucaína (23%).25 Nos Estados Unidos, estima‐se que a incidência seja de 3,4%.26
O quadro clínico surge após 24 a 48 horas da exposição ao agente e é caracterizado por eritema, edema, descamação, infiltração, bolhas e crostas na pele. Os sintomas incluem ardor e prurido.27
Pacientes que apresentam patch teste positivo para lidocaína devem ser submetidos à injeção intradérmica de lidocaína 0,1% para confirmação da dermatite de contato alérgica à substância. Outros anestésicos locais também devem ser testados.25
Reação vasovagalÉ resultante da ansiedade e da percepção de dor e medo pelo paciente à agulha ou ao procedimento. Resulta em estimulação do sistema parassimpático e os sintomas que podem se assemelhar à reação alérgica: tontura, sudorese, náuseas, bradicardia e hipotensão. Em casos extremos, há síncope. O tratamento consiste em acalmar o paciente, colocá‐lo em posição de Trendelenburg e aplicar compressas frias na fronte.24
Anestésicos tópicosAs reações locais aos anestésicos tópicos incluem eritema, palidez e edema. Orienta‐se evitar a aplicação dos cremes anestésicos diretamente em olhos, mucosa oral e conduto auditivo interno, devido ao risco de irritação local. Além disso, a aplicação em mucosa genital exige cautela quanto à quantidade de medicamento usado.8
Reações sistêmicas, embora raras, podem ocorrer, como metemoglobinemia, alterações do sistema nervoso central e cardiotoxicidade.
A metemoglobinemia é uma preocupação particularmente especial na população pediátrica, devido ao metabolismo ainda imaturo da metemoglobina até os 3 meses.6 Ela pode ocorrer com o uso do EMLA®: a prilocaína tem o potencial de impedir o transporte de oxigênio pela hemoglobina.8 Níveis de metemoglobina de 15% a 30% resultam em cianose. Níveis de 30% a 50% resultam em dispneia, taquicardia e cefaleia. Acima de 50%, causam letargia e coma.8
A revisão de Tran e Koo, publicada em 2014, incluiu 12 estudos sobre a segurança do anestésico tópico EMLA®. Foram identificados 12 casos de LAST; desses, nove eram crianças.28
A formulação de lidocaína 7% e tetracaína 7% em creme apresenta risco de eritema e palidez moderados e transitórios no local da aplicação.8
É importante observar que algumas técnicas podem aumentar a absorção dérmica dos anestésicos tópicos ao se remover a camada córnea da pele, como o laser ablativo.29 A aplicação do produto em superfícies inflamadas ou em extensas áreas de superfície corporal também podem aumentar o risco de absorção e toxicidade.8
Ao se identificarem sinais de toxicidade pelo anestésico tópico, o medicamento deve ser imediatamente lavado da superfície cutânea. O paciente deve ser colocado na posição supina e os sinais vitais devem ser avaliados. O tratamento específico deve ser iniciado de acordo com os sinais e sintomas.8
Técnicas para aplicaçãoA técnica correta de aplicação dos anestésicos permite que o procedimento seja seguro e confortável. O médico deve usar luvas e fazer a antissepsia adequada da pele. Sugere‐se marcar a área a ser tratada previamente à aplicação do anestésico, para evitar distorção do local com o volume injetado da medicação.5
Sempre que possível, deve‐se optar pelo uso de agulhas finas e curtas, que causam menor desconforto. Infusão lenta, vibração da pele, uso de solução morna, resfriamento da pele e o mínimo de injeções na pele também auxiliam no conforto. A injeção do líquido no plano subcutâneo é menos dolorosa do que aquela na derme. Em alguns casos, principalmente nas crianças, indica‐se a aplicação de anestésico tópico na pele previamente ao injetável.1,5
Para anestésicos tópicos, recomenda‐se a aplicação em pele intacta, livre de erosão ou eczema. Devem‐se evitar o contato da medicação com a mucosa ocular e o uso de anestésicos do grupo amida em pacientes com insuficiência hepática e do anestésico EMLA® em recém‐nascidos.8
Segurança dos anestésicosSegundo as diretrizes americanas publicadas em 2016, os anestésicos locais são considerados medicamentos seguros para uso em procedimentos dermatológicos feitos em consultório. Os episódios de toxicidade sistêmica e de reação anafilática aos anestésicos locais são eventos raros e muitos autores recomendam procedimentos cirúrgicos fora do ambiente hospitalar.1,2,30–32
O estudo prospectivo de Starling et al., publicado em 2012, coletou dados sobre complicações de procedimentos ambulatoriais nos estados da Flórida, de 2000 a 2010, e no Alabama, de 2003 a 2009, ambos nos Estados Unidos. No primeiro estado, foram reportados 46 óbitos e 263 complicações de procedimentos, 45% ocorreram com cirurgiões plásticos. Apenas quatro complicações ocorreram com dermatologistas, sem óbitos (1,3% dos casos): um episódio de reação vasovagal após lipoaspiração em paciente submetido à anestesia geral; um caso de fibrilação atrial de curta duração em paciente submetido à excisão cutânea; uma excisão cirúrgica incorreta em cirurgia de Mohs e um episódio de queimadura de segundo grau em paciente acamado e em uso de oxigênio domiciliar sedado para o procedimento dermatológico. No Alabama, foram notificados três óbitos e 49 complicações de procedimentos ambulatoriais. A cirurgia plástica foi a especialidade médica com maior índice de complicações (42,3% dos casos). Apenas uma complicação ocorreu com dermatologista, não evoluída para óbito, correspondeu a 1,3% dos casos: um paciente apresentou infecção por Staphylococcus aureus meticilina‐resistente após exérese de melanoma. Não foi relatada complicação após procedimentos cosméticos com anestesia local feitos por dermatologistas.2
O trabalho de Hanke, Bernstein e Bullock incluiu 15.336 pacientes submetidos a lipoaspiração com anestesia tumescente feita por cirurgiões dermatológicos e mostrou complicações em apenas 0,38% dos casos. Dois pacientes tiveram arritmia cardíaca e dois apresentaram taquicardia persistente. Nenhum óbito foi reportado.33 Klein e Jeske também demonstraram níveis séricos seguros de lidocaína com o uso de doses elevadas da anestesia tumescente em pacientes submetidos a lipoaspiração.34
O coorte prospectivo de Alam et al. obteve resultados semelhantes em 19 pacientes submetidos a cirurgia micrográfica de Mohs. Os autores mediram seis níveis séricos de lidocaína aplicada em três tempos durante o procedimento cirúrgico. Não houve elevação dos níveis séricos de lidocaína a doses tóxicas mesmo naqueles procedimentos que usaram doses mais elevadas do anestésico: o valor mais elevado de lidocaína sérica encontrado pelos autores foi de 0,3 μg/mL.35
Em 2012, Walsh et al. demonstraram que o conhecimento dos dermatologistas acerca das doses e da toxicidade dos anestésicos locais é satisfatório. No entanto, o tratamento da toxicidade sistêmica com a emulsão lipídica foi corretamente acertado por 21,7% dos participantes do trabalho, índice considerado baixo pelos autores.36
O trabalho retrospectivo de Kvisselgaard et al. descartou reação de hipersensibilidade em todos os 164 pacientes incluídos no estudo, previamente encaminhados à clínica de Alergologia e Imunologia com suspeita de reação do tipo I a anestésicos locais, de 2010 a 2014. Os autores consideram que esse evento seja raro com essas medicações.37
Embora os efeitos adversos aos anestésicos sejam pouco frequentes, recomenda‐se cautela em seu uso. A seleção da medicação adequada, a identificação dos sinais de risco e o manejo das complicações são conhecimentos primordiais para o médico dermatologista.6
Situações especiaisGestação e lactaçãoA lidocaína é considerada categoria B na gestação e a epinefrina, categoria C.1,16 Recomenda‐se cautela no uso dos anestésicos nessa categoria de pacientes devido ao aumento da sensibilidade local e da absorção sistêmica dessas medicações nessa fase. Deve‐se evitar a injeção intravascular devido ao risco de cardiotoxicidade materna e fetal.38
População pediátrica e idososA aplicação de anestésicos locais na população pediátrica exige cautela. É importante diferenciar os sinais de medo e dor daqueles efeitos do sistema nervoso central.6 Em neonatos, a absorção mucocutânea é maior e mais rápida do que em adultos e há menor ligação dos anestésicos às proteínas plasmáticas, resulta em risco elevado de intoxicação.39
Nos idosos, o clearance (depuração) dos anestésicos locais está reduzido devido à disfunção orgânica e circulação comprometida. Além disso, mudanças neuronais deixam esses pacientes mais sensíveis a essas medicações. Em muitos casos, doses menores são exigidas para se obter a mesma analgesia.6,40
ComorbidadesA disfunção hepática pode afetar a circulação sistêmica dos anestésicos locais. A insuficiência renal e uremia podem aumentar a absorção local dessas medicações e reduzir o clearance da ropivacaína e da bupivacaína.6,38
Circulação sanguínea alterada reduz o metabolismo das substâncias no fígado e nos rins, leva à redução do clearance do anestésico. A insuficiência cardíaca reduz a absorção local desses medicamentos devido à baixa perfusão tecidual. Entretanto, há risco de aumento das concentrações do anestésico no sistema nervoso central. A epinefrina deve ser usada com cautela ou evitada em alguns casos.6,38
Considerações finaisOs anestésicos locais podem ser considerados medicamentos seguros para o uso do médico dermatologista. Embora alguns efeitos adversos sejam considerados graves, como a toxicidade sistêmica e a reação anafilática, sua ocorrência é rara. O manejo correto da medicação, a técnica adequada de aplicação e o conhecimento dos eventos adversos e de seu tratamento específico reduzem os riscos associados ao anestésico local e torna sua aplicação viável em consultório.
Em 18 de setembro de 2017 entraram em vigor as novas regras de funcionamento para consultórios médicos privados, ambulatórios e hospitais no país, publicadas pelo Conselho Federal de Medicina (CFM) após algumas alterações na Resolução CFM n° 2.056/2013.
Foram mantidos como Consultório de Dermatologia do Grupo 3 aqueles consultórios ou serviços que fazem procedimentos médicos invasivos em que há risco de anafilaxias, insuficiência respiratória e cardiovascular, inclusive os locais onde se usam apenas anestésicos locais sem sedação. Nesse caso, além da estrutura básica para a propedêutica, são exigidos os insumos e equipamentos para a terapêutica e o tratamento das reações anafiláticas e aqueles de segurança para a intervenção de socorro imediato a complicações decorrentes da intervenção terapêutica.
De acordo com as evidências mostradas neste trabalho sobre o perfil de segurança dos anestésicos locais para procedimentos dermatológicos, os autores sugerem uma revisão a respeito das exigências da atual resolução em vigor. Procedimentos dermatológicos como exérese de pequenas lesões cutâneas, que exigem doses seguras de anestésicos locais (< 6,4 mL de lidocaína)20 e são feitos diariamente pelo dermatologista clínico, poderiam ser realocados para procedimentos de nível 2.
Suporte financeiroNenhum.
Contribuição dos autoresAna Carolina Figueiredo Pereira Cherobin: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Glaysson Tassara Tavares: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Cherobin ACFP, Tavares GT. Safety of local anesthetics. An Bras Dermatol. 2020;95:82–90.
Trabalho realizado no Serviço de Dermatologia, Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.