A cirurgia é o tratamento de escolha para pacientes com carcinoma basocelular (CBC). Quando a cirurgia não é opção, apenas a radioterapia é recomendada para pacientes com CBC facial de alto risco. Interferon pode ser opção terapêutica aceitável para esses pacientes.
ObjetivoAvaliar a resposta clínica em longo prazo à terapia com interferon em pacientes com CBC facial de alto risco.
MétodosPacientes com CBC facial de alto risco foram tratados com injeções perilesionais de interferon alfa‐2b+gama. Aqueles com resposta clínica incompleta foram reavaliados, os tumores residuais foram excisados e declarados curados. Os pacientes tratados com interferon e aqueles tratados com interferon + cirurgia foram seguidos por cinco anos. O tempo até a recorrência e o surgimento de novo CBC facial foi estimado pela análise de sobrevida de Kaplan‐Meier. Eventos adversos foram documentados.
ResultadosEsse estudo incluiu 195 participantes; 143 (73,3%) apresentaram resposta completa (IC95% 67,2‐80,1). Os pacientes desenvolveram recorrência após tempo médio de 55 meses (IC95% 53,8‐57,4). A taxa estimada de recorrência foi de 12,3% (IC95% 7,4‐17,1). Os pacientes desenvolveram novo CBC em média após 52,7 meses (IC95% 50,4‐54,9). A taxa estimada de desenvolvimento de um novo CBC foi de 20,0% (IC95% 14,4‐25,9). Quinze (7,7%) pacientes abandonaram o estudo durante o seguimento. Os eventos adversos foram frequentes, porém moderados ou leves; febre e dor local foram os mais frequentes.
Limitações do estudoDesenho de coorte observacional sem grupo paralelo para comparação.
ConclusõesInjeções perilesionais de interferon alfa‐2b+gama em pacientes com CBC facial de alto risco oferecem taxa de cura satisfatória após cinco anos de seguimento com perfil de segurança aceitável.
O carcinoma basocelular (CBC) é o câncer mais comum em indivíduos de pele branca e sua incidência está aumentando em todo o mundo.1 Embora a incidência de metástases seja muito baixa, CBCs tratados de forma inadequada podem apresentar crescimento e invasão dos tecidos circunvizinhos causando mutilações, prejuízos funcionais e resultados cosméticos adversos.1
O objetivo principal do tratamento é a remoção completa da lesão, o que resulta em cura e baixo risco de recorrência. Resultados cosméticos aceitáveis também devem ser levados em consideração.2 Múltiplas modalidades de tratamento estão atualmente disponíveis para o CBC, mas a escolha da intervenção para determinado paciente é determinada pelas características do tumor, como localização, tamanho, se primário ou recorrente e subtipos histopatológicos ou clínicos. Além disso, características do paciente (comorbidades, resultados cosméticos, preferências) e fatores do ambiente (recursos materiais e humanos disponíveis e custo) devem ser considerados no processo de tomada de decisão.3
De acordo com as diretrizes clínicas atuais, a estratificação baseada no risco de recorrência é o primeiro passo no manejo clínico do CBC.3,4 A maioria das diretrizes segue as regras de estratificação da National Comprehensive Cancer Network (NCCN), que levam em consideração uma combinação de parâmetros diferentes que dividem o CBC em tumores de alto e baixo risco.3 As intervenções são geralmente classificadas como terapia cirúrgica e não cirúrgica. A terapia cirúrgica é recomendada como tratamento de primeira linha para subtipos de CBC de alto e baixo risco, enquanto as intervenções não cirúrgicas são geralmente reservadas para CBC de baixo risco.3,4
Quando a cirurgia não é opção, há uma infinidade de intervenções não cirúrgicas para CBC de baixo risco, todas com taxa de recorrência aceitável e excelentes resultados cosméticos.5,6 Para tumores de alto risco, a radioterapia (RT) é a primeira e frequentemente a única opção viável. Avaliações de outras intervenções para CBC facial de alto risco, nos quais a cirurgia não é possível (ou desejável), são atualmente necessárias.7
Os interferons já foram avaliados como tratamento local para o CBC.8–12 Mesmo com estudos iniciais demonstrando eficácia e resultados de segurança aceitáveis, as principais diretrizes atuais não recomendam interferons para qualquer tipo de CBC. Como não foi encontrada explicação convincente ou discussão esclarecedora sobre as razões dessa omissão, sugerimos que seja avaliada a eficácia e segurança do interferon perilesional, especialmente no CBC facial de alto risco, no qual a cirurgia não é uma opção. Uma importante revisão sistemática destinada a avaliar dados de diferentes intervenções terapêuticas para o CBC apresenta esse breve argumento contra a pertinência do uso de interferons para o CBC: o tratamento geralmente precisa ser administrado em múltiplas sessões e é caro, o que limita seu uso generalizado. Os efeitos colaterais sistêmicos são comuns.2
O HeberFERON, uma combinação de interferons alfa‐2b e gama, é um biofármaco desenvolvido pelo Centro de Engenharia Genética e Biotecnologia de Havana, Cuba, e aprovado pelas autoridades reguladoras cubanas para o tratamento do CBC.13 Estudo clínico retrospectivo de pacientes com CBC tratados com HeberFERON descreveu a resposta ao tratamento em uma coorte cubana.14 Este estudo tem limitações importantes: somente avaliamos as taxas de cura após 16 semanas de tratamento, sem seguimento em longo prazo. A recorrência em cinco anos foi considerada o desfecho primário para avaliar a eficácia/efetividade de quaisquer intervenções para CBC local.2
O objetivo deste estudo foi avaliar a resposta clínica em longo prazo à terapia com interferon em pacientes com CBC facial de alto risco.
MétodosDesenho e cenário do estudoO presente estudo é de coorte prospectiva, observacional, multicêntrico, com período de seguimento de cinco anos. Participaram do estudo seis centros de saúde de atenção primária de diferentes municípios da província de Sancti Spiritus, Cuba. Cada centro de saúde era equipado com um centro cirúrgico e um dermatologista treinado, com mais de 10 anos de experiência no tratamento de pacientes com CBC. O estudo foi realizado no ambiente da prática clínica local.
ParticipantesOs pacientes procuraram os serviços de dermatologia dos centros de saúde primários após encaminhamento da equipe multidisciplinar de tumores superficiais para avaliação e manejo de casos com diagnóstico clínico de CBC. Apenas pacientes que atendessem aos seguintes critérios foram selecionados para avaliação adicional: adultos (maiores de 18 anos) de ambos os gêneros, com lesões faciais únicas ou múltiplas com diagnóstico confirmado histopatologicamente de CBC de qualquer tamanho, subtipo, recorrentes ou não, com ou sem tratamentos anteriores. Outros critérios foram que o tratamento cirúrgico não fosse possível ou desejável, e o paciente não apresentasse contraindicações para receber HeberFERON (de acordo com as recomendações do fabricante do medicamento ou consideração do dermatologista). A assinatura do termo de consentimento informado por escrito para participação também foi necessária para inclusão no estudo. Após a triagem inicial, apenas os pacientes com tumores classificados de alto risco, seguindo os critérios da National Comprehensive Cancer Network (NCCN), foram incluídos no estudo. O período de recrutamento estendeu‐se de 17 de junho de 2015 a 28 de fevereiro de 2018 e o período de seguimento terminou em 20 de março de 2023.
IntervençõesAs intervenções foram realizadas por dermatologistas experientes, previamente treinados e certificados para administração de HeberFERON. Na consulta inicial foram realizados anamnese e exame físico. Também foram obtidas informações sobre a localização e tamanho do tumor, subtipo clínico e histopatológico, avaliação dermatoscópica, se era tumor primário ou recidivante, entre outras; amostras de sangue foram coletadas para exames laboratoriais de rotina. Foi realizada biopsia por punch de 3mm para estudo histopatológico. Todas as informações foram registradas prospectivamente no prontuário clínico do paciente.
O HeberFERON, uma combinação sinérgica de interferons‐α e ‐γ (HeberPAG, Heber Biotec SA, Havana, Cuba),12,13 foi empregado no tratamento dos pacientes. O medicamento foi administrado por dermatologista treinado; a dose foi de 10,5×106 UI e a via foi intradérmica/perilesional, três vezes por semana, durante três semanas consecutivas. Os pacientes foram entrevistados e examinados em cada consulta e foram observados 90 minutos após a administração do medicamento; todos os eventos adversos agudos foram registrados.
O período de seguimento começou assim que o paciente foi incluído no estudo e as primeiras doses administradas. Um mês após o término do esquema de tratamento, os pacientes foram avaliados com a inspeção (medidas) das lesões, entrevistados sobre eventos adversos e o mesmo conjunto de análises laboratoriais foi indicado para comparação. Dezesseis semanas após o início do tratamento, foi realizada outra avaliação (incluindo biopsia) para determinar as respostas clínicas e eventos adversos. Cada consulta de seguimento incluiu exame dermatológico, dermatoscópico e ganglionar. Cada paciente foi acompanhado por um período mínimo de 60 meses; a cada três meses durante o primeiro ano, duas vezes por ano durante o segundo ano e uma vez por ano a partir de então. Todos os pacientes foram instruídos que se percebessem alguma nova lesão na pele, de qualquer tipo e localização, no intervalo de tempo entre cada consulta agendada, deveriam então ir ao médico para avaliação.
DesfechosTrês variáveis de desfecho caracterizaram a eficácia da terapia: qualidade da resposta clínica, recorrência e desenvolvimento de novo CBC primário.
A resposta clínica foi avaliada por um dermatologista treinado 16 semanas após as primeiras doses. Foram consideradas quatro categorias de respostas clínicas: resposta completa (eliminação completa do tumor do ponto de vista clínico, dermatoscópico e histopatológico); resposta parcial (redução de mais de 30% do tamanho do tumor); doença estável (redução do tamanho do tumor insuficiente para ser considerada resposta parcial ou doença progressiva); e doença progressiva (aumento de mais de 20% no tamanho do tumor).
Foi considerada recidiva quando, após um período de resposta completa, um tumor do mesmo subtipo histopatológico reapareceu no mesmo local. O desenvolvimento de um novo CBC foi considerado quando um novo tumor surgiu em local diferente.
Os eventos adversos foram registrados e codificados de acordo com a WHO‐ART.15
Análise estatísticaA análise estatística foi realizada utilizando o pacote de software SPSS (versão 22). As variáveis quantitativas foram descritas com a média aritmética e seu desvio padrão. Frequência absoluta e relativa (%) foram utilizadas para variáveis qualitativas.
A influência das variáveis demográficas e tumorais na resposta clínica foi testada por meio de análises univariadas pelo teste de Qui‐quadrado como medida de associação com o odds ratio (OR) e intervalo de confiança de 95% (IC95%).
A recorrência e o desenvolvimento de um novo CBC foram avaliados com análise de sobrevida de Kaplan‐Meier para estimar o tempo médio até o evento com seu IC de 95%. Para ambos os endpoints (recorrência e desenvolvimento de um novo CBC), a sobrevida global (com seu IC de 95%) foi estimada para cinco anos de seguimento.
Considerações éticasO Conselho de Ética Institucional aprovou o protocolo desse estudo. Todos os participantes deram seu consentimento informado por escrito. Os procedimentos e o gerenciamento de dados estavam de acordo com as diretrizes de Boas Práticas Clínicas e os princípios éticos estabelecidos na Declaração de Helsinque.
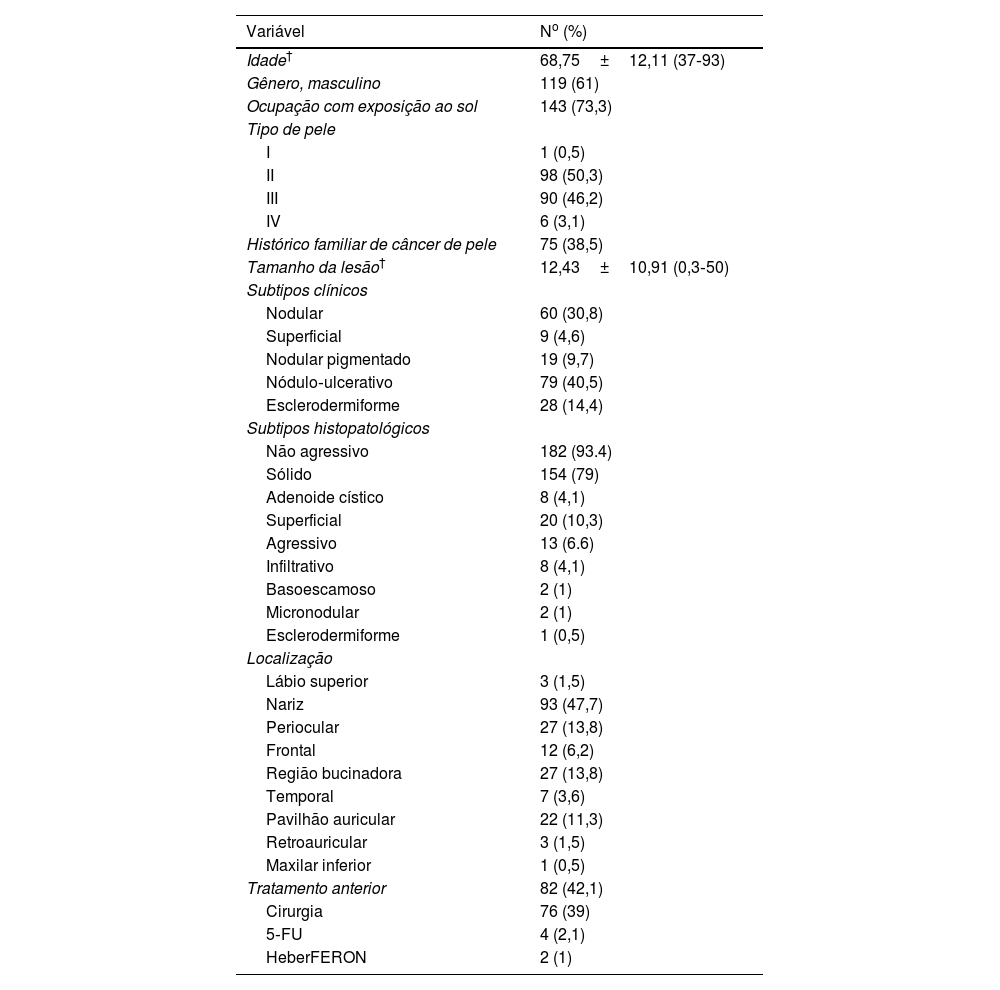
ResultadosQuinhentos e vinte e oito pacientes com diagnóstico clínico de CBC foram avaliados durante o período de recrutamento, e apenas 195 preencheram os critérios de inclusão (CBC facial, de alto risco, confirmado histopatologicamente, não suscetível de cirurgia). As características sociodemográficas e tumorais basais dos pacientes incluídos são mostradas na tabela 1.
Características basais de pacientes com carcinoma basocelular facial de alto risco, n=195
| Variável | No (%) |
|---|---|
| Idade† | 68,75±12,11 (37‐93) |
| Gênero, masculino | 119 (61) |
| Ocupação com exposição ao sol | 143 (73,3) |
| Tipo de pele | |
| I | 1 (0,5) |
| II | 98 (50,3) |
| III | 90 (46,2) |
| IV | 6 (3,1) |
| Histórico familiar de câncer de pele | 75 (38,5) |
| Tamanho da lesão† | 12,43±10,91 (0,3‐50) |
| Subtipos clínicos | |
| Nodular | 60 (30,8) |
| Superficial | 9 (4,6) |
| Nodular pigmentado | 19 (9,7) |
| Nódulo‐ulcerativo | 79 (40,5) |
| Esclerodermiforme | 28 (14,4) |
| Subtipos histopatológicos | |
| Não agressivo | 182 (93.4) |
| Sólido | 154 (79) |
| Adenoide cístico | 8 (4,1) |
| Superficial | 20 (10,3) |
| Agressivo | 13 (6.6) |
| Infiltrativo | 8 (4,1) |
| Basoescamoso | 2 (1) |
| Micronodular | 2 (1) |
| Esclerodermiforme | 1 (0,5) |
| Localização | |
| Lábio superior | 3 (1,5) |
| Nariz | 93 (47,7) |
| Periocular | 27 (13,8) |
| Frontal | 12 (6,2) |
| Região bucinadora | 27 (13,8) |
| Temporal | 7 (3,6) |
| Pavilhão auricular | 22 (11,3) |
| Retroauricular | 3 (1,5) |
| Maxilar inferior | 1 (0,5) |
| Tratamento anterior | 82 (42,1) |
| Cirurgia | 76 (39) |
| 5‐FU | 4 (2,1) |
| HeberFERON | 2 (1) |
Em relação à resposta clínica, 143 (73,3%) pacientes apresentaram resposta completa (IC95% 67,2‐80,1); 49 (25,1%) pacientes apresentaram resposta parcial e dois (1%) apresentaram doença estável. Um paciente abandonou a terapia durante as seções iniciais. As respostas clínicas completas foram corroboradas por histopatologia em 107 pacientes; o restante dos pacientes com resposta clínica completa não aceitou uma segunda biopsia. Pacientes sem resposta completa, após discussão prévia e reavaliação com o dermatologista, foram qualificados para excisão cirúrgica. Então, todos os 194 pacientes (143 tratados com HeberFERON e 51 tratados com HeberFERON mais cirurgia) foram considerados curados e acompanhados por cinco anos.
As análises univariadas pelo teste de Qui‐quadrado mostraram que apenas duas variáveis estavam associadas à resposta clínica: idade superior a 72 anos (OR=3,10; IC95% 1,57‐6,11) e tamanho da lesão superior a 20mm (OR=2,25; IC95% 1,14‐4,41).
Em relação aos subtipos histopatológicos, 130 dos 182 pacientes com tumores não agressivos apresentaram resposta clínica completa. Por outro lado, 10 dos 13 pacientes com subtipos histopatológicos agressivos apresentaram resposta completa; no entanto, 40% dos pacientes com tumores agressivos desenvolveram recorrência após cinco anos de seguimento. Os pacientes com subtipo esclerodermiforme apresentaram resposta completa sem recorrência, mas desenvolveram um segundo CBC primário em outro local.
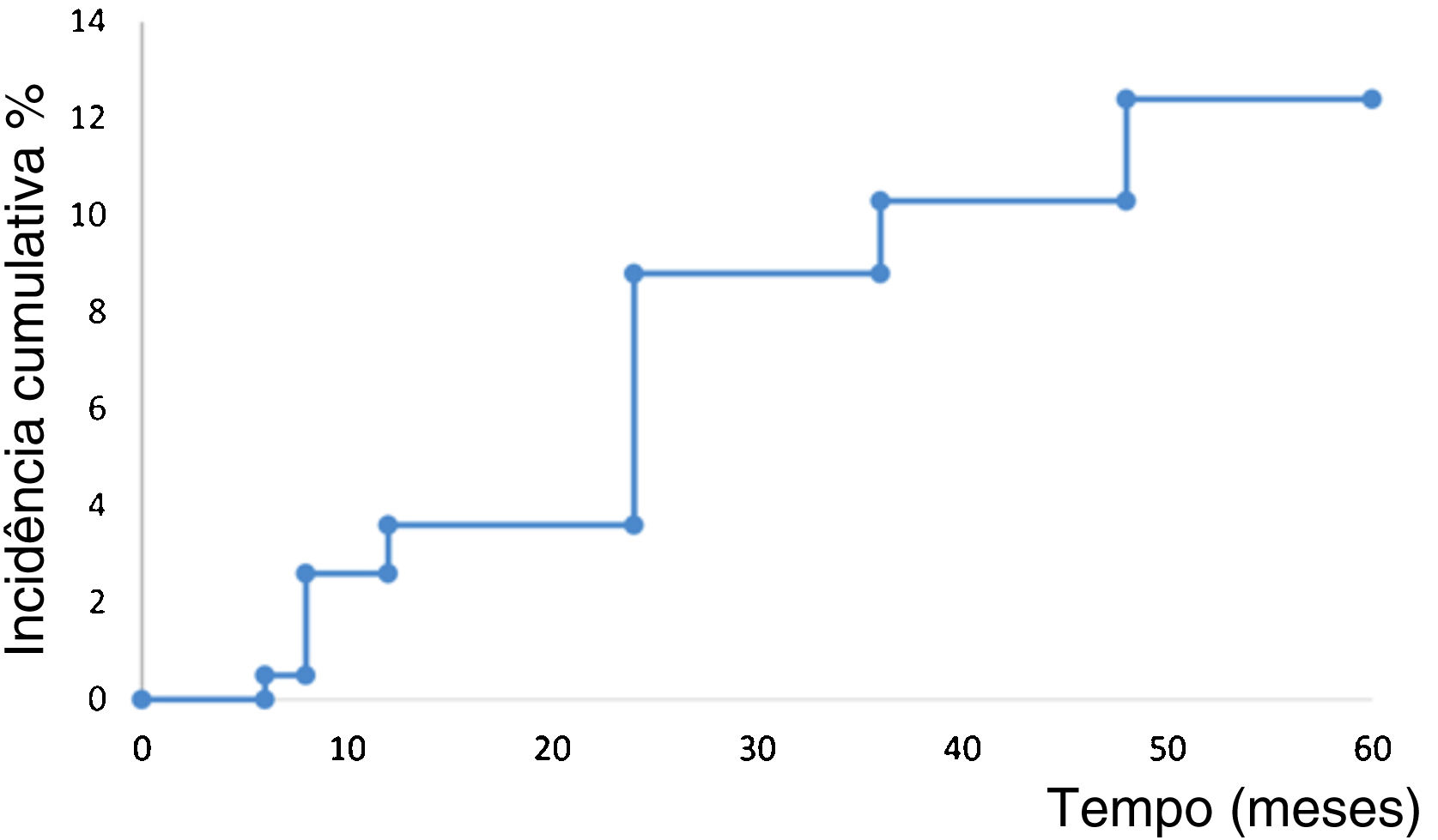
A análise de sobrevida de Kaplan‐Meier mostrou o tempo até o evento de recorrência em 194 pacientes (fig. 1). Os pacientes desenvolveram recorrência em média após 55 meses (IC95% 53,8‐57,4). A taxa estimada de recorrência foi de 12,3% (IC95% 7,4‐17,1).
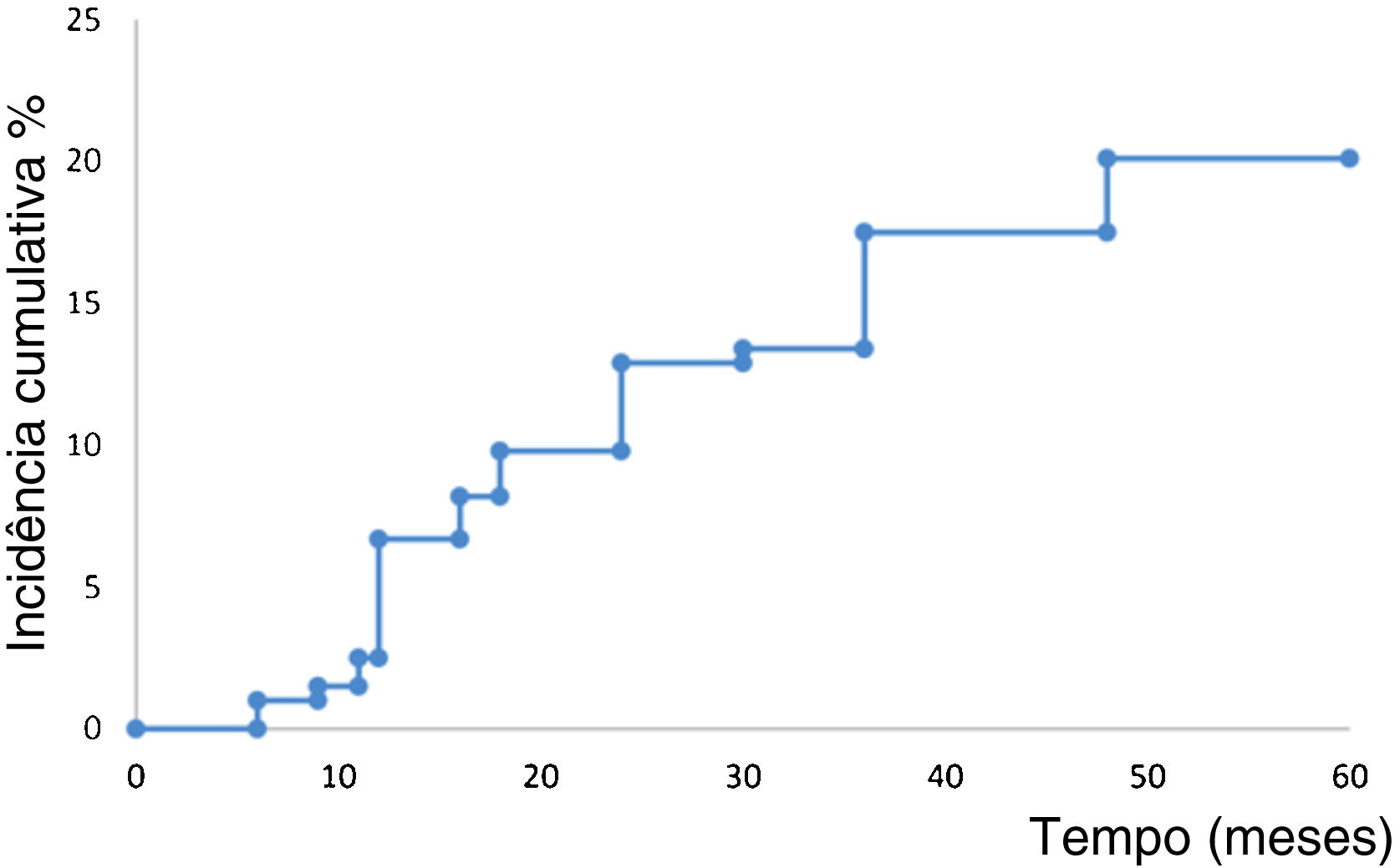
A figura 2 mostra a análise de sobrevida para o desenvolvimento de um novo CBC primário. Os pacientes desenvolveram um novo CBC após 52,7 meses em média (IC95% 50,4‐54,9). A taxa estimada para o desenvolvimento de um novo CBC em cinco anos foi de 20,0% (IC95% 14,2‐25,9). Quinze pacientes (7,7%) abandonaram o estudo durante o período de seguimento de cinco anos.
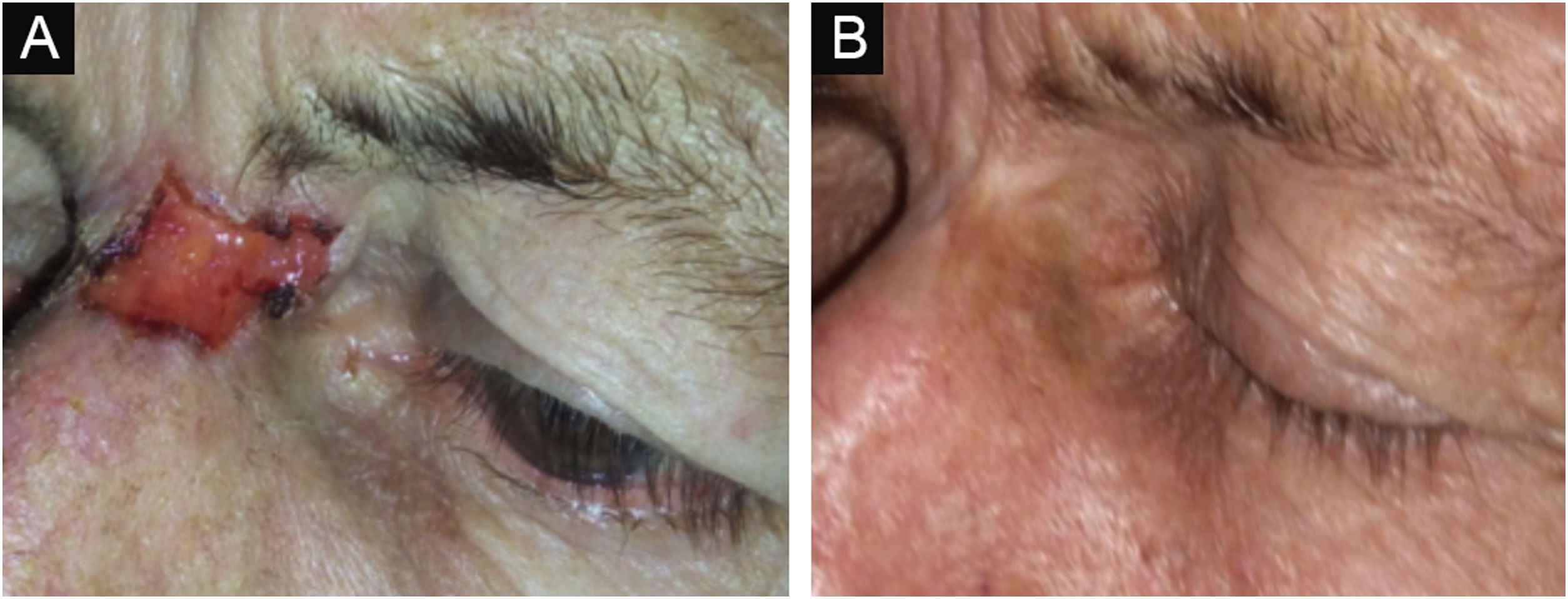
As figuras 3 e 4 mostram fotos de exemplos de respostas clínicas e evoluções dos pacientes.
O tipo e a frequência dos eventos adversos são mostrados na tabela 2. Todos os pacientes apresentaram algum evento adverso. Febre, dor no local da injeção, cefaleia, astenia, artralgia e calafrios foram os eventos adversos mais frequentes. A maioria dos eventos foi de pequeno grau (25%) ou moderado (75%), transitórios e manifestaram‐se apenas durante o período de tratamento. Não foi necessária a interrupção definitiva do tratamento (exceto em um paciente que abandonou a terapia sem explicação) e, apenas em 24 ocasiões a terapia foi interrompida temporariamente em virtude de eventos adversos.
Eventos adversos mais frequentes em pacientes tratados com HeberFERON
| Eventos adversos | Pacientes com o evento | % |
|---|---|---|
| Febre | 195 | 100 |
| Dor no local da injeção | 195 | 100 |
| Cefaleia | 185 | 95 |
| Astenia | 131 | 67 |
| Artralgia | 129 | 66 |
| Edema no local da injeção | 41 | 21 |
| Calafrios | 35 | 18 |
| Náusea | 34 | 17 |
| Diarreia | 29 | 15 |
| Vômitos | 14 | 7 |
| Sepse local | 10 | 5 |
A administração local de interferons tem sido utilizada esporadicamente para o tratamento do CBC,8–12 mas as diretrizes clínicas mais recentes não recomendam esse tipo de terapia.3,4 Este estudo avaliou o efeito da administração perilesional de HeberFERON (uma combinação de interferons alfa‐2b e gama) em 195 pacientes com CBC facial de alto risco não adequados para tratamento cirúrgico. O estudo foi realizado no contexto da prática clínica local em vários centros médicos da província de Sancti Spiritus, em Cuba. A eficácia foi avaliada por meio de três desfechos principais: resposta clínica em 16 semanas, recorrência e desenvolvimento de novo CBC primário em até cinco anos de seguimento. Que seja de conhecimento dos autores, este é o primeiro estudo que avalia o efeito em longo prazo de interferon local em uma grande coorte de pacientes com CBC facial de alto risco.
A maioria dos pacientes, 73,3% (IC95% 67,2%‐80,1%), apresentou resposta completa 16 semanas após o início da terapia. Apenas duas variáveis, idade superior a 72 anos e tamanho da lesão superior a 20mm, foram associadas a resposta clínica ruim. Subtipos histopatológicos agressivos têm sido associados a resposta clínica ruim; essa correlação não foi encontrada no presente estudo, talvez pelo fato de haver apenas 13 CBC agressivos nessa coorte, o que impossibilita um resultado estatisticamente significante. O paciente com subtipo esclerodermiforme apresentou resposta completa sem recorrência, mas desenvolveu um segundo CBC primário em outro local.
Os pacientes com resposta parcial foram avaliados como adequados para excisão cirúrgica e foram considerados curados após a remoção dos tumores. Ambos os grupos (aqueles tratados exclusivamente com HeberFERON e aqueles tratados com HeberFERON mais cirurgia) foram seguidos por cinco anos. A análise de sobrevida estimou que a taxa de recorrência após cinco anos de seguimento foi de 12,3% (IC95% 7,4‐17,1). A taxa de recorrência em cinco anos foi considerada desfecho importante para avaliar a eficácia/efetividade de qualquer terapia para CBC.2 Como não houve um grupo controle neste estudo, esse desfecho foi utilizado para comparação com terapias concorrentes, como a RT.
A RT é uma modalidade de tratamento bem estabelecida para CBC,16 e pode ser utilizada em qualquer fase da doença, como terapia exclusiva ou adjuvante e com finalidade curativa ou paliativa. Quando a cirurgia não é uma opção, principalmente para CBC facial, a RT é o tratamento de escolha. Existem diferentes modalidades de RT, mas as mais extensivamente estudadas são a RT de feixe externo (EBRT, do inglês external‐beam RT) e a braquiterapia (BT) com dose elevada.16
Lee CT et al. publicaram uma metanálise internacional de 58 estudos com 21.000 pacientes.17 Os autores consideram esse artigo a fonte de informação mais recente e completa sobre o efeito da RT no CBC. Os autores avaliaram a cosmese como desfecho primário e a recorrência em um e cinco anos como desfechos secundários. Como a cosmese não foi avaliada no presente estudo, as taxas de recorrência em cinco anos foram utilizadas para comparação. A metanálise estimou taxa de recorrência em cinco anos de 6,7% (IC95% 5,5‐8,5) para EBRT e 2,4% (IC95% 0,2‐5,1) para BT.17 Esses números são pouco melhores que os obtidos no presente estudo, e há uma ligeira sobreposição entre o IC95% deles e o do presente estudo. Essa comparação deve ser interpretada com cautela, pois a coorte do presente estudo é composta exclusivamente por pacientes com CBC facial de alto risco, enquanto os estudos incluídos na metanálise são heterogêneos e compreendem tumores de alto e baixo risco. Outro aspecto que deve ser levado em consideração é que, como a RT é utilizada há décadas, há avanços técnicos e protocolos recentes que oferecem resultados muito melhores que não puderam ser revelados na metanálise.
Mesmo quando há evidências convincentes sobre a eficácia/efetividade e segurança que apoiam a conveniência de incluir interferons no arsenal terapêutico para CBC,8–12 as principais preocupações contra essa recomendação são que o tratamento deve ser administrado em múltiplas sessões e que é caro.2 Ambas as desvantagens também poderiam ser atribuídas à RT. O custo da RT hipofracionada hospitalar para um único CBC varia de US$ 2.000 a US$ 8.000 dólares americanos.18 A EBRT pode precisar de 15 a 30 sessões para tratar um único tumor.19 Além disso, há preocupação importante quanto ao impressionante aumento de 20 vezes entre 2011 e 2013 no uso dos códigos da terminologia processual atual (CPT, do inglês current procedural terminology) para braquiterapia eletrônica em pacientes do Medicare.20 Os autores especulam que esses números parecem ter sido influenciados por incentivos econômicos e não por verdadeiras necessidades clínicas.19 Além disso, os especialistas consideram que as atuais modalidades de RT de alta tecnologia muitas vezes não são bem conhecidas ou são mal compreendidas pelos membros da equipe multidisciplinar altamente especializada e, na ausência de oncologista radioterapeuta na equipe multidisciplinar de tumores, a RT seja provavelmente subutilizada.16 Esse fato limita a possibilidade de utilização da RT em muitos ambientes ou aumenta seu custo.
Cerca de 40% dos pacientes que tiveram um CBC curado desenvolvem novo tumor nos cinco anos seguintes.21 Em relato anterior de pacientes com câncer de pele não melanoma tratados com HeberFERON, foi observada aparente redução no desenvolvimento de novo CBC.22 Os autores especulam que a presença de interferon em tecidos próximos poderia ser inibitória para o desenvolvimento de novos tumores. A análise de sobrevida para ocorrência de novo CBC na presente coorte mostrou que a probabilidade estimada de ocorrência de novo CBC foi de 20% (IC95% 14,2‐25,1). Esse número é inferior ao esperado, mas a possibilidade de um papel preventivo no desenvolvimento de novo CBC por meio do uso de HeberFERON deverá ser determinada em trabalhos futuros.
O perfil de segurança do HeberFERON na presente coorte foi semelhante aos de estudos anteriores com interferon tópico para CBC, e isso foi considerado aceitável.8–12 Todos os pacientes desenvolveram pelo menos um evento adverso; febre, dor e irritação no local da injeção foram os mais comuns. Mesmo sendo variados e comuns, foram transitórios, de pequena gravidade e não houve necessidade de interrupção do esquema terapêutico em virtude dos eventos adversos.
Este estudo tem várias limitações. O desenho observacional, sem grupo controle não é ideal para avaliação de eficácia/efetividade de qualquer intervenção terapêutica. A heterogeneidade da doença em relação a diferentes fatores como local do tumor, localização e subtipos histopatológicos e clínicos, que podem afetar os desfechos, acarreta inconvenientes para um ensaio controlado randomizado (ECR) adequado; na verdade, a maioria dos estudos sobre CBC na literatura utiliza estudos observacionais como o presente projeto. Como os desfechos foram avaliados pelas mesmas pessoas que administraram o medicamento, pode haver algum viés em favor de avaliação favorável.
Entre os pontos fortes do estudo inclui‐se o número aceitável de pacientes com características relativamente homogêneas (CBC facial de alto risco). Em virtude da heterogeneidade intrínseca dessa doença, a maior parte da coorte publicada é composta por uma mistura de pacientes com baixo e alto risco de recorrência, mesmo quando as diretrizes recomendam diferentes modalidades de tratamento para cada grupo. A baixa taxa (7,7%) de abandono durante o seguimento, e o fato de os autores terem selecionado um período de seguimento e desfechos clínicos considerados importantes para inclusão em revisões sistemáticas e metanálises, também são considerados pontos fortes.
ConclusõesA administração perilesional de HeberFERON (uma combinação de interferons alfa‐2b e gama) em pacientes com CBC facial de alto risco oferece taxa de cura satisfatória após seguimento de cinco anos, com perfil de segurança aceitável. Essa modalidade de tratamento merece ser considerada para inclusão no arsenal terapêutico para CBC facial. Com esse propósito, será desejável uma comparação com a RT em um desenho de ECR paralelo que meça a taxa de recorrência local em cinco anos, o desenvolvimento de novo CBC, a cosmese, a aceitação do paciente e o custo.
Suporte financeiroNenhum.
Contribuição dos autoresVladimir Sánchez: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Emilio Carpio: Aprovação da versão final do manuscrito; revisão crítica da literatura; análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Vicente Eloy Fardales: Aprovação da versão final do manuscrito; revisão crítica da literatura; análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Belkys Martínez: Aprovação da versão final do manuscrito; obtenção dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Ana Iris Arias: Aprovação da versão final do manuscrito; obtenção dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Elizabeth Brito: Aprovação da versão final do manuscrito; obtenção dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Niurka Bermudez: Aprovação da versão final do manuscrito; obtenção dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Yoel Rodríguez: Aprovação da versão final do manuscrito; obtenção dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Sánchez V, Carpio E, Fardales VE, Martínez B, Arias AI, Brito E, Bermudez N, Rodríguez Y. Long‐term follow‐up of patients with high‐risk facial basal cell carcinoma treated with interferon. An Bras Dermatol. 2024;99:391–7.
Trabalho realizado no Juana Naranjo Leon, Sancti Spíritus, Cuba. Polyclinic Camilo Cienfuegos, Yaguajay, Sancti Spíritus, Cuba. Polyclinic Manuel de Jesús Lara Cantero, Trinidad, Sancti Spíritus, Cuba. Center Polyclinic Juana Naranjo Leon, Sancti Spíritus, Cuba. Polyclinic Antonio Ávila Valdivia, Jatibonico, Sancti Spíritus, Cuba. Arcelio Suárez Bernal, Jatibonico, Sancti Spíritus, Cuba.